Синдром Леффлера
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Аллергический некротизирующий васкулит, был впервые описан в 1951 году, когда Y. Churg и L. Strauss опубликовали 13 наблюдений больных, имевших сочетание тяжелой бронхиальной астмы с гиперэозинофилией в периферической крови и эозинофильной инфильтрацией тканей [4, 6].
Это редко встречающееся заболевание, названное по именам первооткрывателей синдромом Чарга-Стросса, относят к системным васкулитам с преимущественным поражением сосудов малого и среднего калибра [2, 6].
Основным диагностическим критерием является бронхиальная астма, которая развивается в дебюте заболевания и в течение многих лет может оставаться единственным симптомом болезни [5]. В дальнейшем, как правило, присоединяется эозинофилия, эозинофильная пневмония и синдром Леффлера. В продвинутой стадии заболевания преобладают признаки системного васкулита. Более чем у 60% больных можно выявить поражение нервной системы в форме мононеврита или полинейропатии, в т.ч. нейропатии зрительных и других черепно-мозговых нервов, являющихся, как правило, следствием иммунопатологического процесса в эпиневральных сосудах[1, 2, 3, 5, 6].
У 2/3 больных можно обнаружить кожные проявления, чаще в виде болезненной пальпируемой пурпуры, макуло-папулезных, уртикарных элементов и язв [1].
В разгар системного васкулита у 50% пациентов возможно появление артритов и миалгии, реже (у 20%) – миокардита, полисерозита и фибропластического эндокардита Леффлера [2].
Описаны гастроинтестинальные проявления заболевания в форме эозинофильного гастроэнтерита и кровотечений за счет некротизирующего васкулита мезентеральных сосудов. Важно отметить лабораторные признаки синдрома Чарга-Стросса, к числу которых относят эозинофилию >10% от общего количества лейкоцитов, ускорение СОЭ, высокое содержание общего IgE. Особое внимание в лабораторной диагностике заболевания придается обнаружению антинейтрофильных цитоплазматических антител, повышенное содержание которых выявлено более, чем у 67% больных, а также перинуклеарных антител с антимиелопероксидазной активностью (p-ANCA), содержание которых в крови больного коррелирует с активностью процесса [1, 2, 5].
Вышеописанные симптомы малоспецифичны, в связи с чем синдром Чарга-Стросса может долго оставаться нераспознанным. В подтверждение сказанного приводим собственное клиническое наблюдение.
Больная К.У.Э., 25л., поступила в ревматологическое отделение Областной клинической больницы г.Саратова в сентябре 2014 года с жалобами на редкий кашель и наличие язвенных дефектов на нижних конечностях.
Из анамнеза заболевания известно, что в течение многих лет отмечает гипермобильность голеностопных суставов, изредка появлялись поверхностные язвочки на слизистой оболочке полости рта.
В конце марта 2013 года, после переохлаждения появились афтозный стоматит, язвенно-некротический тонзиллит, отечность шеи, регионарная лимфаденопатия, фебрильная лихорадка. Через несколько дней присоединились боль и припухлость мелких и средних суставов (кистей, локтевых, лучезапястных, голеностопных), а также геморрагические высыпания с локализацией на конечностях, ладонях различных размеров, пальпируемые и не пальпируемые, с образованием везикул и корочек.
В клиническом анализе крови отмечены лейкоцитоз 15 тыс/мкл, повышение уровня эозинофилов до 12%, СОЭ 53мм/ч.
При рентгенографии органов грудной клетки выявлено усиление и сгущение легочного рисунка в прикорневых отделах с обеих сторон.
При ЭхоКГ обнаружена малая аномалия развития: аневризма межпредсердной перегородки, незаращение овального окна.
С целью исключения инфекционной патологии проводилось исследование антител к ВИЧ и посев крови на стерильность, показавшие отрицательные результаты.
При проведении КТ органов грудной полости обнаружена пневмония в S 2, 6, 10 слева. Других патологических изменений выявлено не было.
Гематологическая патология была исключена.
В апреле 2013 года на фоне лечения глюкокортикоидами и антибиотиками состояние улучшилось: разрешились геморрагические высыпания и язвы на миндалинах. Однако, сохранились проявления артрита, субфебрильная лихорадка, афтозный стоматит и лимфаденопатия, в связи с чем состояние больной расценили как сепсис с развитием аутоиммунных осложнений. Было продолжено лечение фторхинолонами и преднизолоном в дозе 15 мг, на фоне которого сохранялась повышенная СОЭ (27-30 мм/ч), эозинофилия 6-7%. Кроме того, были обнаружена анемия легкой степени, положительный СРБ, умеренный лейкоцитоз (11-15×109 /л). При УЗИ органов брюшной полости – гепатомегалия.
С учетом эозинофилии и системных проявлений был продолжен диагностический поиск, выявивший повышение уровня IgЕ в 2,5 раза и положительные АНЦА к протеиназе. Это позволило поставить диагноз недифференцированный васкулит. В мае 2013 года был выставлен диагноз: геморрагический васкулит. При иммунологическом исследовании выявлено повышение уровня IgE в 2,5 раза и положительный ANCA к протеиназе.
С июня 2013 года стала отмечать усиление боли в суставах, онемение кистей, субфебрилитет, в связи с чем была госпитализирована повторно для уточнения диагноза. В ОАК выявлена эозинофилия 10%, СОЭ – 12 мм/ч, при КТ придаточных пазух носа – локальное утолщение слизистой оболочки правой верхнечелюстной пазухи, кистогранулемы зубов верхней челюсти, деформация средних носовых раковин. Стоматологом была обнаружена эрозия слизистой оболочки твердого неба, неврологом – полинейропатия, при рентгеноскопии желудка – гастроэзофагеальный рефлюкс. Результат теста патергии был отрицательным. На основании проведенных исследований был подтвержден ранее поставленный диагноз и рекомендован прием преднизолона 30мг и плаквенила.
На фоне самостоятельного снижения дозы преднизолона в августе 2013 года пациентка отметила онемение кистей, гиперестезию дистальных фаланг пальцев, субфебрилитет до 38,0оC, а также появление папулезно-геморрагических высыпаний на коже голеней, бедер, предплечий с очагами некроза и образованием трофических язв на голенях.
В августе и сентябре 2013 года отмечались осиплость голоса, афония, а также неоднократные эпизоды бронхообструкции, зафиксированные врачом поликлиники. В ОАК эозинофилы достигали 15%, при рентгенографии органов грудной полости патологии выявлено не было.
18 сентября 2013г. без видимой причины возникло кишечное кровотечение, по поводу чего проводились антибактериальная, гемостатическая терапия и плазмотрансфузия.
При поступлении в ОКБ г. Саратова в октябре 2013 г. состояние пациентки удовлетворительное. Телосложение гиперстеническое с преимущественным отложением жира на верхней половине туловища и относительным похуданием конечностей. «Лунообразное» лицо. На коже бедер и голеней – папулезно-гемаррагические элементы с изъязвлением, размером 3-15мм, покрыты корочкой без отделяемого. На тыле правой стопы – поверхностная трофическая язва. Пальпируются подчелюстные лимфатические узлы: до 1см, безболезненные, не спаянные с кожей. Со стороны суставов признаки воспаления отсутствовали. Отмечена пастозность стоп. ЧД 18/мин, дыхание жесткое. Хрипов нет, ЧСС 88 в 1 мин, АД 130/80 мм.рт.ст., одинаковое на правой и левой руках. Тоны сердца приглушены.
Живот мягкий, безболезненный, печень не пальпируется, симптом поколачивания отрицательный с обеих сторон. Стул, мочеиспускание без особенностей.
В общем анализе крови СОЭ – 20 мм/ч, Hb 80 г/л, Er – 2,8×1012/л, лейкоциты 10,0×109/л, палочкоядерные 8, сегментоядерные – 50, эозинофилы – 20, лимфоциты – 30, моноциты – 7, тромбоциты – 190×109 /л.
При иммунологическом исследовании: положительные АНЦА к протеиназе, СРБ – отрицательный, антитела к ДНК не обнаружены.
Общий анализ мочи: соломенно-желтого цвета, прозрачная, реакция кислая, относительная плотность 1018, белок 0,03 г, лейкоциты 2-3 в п/зр.
Биохимический анализ крови: белок 80 г/л, общий билирубин 10 мкмоль/л, холестерин 3,2 мкмоль/л, триглицериды 1,8 мкмоль/л, мочевая кислота 0,32 мкмоль/л, мочевина 5,2 мкмоль/л, глюкоза 4 ммоль/л, АсТ 18 МЕ/л, АлТ 20 МЕ/л, КФК 98 Ed/л, ЛДГ 370 МЕ/л, фибриноген 2 г/л. Антитела к ВИЧ, антитела HCV, HbsAg не обнаружены.
Рентгенография органов грудной клетки: в легких патологических изменений не выявлено.
Функция внешнего дыхания: легкие обструктивные изменения.
Тест с бронходилятатором: прирост показателей ОФВ1 – 15%.
УЗИ органов брюшной полости: выявлена гепатомегалия
При колоноскопии и ирригоскопии патологических изменений выявлено не было. Пациентке был поставлен диагноз:
Основной: Эозинофильный гранулематоз с полиангиитом (синдром Чарга-Стросса), АНЦА-ассоциированный, активность IIст. Кожный язвенно-некротический васкулит. Бронхообструктивный синдром. Эозинофилия. В анамнезе язвенно-некротический тонзиллофарингит, афтозный стоматит, васкулит кишечника, полиартрит, полиневрит, пневмонит.
Сопутствующий: синдром дисплазии соединительной ткани, аневризма межпредсердной перегородки, незаращение овального окна.
Осложнения: Медикаментозный сидром Иценко-Кушинга. Вторичная артериальная гипертония. Трофические язвы конечностей.
Диагноз был поставлен на основании критериев заболевания Американской ревматологической ассоциации (1990 г.), обнаруженных у пациентки: наличие бронхообструктивного синдрома, эозинофилии свыше 10%, полинейропатии и рентгенологических изменений околоносовых пазух в анамнезе. Пациентке была назначена терапия: метипред 25 мг/сут, пульмикорт 200 мкг, по 2 ингаляции 2 р/сутки, метотрексат 15 мг/неделю. В результате проведенного лечения состояние пациентки улучшилось, уменьшился кашель, произошел регресс геморрагических высыпаний и регенерация язв.
Описанный клинический случай иллюстрирует сложности диагностики синдрома Чарга-Стросса, связанные прежде всего с высокой активностью и тяжелым течением в дебюте заболевания, что дало основание заподозрить сепсис, а также с неспецифичностью клинических проявлений и отсутствием фазности течения, присущей классической картине заболевания.
Cиндром Леффлера
Cиндром Леффлера является аллергической болезнью, происходящей вследствие увеличения эозинофилов у пациента в крови. Впоследствии может возникнуть пневмония в легких.

Врачи различают два синдрома заболевания:
В большинстве случаев заболеванием страдают по достижении подросткового возраста и старше. Болезнь быстрей всего развивается в жарком климате и активно прогрессирует. Часто синдром Леффлера появляется у людей, склонных к аллергии и повышенному порогу чувствительности.
Причины развития синдрома Леффлера
Выделяется несколько причин возникновения заболевания:
- аллергены в природе;
- лекарственные средства;
- бактерии;
- паразиты;
- невыясненные причины.
В основном заболевание можно выявить только после длительного контакта с аллергенами в течение нескольких лет. После ликвидации контакта симптоматика проходит быстро или развиваются осложнения в виде второй стадии синдрома.
Здоровые люди могут заразиться синдромом Леффлера после контакта с больным человеком посредством:
- еды;
- рукопожатия;
- предметов личной гигиены.
При попадании в кровь бактерии оказываются в организме человека. Также можно заразиться воздушно-капельным путем.
Симптомы заболевания и первые признаки
Обычно симптом Леффлера не имеет симптомов во время развития. Иногда может проявляться сухой или мокрый кашель с кровянистыми выделениями. Также появляется температура.
Дополнительными симптомами заболевания могут быть:
- спазмы в бронхах;
- сухая хрипота в верхних дыхательных путях;
- повышение количества лейкоцитов в крови;
- инфильтрация легочных тканей;
- одышка;
- пятна на кожных покровах;
- лихорадка.
Методы диагностики
Специалист может быстро обнаружить заболевание, ведь в крови пациента высокое содержание эозинофилов. Однако могут возникнуть определенные сложности по причине таких симптомов:
- аллергические реакции;
- неблагоприятные условия жизни;
- обострение сезонной аллергии и проявления астмы;
- генетическая расположенность.
Когда имеются подозрения на другие болезни, специалист направляет пациента на обследование к другим врачам.
Если существует подозрение на синдром Леффлера, то следует обязательно провести исследования в лаборатории:
- может показать наличие эозинофилов и кристаллов Шарко-Лейдена; выявляет эозонофилы;
- часто в крови можно обнаружить большое содержание IgE, иногда до 1000 МЕ/мл.
Также существуют и другие способы диагностики:
- проведение кожных тестов для обнаружения возбудителя заболевания (врач имеет право назначить назальные средства или ингаляции); с учетом цикла развития и времени со дня заражения; с реакцией связывания комплемента и реакции преципитации;
- применение клеточного тестирования на реакцию дегрануляции тучных клеток с определенными аллергенами, реакцию дегрануляции базофилов по Шелли, для выявления специфических IgE при помощи радиоаллергосорбентных тестов и ИФА.
Лечение
Нередко может случиться самостоятельное и неожиданное выздоровление пациента без соответствующего лечения. Это происходит в случае избавления от паразитов в организме. Следует провести дегельментизацию, пропить средства против паразитов, которые может назначить только специалист. Если болезнь продолжает прогрессировать, то следует пропить антигистаминные препараты, которые будут подавлять выделенные организмом образования.
Крайне важно не заниматься самолечением, нужно обязательно обратиться к специалисту при обнаружении симптомов!
Профилактические меры
Для профилактики синдрома Леффлера желательно периодически обращаться к аллергологу и другим врачам, проходить обследование. Важно следить за гигиеной, как можно меньше общаться с животными, в особенностями дворовыми.
Также следует приобрести стандартные лекарственные средства для профилактики аллергии на лекарства.
Синдром Леффлера не считается особо опасным заболеванием, его можно вылечить быстро и легко, если пациент будет выполнять все рекомендации врача и соблюдать правила гигиены. В противном случае болезнь может спровоцировать неприятные осложнения, пневмонию и бронхиальную астму, от которых будет сложно избавиться.
Россия, Краснодарский край,
г. Сочи, ул. Старонасыпная, 22.
Размещенная на сайте информация и прейскурант не являются публичной офертой.
Синдром Леффлера
Синдром Леффлера (эозинофильный летучий инфильтрат, простая эозинофильная пневмония, простая легочная эозинофилия) – это заболевание, для которого характерно наличие транзиторных легочных инфильтратов с высоким уровнем эозинофилов в крови, способных самостоятельно разрешаться.
Впервые заболевание было описано в 1932 году Вильгельмом Леффлером, профессором Цюрихского университета. Он доказал, что эозинофильное воспаление ткани легких развивается в результате прохождения через нее личинок гельминтов в процессе их миграции.
В развитии синдрома Леффлера играют роль:
- паразитарная инвазия (анкилостомы, аскариды, трихинеллы, печеночный сосальщик, кошачий сосальщик, плоские черви, стронгилоиды, шистосомы, токсокара, филярии, острицы);
- ингаляционные аллергены: споры грибов (особенно рода аспергилл), пыльца растений (лилия, бирючина, ландыш, липа и др.), производственные аллергены («никелевые» инфильтраты, сочетающиеся с контактным дерматитом);
- лекарственные препараты (пенициллин, нитрофураны, сульфаниламиды, β-адреноблокаторы, соединения золота, интал);
- бактериальные факторы (бруцеллы, стрептококк, стафилококк); (яйца, мясо, раки, рыба).
В случаях с эозинофильной пневмопатией выяснить этиологический фактор, как правило, не удается.
Патогенез
В развитии синдрома Леффлера основная роль принадлежит реакциям гиперчувствительности немедленного типа.
Характерными явлениями являются:
- «летучий» характер инфильтратов;
- регрессия инфильтратов без образования вторичных патологических очагов;
- повышение уровня $IgE$ в сыворотке крови.
Синдром Леффлера может развиваться по типу феномена Артюса в результате образования преципитирующих антител к антигенам.
В патогенезе иногда принимают участие клеточно-опосредованные реакции.
Клиническая картина и дифференциальная диагностика
Чаще всего жалобы на состояние больного отсутствуют.
Иногда проявляются следующие симптомы:
- повышенная утомляемость;
- непродуктивный, сухой кашель;
- в небольшом количестве присутствует вязкая мокрота, иногда есть примеси крови;
- болезненность в области трахеи;
- субфебрильная температура;
- бронхоспазм;
- при аускультации – в верхних отделах легких выслушиваются сухие хрипы.
Готовые работы на аналогичную тему
Дифференциальную диагностику необходимо проводить у пациентов с:
- вирусными и бактериальными пневмониями;
- легочным туберкулезом;
- саркоидозом;
- гранулематозом Вегенера;
- лимфогранулематозом;
- аллергическим бронхолегочным аспергиллезом;
- синдромом Черджа-Стросса.
Диагностика и лечение
- Физикальное обследование. Диагноз ставится на основании осмотра больного и его жалоб.
- Аллергологическое обследование.
- Лабораторные исследования: клинический анализ крови (показывает высокий уровень эозинофилии, лейкоцитоз), цитологическое исследование мокроты (наличие эозинофилов, кристаллов Шарко-Лейдена), определение уровня общего IgE в сыворотке крови, определение уровня специфических IgE в сыворотке крови (наблюдается их повышение), паразитологическое обследование (выявление антител к антигенам эхинококка, токсокары, трихинеллы, описторхиса, копроовоцистоскопия).
- Инструментальное исследование – рентгенологическое обследование органов грудной клетки, позволяющее выявить множественные или единичные инфильтраты округлой формы, располагающиеся в верхних отделах легких или субплеврально.
Лечение синдрома Леффлера включает:
- применение противопаразитарных лекарственых препаратов (альбендазол, карбендацим, пирантел, мебендазол);
- проведение десинсибилизирующей терапии (системные глюкокортикоиды, блокаторы Н1-рецепторов гистаминов).
Иногда происходит спонтанное выздоровление.
Нужны еще материалы по теме статьи?
Воспользуйся новым поиском!
Найди больше статей и в один клик создай свой список литературы по ГОСТу
Автор этой статьи Дата написания статьи: 16.02.2017
Наталья Николаевна Чувелева
Эксперт по предмету «Медицина» , преподавательский стаж — 20 лет
Автор24 - это сообщество учителей и преподавателей, к которым можно обратиться за помощью с выполнением учебных работ.
Эндокардит Леффлера с поражением обоих желудочков

Фибропластический париетальный эндокардит, или эндокардит Леффлера (Loeffler) – редко встречающееся приобретенное заболевание эндокарда и миокарда, которое характеризуется резким снижением податливости одного или обоих желудочков с резким нарушением его/их диастолической функции и массивным пристеночным тромбообразованием. На сегодняшний день существует несколько классификаций заболеваний, куда включен эндокардит Леффлера. Согласно современной классификации кардиомиопатий (2008) данное заболевание относится к вторичным рестриктивным кардиомиопатиям (РКМП), развившимся в результате таких системных заболеваний, как амилоидоз, саркоидоз, карциноидная болезнь, склеродермия, антрациклиновая КМП, фиброэластоз и др. [1].
С другой стороны, на сегодняшний день эндокардит Леффлера рассматривают как проявление гиперэозинофильного синдрома (ГЭС), протекающего с преимущественным поражением сердца [2]. Гиперэозинофильный синдром включает две клинические формы: синдром Леффлера І (летучие эозинофильные инфильтраты в легких) и синдром Леффлера ІІ (эндокардит Леффлера). Поражение сердца – основная причина осложнений и летальных исходов при ГЭС.
Крайне редко подобное поражение сердца бывает изолированным (только сердце) и первичным (скорее, идиопатическим). По гемодинамике эндокардит Леффлера – классическая рестриктивная кардиомиопатия, по патогенезу – следствие гиперэозинофилии.
Связь между эозинофилией, активной фазой миокардита и полиорганной недостаточностью впервые была установлена Леффлером в 1936 г. При данной патологии выявляется эозинофильный эндомиокардит с тенденцией к фиброзированию, что клинически проявляется прогрессирующей сердечной недостаточностью (СН) и тромбоэмболическими осложнениями.
Эозинофильный эндокардит хорошо освещен в литературе, однако прижизненная диагностика повреждения миокарда и сосудов вследствие эозинофильной инфильтрации и их обильной дегрануляции встречается редко [3]. Причиной поздней диагностики в большинстве случаев является быстрое развитие эозинофильных артериитов и миокардитов [4, 5]. Вовлечение в патологический процесс миокарда указывает на острую некротическую фазу эозинофильного эндомиокардита [6, 7]. Токсическое повреждение органов обусловлено содержимым внутриклеточных гранул эозинофилов [8, 9]. Морфологические аномалии эозинофилов выражаются в преобладании зрелых активных форм. Они развиваются из стволовой клетки-предшественницы костного мозга и содержат целый ряд Т-клеточных цитокинов, ростовые факторы, включая интерлейкины 3, 5, а также гранулоцитарный моноцитарный колониестимулирующий фактор. Цитокины и ростовые факторы индуцируют повреждение органа-мишени путем стимулирования секреции воспалительных медиаторов, что приводит к повреждению ткани, ремоделированию и фиброзу. Кроме того, катионы эозинофильных белков связываются с анионами эндотелиальных белков (тромбомодулинами). Образующийся комплекс белков ухудшает антикоагулянтную активность и приводит к повышенному тромбообразованию [10, 11]. Интенсивность и острота активной фазы эозинофильного эндокардита тесно связана с количеством циркулирующих эозинофилов и длительностью предшествующей эозинофилии [12].
Типичные клинические симптомы эндокардита Леффлера – потеря массы тела, лихорадка, кашель, сыпь и нарастающая ХСН. Несмотря на то что поражение сердца вначале может протекать бессимптомно, у 50% пациентов одышка появляется уже на ранних этапах заболевания.
При рентгенологическом обследовании органов грудной клетки обнаруживают кардиомегалию и признаки венозного застоя в легких. Изменения ЭКГ не специфичны. Частые находки – нарушения ритма сердца, особенно фибрилляция предсердий (ФП). В диагностике заболевания основную роль играет эхокардиография (ЭхоКГ), позволяющая обнаружить локальное (реже – диффузное) утолщение верхушки одного или обоих желудочков с вовлечением в патологический процесс хорд, умеренную митральную или трикуспидальную регургитацию, пристеночные, особенно верхушечный, крупные тромбы. Показательным является «рестриктивный тип» ремоделирования сердца и внутрисердечной гемодинамики – очевидное преобладание объема предсердий над объемами желудочков. Систолическая функция, как правило, сохранена, но диагностируется диастолическая дисфункция – рестриктивный тип трансмитрального/транстрикуспидального кровотока. Наиболее информативными методами исследования на сегодняшний день являются магнитно-резонансная томография (МРТ) и мультиспектральная компьютерная томография с контрастированием 13. В литературе описан случай динамического наблюдения за развитием эндокардита Леффлера с серией одновременно производимой позитронно-эмиссионной томографии и контрастированной МРТ с выделением стадий: бессимптомной, острой некротической, симптомной тромботической и фибротической [13]. Выполнение эндомиокардиальной биопсии миокарда правого (ПЖ) или левого (ЛЖ) желудочка позволяет подтвердить или опровергнуть диагноз эндокардита Леффлера.
Прогноз при классическом эндокардите Леффлера неблагоприятный. Большинство пациентов умирают в течение 6-12 мес от манифестации СН (а не от постановки диагноза). Смерть обычно наступает вследствие хронической СН (ХСН) и полиорганной недостаточности. К сожалению, в подавляющем большинстве случаев до сих пор не удается установить причины возникновения гиперэозинофилии или выявление причинного фактора уже не влияет на прогноз. Именно поэтому клинический исход заболевания часто неблагоприятный, несмотря на то что назначение преимущественно глюкокортикоидов и некоторых противоопухолевых препаратов может уменьшить гиперэозинофилию.
Клинический случай
Пациентка О., 39 лет (рост 161 см, вес 62 кг), в течение полугода наблюдалась у семейного врача с жалобами на одышку от легкой до умеренной, возникающую при физической нагрузке, выраженную метеочувствительность, слабость, эпизоды сердцебиения, перебои в работе сердца. Согласно записям в амбулаторной карте уровень артериального давления (АД) варьировал от 80/50 до 110/80 мм рт. ст.
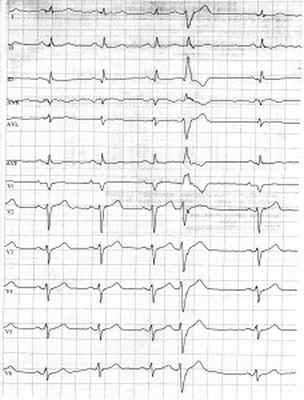
Рис. 1. Синусовая тахикардия. Желудочковые экстрасистолы (ЭС). Отклонение электрической оси сердца вправо. Отсутствие амплитудной динамики низковольтного зубца R в грудных отведениях
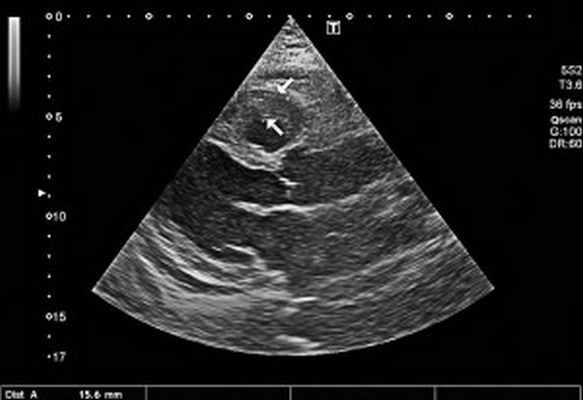
Рис. 2. Неравномерное значительное утолщение стенок ПЖ (парастернальный доступ, позиция по длинной оси)
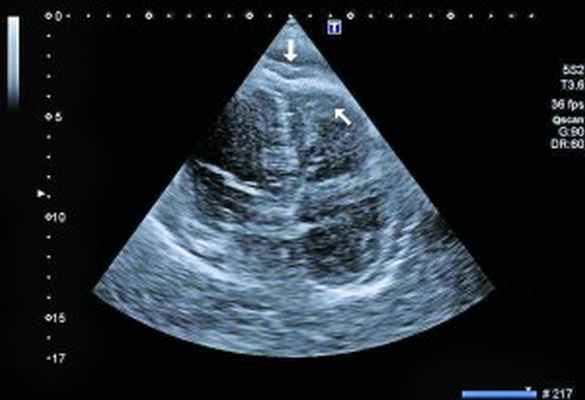
Рис. 3. Тромб у верхушки ПЖ, уплотнение между листками перикарда в области верхушки (четырехкамерная позиция сердца)
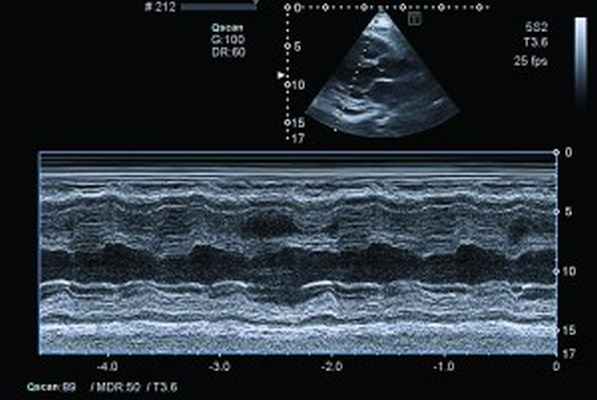
Рис. 4. Сохраненная кинетика стенок ЛЖ, гидроперикард по ЗСЛЖ (парастернальный доступ, позиция по длинной оси, М-режим)
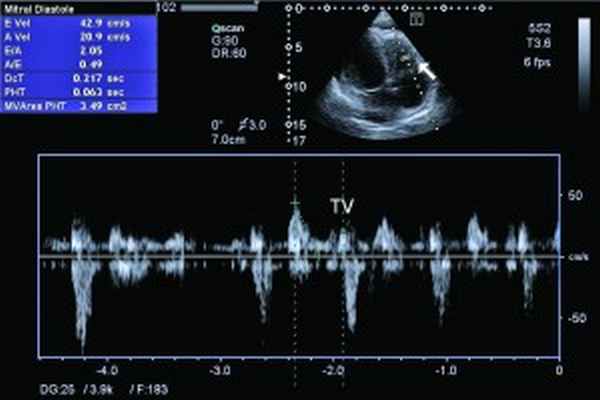
Рис. 5. Рестриктивный транстрикуспидальный кровоток (допплер)
УЗИ органов брюшной полости: эхопризнаки гепатоспленомегалии, диффузные изменения в поджелудочной железе, отек стенок желчного пузыря, выпот в обеих плевральных полостях (синусы).
Лечение – метилпреднизолон 500 мг 2 раза в сутки 5 дней, далее преднизолон 30 мг/сут, иматиниб 100 мг по 4 табл./сут (400 мг), ивабрадин 5 мг 2 раза в сутки, спиронолактон 100 мг/сут, торасемид 10 мг/сут, силденафил 25 мг 2 раза в сутки, надропарин 0,4 мл 2 раза в сутки внутримышечно, омепразол 40 мг/сут.
Через 4 дня лечения состояние пациентки заметно улучшилось, основным признаком улучшения стало уменьшение одышки. Повторные ЭхоКГ очевидной динамики не выявили.
14.04.2015 г. пациентка была госпитализирована в Национальный научный центр «Институт кардиологии им. Н.Д. Стражеско» в отделение некоронарогенных заболеваний сердца и клинической ревматологии, где был выставлен (подтвержден и уточнен) диагноз: ГЭС. Эндокардит Леффлера с поражением ЛЖ и ПЖ. Массивные пристеночные тромботические наслоения в ПЖ. Апикальный тромб ЛЖ. Мелкие тромбы в ушках обоих предсердий. Синусовая тахикардия. Единичные желудочковые ЭС. Перикардит с небольшим количеством жидкости. СН IIА ст. со сниженной сократительной функцией ЛЖ ІІ ФК по NYHA. Аутоиммунный тиреоидит, эутиреоз. Токсокароз, висцеральная фаза.
Рис. 6. Нарастание низковольтности ЭКГ в динамике (в сравнении с ЭКГ от 2012 г., рис. 1)
ЭКГ, представленная на рисунке 6, демонстрирует нарастание низковольтности ЭКГ в динамике (в сравнении с ЭКГ от 2012 г., рис. 1).
ЭхоКГ: Патологические изменения миокарда ПЖ с утолщением стенок до 18 мм. Диффузный гипокинез стенок ЛЖ с дискинезом верхушки – ФВ 44%. В области верхушки ПЖ – наслоения между листками перикарда. Небольшое количество жидкости в полости перикарда – по ЗСЛЖ до 5 мм. Таким образом, в динамике на ЭхоКГ наблюдалось снижение сократительной функции ЛЖ на фоне его гипертрофии и, несмотря на проведенную высокодозовую терапию гормонами, не уменьшилась гипертрофия ПЖ.
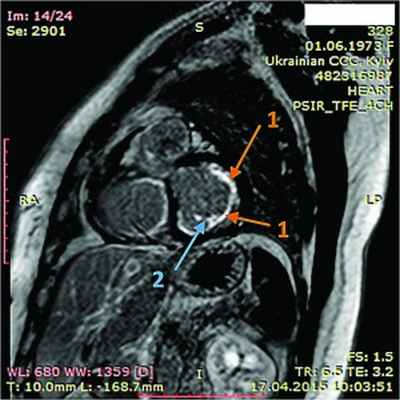
Рис. 7. Динамическая томография, боковая проекция с контрастированием эндокарда (1) и тромба ПЖ (2)
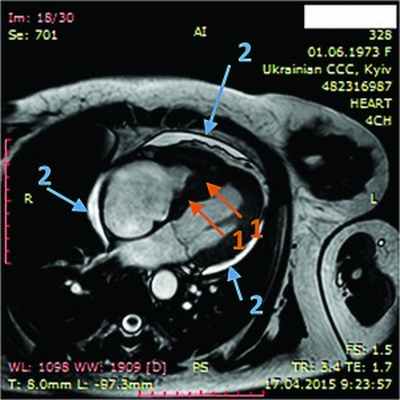
Рис. 8. Динамическая томография, поперечная проекция с контрастированием полостей и тромба в ПЖ (1), гидроперикарда по всем стенкам (2)

Рис. 9. Динамическая томография, поперечная проекция с контрастированными полостями и стенками – неравномерное утолщение миокарда желудочков (1) с двумя апикальными тромбами (2)
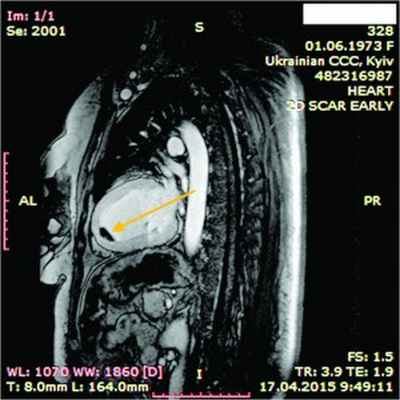
Рис. 10. Динамическая томография, боковая проекция с контрастированием полостей и стенок – апикальный тромб ЛЖ
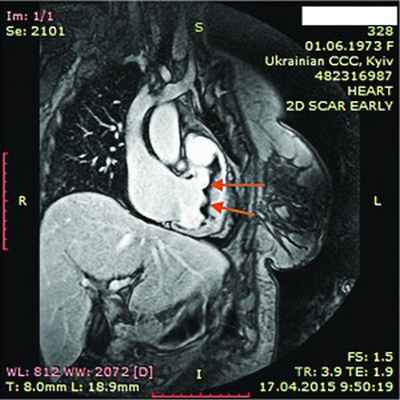
Рис. 11. Динамическая томография, косая проекция с контрастированием полостей и стенок – апикальные тромбы ЛЖ
В ходе серии динамических МРТ с контрастированием (рис. 7-11) выявлены массивные пристеночные тромботические наслоения в ПЖ, апикальный тромб ЛЖ.
С учетом наличия и стойкости в динамике гиперэозинофилии у пациентки были взяты анализы крови для определения наличия антител IgG к гельминтам и выявлены хронический токсокароз и аскаридоз (табл. 1).
Количественный анализ показал четырехкратное увеличение титра антител IgG к токсокаре (табл. 2), что было расценено как причина ГЭС. Трехкратное увеличение концентрации IgЕ в сыворотке крови косвенно подтвердило хроническую глистную инвазию (табл. 3).
СТАТТІ ЗА ТЕМОЮ Кардіологія
Сьогодні в рамках оцінки чинників ризику серцево-судинних (СС) захворювань дедалі більший інтерес наукового світу прикутий до ендотелію та його функції. Ендотелій уражається насамперед унаслідок артеріальної гіпертензії (АГ), це проявляється розвитком його дисфункції та морфологічною перебудовою артеріальної стінки. Добре відомо, що з віком підвищується судинна жорсткість, що пов’язують зі зниженням в артеріальній стінці вмісту еластину та підвищенням кількості колагену 3. У разі АГ перебіг цих процесів значно прискорюється – судинний вік починає випереджати хронологічний (паспортний). Тому дедалі більше науковців для опису функціонального та морфологічного стану серцево-судинної системи використовують термін «синдром раннього старіння судин», або EVA‑синдром (early vascular aging), як модель старіння судин, яка більш точно відображає структурні та функціональні зміни, що відбуваються в організмі в міру його старіння [1].
Ішемічна хвороба серця (ІХС) є провідною причиною інвалідизації та смертності від серцево‑судинних захворювань (ССЗ). У розвинених країнах Європи на 1 млн населення припадає 30-40 тис. хворих, які страждають на ІХС [1]. До того ж немає пояснень для показників смертності українських чоловіків і жінок, які в 14 і 23 рази більше, ніж у Франції [2]. Крім базисної терапії пацієнтів з ІХС, потенційним напрямом лікування є застосування підходів, які здатні покращити енергозабезпечення кардіоміоцитів, мікроциркуляцію та функцію ендотелію судин [3].
COVID‑19 чинить суттєвий негативний вплив на серцево-судинну (СС) систему. Наявні у пацієнтів серцево-судинні захворювання (ССЗ) до інфікування COVID‑19 та вірусне навантаження асоційовані з пошкодженням міокарда й гіршими результатами. Пандемія триває, зокрема, з’являються нові варіанти коронавірусу, тож розуміння патофізіології та відповідних клінічних наслідків допоможе розширити уявлення про основні механізми розвитку хвороби. Вирішальне значення також мають встановлення нових біомаркерів СС-ускладнень і розробка ефективних методів лікування COVID‑19. Пропонуємо до вашої уваги консенсусний документ Європейського товариства кардіологів (ESC) та Асоціації невідкладної кардіологічної допомоги (ACVC) у співпраці з Європейською асоціацією серцевого ритму (EHRA) 2021 р., у якому підсумовано сучасні відомості про ураження СС-системи на тлі COVID‑19 та його постгострі наслідки. .
Незважаючи на сучасні методи відновлення коронарного кровотоку, показники смертності після перенесеного гострого коронарного синдрому (ГКС) залишаються досить високими, що пов’язують з ушкодженням міокарда під час реперфузії. Відповідно до сучасних уявлень, провідною причиною цього явища є ішемічний каскад, який може запускати процеси загибелі кардіоміоцитів і бути відповідальним за 50% кінцевого розміру зони некрозу при ГКС, виникнення реперфузійних аритмій, систолічної мікросудинної дисфункції. Саме тому адекватне блокування ішемічного каскаду, спрямоване на елімінацію активних форм кисню, активацію антиоксидантів, на сьогодні вважається важливою складовою менеджменту пацієнтів із ГКС. .
Синдром Леффлера
Синдром Леффлера — аллергическая
болезнь, при которой в периферической крови
увеличивается чисто эозинофилов, в одном или
двух легких образуются эозинофильные
инфильтраты. Заболевание также известно как
простая легочная эозинофилия, эозинофильный
летучий инфильтрат легкого, простая
эозинофильная пневмония.
Различают два синдрома Леффлера:
1. Синдром Леффлера 1-эозинофильный летучий
инфильтрат
2. Синдром Леффлера 2- рестриктивная кардиомиопатия
Синдром Леффлера 1-эозинофильный летучий
инфильтрат , Эозинофильная астма, пневмония Лёффлера.
Данный синдром фиксируют во всех странах, но чаще
всего в тропическом климате. Частота среди женщин и
мужчин одинаковая, в основном бывает в возрасте от 16
до 40 лет.
Классификация
По патогенезу и этиологии (причинам)
делится на три вида:
1. обусловленный сенсибилизацией к
аэроаллергенам
2. вызванный паразитарной инвазией
3. развившийся вследствие лекарственной
аллергии
Симптомы и жалобы
Жалоб у большей части больных нет. Редко бывает
кашель, в основном сухой или с вязкой мокротой в
небольшом количестве, может быть примесь крови. Еще
одна жалоба — субфебрильная температура. Часто у
больного — признаки бронхоспазма. Аускультативные
методы обнаруживают сухие хрипы, локализация которых в
основном в верхних отделах лёгких.
При массивной гематогенной диссеминации личинок и яиц
паразитов (трихинелл, шистосом, аскарид) в органы и ткани
организма, включая легочную ткань, появляются такие
симптомы:
Кашель
Одышка
сыпь на коже
Лихорадка
пневмонит (хрипы в легких)
Причины и возбудители
Синдром Леффлера первый раз был описан
профессором Цюрихского университета Вильгельмом
Лёффлером в 1932 году. Исследователем было доказано,
что в развитии эозинофильного воспалении легочной
ткани играют роль гельминты: их личинки проходят в
процессе миграции через ткани легкого. На сегодня под
синдромом Леффлера подразумевается ряд
воспалительных процессов в одном или обоих лёгких,
имеющих различную этиологию.
Диагностика
Диагноз синдрома в основном трудностей для врача не вызывает.
Типичными проявлениями являются высокая эозинофилия крови в
сочетании с летучими легочными инфильтратами. При установлении
причины, тем не менее, трудности довольно частые. Данные
аллергологического анамнеза очень важны для врача-диагноста:
ранее обнаруженные аллергические заболевания
чёткая связь симптомов с профессиональными и бытовыми
факторами
сезонные обострения риноконъюнктивального синдрома и астмы
фармакологический анамнез
семейный анамнез
Для обнаружения аллергических заболеваний, играющих роль в
патогенезе, нужна консультация аллерголога. При подозрении на
аллергический ринит прибегают к помощи отоларинголога.
Лабораторные исследования необходимы при подозрении на
синдром Леффлера. Эта информация позволяет подтвердить
данные физикального обследования и анамнеза. Общий
анализ мокроты часто говорит о эозинофилах и кристаллах
Шарко-Лейдена. В общем анализе крови в начале развития
болезни зачастую обнаруживают высокую эозинофилию (до
20%). Но, когда процесс хронизируется, эозинофилы
приходят в норму. В части случаев в крови находят высокое
содержание IgE — показатель достигает отметки до 1000
МЕ/мл.
Кожные тесты проводят, чтобы обнаружить причину,
возбудителя (споры низших грибов, пальцы, аллергены
гельминтов). По показаниям врач может назначить
провокационные назальные и ингаляционные пробы.
Обязательно во всех случаях проводят анализ кала. Присутствие в
организме некоторых гельминтов дает шанс на обнаружение яиц
паразита. При этом учитывается цикл их развития. Например, при
первичном заражении аскаридами личинки внедряются в лёгкие лишь
спустя одну или две недели, а яйца их в кале больного можно найти
только спустя два или три месяца. При токсокарозе личинки паразита в
организме человека не развиваются до взрослого состояния, потому
анализ кала не обнаружит их яиц.
Врачи используют для диагностики серологические тесты,
включающие реакцию связывания комплемента и реакцию
преципитации. Применяются и клеточные тесты: реакция
дегрануляции тучных клеток с соответствующими аллергенами,
реакция дегрануляции базофилов по Шелли, выявление специфических
IgE с помощью радиоаллергосорбентного теста и ИФА.
Инструментальная диагностика
Рентгенологическое исследование обнаруживает в легкие
нечёткие инфильтраты округлой формы (единичные или
множественные), которые локализируются субплеврально, в
основном в верхних отделах двух легких. Если
инфильтративное воспаление протекает долгое время, в
исходе болезни может отмечаться формирование фиброзных
узлов, которые сливаются, формируя кистозные полости.
Оценка бронхиальной проходимости проводится при
помощи исследования ФВД (функции внешнего дыхания). В
части случаев необходимо проведение бронхомоторных
тестов.
Лечение
Больной может выздороветь спонтанно, без
специального лечения. К фармакотерапии часто не
прибегают. Основной целью лечения является, говоря
научным языком, элиминация этиологического фактора.
То есть, например, выведение токсокар из организма и
препятствие их дальнейшему размножению внутри.
Проводят дегельминтизацию, по возможности,
устраняют контакт с аллергенами (аэроаллергенами,
лекарствами), если именно они лежат в основе развития
заболевания.
Противопаразитарная терапия
При глистной инвазии больному назначают
противопаразитарные лекарственные средства. В последнее
время часто назначают такие эффективные и хорошо
переносимые лекарства:
карбендацим (принимать внутрь, однократно 0.01 г/кг)
альбендазол (принимать внутрь, однократно 400 мг;
прописывают только пациентам старше 2 лет)
пирантел внутрь 10 мг однократно
мебендазол (принимают 100 мг внутрь один раз, можно
только пациентам от 2 лет)
Лечение глюкокортикоидами
Читайте также:
