Синдром Noonan. Причины и проявления синдрома Ноонан
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
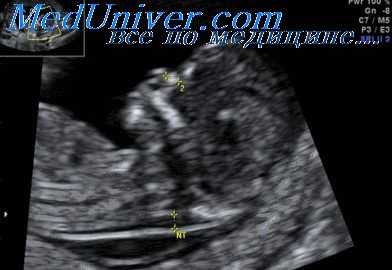
Синдром Нунан у плода. Секвенция маловодия
В 1968 году J.A. Noonan сообщил о 19 клинических наблюдениях, при которых отмечались нарушения, очень похожие на те, которые были описаны Н.Н. Turner. Среди этих пациентов у 17 был стеноз легочного ствола и у 2 - функционирующий артериальный проток (12 из них были мужского пола и 7 - женского). Другие аномалии включали лимфатический отек; крыловидные складки шеи; деформацию грудины, обусловленную преждевременным закрытием швов и формированием килевидной грудной клетки в верхних отделах и впалой - в нижних; коарктацию аорты; крипторхизм и тромбоцитопению.
Несмотря на то что данный синдром поражает оба пола, существует значительное фенотипическое сходство с фенотипом лиц с синдромом Тернера (Turner).
Синонимы. Синдром Тернера (Turner) с нормальными половыми хромосомами, псевдо-Тернер (Turner), мужской синдром Тернера (Turner) и синдром Ульриха (Ullrich).
Распространенность. Варьирует от 0,25 до одного на 10 000 родов.
Этиология. Аутосомно-доминантное наследование со спорадически возникающими новыми мутациями.
Диагностика. Начальные проявления синдрома в первом триместре беременности наиболее вероятно могут быть представлены кистозной шейной гигромой, которая в более поздние сроки гестации может уменьшаться и приводить к формированию избыточной шейной складки или шейных птеригумов. Также выявляются пороки сердца, гидрото-рокс и водянка. У некоторых плодов синдром Нунан (Noonan) может быть заподозрен на основании результатов маркеров тройного биохимического скрининга.
Генетические нарушения. Первоначально предполагался Х-сцепленный доминантный тип наследования моногенной мутации или субмикроскопической делеции. В настоящее время признано, что один из генов, ответственных за возникновение синдрома Нунана (Noonan), локализован в хромосоме 12q24.2-q24.31.
Дифференциальный диагноз. Семейные формы наследования при синдроме Тернера (Turner) (может быть исключен у плодов мужского пола или путем кариотипирования) являются маловероятными, в то время как синдром Нунана (Noonan) имеет выраженную семейную предрасположенность. Другие диагнозы включают трисомию 21 и синдром Эскобара (Escobar).
Прогноз. Достаточно нормальная ожидаемая продолжительность жизни для тех, у кого нет серьезных осложнений, связанных с заболеваниями сердца.
Секвенция маловодия
Последствия маловодия представляют сочетание связанных между собой состояний, возникающих вследствие выраженного уменьшения количества амниотической жидкости. Обычно это наблюдается при двухсторонней агенезии почек (34%) или хроническом подтекании околоплодных вод. К такому сочетанию признаков могут также приводить другие состояния, такие как двухсторонняя мультикистозная дисплазия почек (34%), односторонняя агенезия почки и контралатеральная мультикистозная дисплазия почки (9%), тубулярная дисге-незия почек; аутосомно-рецессивная (инфантильная) поликистозная болезнь, нефункционирующие, но морфологически нормальные мочевыводящие пути (3%) и нарушения плацентации (например, имплантация на внутриматочной перегородке).
У 50% таких плодов имеются аномалии, не являющиеся следствием маловодия (ассоциация VACTERL, синдромы Мекеля (Meckel) и Смита-Лемли-Опица (Smith-Lemli-Opitz)).
При секвенции маловодия уменьшение количества околоплодных вод вызывает гипоплазию легких и компрессию плода. Компрессия плода приводит к аномалиям положения конечностей и вывихам, а также к патологии лица (уплощение лица и низкое расположение ушных раковин).
В неонатальном периоде такие дети погибают от дыхательной недостаточности (вследствие пневмоторакса).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Синдром Бругада
Синдром Бругада – генетически обусловленное кардиологическое состояние, характеризующееся различными нарушениями работы сердца, которые приводят к резкому повышению риска развития внезапной сердечной смерти. Симптомами этого состояния являются приступы пароксизмальной тахикардии, обмороки, фибрилляции предсердий и жизнеугрожающие фибрилляции желудочков, чаще всего возникающие во время сна. Диагностика синдрома Бругада производится на основании характерного симптомокомплекса, электрокардиографических данных и изучения наследственного анамнеза, некоторые формы патологии определяются молекулярно-генетическими методами. Специфического лечения заболевания не существует, применяют антиаритмическую терапию, используют разнообразные кардиостимуляторы.
Общие сведения
Синдром Бругада – группа генетических нарушений, приводящих к изменению ионной проницаемости мембран кардиомиоцитов, вследствие чего возникают патологии ритма и проводимости, создающие повышенный риск внезапной сердечной смерти. Впервые такое состояние было описано в 1992 году двумя братьями – бельгийскими кардиологами испанского происхождения Хосе и Педро Бругада, обратившими внимание на взаимосвязь определенных электрокардиологических проявлений и нарушений сердечного ритма. В настоящее время установлено, что синдром Бругада является наследственным состоянием с предположительно аутосомно-доминантным механизмом передачи, удалось выявить несколько генов, мутации которых способны вызывать это заболевание. По некоторым данным, практически половина всех случаев внезапной сердечной смерти в мире обусловлены именно этой патологией. Распространенность синдрома Бругада различается в разных регионах планеты – в странах Америки и Европы она составляет примерно 1:10 000, тогда как в африканских и азиатских государствах это заболевание встречается чаще – 5-8 случаев на 10 000 населения. Синдром Бругада примерно в 8 раз чаще поражает мужчин, чем женщин, проявления патологии возникают в разном возрасте, но чаще всего выраженная симптоматика наблюдается в 30-45 лет.
Причины и классификация синдрома Бругада
Причина развития нарушений при синдроме Бругада заключается в патологической работе ионных каналов кардиомиоцитов, в основном натриевых и кальциевых. Их дефект, в свою очередь, обусловлен мутациями генов, кодирующих белки ионных каналов. Методами современной генетики удалось достоверно идентифицировать 6 основных генов, поражение которых приводит к развитию синдрома Бругада, в отношении еще нескольких существует подозрение, но отсутствует необходимая доказательная база. На этой основе построена классификация данного состояния, включающая в себя 6 форм заболевания (BrS):
- BrS-1 – наиболее распространенный и хорошо изученный вариант синдрома Бругада. Обусловлен мутацией гена SCN5A, расположенного на 3 хромосоме. Продуктом экспрессии данного гена является альфа-субъединица натриевого канала 5 типа, широко представленного в миокарде. Помимо синдрома Бругада мутации данного гена становятся причиной большого количества наследственных кардиологических патологий – семейной фибрилляции предсердий, синдрома слабости синусового узла 1 типа и ряда других.
- BrS-2 – данная разновидность синдрома Бругада вызывается дефектами гена GPD1L, который локализован на 3 хромосоме. Он кодирует один из компонентов глицерол-3-фосфат дегидрогеназы, принимающей активное участие в работе натриевых каналов кардиомиоцитов.
- BrS-3 – этот тип синдрома Бругада обусловлен дефектом гена CACNA1C, расположенного на 12 хромосоме. Продуктом его экспрессии является альфа-субъединица кальциевого канала L-типа, также присутствующего в кардиомиоцитах.
- BrS-4 – как и в предыдущем случае, причиной развития синдрома Бругада 4 типа является поражение потенциал-зависимых кальциевых каналов L-типа. Оно обусловлено мутацией гена CACNB2, расположенного на 10 хромосоме и кодирующего бета-2-субъединицу вышеуказанных ионных каналов.
- BrS-5 – распространенная разновидность синдрома Бругада, обусловленная мутацией гена SCN4B, локализованного на 11 хромосоме. Он кодирует белок одного из малых натриевых каналов кардиомиоцитов.
- BrS-6 – вызывается дефектом гена SCN1B, расположенного на 19 хромосоме. Во многом этот вариант синдрома Бругада схож с первым типом заболевания, поскольку в этом случае тоже поражаются натриевые каналы 5 типа. Ген SCN1B кодирует бета-1-субъединицу этого ионного канала.
Кроме того, в развитии синдрома Бругада подозреваются мутации генов KCNE3, SCN10A, HEY2 и некоторых других. Однако на сегодняшний день достоверно доказать их роль в возникновении данного заболевания не удается, поэтому пока количество генетических вариантов синдрома Бругада ограничено шестью. Наследование всех форм данной патологии неясно, лишь у 25% больных определяются признаки аутосомно-доминантной передачи. Предположительно имеет место доминантный тип наследования с неполной пенетрантностью либо влияние спонтанных мутаций. Также непонятны причины того, почему синдром Бругада чаше поражает мужчин, нежели женщин – возможно, выраженность проявлений заболевания находится в зависимости от гормонального фона больного.
Патогенез нарушений при любой форме синдрома Бругада примерно одинаков – из-за изменения проницаемости мембраны кардиомиоцитов для ионов натрия происходит нарушение трансмембранного потенциала и взаимосвязанных с ним характеристик возбудимых тканей: возбудимости, сократимости, передачи возбуждения окружающим клеткам. В результате возникают блокады проводящих путей сердца (пучков Гиса), тахиаритмии, усиливающиеся при повышении вагусных воздействий (во время сна). Степень выраженности симптомов при синдроме Бругада зависит от доли пораженных натриевых каналов. Усиливать проявления болезни могут некоторые лекарственные вещества, способны ингибировать ионные каналы сердца.
Симптомы синдрома Бругада
Обычно больные синдромом Бругада жалуются на беспричинное головокружение, обмороки, частые приступы тахикардии, особенно в ночное время или в период дневного отдыха. Иногда отмечается аномальная реакция на прием некоторых лекарственных средств – антигистаминных препаратов первого поколения, бета-адреноблокаторов, ваготонических средств. Их применение при синдроме Бругада может сопровождаться усилением побочных явлений, а также сердцебиениями, обмороками, падением артериального давления и другими негативными проявлениями. Никаких других симптомов при этом заболевании не выявляется, чем объясняется редкое обращение пациентов к кардиологу или другим специалистам – в ряде случаев проявления синдрома Бругада достаточно редкие и слабовыраженные. Тем не менее, это не снижает риск внезапной сердечной смерти, обусловленной данной патологией.
Диагностика синдрома Бругада
Для определения синдрома Бругада используют электрокардиографические методики, изучение наследственного анамнеза пациента, молекулярно-генетический анализ. Заподозрить наличие этого заболевания можно при наличии синкопальных явлений (головокружений, обмороков) неясного происхождения, жалоб на внезапные приступы тахиаритмий. Изменения на электрокардиограмме при синдроме Бругада могут определяться на фоне полного отсутствия клинических симптомов заболевания. При этом кардиологи выделяют три основных типа изменений на ЭКГ, незначительно отличающихся между собой. Типичная картина электрокардиограммы при синдроме Бругада сводится к элевации (подъему) сегмента ST над изоэлектрической линией и отрицательному зубцу Т на правых грудных отведениях (V1-V3). Также могут определяться признаки блокады правой ножки пучка Гиса, при холтеровском мониторировании выявляются приступы пароксизмальной тахикардии или фибрилляции предсердий.
Как правило, наследственный анамнез больных синдромом Бругада отягощен – среди родственников или предков имеются случаи летальных исходов от сердечной недостаточности, смерти во сне или внезапной сердечной смерти. Этот факт, а также наличие вышеперечисленных симптомов и изменений на ЭКГ дает основания для проведения молекулярно-генетической диагностики. В настоящее время врачи-генетики в подавляющем большинстве клиник и лабораторий производят определение синдрома Бругада, вызванного только мутациями генов SCN5A и SCN4B (1 и 5 типы патологии), в отношении остальных форм методы генетической диагностики пока не разработаны. Дифференцировать это состояние следует с реакцией организма на прием некоторых лекарственных средств, хроническим миокардитом и другими кардиологическими патологиями.
Лечение и профилактика синдрома Бругада
Специфических методов лечения синдрома Бругада на сегодняшний момент не существует, поэтому ограничиваются только борьбой с проявлениями этого заболевания, а также профилактикой жизнеугрожающих приступов тахиаритмии и фибрилляций. Наиболее широко при этом состоянии применяется амиодарон, несколько реже используются дизопирамид и хинидин. Однако медикаментозная терапия при синдроме Бругада в ряде случаев является малоэффективной, единственным надежным средством профилактики аритмии и внезапной сердечной смерти в этом случае становится имплантация кардиовертера-дефибриллятора. Только этот прибор способен оценивать работу миокарда больного и при патологических и жизнеугрожающих изменениях сердечного ритма приводить ее в норму посредством электрического разряда.
Многие традиционные антиаритмические препараты при синдроме Бругада противопоказаны, так как они угнетают деятельность натриевых каналов кардиомиоцитов и усиливают проявления патологии. К средствам, запрещенным при этом заболевании, относят аймалин, пропафенон, прокаинамид. Поэтому больным синдромом Бругада следует обязательно сообщать специалистам об имеющемся диагнозе, чтобы избежать назначения неверного антиаритмического средства. При наличии подобного заболевания у родственников или случаях внезапной сердечной смерти в роду следует регулярно производить ЭКГ-исследование для как можно более ранней диагностики этого состояния.
Прогноз синдрома Бругада
Прогноз синдрома Бругада неопределенный, так как степень выраженности симптомов заболевания очень вариабельна и находится в зависимости от ряда факторов. При наличии только электрокардиографических проявлений патологии без выраженных клинических симптомов прогноз относительно благоприятный. Если синдром Бругада сопровождается потерями сознания и приступами аритмии – без установки кардиовертера-дефибриллятора риск внезапной сердечной смерти возрастает во много раз. При применении данного прибора прогноз несколько улучшается, поскольку устройство может круглосуточно корректировать патологические изменения сердечного ритма.
Синдром Нунан
Синдром Нунан – генетическая патология, которая характеризуется развитием у больных симптомокомплекса, сходного с болезнью Шерешевского-Тернера, но встречается у лиц обоих полов и не сопровождается изменением количества хромосом. Симптомами этой патологии являются малый рост, гипертелоризм, крыловидные складки на шее, пороки развития мочеполовой и сердечно-сосудистой систем, у мужчин – бесплодие. Диагностика синдрома Нунан производится на основании данных настоящего статуса пациента, изучения его наследственного анамнеза, молекулярно-генетических и цитологических исследований. Специфического лечения патологии не существует, применяют симптоматическую и поддерживающую терапию.
Синдром Нунан (тернероидный синдром с нормальным кариотипом) – наследственное заболевание, которое сопровождается развитием у больных обоих полов клинической картины синдрома Шерешевского-Тернера при сохранении нормального кариотипа. Впервые это заболевание было описано в 1962 году детским кардиологом Жаклин Нунан, которая обратила внимание на сочетание пороков сердца с низкорослостью, наличием крыловидных складок на шее и другими нарушениями. В настоящее время выяснена генетическая природа синдрома Нунан – это заболевание с аутосомно-доминантным типом наследования, однако в основном передача идет по материнской линии. Значительная часть случаев патологии обусловлена спонтанными мутациями. Причиной передачи по материнской линии является наличие у мужчин выраженных аномалий развития мочеполовой системы вплоть до бесплодия. Распространенность синдрома Нунан по различным данным составляет от 1:1000 до 1:16 000 новорожденных. Это заболевание в среднем чаще встречается у девочек и протекает у них несколько легче, чем у мальчиков. Генетические дефекты при синдроме Нунан обнаруживаются примерно у половины больных, поэтому врачи-генетики продолжают изучение этого заболевания с целью более точного определения его причин.
Причины синдрома Нунан
По данным современной генетики, синдром Нунан обусловлен мутациями гена PTPN11, расположенного на 12 хромосоме. Он кодирует последовательность одного из белков-регуляторов клеточного ответа на разнообразные внешние влияния. Другие дефекты этого гена обуславливают развитие таких заболеваний, как ювенильная миеломоноцитарная лейкемия, метахондроматоз и некоторые наследственные пороки развития сердечно-сосудистой системы. В настоящий момент описано несколько десятков мутаций гена PTPN11, в основном дефекты расположены на 3, 7 и 13 экзонах. На этих участках кодируются домены протеина, структура которых обуславливает переход сигнального белка в активное состояние. Изменение аминокислотной последовательности резко снижает активность и нарушает работу данного соединения, что приводит к развитию синдрома Нунан.
Дефектами гена PTPN11 обусловлена лишь половина случаев развития синдрома Нунан, в остальных случаях этиология заболевания остается неизвестной. Мутации наследуются по аутосомно-доминантному механизму, однако большинство новых случаев заболевания обусловлено спонтанными герминативными генетическими дефектами. Семейные варианты синдрома Нунан обычно характеризуются передачей по материнской линии, так как у больных женщин, в отличие от мужчин, сохраняется фертильность и возможность зачать ребенка. Нарушение клеточного ответа на различные воздействия приводит к формированию пороков сердечно-сосудистой, мочевыделительной и отчасти опорно-двигательной системы. Интеллектуальное развитие при синдроме Нунан страдает в различной мере – от выраженной умственной отсталости до незначительно сниженного или нормального интеллекта.
Симптомы синдрома Нунан
Клиническая картина синдрома Нунан характеризуется значительной схожестью с синдромом Шерешевского-Тернера – низкий рост (высшая граница порядка 150-160 сантиметров), наличие крыловидных складок на шее, деформация локтевых суставов. У пациентов выявляются характерные черты лица – широкая переносица с гипертелоризмом, птоз (опущение уголков рта вниз), антимонголоидный разрез глаз, низкое расположение ушных раковин, нередко сопровождающееся их деформацией. Лицо часто асимметричное. Шея у больных синдромом Нунан короткая, грудная клетка впалая, пальцы на руках укорочены. Также наблюдаются нарушения со стороны лимфатической системы – возможны лимфатические отеки нижних конечностей и (реже) кистей.
Со стороны внутренних органов при синдроме Нунан наиболее часто встречаются разнообразные пороки сердца – это может быть стеноз легочного ствола, дефект межжелудочковой перегородки и другие нарушения. Нередки патологии мочевыделительной системы. У таких больных часто отмечается гидронефроз, гипоплазия почек или даже агенезия одной из них, в старшем возрасте все это может приводить к хронической почечной недостаточности. Половое развитие при синдроме Нунан особенно сильно страдает у больных мужского пола – у них часто развивается гипоплазия яичек, крипторхизм, олиго- или азооспермия, в 90% случаев такие пациенты остаются бесплодными. У девочек с данным заболеванием недоразвитие половой системы выражено слабее, в основном наблюдается гипоплазия наружных половых органов и более позднее наступление менструаций, однако фертильность может быть сохранена.
Умственное развитие при синдроме Нунан обычно несколько снижено по сравнению со здоровыми сверстниками, иногда выявляются различные степени умственной отсталости. Среди других нарушений при этом заболевании отмечают повышенную кровоточивость, более легкое развитие гипертрофических и келоидных рубцов. В некоторых случаях наблюдается снижение уровня иммунитета и плоскостопие. Как правило, больные синдромом Нунан сохраняют уровень умственного и физического развития, позволяющий им выполнять определенную работу – иными словами, инвалидизация таких пациентов возникает не всегда.
Диагностика синдрома Нунан
Для выявления синдрома Нунан используют метод общего осмотра, изучение наследственного анамнеза больного, кардиологические исследования, генетические и цитогенетические анализы. Вспомогательную роль в диагностике этого заболевания играют анализы на уровень половых и других гормонов, изучение функционирования мочевыделительной и половой системы больных. При осмотре девочек с синдромом Нунан определяются изменения, нередко приводящие к постановке диагноза синдром Шерешевского-Тернера – низкий рост, крыловидные складки, характерный тип лица. Однако предположение о наличии данного заболевания опровергают результаты изучения кариотипа больных – у них определяется нормальное количество хромосом (46 ХХ у девочек и 46 XY у мальчиков). Таким образом, цитогенетический анализ является основным методом дифференциального диагноза синдромов Нунан и Шерешевского-Тернера.
При проведении кардиологических исследований (электрокардиографии, эхокардиографии и других) при синдроме Нунан в 80% случаев выявляются разнообразные врожденные пороки сердца – стеноз легочного ствола, дефект межжелудочковой перегородки, открытый Боталлов проток. У больных старшего возраста может регистрироваться гипертрофия различных отделов миокарда. Довольно часто у больных синдромом Нунан при проведении ультразвукового исследования определяются аномалии развития почек – от гидронефроза и гипоплазии до полного отсутствия (агенезии) одной из них. У пациентов мужского пола нередко определяется крипторхизм, который следует дифференцировать с полной агенезией яичек, что также может иметь место при этом состоянии. Спермограмма обнаруживает азооспермию или снижение количества активных сперматозоидов. При проведении УЗИ у девочек с синдромом Нунан выявляют уменьшенные размеры матки и яичников, но тяжелые пороки развития внутренних половых органов нередко отсутствуют.
Анализ крови на различные гормоны при синдроме Нунан у мальчиков обычно подтверждает снижение уровня тестостерона различной степени – от нижней границы нормы до выраженного дефицита. При этом уровень гипофизарного гонадотропина довольно ощутимо повышается у пациентов обоих полов. Концентрация гормона роста, несмотря на низкорослость больных синдромом Нунан, находится в пределах нормы или даже несколько повышена. Молекулярно-генетический анализ при этом заболевании сводится к секвенированию гена PTPN11 с целью выявления мутаций. Отсутствие мутаций не является полноценным критерием для исключения синдрома Нунан – по последним данным, дефекты PTPN11 имеют место только у половины таких больных. В настоящее время основным поводом для постановки диагноза является наличие характерной клинической картины на фоне нормального кариотипа больных.
Лечение синдрома Нунан
Специфического лечения синдрома Нунан на сегодняшний день не существует, применяются разнообразные симптоматические мероприятия, в том числе и хирургического характера. Чаще всего помощь хирургов уже в раннем возрасте требуется для коррекции врожденных пороков сердца, характерных для этого заболевания. У мальчиков может определяться длительный крипторхизм, поэтому для снижения риска злокачественного перерождения тканей яичек осуществляют исправление этого дефекта оперативным путем. Кроме того, при синдроме Нунан может потребоваться вмешательство хирургов в случае выраженных нарушений формирования мочевыделительной системы или выраженного лимфостаза нижних конечностей. При проведении операций необходимо учитывать повышенную склонность таких больных к развитию кровотечений.
Консервативное лечение у мальчиков с синдромом Нунан обычно включает в себя заместительную терапию андрогенами – это позволяет уменьшить проявления гипогонадизма. При нарушении функций мочевыделительной системы и развитии хронической почечной недостаточности показан регулярный гемодиализ. В тяжелых случаях ставится вопрос о трансплантации почки, однако при синдроме Нунан потребность в этом возникает достаточно редко. Если больная с данным синдромом вынашивает ребенка, требуется тщательный патронажный контроль над течением беременности и поддерживающее лечение витаминно-минеральными комплексами.
Прогноз и профилактика синдрома Нунан
Прогноз синдрома Нунан относительно жизни больного довольно благоприятен, особенно при правильно и своевременно производимых симптоматических мероприятиях – коррекции пороков сердца, крипторхизма и других нарушений. Больные должны проходить регулярное обследование у специалистов различного профиля, главным образом у кардиолога, уролога или андролога. Это позволяет выявить возможные осложнения синдрома Нунан на ранних этапах и начать их своевременную терапию. Каких-либо иных методов профилактики этого состояния на сегодняшний момент не существует за исключением пренатальной диагностики. Следует учитывать, что при наличии заболевания у будущей матери вероятность развития синдрома Нунан у ребенка (при генетически здоровом отце) составляет 50%.
Синдром Корнелии де Ланге ( Амстердамская карликовость , Амстердамский нанизм , Синдром Брахмана де Ланге )
Синдром Корнелии де Ланге – это генетически опосредованное мультисистемное заболевание, включающее множественные аномалии развития и олигофрению. Фенотипические признаки синдрома представлены микробрахицефалией, заниженной линией роста волос, тонкими сросшимися бровями, широкой запавшей переносицей, микрогенией и др. Характерна низкорослость, возможны врожденные пороки (ВПС, мочеполовые аномалии, пилоростеноз, диафрагмальная грыжа). При диагностике учитываются клинические критерии и результаты генетического тестирования. Дети с данной патологией нуждаются в симптоматической терапии, дефектологической помощи.
МКБ-10
Синдром, характеризующийся комплексом стигм дизэмбриогенеза, пороками развития и умственной неполноценностью, был описан в 1916 г. доктором медицины В. Брахманом. Однако свое официальное название заболевание получило в честь педиатра из Амстердама Корнелии де Ланге, которая подробно описала сразу два клинических наблюдения в 1933 г. В литературе наряду с общепринятым – синдром Корнелии де Ланге – встречаются названия «синдром Брахмана де Ланге», «амстердамская карликовость/нанизм». Патология регистрируется с частотой 1:10000–1:30000, распространенность не имеет географических, расовых и гендерных различий.
Причины
Синдрому свойственна генетическая неоднородность, на данный момент известно три гена, ответственных за данную патологию. Около 50% описанных случаев связано с дефектами в гене NIPBL, кодирующем белок делангин (5p13.2), около 5% – с мутациями гена когезинового комплекса SMC1A (Xp11.22). Один известный случай ассоциирован с нарушением другой субъединицы когезина, кодируемой SMC3 (10q25). Примерно в 40% наблюдений синдром Корнелии де Ланге вызывается неизвестными мутациями, которые еще только предстоит вычислить.
Большая часть мутаций NIPBL являются вновь возникшими, поэтому чаще больные дети рождаются от генетически здоровых родителей. Однако известны наблюдения семейных случаев с аутосомно-доминантным наследованием. Ген SMC1A расположен на половой Х-хромосоме – при его дефектах наследование сцеплено с полом (болеют мужчины, женщины выступают гетерозиготными носительницами).
Факторы риска
Спонтанные патологические изменения генетического материала могут быть обусловлены следующими факторами:
- интоксикациями и инфекциями беременной, перенесенными в первом триместре;
- эндокринопатиями беременной;
- лекарственным (в т. ч. цитостатическим), радиационным воздействием на плод;
- близкородственным браком;
- поздними родами (у женщин старше 35 лет).
При отсутствии генных мутаций у родителей риск повторного рождения ребенка с синдромом Брахмана де Ланге в одной семье равен 2-5%.
Патогенез
Молекулярную основу патологии составляет нарушение функционирования белков когезинового комплекса. Когезины играют важнейшую роль в процессе клеточного деления. Они располагаются внутри хромосомы, сцепляя и удерживая между собой две сестринские хроматиды. Другие, не менее важные функции когезина – это репарация ДНК и регуляция экспрессии генов.
По всей видимости, воздействие различных мутагенных факторов в критические периоды приводит к неправильному делению клеток и закладке органов. Патологоанатомическое исследование выявляет значительные изменения головного мозга: аплазию оперкулярной коры, недоразвитие роландовой борозды, запаздывающую миелинизацию и и миелодегенерацию. Также обнаруживаются пороки развития почек, надпочечников, гонад, сердца, гипоплазия тимуса.
Классификация
По степени выраженности фенотипических проявлений выделяют 2 варианта синдрома Корнелии де Ланге. Они различаются как проявленностью внешней симптоматики, так и витальным прогнозом:
- классический: значительная задержка развития плода, грубые пороки развития и выраженная умственная неполноценность;
- доброкачественный: лицевые и скелетные аномалии без грубых пороков внутренних органов, пограничная ЗПР. Дефекты генов SMC3 и SMC1A коррелируют с доброкачественным течением синдрома.
Симптомы
Физическое развитие
Младенцы с синдромом Корнелии де Ланге рождаются с низкими росто-весовыми показателями: средняя масса составляет 2100-2300 г. Они малоактвны, редко выражают свои потребности криком. С первых дней отмечается вялое сосание груди, частые срыгивания, диспепсические расстройства. Такие проблемы нередко вынуждают кормить ребенка через назогастральный зонд или гастростому. Дети часто страдают рецидивирующими респираторными инфекциями. Физическое и психомоторное развитие отстает от возрастной нормы.
Фенотипические признаки
Внешний вид ребенка очень своеобразный. Перечисленные черепно-лицевые дисморфии входят в число основных критериев при диагностике патологии:
- аномалии черепа и лицевого скелета: микро- и брахицефалия, готическое небо, небные расщелины, микрогнатия;
- черты лица: тонкие сросшиеся брови, длинные ресницы, широкая переносица с седловидной деформацией и широкими ноздрями, низко посаженные уши, тонкие губы с опущенными вниз уголками;
- аномалии кожи и ее придатков: на голове ‒ густые волосы с низкой линией роста, на теле – гипертрихоз, мраморная кожа.
Скелетные аномалии
Пациенты имеют воронкообразную грудную клетку, короткую шею. В области позвоночного столба могут обнаруживаться такие дефекты, как Spina bifida, люмбализация или сакрализация позвонков. Присутствует гипоплазия кистей и стоп, дефекты развития пальцев (клинодактилия, синдактилия, олигодактилия), суставные контрактуры, дисплазия и врожденный вывих бедра. Отставание в росте сохраняется и во взрослом возрасте: мужчины с амстердамским нанизмом имеют рост около 156 см, женщины ‒ 131 см.
Неврологические и психопатологические проблемы
Больные с классической формой синдрома Корнелии де Ланге имеют интеллектуальные нарушения в степени имбецильности или глубокой дебильности. При мягкой форме интеллектуальный дефект выражен нерезко – больные имеют диагноз ЗПР. У четверти пациентов эпизодически отмечается судорожный синдром.
Поведенческие особенности представлены синдромом гиперактивности, тревожностью, признаками ОКР. Отмечается агрессивность по отношению к окружающим, аутоагрессия и самоповреждающее поведение, стереотипные действия. Речевые расстройства носят системный характер, страдает вербальная коммуникация, при небных расщелинах возникает ринолалия.
Зрительные нарушения
Распространенными проблемами со стороны зрительной системы выступают миопия, птоз века, блефарит. Реже диагностируется косоглазие, микрокорнеа, в единичных наблюдениях выявлены катаракта и глаукома. При тяжелом варианте синдрома Корнелии де Ланге высок риск отслойки сетчатки и атрофии зрительного нерва.
Пороки внутренних органов
Почти в половине случаев синдрому сопутствуют врожденные кардиальные пороки: дефекты перегородок сердца (аортолегочной, межжелудочковой, межпредсердной), коарктация аорты, тетрада Фалло. Аномалии развития ЖКТ чаще всего представлены гастроэзофагеальным рефлюксом (90%), может выявляться диафрагмальная грыжа (2%), пилоростеноз (4%), незавершенный поворот кишечника (10%). Частыми патологиями мочеполовой системы выступают поликистозная или подковообразная почка, гидронефроз, двурогая матка, неопущение яичек, гипоспадия. Характерна задержка полового развития.
Осложнения
Тяжелые варианты синдрома ассоциированы с пороками развития, несовместимыми с жизнью, и гибелью новорожденных вскоре после рождения. При более мягком течении тормозить развитие ребенка могут рецидивирующие синуситы, отиты с последующим развитием кондуктивной тугоухости. На фоне гастроэзофагеального рефлюкса нередко возникает анемия, аспирационная пневмония, стеноз пищевода, иногда − пищевод Барретта, аденокарцинома. В бытовом плане пациенты с синдромом Корнелии де Ланге нуждаются в уходе, всесторонней помощи. Им требуется специальное обучение и дефектологическое сопровождение.
Диагностика
При рождении диагностическая гипотеза о наличии у ребенка синдрома Корнелии де Ланге может быть выдвинута на основании визуально определяемых дефектов. Новорожденный должен быть осмотрен неонатологом, детским кардиологом, хирургом, неврологом. В плановом порядке проводятся консультации челюстно-лицевого хирурга, эндокринолога, ортопеда, логопеда. Диагностическая тактика включает:
- Антропометрию. При рождении и на протяжении всего раннего детства проводится регулярное измерение длины (роста), массы тела, окружности головы. Все антропометрические показатели находятся ниже возрастных норм (
- Обследование сердечно-сосудистой системы. Выявить наличие сердечных пороков позволяет ЭхоКС, ЭКГ. При необходимости могут потребоваться инвазивные исследования: катетеризация сердца, вентрикулография и др.
- Обследование ЖКТ. Для обнаружения ГЭРБ и морфологических изменений пищевода показана ЭГДС под наркозом. С целью исключения возможных аномалий кишечника необходима рентгенография с барием.
- Психоневрологическую диагностику. При первичном осмотре определяются рефлексы, тонус мышц, уровень психомоторного развития. В дальнейшем исследуется НСГ, ЭЭГ, выполняется рентгенография костей черепа, МРТ головного мозга.
- Прочие обследования. В целях выявления аномалий органов осуществляется УЗИ брюшной полости, почек, гениталий. Обязательна проверка функции зрения (рефрактометрия, офтальмоскопия, биомикроскопия), слуха (отоскопия, аудиограмма, слуховые ВП). С помощью рентгена костей и позвоночника выявляются скелетные аномалии.
- Молекулярное тестирование. Генодиагностика синдрома предполагает консультирование семьи генетиком с проведением кариотипирования больного ребенка, поиском мутаций в генах NIPBL, SMC1A.
Выявление синдрома возможно на дородовом этапе в рамках пренатального УЗИ-скрининга и фетометрии плода. Эхографическими маркерами патологии служат ЗВУР, особенности черепа, аномалии конечностей. С помощью УЗИ могут быть обнаружены ВПС, диафрагмальная грыжа и другие аномалии органов плода.
Дифференциальная диагностика
При проведении обследования необходимо исключить другие заболевания, имеющие сходные фенотипические черты:
- алкогольный синдром плода;
- трисомию 3q;
- синдром Фринса;
- синдром Нунан;
- синдром Прадера-Вилли;
- синдром Рубинштейна-Тейби.
Лечение синдрома Корнелии де Ланге
Тактика зависит от комплекса выявленных пороков, степени их влияния на качество жизни ребенка, его социализацию. В первую очередь осуществляется лечение тех патологий, которые могут привести к дестабилизации состояния:
- Желудочно-пищевой рефлюкс: разработка диеты, прием антацидов и H2-гистаминоблокаторов, по показаниям – фундопликация.
- Пороки сердца: ушивание/пластика дефектов перегородок, дилатация или резекция коарктации аорты, коррекция тетрады Фалло.
- Неврологические нарушения: прием противосудорожных препаратов, анксиолитиков, СИОЗС, лечение средой.
- Аномалии мочеполовой системы: орхипексия, коррекция гипоспадии, пластика гидронефроза, коррекция пузырно-мочеточникового рефлюкса.
- Расщелины неба: уранопластика, велофарингопластика.
- Скелетные аномалии: лечебная физкультура, массаж, физиотерапия с целью предотвращения суставных контрактур.
Коррекция тугоухости проводится с помощью слуховых аппаратов, аномалий зрения – с использованием очков, аппаратных методик. В программу педагогического сопровождения ребенка обязательно включаются занятия с дефектологом, психологом, логопедом. Терапия гормоном роста неэффективна.
Прогноз и профилактика
Ввиду большого количества аномалий развития средняя продолжительность жизни лиц с синдромом Корнелии де Ланге ниже, чем в популяции. Однако при благоприятном варианте пациенты могут дожить до 50-60 лет. Больным необходима социально-психологическая поддержка, трудовая реабилитация, помощь в самообслуживании. Вследствие имеющегося иммунодефцита критически важным является предупреждение инфекций.
Профилактика генетического синдрома требует исключения кровнородственных браков и ответственного планирования беременности. Беременным обязательно прохождение лабораторного и ультразвукового скрининга, а при необходимости – инвазивной пренатальной диагностики.
2. Синдром Корнелии де Ланге: клиника, диагностика, лечение (случай из практики)/ Бугаенко О.А., Сиротченко Т.А., Бондаренко Г.Г., Вельковская М.М.// Медицинский вестник Юга России. – 2018.
Синдром Noonan. Причины и проявления синдрома Ноонан
Синдром Нунан - этиология, клиника, диагностика
В 1968 г. Жаклин Нунан сообщила о поражающем мужчин и женщин синдроме, который характеризовался многими проявлениями, сходными с синдромом Тернера.
а) Распространенность. Большинство авторов ссылается на распространенность заболевания 1 на 1000-2500 живорожденных. Тем не менее, данная информация не основывается на популяционных исследованиях. Синдром Нунан является причиной гибели плодов, таким образом, частота заболевания превышает его распространенность, но установить несоответствие данных показателей не представляется возможным.
б) Клинические проявления и клиническая диагностика. Диагноз синдрома Нунан устанавливается на основании клинических проявлений путем выявления основных признаков. Несмотря на отсутствие четких диагностических критериев, ключевые проявления заболевания хорошо выражены (Allanson, 1987; Fragale et al., 2004): низкорослость, широкая или крыловидная шея, как при синдроме Тернера, пороки сердца (и различные варианты нарушений коагуляции и лимфатических дисплазий), необычная форма грудной клетки с килевидной верхней частью и воронкообразной нижней частью, низко расположенные соски, крипторхизм у мальчиков и характерное строение лица.
Общий вид лица меняется с возрастом, характерные черты наиболее выражены в период новорожденности, умеренно выражены в детстве и едва уловимы во взрослом возрасте (Allanson, 1987). Основные проявления вне зависимости от возраста, включают низко расположенные развернутые назад уши с толстыми завитками, ярко-голубой или сине-зеленый цвет радужки, широко расставленные глаза с эпикантом и толстые или свисающие веки.
Часто отмечаются некоторые затруднения в обучении (выраженная неспособность к обучению встречается редко). В среднем IQ составляет около 85 (от этого значения возможно колоколообразное распределение показателей IQ). Показатель IQ исполнения заданий несколько выше, чем показатель вербального IQ.
Очень часто встречаются нарушения координации; примерно в половине случаев имеются множественные проявления нарушения развития координации. Явного «поведенческого фенотипа» не установлено (Lee DA et al., 2005).
в) Генетическая диагностика и патогенез. С синдромом Нунан связано три гена: мутации гена PTPN11 выявляются в 50% случаев (Allanson, 2002); мутации гена KRAS выявляются у 5-10% пациентов, у которых не выявлены мутации гена PTPN11 (Schubbert et al., 2006); мутации гена SOS1 могут быть выявлены у 10-20% пациентов, у которых не были обнаружены мутации двух других генов (Lee J. S. et al, 2005). Предполагается, что могут быть выделены дополнительные локусы. Возможно проведение клинического молекулярного генетического тестирования (обычно методом анализа последовательностей), включая пренатальную диагностику.
Оба гена (PTPN11 и KRAS) располагаются на 12-й хромосоме, но на очень удаленных друг от друга участках. Ген PTPN 11 кодирует фосфатазу белка тирозина, широко распространенного внеклеточного белка, который играет ключевую роль в клеточном ответе на действие факторов роста и молекул клеточной адгезии, оказывает модулирующее воздействие на клеточную пролиферацию, дифференцировку, миграцию и апоптоз (Fragale et al., 2004). Аномалии белка KRAS индуцируют гиперчувствительность клеток предшественниц гемопоэза к факторам роста и приводят к нарушению специфической регуляции передачи сигнала клеточным линиям.
Мутации гена KRAS с образованием аномально функционирующих белков могут быть несовместимы с жизнью. Миссенс-мутации гена SOS1 приводят к нарушению кодирования RAS-специфичного фактора замены гуанин-нуклеотида и могут быть причиной развития синдрома приблизительно в 20% случаев.
Читайте также:
- Герминогенные опухоли яичников: классификация, герминогенные опухоли яичников клинические рекомендации
- Показания для поверхностного эндопротезирования головки плеча
- Клиника и диагностика атриовентрикулярной блокады.
- Дифференциальная диагностика патологического прелиминарного периода. Тактика при патологическом прелиминарном периоде.
- Жирные кислоты. Насыщенные и ненасыщенные жирные кислоты. Триглецериды.
