Сосуды микроциркуляторного русла. Артериолы. Прекапилляры. Посткапилляры. Венулы.
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Мусаев А.Т. 1 Алмабаева А.Ы. 2 Мергенбаев Ж.Е. 1 Аметов А.Б. 1 Султанбаева Ж.Т. 1 Пирмаханов Б.А. 1 Советаева А.М. 1 Сейдан О.К. 1 Смадил Н.С. 1 Уснадин Ж.Н. 1
Проведено экспериментальное исследование морфологических изменений гемомикроциркуляторного русла оперированного желудка. Исследование проводилось на беспородных крысах массой 160–250 г. обоего пола. Гастротомия влечет за собой перестройку сосудистых конструкций. Через 6 часов после операции диаметр коротких артерий дна желудка до их погружения увеличивается почти на 12 %, а одноименных вен на 9 %.В то же время по обе стороны от шва в стенке желудка начинает развиваться отек и клеточная инфильтрация. К концу 1-х суток развивается лейкоцитарная инфильтрация, степень выраженности которой непосредственно зависит от уровня деструктивных изменений в микроциркуляторном русле. В течение трех-шести дней после операции явления воспаления нарастают. Увеличиваются воспалительный отек и инфильтрация, участки слизистой оболочки в пределах внутренних швов некротизировались, во многих местах некроз распространяется на другие слои. Уже к концу первой недели уменьшается отек тканей, края слизистых оболочек очищаются от некротических тканей, уменьшается воспалительная инфильтрация, дно дефекта слизистых оболочек выстилается однослойным цилиндрическим эпителием. Экспериментальные исследования показали, что выраженность лейкоцитарной инфильтрации в области шва желудка зависит от степени изменений в микроциркуляторном русле.
1. Афанасьев Ю.И., Юрина Н.А. Гистология, цитология и эмбриология. – 5-е изд. перераб. и доп.. – М.: Медицина, 2002. – С. 123–131.
3. Циммерман Я.С. Современные методы исследования функций желудка и их диагностические возможности // РЖГГК. – 2011. – Т.21. – №5. – С. 58–62.
5. Matsukura N., Asano G. Anatomy, Histology, Ultrastructure, Stomach, Rat. Digestive system. 1997. P. 343–344.
Актуальность. В настоящее время проблема исследования микроциркуляции занимает одно из ведущих мест в медицинской практике. Актуальность этой проблемы определяется реакцией микроциркуляторного русла на воздействие факторов внешней и внутренней среды, обеспечивая приспособление местной гемодинамики в соответствии с потребностями организма.В патогенезе многих заболеваний важную роль играет изменение состояния микроциркуляции крови, от которой непосредственно зависит поддержание жизнеспособности органов и тканей, дальнейшее течение воспалительныхпроцессов. Изменения микроциркуляции возникают раньше и исчезают позже клинических проявлений повреждения тканей, и в этом отношении позволяют адекватно отражать состояние их жизнеспособности. При многих заболеваниях изменения микроциркуляции составляют важное звено патогенеза. Поэтому в клинике различных заболеваний и экстремальных состояний, а также при коррекции микроциркуляторных нарушений необходима как оперативная информация о состоянии кровотока на тканевом уровне, так и длительный мониторинг за состоянием микроциркуляции [3,5].
Артериальное кровоснабжение желудка осуществляется за счет ветвей чревного ствола (truncus coeliacus), который, начинаясь от брюшной аорты на уровне XII грудного позвонка коротким стволом в 1–1,5 см, сейчас же распадается на три основные свои ветви – левую желудочную артерию (a.gastrica sinistra), селезеночную артерию (a.lienalis) и общую печеночную артерию (a.hepatica communis), принимающие участие в кровоснабжении желудка. Непосредственное участие в кровоснабжении желудка принимают 5 сосудов: левая и правая желудочные артерии, левая и правая желудочно-сальниковые артерии и короткие желудочные артерии. Наиболее мощной и важной в практическом отношении является левая желудочная артерия (a.gastrica sinistra), отходящая в 75 % случаев от чревного ствола в остальных – от общей печеночной или селезеночной артерий. Различают восходящую, или проксимальную, часть и нисходящую, или дистальную, часть a.gastrica sinistra. Восходящая часть артерии идет в желудочно-поджелудочной связке и подходит к малой кривизне желудка на границе верхней и средней третей ее длины, где располагается между листками печеночно-желудочной связки уже как нисходящая (или дистальная) часть артерии. В этой связке она идет слева направо вдоль малой кривизны, отдавая передние и задние ветви соответственно стенкам желудка.
Правая желудочная артерия (a.gastrica dextra) является ветвью чаще всего собственной печеночной артерии (a.hepatica propria) из системы общей печеночной артерии. Реже она отходит от общей печеночной артерии (a.hepatica communis) или одной из ее основных ветвей – желудочно-двенадцатиперстной артерии (a.gastroduodenalis). Правая желудочная артерия идет справа налево по малой кривизне желудка между листками печеночно-двенадцатиперстной связки (lig.hepatoduodenale), отдавая ветви к желудку и анастомозируя с a.gastrica sinistra. Таким образом, на малой кривизне образуется мощная анастомотическая артериальная дуга, формированная правой и левой желудочными артериями. Из этих двух артерий малой кривизны желудков правая обычно выражена значительно слабее и имеет меньшее значение для кровоснабжения желудка, чем левая желудочная артерия. Ведущим звеном в развитии микроциркуляторных нарушений является расстройство капиллярного кровотока, начинающееся со снижения его интенсивности, а заканчивающееся развитием капиллярного стаза. Очевидно, что объективная регистрация состояния именно капиллярного кровотока важна как для оценки системных и локальных расстройств микроциркуляции, так и для прогноза течення тех или иных патологических состояний [1,4,6].
Цель исследования. Изучить изменения гемомикроциркуляторного русла желудка после гастротомии.
Материалы и методы исследования
Для выполнения поставленных задач нами были проведены экспериментальные исследования. Они проводились на беспородных крысах массой 160–250г. обоего пола. Животные до и после операции содержались в условиях вивария.
Материалом исследования являлись ткани желудка крыс. Все животные до операции наблюдались в карантине, где изучались контрольные данные гемодинамики. Сроки наблюдения за экспериментальными животными составили от 3 часа до 7 суток.
После лапаротомии на передней стенке кардиального отдела желудка проводили гастротомию. Рану желудка ушивали двухрядным швом. Затем ушивалась операционная рана.
Микротомные срезы желудка толщиной 5–7 мкм окрашивали гематоксилином и эозином, по ван-Гизону.Сосудистая сеть желудка наполнялась 0,5 % раствором азотнокислого серебра, после промывание теплым (37°С) физиологическим раствором, под строгим контролем манометра. При морфометрии применяли стандартную методику определения диаметра сосудов с помощью окулярометра и объектмикрометра.
Результаты исследования и их обсуждение
Гастротомия влечет за собой перестройку сосудистых конструкций[2]. Через 6 часов после операции диаметр коротких артерий дна желудка до их погружения увеличивается почти на 12 %, а одноименных вен на 9 %. Отмечалось характерное нарастание количества артериальных и венозных анастомозов в области шва желудка. На месте анастомоза наблюдается хорошо развитая сеть тончайших капилляров.
При изучении интраорганных сосудов вблизи шва желудка получены следующие данные. Через 6 часов после операции по обе стороны от шва в стенке желудка начинает развиваться отек и клеточная инфильтрация. Между соединенными швами стенками желудка сосудистых связей нет. Края их разобщены бессосудистой фибринной спайкой, образовавшейся по линии швов. Внутриорганные сосуды вблизи спайки расширены, переполнены форменными элементами крови. На границе со спайкой некоторые сосуды образовали булавовидное утолщение (рис. 1).
Рис. 1. Через 6 часов после гастротомии. Булавовидное утолщение сосудов на границе со спайкой. Ув.100. Наливка 0,5 % раствором азотнокислого серебра
К концу 1-х суток развивается лейкоцитарная инфильтрация, степень выраженности которой непосредственно зависит от уровня деструктивных изменений в микроциркуляторном русле. Степень выраженности микроциркуляторных изменений наибольшая в подслизистой основе стенки желудка и серозной оболочке, менее выраженная – в слизистой оболочке и наименьшая – в мышечной оболочке.
При рассмотрении срезов, докрашенных гематоксилином и эозином, во многих местах по обе стороны от спайки обнаруживаются сосуды, в которые краситель во время инъекции либо совсем не проник, либо заполнил сосуд только частично. Эти сосуды видны в пределах тканей, захваченных швами. Это связано с тем, что часть сосудов сдавливается швами, в результате чего образуются ишемические участки.
В течение трех-шести дней после операции явления воспаления нарастают. Увеличиваются воспалительный отек и инфильтрация. Участки слизистой оболочки в пределах внутренних швов некротизировались, во многих местах некроз распространяется на другие слои. Воспалительная инфильтрация наиболее выражена на границе с омертвевшими тканями (рис. 2).
В эти сроки по обе стороны от спайки обнаруживаются тромбированные сосуды. Свежие тромбы видны не только в мелких сосудах и капиллярах, но и в крупных сосудах подслизистого слоя в очагах интенсивной инфильтрации. В ряде случаев тромбы в сосудах можно обнаружить на расстоянии приблизительно 0,5–1 см от спайки, в этих же местах определяется воспалительная инфильтрация и отек тканей.
Рис. 2. Через 3 суток после операции. Полнокровие и клеточная инфильтрация вокруг шовного материала. Ув.х 200. Окраска: гематоксилин и эозин
В результате тромбирования части интраорганных сосудов по обе стороны от спайки сосудистые сети в различных слоях желудка изменяют свой характерный рисунок. Особенно это заметно в капиллярной сети мышечных слоев, петли которых в ряде случаев разомкнуты, теряют свою форму.
Изменения рисунка интраорганных сосудистых сетей еще больше происходит к концу первой недели связи с тем, что в эти сроки начинается процесс новообразования капилляров. Этот процесс находится в тесной связи с нарушением кровообращения в оперированном органе и с восстановлением новых сосудистых связей в области соустья в результате прорастания фибринной спайки новообразованными капиллярами.
Через трое суток после 6 минутной компрессии воротной вены диаметры звеньев гемомикроциркуляторного русла(ГМЦР) желудка по сравнению с предыдущим сроком уменьшаются. Диаметр артериол серозной оболочки составил 30±2,4 мкм, что больше по сравнению с контролем на 11,1 % прекапилляров – 18±1,6 мкм, капилляров- 7,2±0,4 мкм, посткапилляров – 20±1,5 мкм (р<0,05), венул – 32±2,4 мкм. Диаметры артериол мышечного слоя составили 36±3,0 мкм, прекапилляров – 17±1,7 мкм, капилляров – 5,8±0,9 мкм, посткапилляров – 21±1,6 мкм, венул – 44±3,1 мкм.
Через семь суток после 6 минутного пережатия воротной вены наблюдается дальнейшее уменьшение диаметра микрососудов и приближение их к контрольным цифрам. Диаметр артериол серозной оболочки составил 27±1,8 мкм, что одинаково с контрольными данными. Прекапилляры расширены на 6,7 % (16±1,4), посткапилляры – на 7,7 % (7,0±0,5), капилляры – на 11,8 % (19±1,7), венулы – на 3,4 % (30±2,8). Артериолы мышечного слоя расширены на 2,9 % (35±3,0), прекапилляры – на 6,7 % (16±1,4), капилляры – на 3,7 % (5,6±0,8). Диаметр посткапилляров составил 18±1,6 мкм, что совпадает с контрольным показателем. Диаметры венул расширились на 5 % (42±2,8) от контрольных величин. В слизистом слое полнокровие капилляров сохраняется.
К концу первой недели после операции происходит обратное развитие воспалительного процесса. Уже к концу первой недели уменьшается отек тканей, края слизистых оболочек очищаются от некротических тканей, уменьшается воспалительная инфильтрация, дно дефекта слизистых оболочек выстилается однослойным цилиндрическим эпителием.
В эти сроки фибринная спайка замещается грануляционной тканью с образованием густой капиллярной сети. Большое количество беспорядочно вросших новообразованных капилляров видно также по обе стороны от спайки.
Установление большого числа связей между новообразованными капиллярами в стенке органа и капиллярами спайки еще в большей степени меняет рисунок интраорганных сосудистых сетей по обе стороны от спайки.
Новообразованные сосуды отличаются не только строением стенки, но и направлением, что особенно отчетливо заметно на уровне мышечного слоя, где интраорганные сосуды имеют определенную ориентацию, а новообразованные сосуды располагаются в самых различных направлениях.
Выводы. Таким образом, экспериментальные исследования показали, что выраженность лейкоцитарной инфильтрации в области шва желудка после гастротомии зависит от степени изменений в микроциркуляторном русле.
5. Микроциркуляторное русло включает в себя следующие компоненты: артериолы, прекапилляры, капилляры, посткапилляры, венулы, артериоло-венулярные анастомозы.
В микроциркуляторном русле различают три звена: артериальное (артериолы прекапилляры), капиллярное и венозное (посткапилляры, собирательные и мышечные венулы).
Артериолы имеют диаметр 50—100 мкм. В их строении сохраняются три оболочки, но они выражены слабее, чем в артериях. В области отхождения от артериолы капилляра находится гладкомышечный сфинктер, который регулирует кровоток. Этот участок называется прекапилляром.
Капилляры — это самые мелкие сосуды, они различаются по размерам на:
узкий тип 4—7 мкм;
обычный или соматический тип 7—11 мкм;
синусоидный тип 20—30 мкм;
лакунарный тип 50—70 мкм.
В их строении прослеживается слоистый принцип. Внутренний слой образован эндотелием. Эндотелиальный слой капилляра — аналог внутренней оболочки. Он лежит на базальной мембране, которая вначале расщепляется на два листка, а затем соединяется. В результате образуется полость, в которой лежат клетки перициты. На этих клетках на этих клетках заканчиваются вегетативные нервные окончания, под регулирующим действием которых клетки могут накапливать воду, увеличиваться в размере и закрывать просвет капилляра. При удалении из клеток воды они уменьшаются в размерах, и просвет капилляров открывается. Функции перицитов:
изменение просвета капилляров;
источник гладкомышечных клеток;
контроль пролиферации эндотелиальных клеток при регенерации капилляра;
синтез компонентов базальной мембраны;
Базальная мембрана с перицитами — аналог средней оболочки. Снаружи от нее находится тонкий слой основного вещества с адвентициальными клетками, играющими роль камбия для рыхлой волокнистой неоформленной соединительной ткани.
Для капилляров характерна органная специфичность, в связи с чем выделяют три типа капилляров:
капилляры соматического типа или непрерывные, они находятся в коже, мышцах, головном мозге, спинном мозге. Для них характерен непрерывный эндотелий и непрерывная базальная мембрана;
капилляры фенестрированного или висцерального типа (локализация — внутренние органы и эндокринные железы). Для них характерно наличие в эндотелии сужений — фенестр и непрерывной базальной мембраны;
капилляры прерывистого или синусоидного типа (красный костный мозг, селезенка, печень). В эндотелии этих капилляров имеются истинные отверстия, есть они и в базальной мембране, которая может вообще отсутствовать. Иногда к капиллярам относят лакуны - крупные сосуды со строением стенки как в капилляре (пещеристые тела полового члена).
Венулы делятся на посткапиллярные, собирательные и мышечные. Посткапиллярные венулы образуются в результате слияния нескольких капилляров, имеют такое же строение, как и капилляр, но больший диаметр (12—30 мкм) и большое количество перицитов. В собирательных венулах (диаметр 30—50 мкм), которые образуются при слиянии нескольких посткапиллярных венул, уже имеются две выраженные оболочки: внутренняя (эндотелиальный и подэндотелиальный слои) и наружная — рыхлая волокнистая неоформленная соединительная ткань. Гладкие миоциты появляются только в крупных венулах, достигающих диаметра 50 мкм. Эти венулы называются мышечными и имеют диаметр до 100 мкм. Гладкие миоциты в них, однако, не имеют строгой ориентации и формируют один слой.
Артериоло-венулярные анастомозы или шунты — это вид сосудов микроциркуляторного русла, по которым кровь из артериол попадает в венулы, минуя капилляры. Это необходимо, например, в коже для терморегуляции. Все артериоло-венулярные анастомозы делятся на два типа:
истинные — простые и сложные;
атипичные анастомозы или полушунты.
В простых анастомозах отсутствуют сократительные элементы, и кровоток в них регулируется за счет сфинктера, расположенного в артериолах в месте отхождения анастомоза. В сложных анастомозах в стенке есть элементы, регулирующие их просвет и интенсивность кровотока через анастомоз. Сложные анастомозы делятся на анастомозы гломусного типа и анастомозы типа замыкающих артерий. В анастомозах типа замыкающих артерий во внутренней оболочке имеются скопления расположенных продольно гладких миоцитов. Их сокращение приводит к выпячиванию стенки в виде подушки в просвет анастомоза и закрытию его. В анастомозах типа гломуса (клубочек) в стенке есть скопление эпителиоидных Е-клеток (имеют вид эпителия), способных насасывать воду, увеличиваться в размерах и закрывать просвет анастомоза. При отдаче воды клетки уменьшаются в размерах, и просвет открывается. В полушунтах в стенке отсутствуют сократительные элементы, ширина их просвета не регулируется. В них может забрасываться венозная кровь из венул, поэтому в полушунтах, в отличии от шунтов, течет смешанная кровь. Анастомозы выполняют функцию перераспределения крови, регуляции артериального давления.
6. Лимфатическая система проводит лимфу от тканей в венозное русло. Она состоит из лимфокапилляров и лимфососудов. Лимфокапилляры начинаются слепо в тканях. Их стенка чаще состоит только из эндотелия. Базальная мембрана обычно отсутствует или слабо выражена. Для того, чтобы капилляр не спадался, имеются стропные или якорные филаменты, которые одним концом прикрепляются к эндотелиоцитам, а другим вплетаются в рыхлую волокнистую соединительную ткань. Диаметр лимфокапилляров равен 20—30 мкм. Они выполняют дренажную, функцию: всасывают из соединительной ткани тканевую жидкость.
Лимфососуды делятся на интраорганные и экстраорганные, а также главные (грудной и правый лимфатические протоки). По диметру они делятся на лимфососуды малого, среднего и крупного калибра. В сосудах малого диаметра отсутствует мышечная оболочка, и стенка состоит из внутренней и наружной оболочек. Внутренняя оболочка состоит из эндотелиального и подэндотелиального слоев. Подэндотелиальный слой постепенно, без резких границ. Переходит в рыхлую волокнистую неоформленную соединительную ткань наружной оболочки. Сосуды среднего и крупного калибра имеют мышечную оболочку и по строению похожи на вены. В крупных лимфососудах есть эластические мембраны. Внутренняя оболочка формирует клапаны. По ходу лимфососудов находятся лимфоузлы, проходы через которые, лимфа очищается и обогащается лимфоцитами.
Сосуды микроциркуляторного русла. Артериолы. Прекапилляры. Посткапилляры. Венулы.
Сосуды микроциркуляторного русла. Артериолы. Прекапилляры. Посткапилляры. Венулы.
По мере уменьшения калибра артерий все оболочки их стенок становятся тоньше. Артерии постепенно переходят в артериолы, с которых начинается микроциркуляторное сосудистое русло (МЦР). Через стенки его сосудов осуществляется обмен веществ между кровью и тканями, поэтому микроциркуляторное русло именуется обменным звеном сосудистой системы. Постоянно происходящий обмен воды, ионов, микро- и макромолекул между кровью, тканевой средой и лимфой, представляет собой процесс микроциркуляции, от состояния которого зависит поддержание постоянства внутритканевого и внутриорганного гомеостаза. В составе МЦР различают артериолы, прекапилляры (прекапиллярные артериолы), гемокапилляры, посткапилляры (посткапиллярные венулы) и венулы.
Артериолы — мелкие сосуды диаметром 50-100 мкм, постепенно переходящие в капилляры. Основная функция артериол — регулирование притока крови в основное обменное звено МЦР — гемокапилляры. В их стенке еще сохраняются все три оболочки, свойственные более крупным сосудам, хотя они и становятся очень тонкими. Внутренний просвет артериол выстлан эндотелием, под которым лежат единичные клетки подэндотелиального слоя и тонкая внутренняя эластическая мембрана. В средней оболочке спиралевидно располагаются гладкие миоциты. Они образуют всего 1-2 слоя. Гладкие мышечные клетки имеют непосредственный контакт с эндотелиоцитами, благодаря наличию перфораций во внутренней эластической мембране и в базальной мембране эндотелия. Эндотелио-миоцитарные контакты обеспечивают передачу сигналов от эндотелиоцитов, воспринимающих изменение концентраций биологически активных соединений, регулирующих тонус артериол, на гладкомышечные клетки. Характерным для артериол является также наличие миомиоцитарных контактов, благодаря которым артериолы выполняют свою роль "кранов сосудистой системы" (Сеченов И.М.). Артериолы обладают выраженной сократительной активностью, называемой вазомоцией. Наружная оболочка артериол чрезвычайно тонка и сливается с окружающей соединительной тканью.
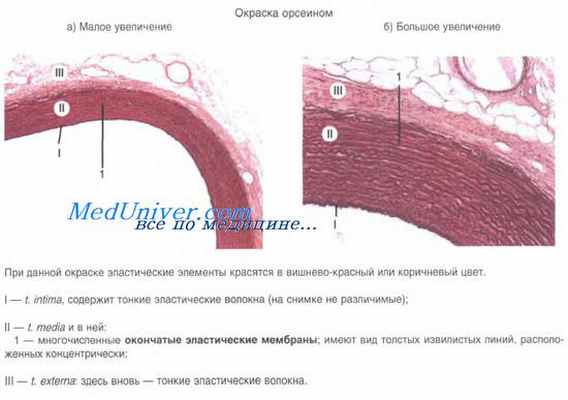
Прекапилляры (прекапиллярные артериолы) — тонкие микрососуды (диаметром около 15 мкм), отходящие от артериол и переходящие в гемокапилляры. Их стенка состоит из эндотелия, лежащего на базальной мембране, гладкомышечных клеток, расположенных поодиночке и наружных адвентициальных клеток. В местах отхождения от прекапиллярных артериол кровеносных капилляров имеются гладкомышечные сфинктеры. Последние регулируют приток крови к отдельным группам гемокапилляров и при отсутствии выраженной функциональной нагрузки на орган большая часть прекапиллярных сфинктеров закрыта. В области сфинктеров гладкие миоциты формируют несколько циркулярных слоев. Эндотелиоциты имеют большое количество хеморецепторов и образуют множество контактов с миоцитами. Эти особенности строения позволяют прекапиллярным сфинктерам реагировать на действие биологически активных соединений и изменять приток крови в гемокапилляры.
Стенка кровеносных капилляров состоит из клеток — эндотелиоцитов и перицитов, а также неклеточного компонента — базальной мембраны. Снаружи капилляры окружены сетью ретикулярных волокон. Внутренняя выстилка гемокапилляров образована однослойным пластом плоских эндотелиоцитов. Стенку капилляра в поперечнике образуют от одной до четырех клеток. Эндотелиоциты имеют полигональную форму, содержат, как правило, одно ядро и все органеллы. Наиболее характерными ультраструктурами их цитоплазмы являются пиноцитозные везикулы. Последних особенно много в тонких периферических (маргинальных) частях клеток. Пиноцитозные везикулы связаны с плазмолеммой наружной (люминальной) и внутренней (аблюминальной) поверхностей эндотелиоцитов. Их образование отражает процесс трансэндотелиального переноса веществ. При слиянии пиноцитозных пузырьков формируются сплошные трансэндотелиальные канальцы. Плазмолемма люминальной поверхности эндотелиальных клеток покрыта гликокаликсом, выполняющим функцию адсорбции и активного поглощения из крови продуктов обмена веществ и метаболитов. Здесь эндотелиальные клетки образуют микровыросты, численность которых отражает степень функциональной транспортной активности гемокапилляров. В эндотелии гемокапилляров ряда органов наблюдаются "отверстия" (фенестры) диаметром около 50-65 нм, закрытые диафрагмой толщиной 4-6 нм. Их присутствие облегчает течение обменных процессов.
Эндотелиальные клетки обладают динамическим сцеплением и непрерывно скользят одна относительно другой, образуя интердигитации, щелевые и плотные контакты. Между эндотелиоцитами в гемокапиллярах некоторых органов обнаруживаются щелевидные поры и прерывистая базальная мембрана. Эти межклеточные щели служат еще одним из путей транспорта веществ между кровью и тканями.
Снаружи от эндотелия располагается базальная мембрана толщиной 25-35 нм. Она состоит из тонких фибрилл, погруженных в гомогенный липопротеиновый матрикс. Базальная мембрана в отдельных участках по длиннику гемокапилляра расщепляется на два листка, между которыми лежат перициты. Они оказываются как бы "замурованными" в базальной мембране. Полагают, что деятельность и изменение диаметра кровеносных капилляров регулируется, благодаря способности перицитов набухать и отбухать. Аналогом наружной оболочки сосудов в гемокапиллярах служат адвентициальные (периваскулярные) клетки вместе с преколлагеновыми фибриллами и аморфным веществом.
Для гемокапилляров характерна органная специфичность строения. В этой связи различают три типа капилляров: 1) непрерывные, или капилляры соматического типа, — располагаются в мозгу, мышцах, коже; 2) фенестрированные, или капилляры висцерального типа, — располагаются в эндокринных органах, почках, желудочно-кишечном тракте; 3) прерывистые, или капилляры синусоидного типа, — располагаются в селезенке, печени.
В гемокапиллярах соматического типа эндотелиоциты соединены друг с другом с помощью плотных контактов и образуют сплошную выстилку. Базальная мембрана их также непрерывная. Присутствие подобных капилляров со сплошной эндотелиальной выстилкой в мозгу, например, необходимо для надежности гемато-энцефалического барьера. Гемо-капилляры висцерального типа выстланы эндотелиоцитами с фенестрами. Базальная мембрана при этом непрерывная. Капилляры этого типа характерны для органов, в которых обменно-метаболические отношения с кровью более тесные — эндокринные железы выделяют в кровь свои гормоны, в почках из крови фильтруются шлаки, в желудочно-кишечном тракте в кровь и лимфу всасываются продукты расщепления пищи. В прерывистых (синусоидных) гемокапиллярах между эндотелиоцитами имеются щели, или поры. Базальная мембрана в этих участках отсутствует. Такие гемокапилляры присутствуют в органах кроветворения (через поры в их стенке в кровь поступают созревшие форменные элементы крови), печени, которая выполняет множество метаболических функций и клетки которой "нуждаются" в максимально тесном контакте с кровью.
Количество гемокапилляров в разных органах неодинаково: на поперечном срезе в мышце, например, на 1 мм2 площади насчитывается до 400 капилляров, тогда как в коже — всего 40. В обычных физиологических условиях до 50 % гемокапилляров являются нефункционирующими. Количество "открытых" капилляров зависит от интенсивности работы органа. Кровь протекает через капилляры со скоростью 0,5 мм/с под давлением 20-40 мм рт. ст.
Посткапилляры, или посткапиллярные венулы, — это сосуды диаметром около 12-30 мкм, образующиеся при слиянии нескольких капилляров. Посткапилляры по сравнению с капиллярами имеют больший диаметр и в составе стенки чаще встречаются перициты. Эндотелий фенестрированного типа. На уровне посткапилляров происходят также активные обменные процессы и осуществляется миграция лейкоцитов.
Венулы образуются при слиянии посткапилляров. Начальным звеном венулярного отдела МЦР являются собирательные венулы. Они имеют диаметр около 30-50 мкм и не содержат в структуре стенки гладких миоцитов. Собирательные венулы продолжаются в мышечные, диаметр которых достигает 50-100 мкм. В этих венулах имеются гладкомышечные клетки (численность последних увеличивается по мере удаления от гемокапилляров), которые ориентированы чаще вдоль сосуда. В мышечных венулах восстанавливается четкая трехслойная структура стенки. В отличие от артериол, в мышечных венулах нет эластической мембраны, а форма эндотелиоцитов более округлая. Венулы отводят кровь из капилляров, выполняя отточно-дренажную функцию, выполняют вместе с венами депонирующую (емкостную) функцию. Сокращение продольно ориентированных гладких миоцитов венул создает некоторое отрицательное давление в их просвете, способствующее "присасыванию" крови из посткапилляров. По венозной системе вместе с кровью из органов и тканей удаляются продукты обмена веществ.
Гемодинамические условия в венулах и венах существенно отличаются от таковых в артериях и артериолах в связи с тем, что кровь в венозном отделе течет с небольшой скоростью (1-2 мм/с) и при низком давлении (около 10 мм рт. ст.).
В составе микроциркуляторного русла существуют также артериоло-венулярные анастомозы, или соустья, обеспечивающие прямой, в обход капилляров, переход крови из артериол в венулы. Путь кровотока через анастомозы короче транскапиллярного, поэтому анастомозы называют шунтами. Различают артериоло-венулярные анастомозы гломусного типа и типа замыкающих артерий. Анастомозы гломусного типа регулируют свой просвет посредством набухания и отбухания эпителиоидных гломусных Е-клеток, расположенных в средней оболочке соединяющего сосуда, образующего нередко клубочек (гломус). Анастомозы типа замыкающих артерий содержат скопления гладких мышечных клеток во внутренней оболочке. Сокращение этих миоцитов и их выбухание в просвет в виде валика или подушечки могут уменьшить или полностью закрыть просвет анастомоза. Артериоло-венулярные анастомозы регулируют местный периферический кровоток, участвуют в перераспределении крови, терморегуляции, регуляции давления крови. Различают еще атипические анастомозы (полушунты), в которых соединяющий артериолу и венулу сосуд представлен коротким гемокапилляром. По шунтам протекает чистая артериальная кровь, а полушунты, будучи гемокапиллярами, передают в венулу смешанную кровь.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Сосуды микроциркуляторного русла. Артериолы. Прекапилляры. Посткапилляры. Венулы.
- Энциклопедия «Известные ученые»
- Ведущие научные школы
- Экспертный совет
- Студенческий научный форум
- Европейский
научно-промышленный
консорциум - Программа
- Электронные конференции
Главная / Издательство / Микроциркуляторное русло твердой мозговой оболочки в опытной группе (I”II”) экспериментальных животных.
II.3. Микроциркуляторное русло твердой мозговой оболочки в опытной группе (I”II”) экспериментальных животных.
В опытных группах (I”,II”) с использованием алкоголя с высокой концентрацией в среднем слое ТМО обнаруживаются бессосудистые зоны. Зоны «ишемии» среднего слоя оболочки отмечены в затылочной и лобной областях. Обратный феномен выявлен в теменных и височных областях в виде большого количества артерий и артериол, имеющих микрососудистую сеть, но с низкой плотностью капилляров в данной сети. В отдельных капиллярах определялись локальные участки агрегации эритроцитов, признаки экстравазации форменных элементов крови в перикапиллярную соединительную ткань. Во внутреннем слое ТМО нарастает число артериоло-венулярных анастомозов, их отводящие отделы местами расширены и деформированы. Прекапиллярно-капиллярная сеть приобретает деформированный характер, капилляры имеют вид штопорообразных петель или кустиков. Отмечаются спазм сосудов прекапиллярного звена, сгущение и гипертрофия гладких мышечных клеток в местах отхождения прекапилляров. Возрастает количество нефункционирующих капилляров, формируются области с малососудистыми и бессосудистыми зонами.
Микрососуды у половозрелых самцов отличаются большей извитостью, а также чередованием суженных и расширенных фрагментов, которые особо выражены в отводящих звеньях. Сопоставление морфометрических показателей выявляет достоверно большие значения диаметров артериол и венул у половозрелых крыс. Диаметры прекапилляров и капилляров половозрелых самцов достоверно меньше аналогичных показателей у молодых крыс.
Изучение гистологических срезов ТМО крыс, подвергнутых длительной алкогольной нагрузке, выявило, в целом, выраженную картину изменений. Отмечалось наличие участков локальных спастических сокращений прекапиллярного звена микроциркуляторного русла. В местах расположения прекапиллярных сфинктеров определялись в различной степени сужения их просвета. Средние диаметры артериол в опытных группах (I”, II”), по сравнению с контрольными показателями, отличались у молодых самцов на 8% и 14%, у половозрелых крыс – на 20% и 35%. Уменьшение средних диаметров прекапилляров у молодых самцов достигали 18%, а у половозрелых – 23%.
Микроциркуляторное русло ТМО при длительной алкогольной нагрузке претерпевает значительные изменения. Во всех слоях оболочки отмечается редукция капиллярного звена, увеличивается количество артериоло-венулярных анастомозов до 90%, что обуславливает сброс артериальной крови в венозную систему, минуя капиллярное звено. В контрольной группе количество артериоло-венулярных анастомозов составляет 55%. Анастомозы обнаруживаются во всех трех слоях ТМО. В условиях эксперимента артериоло-венулярные анастомозы формируют зоны с максимальным сбросом артериальной крови в венозную систему при отсутствии сосудов других типов.
Описанная шунтирующая система имеет не одинаковую протяженность в разных слоях оболочки, в условиях длительной алкогольной нагрузки. В наружном слое ТМО шунтирующая система имеет низкую и среднюю протяженность. В среднем слое ТМО отмечается высокая протяженность данной системы. Во внутреннем слое оболочки определяется низкая протяженность шунтирующей системы. Максимальная концентрация артериоло-венулярных анастомозов приходится на височно-теменные области, образуя лестнецеподобные связи.
На фоне общей редукции капиллярного звена, посткапиллярные структуры имеют тенденцию к увеличению калибра венозных сосудов. Максимальное расширение венул отмечается в наружном и среднем слое ТМО с относительным сдвигом к внутреннему слою. Выражено прогрессивное расширение посткапиллярного звена вплоть до венозных корней, в сравнении с контрольной группой. Венулярные сосуды на большом протяжении не имеют разветвлений. Длина не разветвляющихся путей достигает в наружном слое оболочки более 434 мкм.
Параллельный ход сосудов не всегда сохраняется и встречается лишь в 20% случаев в опытных группах. Промежутки между венулами, отходящими от артериол, не одинаковы и варьируют в пределах от 21,7 мкм до 195,3 мкм.
Для артериол и прекапилляров характерно увеличение распространенности и интенсивности спазма гладких мышц их стенки. Уменьшение диаметров артериол в спазмированных участ¬ках достигает 25% и 75%. Это приводит к выраженной сепара¬ции потоков крови с периодическими выключениями кровотока в отдельных артериолярных ветвях. Значительное число прекапиллярных сфинктеров спазмировано или полностью сомкнуто.
Степень дилятации посткапилляров в опытных группах с использованием алкоголя низкой концентрации, по сравнению с опытной группой с использованием алкоголя высокой концентрации уменьшалась на 35%. Однако, по сравнению с контрольной группой, посткапилляры оставались расширенными на 89%. Расширенные капилляры резко извиты и дефор¬мированы, в ряде случаев они приобретают микроварикозную структуру. В местах выбухания капилляров определяются слив¬ные геморрагии.
Особенно значительные морфологические изменения наблюдались у половозрелых белых крыс, при длительной алкоголизации, в отводящих микрососудах ТМО. В истонченных и извитых посткапиллярах и венулах кровоток был резко замедлен, так как отмечалось выраженное полнокровие. Определялись эритроцитарные агрегаты, перемежающиеся с пассажем плазмы. Вокруг отдельных посткапилляров и венул определялись локальные геморрагии. Средние диаметры отводящего звена микроциркуляторного русла ТМО были увеличены по сравнению с контролем соответственно 36% и 48%.
Общая ангиоархитектоника микроциркуляторного русла ТМО, в условиях эксперимента, представлена чередованием полей с типичной сетевидной организацией микрососудов, полей, имеющих бессосудистые зоны, и полей с ограниченным числом боковых коллатералей.
Морфо-функциональная организация микрососудистого русла твердой мозговой оболочки, в условиях длительной алкогольной нагрузки, претерпевает значительные изменения, направленные на компенсацию кровотока в патологически измененных сосудах, обуславливая высокую ранимость в теменно-височных областях при декомпенсации (травмы, гипертония, инфекционные процессы и т.д.).
Описанные морфологические изменения микроциркуляторного русла резко возрастали как количественно, так и качественно с применением алкоголя с высокой концентрацией спирта.
В данных опытных группах имеется выпадение структурно-функциональных единиц в среднем слое ТМО, что обуславливает зоны ишемии. Артериолы наружного и внутреннего слоев ТМО имеют бифуркации, трифуркации и единичные тетрафуркации, дочерние ветви отходят под острыми, тупыми, прямыми и развернутыми углами. Между структурно-функциональными единицами микроциркуляторного русла значительно увеличиваются артериоло-венулярные анастомозы. В наружном слое ТМО венозный компонент структурно-функциональных единиц имеет хаотичное расположение по отношению к среднему слою ТМО. Во внутреннем слое ТМО венозный компонент структурно-функциональной единицы располагается у среднего слоя ТМО и отличается выраженным полнокровием.
Сосуды микроциркуляторного русла. Артериолы. Прекапилляры. Посткапилляры. Венулы.
Нами современными методами исследования на значительном материале толстой кишки у человека (162 препарата) в онтогенезе установлено, что в подслизистой основе все звенья микроциркуляторного русла (МЦР): артериола, прекапилляр, посткапилляр, венула более плотно расположена на 1 мм кв. и имеют больше поперечник, чем в других слоях. Наиболее интенсмивно МЦР выражено во всех частях толстой кишки у детей I периода, в юношеском и I зрелом возрасте. Возрастные изменения начинаются со II периода зрелого возраста (35-60 лет).
Морфология к началу века нуждается в тщательном изучении сосудистого русла и иммунных органов пищеварительной системы, как актуальной проблемы (1,2,3,4,6,7,10,11,12,13).
Понимание морфологических механизмов регулирования внутриорганного кровотока возможно лишь на основе достаточно полной количественной информации о состоянии кровеносного русла (10).
Установлено, что к 4-месячному возрасту у плодов человека в подвздошно-слепокишечном отделе в заслонке обнаруживается большое количество сосудов микроциркуляторного русла. Артериолы подслизистой основы имели диаметр 17,2+0 мкм, капилляры - 5,0+1,3 мкм. Количество венул в 2 раза больше чем артериол. Эндотелиоциты капилляров имеют округлую и овальную форму. Вокруг сосудов микроциркуляторного русла много клеток лимфоидного ряда, в основном лимфоциты. Вокруг гемокапилляров лимфоциты в один ряд, а вокруг артериол и венул в два ряда. С возрастом диаметр сосудов увеличивается (14).
Калибр сосудов, их плотность , форма эндотелиальных клеток зависят от многих факторов, действующих на кишечную стенку и ее гемоциркуляторное русло. Как отмечают (8) такие изменения связаны с кровяным давлением, эластичностью сосудов и их стенок, функцией, интерстициальным транспортом продуктов метаболизма и т.д.
Учитывая недостаточную изученность и важность анатомии микроциркуляторного русла толстой кишки, мы задались целью изучить этот вопрос.
Последнее одно- и два десятилетия являются ареной успешных исследований, новых технологических поисков в ангиологии, успешных внедрений в микрохирургию, эндоскопию, клиническую лимфологию, гастроэнтерологию. Глубокая разработка морфологии сосудистого бассейна тонкой и толстой кишки основа для новых поисков разработок в теоретической и клинической гастроэнтерологии и смешанных дисциплинах. Из сказанного вытекает и общий план строения системы микроциркуляции, в состав которой входят не только сосудистые коммуникации, составляющие русло микроциркуляторного крово- и лимфотока, но и субмикроскопические пути трансмурального и внесосудистого транспорта, используемые микромолекулами для обеспечения взаимодействия между кровью, интерстициальной жидкостью, лимфой и органными клетками (8).
Серьезного внимания заслуживают данные о строении стенки сосудов в связи с гистопографией мышечных клеток, коллагеновых и эластических волокон тонкой кишки. Об активной роли на примере миоцитов кишечника указано в работах (15,16,17,18) отмечающих их связь по типу нексусов.
Добытые лимфологами морфо- функциональные данные с успехом применяют в комплексном лечении острых хирургических заболеваний органов брюшной полости, эхографии и диагностике поражений абдоминальных лимфатических узлов, печени и селезенки при злокачественных лимфомах, эндоэкологии (3,4,9).
На важность и актуальность изучения сосудистого русла писал (5) «С нашей точки зрения наибольшего внимания заслуживают исследования архитектуры сосудистого русла внутри органов, где сосредоточены сложнейшие процессы обменных взаимоотношений крови и ткани. Гемодинамические особенности находятся в теснейшей связи с общей активностью животного, со всей экологической характеристикой его организма в целом».
Материалом нашего исследования служили 162 трупа различного возраста и пола, умерших от травм и о болезни, причины которых не связаны с заболеваниями органов желудочно-кишечного тракта и сердечно-сосудистой системы.
Использованы анатомо-гистологические исследования интерстициальная инъекция сосудов , полихромная наливка сосуда, импрегнация кровеносных сосудов, окраска по ван Гизон, гематоксилин-эозином, стат. обработка на компьютере.
Нами на значительном материале толстой кишки у человека в онтогенезе установлено, что в подслизистои основе все звенья микроциркуляторного русла (МЦР): артериол , прекапилляр, гемокапилляр, посткапилляр, венул более плотно расположена на 1 кв.мм и имеет больше поперечник, чем в других слоях.
Наиболее интенсивно МЦР выражено во всех частях толстой кишки у детей I периода, в юношеском и 1 зрелом возрасте. Возрастные инволюционные изменения начинаются со II периода зрелого возраста (35-60 лет).
При морфометрических исследованиях более выражено, микроциркуляторное русло (МЦР) в слепой и восходящей ободочной кишке по сравнению с другими отрезками толстой кишки (таблица 1-6).
Полученные нами данные свидетельствуют что в онтогенезе у человека МЦР в толстой кишке развивается гетерохронно и эти особенности необходимо учитывать при вмешательствах на толстой кишке (резекция, непроходимость, анастомозы, УЗИ,эндоскопия, колоноскопия и т.д.) .
Таблица 1. Мофрометрия (в мкм) МЦР подслизистои основы слепой кишки у человека
Читайте также:
