Сосуды сердца при лучевой болезни. Морфология лучевой болезни сердца
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Сердечно-сосудистая система при острой лучевой болезни. Сердце после радиационного поражения
Функциональные и морфологические изменения сердечнососудистой системы занимают значительное место в патогенезе острой лучевой болезни и, как показали наблюдения последних лет, в развитии поздних и отдаленных последствии заболевания. Указания на те или иные проявления расстройства кровообращения и структурные нарушения в сердце и кровеносных сосудах можно найти почти во всех работах, касающихся биологического действия ионизирующих излучений на животный организм.
Однако специальные морфологические исследования сердца и сосудов относительно немногочисленны, причем большая часть их относится к местному действию ионизирующих излучений. Только в немногих работах имеются достаточно полные сведения о морфологических изменениях в этих органах при острой лучевой болезни, вызванной общим облучением. Вместе с тем литературные данные, касающиеся физиологии и патологии кровообращения в условиях лучевого поражения свидетельствуют о значительных расстройствах гемоциркуляции при острой лучевой болезни [Лебединский А. В., 1956; Горизонтов П. Д., 1962; Куршаков Н. А., 1963; Гуськова А. К., Байсоголов Г. Д., 1971].
После облучения стойко понижается артериальное и венозное давление, уменьшается скорость кровотока и объема циркулирующей крови, изменяется частота и ритм сердечных сокращений. Одновременно появляются признаки кровоточивости сосудов вследствие изменения реологических свойств крови и прочности сосудистых стенок, которые всегда наблюдаются при патологоаватомическом исследовании в разгар типичной формы острой лучевой болезни, вызванной однократным внешним облучением в минимальной смертельной дозе [Краевский Н. А., 1957].
Сведения о патоморфологических изменениях в сердце при лучевых поражениях до сих пор в основном относятся к случаям изолированного облучения области сердца у людей, подвергшихся лучевой терапии при заболеваниях органов грудной клетки. В свое время было отмечено, что изолированное облучение в небольших дозах не вызывает существенных морфологических изменеиий и только воздействие в массивных дозах приводит к выраженным нарушениям в миокарде и других структурах сердца.
В частности, И. М. Жданов (1941) не смог выявить каких-либо заметных морфологических изменений в мышцах и нервном аппарате сердца у кроликов после локального облучения фильтрованными рентгеновскими лучами даже в дозе 1500 Р. В некоторых работах последних лет тоже не отмечено существенных изменений в мышечных волокнах и эндотелии сосудов сердца после локального облучения рентгеновскими и у-лучами [Mollmann H. ct al., 1971].
В то же время в других исследованиях с помощью светового и электронного микроскопов отчетливо прослежено, что локальное внешнее облучение области сердца, например, в дозах 500—2400 рад, вызывает отчетливые изменения миокардиальных клеток и кровеносных сосудов сердца в виде расширения и переполнения кровью их просветов, плазматического пропитывания стенок, набухания и вакуолизации эндотелия (Morgenroth J. К. et al., 1967; Fajardd L. et al., 1970; Huff H. et al., 1972; Лебкова Н. П., 1967].
Однако Л. А. Яковлева (1975) считает, что эти изменения прежде всего зависят от нарушения нервной и гуморальной регуляции, а не от непосредственного действия радиации на сердце.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Кардиопатии, обусловленные радиотерапией
Данная работа представляет собой систематический обзор литературы Национальной медицинской библиотеки США по теме «кардиопатии, обусловленные воздействием химиотерапии и лучевой терапии». В обзор включены все источники, найденные по ключевым словам: «cardiopathy-induced radiotherapy»
Введение
Совокупность изменений сердца под воздействием лучевой терапии получила название «радиационно-индуцированной болезни сердца», которая включает в себя целый комплекс изменений, возникающий в результате лучевого повреждения миокарда, перикарда, клапанного аппарата, коронарных артерий, проводящей системы сердца [21].
Таким образом, применение химиотерапии и лучевой терапии при лечении онкологических больных приводит к развитию хронической сердечной недостаточности (ХСН).
По результатам фармако — экономических анализов, на лечение ХСН в странах Европы и США ежегодно расходуется 1-2% всего бюджета здравоохранения, что в 5 раз превышает затраты, направленные на лечение всех форм злокачественных новообразований [Фомин И. В. и др. , 2006].
Кардиопатии, обусловленные радиотерапией
В последние десятилетия проблема поражений сердца вследствие радиотерапии приобрела новое значение, прежде всего в связи с существенным увеличением в современном мире числа лиц, подвергшихся радиационному воздействию, как локальному, так и общему. Это касается прежде всего пациентов с ходжскинской лимфой, для которых сердечно-сосудистые осложнения в последующие 30-40 лет после облучения являются основной причиной смерти, больных с раком лёгкого, молочной железы (чаще левостороннего), пациентов, перенёсших трансплантацию, сочетающиеся с тотальным облучением [1, 2, 21].
В настоящее время минимальный порог эффективной лучевой дозы безопасной для сердца не известен. В большинстве случаев стандартная суммарная доза облучения для пациентов с лимфомой Ходжкина составляет 30Гр, для пациентов с раком молочной железы 45-50Гр, и между величиной суммарного облучения и сердечной заболеваемостью последующие годы существует прямая пропорциональная зависимость. С дозой облучения напрямую связана продолжительность жизни больного, которая снижается в результате ускоренного прогрессирование коронароатеросклероза, фиброзных изменений клапанов (чаще левосторонних), перикарда с возникновение фибринозного, реже экссудативного плеврита, самого миокарда с развитием диастолической дисфункции и скорейшего развития терминальной ХСН. 3
В тоже время анализ заболеваемости ССЗ у людей, выживших после взрыва атомной бомбы и многолетнее наблюдения за ликвидаторами аварии на Чернобыльской АЭС показали, что даже малые дозы облучения 1 Гр и менее способны повлиять на состояние сердечной мышцы. Множество исследований показывают, что радиационное облучение области сердца в любой дозе представляет риск для возникновения сердечных событий [ 6].
Постлучевая кардиомиопатия — это гетерогенное заболевание, характеризующиеся дозозависимым прогрессирующим снижением сократительного резерва миокарда, снижением ФВ ЛЖ, повышением жёсткости сердца как за счёт миокарда, так и за счёт перикарда и преждевременной смертью [1].
Патогенез
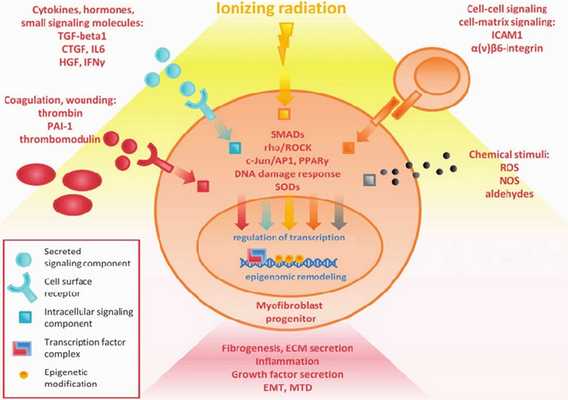
Механизм развития (Рисунок 3) постлучевых повреждений полностью не изучен, но известно, что ионизирующие облучение приводит к микроваскулярным нарушениям, повреждению эндотелия с повышением проницаемости сосудистой стенки, микротромбозу со снижением количества функционирующих капилляров — всё это является следствием запуска воспалительного ответа и причиной активации фиброзного замещения кардиомиоцитов. В миокарде увеличивается содержание коллагена I и III типов, которые вызывают снижение эластических свойств мышцы, повышая конечно-диастолическое давление [7].
Радиационные повреждения сердца включают в себя остро и хронически протекающие изменения. Сразу же после облучения повреждённые эндотелиоциты высвобождают факторы адгезии и пролиферации, активируются клетки воспаления с выделением провоспалительных цитокинов, таких как интерлейкины-1, 6, 8, фактор некроза опухоли-β, основной фактор роста фибробластов, инсулин-подобный фактор роста, соединительнотканный факторы роста, матриксные металлопротеазы разрушающие базальную мембраны сосудов, происходит активацию проонкогенов, c-myc и c-jun, которые поддерживают фиброз в тканях сердца [6, 21].
В позднем периоде происходят глубокие фибринозные изменения, протекающие десятилетия бессимптомно и приводящее в конечном счёте к развитию рестриктивной кардиопатией с умеренным снижением насосной функции ЛЖ или реже дилатационной с выраженными нарушениями показателей диастолической функции ЛЖ [8].
Важным моментом в развитии радио-индуцированной кардиопатии является её растянутое во времени развитие, что приближает её к антрациклинновой кардиопатии и предполагает наличие реорганизации многих белковых структур клетки, митохондриальных белков, повреждения митохондриальной ДНК и оксидативного стресса в её основе [9].
В патогенезе лучевой кардиопатии принимают участие уже известный гипоксия-индуцированный фактор1-α, интерлейкин-1, блокирование рецепторов которого как и в случае с воздействием Доксорубицина препятствует снижению ФВ, но при этом не оказывает влияние на процессы фиброза, ядерный фактор kappa B, представляющий собой белковый комплекс, регулирующий транскрипцию ДНК и участвующий в клеточном ответе на различные стрессовые воздействия, на оксидативный стресс в частности и выявленные недавно в качестве участников длительного асептического воспаления представители каликреин-кининновой системы, работающие посредством митоген-активируемых протеинкиназ [1].
Диагностика
При лучевом поражении сердца ЭКГ изменения обычно выражаются в неспецифических смещениях сегмента ST, низком вольтаже зубцов, появлении и прогрессировании нарушений ритма сердца, развитии внутрижелудочковых блокад, иногда атриовентрикулярных блокад, что, конечно, имеет лишь вспомогательное значения для диагностики кардиопатий.
Широко изучается выявление ЭХОКГ-признаков диастолической дисфункции, как наиболее ранних предвестников развития СН, однако в настоящее время отсутствуют практические руководства по раннему выявлению постлучевой кардиопатии с помощью показателей расслабления миокарда. Несмотря на это большинством экспертов поддерживает обязательное проведение ЭХОКГ спустя 10 лет после проведённой лучевой терапии в качестве мониторинга [2].
Натрий-уретические пептиды и тропонины могут быть использованы в качестве оценки степени лучевого повреждения миокарда, но опять-таки, определённых рекомендаций по их использованию в плане диагностики кардиопатий, обусловленных радиотерапией, не существует [117].
Главный приоритет в диагностике развивающегося интерстициального фиброза миокарда, основного морфологического проявления радиационного воздействия, принадлежит дорогостоящим методикам: МРТ с контрастным усилением, позволяющие выявить по эффекту задержки гадолиния признаки фиброза, происходящие после облучения средостения, перфузионная сцинтиграфия с 99mTс-МИБИ, однофотонная эмиссионная томография, способная визуализировать временные дефекты микроперфузии миокарда, попавшего под облучение, объём которых статистически коррелирует с лучевой нагрузкой 10.
В мировой литературе приводятся данные о применении радионуклиидной ангиографии, определение потребления миокардом кислорода в покое и при физической нагрузке в качестве скрининговых методов диагностики пациентов, прошедших радиотерапию, а также выявление радиационных повреждений сердца посредством обнаружения экстравазальных скоплений альбумина в миокарде [8, 13-17].
Радиопротекция и лечение
Современные методики лучевой терапии способствуют сокращению дозы облучения и уменьшению поля облучения, но неизвестно способствует ли это безопасности или просто оттягивает во времени проявление осложнений, так как, отсутствуют статистически достоверные данные, свидетельствующие об уменьшении долгосрочных событий.
К методикам, способствующим избежать повреждения сердца, относятся:
трёхмерное планирование облучения,
дыхательное стробирование с модуляцией интенсивности облучения,
использование свинцовых блоков для защиты сердца,
Техническое усовершенствование радиотерапевтической аппаратуры, развитие клинической дозиметрии, разработка предлучевой топометрии с использованием компьютерной техники служат основой повышения эффективности лучевой терапии при лечении опухолей. Наличие рентгеносимулятора, компьютерного томографа, возможность использования магнитно-резонансного и позитронного эмиссионного томографа позволяют весьма точно определить границы мишени, подлежащей облучению. Даже такая мелочь, как синхронизация лучевой терапии с дыханием, позволяет уменьшить дозу ионизирующего излучения в органах риска (сердце и лёгкие) и, тем самым, снизить вероятность развития лучевых осложнений.
Экспериментально на крысах были проведены попытки уменьшить лучевой воздействие на сердце путём синхронизации пучка облучения с сердечным циклом, тем самым оказывая воздействие в тот момент, когда миокард находится в состоянии относительной гипоксии [18].
На прогноз пациентов, подвергнутых радиотерапии, влияет возраст, так как известно, что риск поражения сердечно-сосудистой системы при радиационном облучении наиболее высок у лиц молодого возраста, перенесших радиотерапию до 40 лет облучение зоны средостения у детей и подростков, больных лимфогранулематозом, сопровождается ростом кардиальной смертности уже в течение первых пяти лет после облучения [10].
Сердечная смертность значительно увеличивается даже после облучения небольшой дозой в 5Гр в случае присоединения антракциклинов.
Несмотря на то, что радиационные поражения сердечно-сосудистой системы могут возникать в отсутствие факторов риска кардиологических заболеваний, необходимо помнить, что классические факторы риска (артериальная гипертензия, курение и гиперлипидемия) увеличивают риск прогрессирования радиационно обусловленных изменений сердца и требуют более агрессивной терапии [19].
Фармакологические методы предупреждения последствий лучевого воздействия в настоящее время не известны, но идут исследования в направлении препаратов, воздействующих на каликреин-кининовую систему. Так известно, что тучные клетки неожиданно оказывают протективную роль для сердца, посредством подавления активности эндотелина-1. Экспериментальные методы по использованию блокатора эндотелинновых рецепторов Бозентана в настоящее время не дали каких-либо положительных результатов. Также проводятся работы по изучению радиопротективных свойств Пентоксифиллина [4].
Описаны попытки экспериментального воздействия на процесс миокардиального фиброза и оксидативный стресс, индуцированные ионизирующей радиацией, с помощью статинов, гормона мелатонина, известного своими мощными кардиопротективными свойствами, витаминов С, Е, N-ацетилхолина. [20]
В эксперименте на мышах назначение Талидомида, известного седативного препарата, за которым были замечены возможности активировать созревание сосудистой стенки за счёт размножения перицитов, не приводило к защите сердца от радиационного повреждения [21].
В будущем должны быть проведены исследования по оценке эффективности профилактического приёма и-АПФ, ингибиторов минералкортикоидных рецепторов, аллопуринола.
Есть сведения о положительном лечебном эффекте пересадки мезенхимальных стволовых клеток пациенту с радиационной кардиопатией и перикардитом [22].
И наконец, пациенты с радио-индуцированной рестриктивной кардиопатией имеют наихудший прогноз после трансплантации сердца, им чаще требуется механическая поддержка в период ожидании трансплантанта с замещением функции правого желудочка и у них нередко почечная и дыхательная недостаточность вследствие лучевого повреждения соответствующих органов [23].
Однако, выживаемость таких пациентов, согласно данным клиники Мейо, после ортотопической трансплантации сердца в течение 1, 5, 10 лет составила 91, 7%, 75% и 46, 7% соответственно [24].
Таким образом, -радио-индуцированные кардиопатии, несмотря на низкую частоту развития, должны иметь должное внимание со стороны специалистов онкологии и кардиологии. В настоящее время существуют практические руководства, позволяющие уменьшить риск возникновения кардиопатии на фоне химиотерапии. В отношении профилактики радиационного повреждения миокарда ведутся дальнейшие работы.
Список литературы
Mawad R. , Gooley T. A. , Rajendran J. G. , Fisher D. R. et. al. Radiolabeled anti-CD45 antibody with reduced-intensity conditioning and allogeneic transplantation for younger patients with advanced acute myeloid leukemia or myelodysplastic syndrome. Biol Blood Marrow Transplant. 2014 Sep;20 (9): 1363-8. doi: 10. 1016/j. bbmt. 2014. 05. 014. Epub 2014 May 20.
Gyenes G. , Fornander T. , Carlens P. , Glas U. et. al. Myocardial damage in breast cancer patients treated with adjuvant radiotherapy: a prospective study. Int J Radiat Oncol Biol Phys. 1996 Nov 1;36 (4): 899-905.
Mezzaroma E. , Mikkelsen R. B. , Toldo S. , Mauro A. G. et. al. Role of interleukin-1 in radiation induced cardiomyopathy. Mol Med. 2015 Mar 26. doi: 10. 2119/molmed. 2014. 00243.
Lipshultz S. E. , et al; American Heart Association Congenital Heart Defects Committee of the Council on Cardiovascular Disease in the Young, Council on Basic Cardiovascular Sciences, Council on Cardiovascular and Stroke Nursing, Council on Cardiovascular Radiology. (2013) Long-term cardiovascular toxicity in children, adolescents, and young adultswho receive cancer therapy: pathophysiology, course, monitoring, management, prevention, and research directions: a scientific statement from the American Heart Association. Circulation. 128: 1927-95. doi: 10. 1161/CIR. 0b013e3182a88099
Jaworski C, Mariani JA, Wheeler G, Kaye DM. (2013) Cardiac complications of thoracic irradiation. J Am Coll Cardiol. 61: 2319-28. doi: 10. 1016/j. jacc. 2013. 01. 090.
Lipshultz SE, Adams MJ. (2010) Cardiotoxicity after childhood cancer: beginning with the end in mind. J Clin Oncol. 28: 1276–1281. doi: 10. 1200/JCO. 2009. 26. 5751
Taunk N. K. , Haffty B. G. , Kostis J. B. , Goyal S. Radiation-induced heart disease: pathologic abnormalities and putative mechanisms. Front Oncol. 2015 Feb 18;5: 39. doi: 10. 3389/fonc. 2015. 00039. ECollection 2015
Azimzadeh O. , Scherthan H. , Sarioglu H. , Barjaktarovic Z. et. al. Rapid proteomic remodeling of cardiac tissue caused by total body ionizing radiation. Proteomics. 2011 Aug;11 (16): 3299-311. doi: 10. 1002/pmic. 201100178.
Mezzaroma E. , Di X. , Graves P. , Toldo S. et. al. A mouse model of radiation-induced cardiomyopathy. Int J Cardiol. 2012 Apr 19;156 (2): 231-3. doi: 10. 1016/j. ijcard. 2012. 01. 038. Epub 2012 Feb 16.
Herrmann J. , Lerman A. , Sandhu N. P. , Villarraga H. R. et. al. Evaluation and management of patients with heart disease and cancer: cardio-oncology. Mayo Clin Proc. 2014 Sep;89 (9): 1287-306. doi: 10. 1016/j. mayocp. 2014. 05. 013.
Umezawa R. , Ota H. , Takanami K. , Ichinose A. et. al. MRI findings of radiation-induced myocardial damage in patients with oesophageal cancer. Clin Radiol. 2014 Dec;69 (12): 1273-9. Doi: 10. 1016/j. crad. 2014. 08. 010.
van Nimwegen F. A. , Schaapveld M. , Janus C. P. , Krol A. D. et. al. Cardiovascular Disease After Hodgkin Lymphoma Treatment: 40-Year Disease Risk. JAMA Intern Med. 2015 Apr 27. doi: 10. 1001/jamainternmed. 2015. 1180.
Dogan I. , Sezen O. , Sonmez B. , Zengin A. Y. et. al. Myocardial perfusion alterations observed months after radiotherapy are related to the cellular damage. Nuklearmedizin. 2010;49 (6): 209-15. doi: 10. 3413/nukmed-0315-10-05.
Burns R. J. , Bar-Shlomo B. Z. , Druck M. N. , Herman J. G. et. al. Detection of radiation cardiomyopathy by gated radionuclide angiography. Am J Med. 1983 Feb;74 (2): 297-302.
Lipshultz S. E, Adams M. J. Cardiotoxicity after childhood cancer: beginning with the end in mind. J Clin Oncol. 2010 Mar 10;28 (8): 1276-81. doi: 10. 1200/JCO. 2009. 26. 5751. Epub 2010 Feb 8.
Gladstone D. J. , Flanagan M. F. , Southworth J. B. , Hadley V. et. al. Radiation-induced cardiomyopathy as a function of radiation beam gating to the cardiac cycle. Phys Med Biol. 2004 Apr 21;49 (8): 1475-84.
Hong R. A. , Iimura T. , Sumida K. N. , Eager R. M. Cardio-oncology/onco-cardiology. Clin Cardiol. 2010 Dec;33 (12): 733-7. doi: 10. 1002/clc. 20823.
Wagdi P, Fluri M. , Aeschbacher B. , Fikrle A. , Meier B. Cardioprotection in patients undergoing chemo- and/or radiotherapy for neoplastic disease. A pilot study. Jpn Heart J. 1996 May;37 (3): 353-9.
Hoving S, Seemann I, Visser NL, te Poele JA, Stewart FA. Thalidomide is not able to inhibit radiation-induced heart disease. Int J Radiat Biol (2013) 89 (9): 685–91. doi: 10. 3109/09553002. 2013. 788797
Kursova L. V. , Konoplyannikov A. G. , Kal'sina S. Sh. , Baboyan S. B. Allogenic cardiomyoblasts raised from human mesenchymal stem cells in the therapy of radiation cardiomyopathy and pericarditis: case report. Bull Exp Biol Med. 2014 May;157 (1): 143-5. doi: 10. 1007/s10517-014-2510-4. Epub 2014 Jun 10.
Shah S. , Nohria A. Advanced heart failure due to cancer therapy. Curr Cardiol Rep. 2015 Apr;17 (4): 16. doi: 10. 1007/s11886-015-0570-3.
Saxena P. , Joyce L. D. , Daly R. C. et. al. Cardiac transplantation for radiation-induced cardiomyopathy: the Mayo Clinic experience. Ann Thorac Surg. 2014 Dec;98 (6): 2115-21. doi: 10. 1016/j. athoracsur. 2014. 06. 056
Сосуды сердца при лучевой болезни. Морфология лучевой болезни сердца
Морфология сердца при острой лучевой болезни. Патология сердца после радиационного поражения
Анализ литературных материалов показывает, что морфологические изменения в сердце после местного облучения рентгеновскими лучами в пределах эритемной дозы (600 Р) ограничиваются лишь явлениями острого венозного застоя, а после воздействия в дозах, превышающих 1000 рад, наступает нарушение кровообращения вследствие набухания эндотелия капилляров и нарушения целостности их стенок, отека периваскулярной и интерстициальной ткани, кровоизлияния и очаговых дистрофических изменений в сердечной мышце, вплоть до гибели отдельных мышечных волокон, с последующим уменьшением капиллярной сети и развитием интерстициального склероза [Лебкова Н. П., 1976].
Наиболее тяжелые изменения описаны после многократных облучений области сердца. В этих случаях обнаруживается переполнение кровью мелких кровеносных сосудов и капилляров, плазматическое пропитывание сосудистых стенок и наличие отечной жидкости в периваскулярной и межуточной ткани, кровоизлияния, признаки белковой и жировой дистрофии, исчезновение поперечной исчерченности, некроз мышечных волокон, а в отдаленные сроки — большое количество липофусцина н атрофия мышечных волокон.
Одновременно происходит разрастание периваскулярной межуточной ткани, склеротическое утолщение эпикарда, дистрофические изменения в нервных образованиях [Фунштейн Л. В. и др., 1976; Fajardo L. et al., 1970, 1971; Bourain Y. et al., 1977].
Отмеченные закономерности свидетельствуют об определенной зависимости характера патологоанатомических изменений в сердце от количества энергии, поглощенной тканью органов, что подтверждается и наблюдениями в условиях общего облучения организма.
Поэтому вполне очевидно, что некоторые исследователи, применявшие в своих экспериментах мягкие рентгеновские лучи, не обнаружили в сердце заметных изменений, кроме признаков застойного полнокровия капилляров и мелких кровеносных сосудов.
Как известно, при острой лучевой болезни, обусловленной внешним облучением, развиваются тяжелые функциональные нарушения сердечной деятельности [Куршаков Н. А., 1954; Горизонтов П. Д., 1962]. Тем не менее даже в монографических трудах, посвященных патологической анатомии экспериментальной лучевой болезни [Яковлева Л. А,, 1966], состоянию миокарда уделяется мало внимания. Отмечается только, что в сердце облученного организма наблюдаются дистрофические изменения.
Существует даже мнение о достаточной устойчивости сердца к лучистой энергии [Herapelmann L. et ai., 1952; Jones A. et al., 1960]. Однако большинство исследователей относят его к радиочувствительным органам [Саркисов Д. С, 1955; Краевский Н. А„ 1957, 1962; Фунштейн Л. В., 1961; Иванов А. Е., 1962], поражение которого занимает существенное место в патогенезе острой лучевой болезни. В случаях данного поражения людей, описанных ранее в зарубежной литературе [Shipman Т., 1962; Feindger J. et al., 1967], имелось расстройство кровообращения главным образом по типу правосторонней сердечной недостаточности, сопровождавшееся массивным отеком тканей.
Кровеносные сосуды при лучевой болезни. Морфология сосудов после лучевого поражения
Возникающие под действием ионизирующего излучения патологоанатомические изменения кровеносных сосудов сходны как при местном, так и при общем внешнем облучении. В основе их лежат расстройства гемодинамики и дистрофические процессы, ведущие к нарушению проницаемости сосудистых стенок. Различие заключается только в степени проявления тех или других нарушений, что в первую очередь определяется видом и дозой ионизирующего излучения, а также биологическими свойствами и объемом облученных тканей.
Обнаруживаемые при патологоанатомическом исследовании изменения могут заключаться в паралитическом "расширении и кровенаполнении мелких сосудов и капилляров или указывать на нарушение проницаемости не только мелких, но и крупных сосудов с вытекающими отсюда последствиями. Однако по характеру морфологических изменений без учета времени, прошедшего с момепта воздействия, не всегда можно судить о тяжести лучевого поражения, так как в развитии сосудистых изменений имеется определенная последовательность.
В ранние сроки после облучения, как правило, наблюдаются явления острого венозного застоя, которые в зависимости от тяжести поражения и продолжительности заболевания могут проходить бесследно или сменяться грубыми изменениями сосудистых стенок. Наличие венозного застоя подтверждается контрастированием сосудов в тотальных препаратах [Абдурахманов Ф. А., 1972].
Наиболее типичные изменения сосудов наблюдаются при острой лучевой болезни. Если патологоанатомическое исследование проводится в скрытом периоде острой лучевой болезни, вызванной равномерным облучением в минимальной смертельной дозе, то макроскопические признаки сосудистых расстройств почти не различаются. В случае же ранней смерти после облучения в дозах, намного превышающих абсолютно смертельную, или при гибели «под лучом» обнаруживается картина, свидетельствующая об острейшем расстройстве кровообращения по типу коллапса или шока [Иванов А, Е,, 1957, 1961; Краевский Н. А., 1957, 1962].
Особенно выраженные признаки острой сердечно-сосудистой недостаточности наблюдаются в органах грудной клетки и брюшной полости в виде переполнения кровью полостей правого сердца, венозного полнокровия легких, печени, селезенки, почек. Крупных кровоизлияний в таких случаях, как правило, не наблюдается. В серозных и слизистых оболочках встречаются мелкие геморрагии. Тем не менее нарушения кровообращения в венозной системе могут быть настолько тяжелыми, что уже сами по себе служат причиной массивных кровоизлияний в оболочках мозга, острого мускатного застоя в печени с грубыми некробиотическими и деструктивными изменениями центральных вен и гепатоцитов, резкого кровенаполнения селезенки, гибели паренхиматозных клеток в других органах.
Однако следует иметь в виду, что подобные изменения никакого отношения к собственной лучевой патологии не имеют. Они являются постоянными явлениями, при всякой смерти от острого нарушения гемодинамики, асфиксии и острой кислородной недостаточности [Краевс кий Н, А., 1957, I960], хотя L. H. Hempelmann и соавт.. (1952) связывают возникновение коллапса после массивного лучевого воздействия с поражением надпочечников. В известной мере это согласуестя с мнением Б. Б. Мороза и соавт. (1974), которые считают, что реакция коры надпочечников в первые часы после лучевого поражения аналогична реакции на другие стрессовые воздействия.
Постлучевое поражение сердечно-сосудистой системы
ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава РФ, 119992 Москва, ул. Трубецкая, 8, стр. 2.
Комплексный подход в лечении онкологических больных, в том числе применение лучевой терапии существенно уменьшает риск рецидива первичной опухоли, но вместе с тем несет угрозу отдаленных осложнений. Риск смерти от патологии сердца после лучевой терапии увеличивается со снижением возраста на момент облучения, увеличением продолжительности наблюдения, увеличением дозы радиации и объема облучения. Традиционные факторы риска могут взаимодействовать с постлучевым повреждением сердца и повышать риск смерти от сердечно-сосудистой патологии. Ранняя диагностика и своевременная терапия радиационно-индуцированной болезни сердца является одной из актуальных проблем для выживших после рака.
Внедрение современных схем полихимиотерапии, в том числе «таргетной» в сочетании с точечной лучевой терапией у пациентов с различными онкологическими заболеваниями приводит к достижению стойкой ремиссии и увеличению выживаемости после лечения. Поэтому в практике кардиолога все чаще встречаются клинические наблюдения отдаленных сердечно-сосудистых осложнений у больных этой группы. Развитие этих осложнений значительно ухудшает качество жизни пациентов и увеличивает риск смерти от сердечно-сосудистых заболеваний (ССЗ) спустя 10 лет и более после лучевой терапии.
Радиация оказывает негативное воздействие на все структуры сердца, поэтому диапазон постлучевых сердечно-сосудистых осложнений (ССО) довольно широк. Для обозначения комплекса клинически значимых поражений тканей сердца, которые возникли в результате облучения, используется термин «радиационно-индуцированная болезнь сердца» (radiation induced heart disease) [1, 2]. Верификация подобных нарушений связана с определенными диагностическими сложностями вследствие длительного промежутка времени между причиной и следствием и не стандартизирована на международном уровне. Вместе с тем радиационно-индуцированная болезнь сердца — одна из важнейших проблем современной медицины, поскольку приводит к снижению качества жизни пациентов и увеличивает риск развития летальных ССО, даже в когорте больных, исходно не страдающих от заболеваний сердца [3—5].
В структуре радиационно-индуцированной болезни сердца описаны перикардит, кардиомиопатия, коронарная и клапанная патология, нарушения ритма сердца и проводимости [1, 4, 6—8] (табл. 1). Эти различные клинические проявления радиационно-индуцированной болезни сердца, как правило, характеризуются различным временем манифестации в зависимости от полученной дозы излучения, но обычно формируются спустя 10—15 лет после лучевой терапии и рассматриваются в качестве отдаленных осложнений (более 6 лет).
Согласно современным представлениям, к ранним осложнениям лучевой терапии относятся патологические изменения, если они сформировались в течение 1-го года после лечения, а ранние отсроченные — в первые 5—6 лет.
Изучение связи между лучевой терапией и патологией сердца началось в 80-е гг. прошлого века, когда были опубликованы результаты первых наблюдений за большими группами больных лимфогранулематозом. Установлено, что распространенность постлучевых повреждений сердца достаточно высока. Например, по данным T. Girinsky [9], изучавшим последствия лучевой терапии в дозе более 40 Гр, хронический перикардит развивался примерно у 5% больных, клапанные дефекты выявляли у 15—30%, стенокардия — у 5—10% и примерно у 5% пациентов регистрировали нарушения проводимости.
На основании многочисленных научно-клинических исследований и наблюдений были определены наиболее значимые факторы риска. В первую очередь – это доза облучения. Предполагается, что для профилактики постлучевых кардиальных осложнений доза облучения на область сердца не должна превышать 30 Гр [9].
Вторым по значимости радиобиологическим параметром является объем тканей сердца, подвергавшихся облучению. A.M. Gaya [10] установлено, что радиационно-индуцированная болезнь сердца закономерно возникает после лучевой терапии при облучении 65% и более от всего объема тканей сердца.
Кроме того, среди факторов риска развития постлучевых ССО выделяют время, прошедшее после лучевой терапии, и возраст пациента на момент лечения.
Так, V. King и соавт. [11] приводят данные об увеличении риска развития фатального инфаркта миокарда в 2,8 раза спустя 10 лет после лучевой терапии лимфогранулематоза, а S.L. Hancock и соавт. [12] отмечают, что облучение зоны средостения у детей и подростков с лимфогранулематозом повышает смертность от патологии сердца уже в первые 5 лет после радиотерапии.
Механизм развития постлучевых повреждений полностью не изучен. Предполагается, что лучевая терапия вызывает повреждение эндотелия и периваскулярный фиброз с пролиферацией гладких мышечных клеток [13, 14].
Радиация также оказывает протромбический эффект, приводя к увеличению уровня фактора Виллебранда в крови, что было выявлено после облучения эндотелиальных клеток in vitro [13].
Структурные изменения в коронарных артериях, которые формируются вследствие лучевой терапии, подобны патогенезу атеросклероза, однако имеют некоторые отличия [6, 8].
Это проявляется высокой частотой проксимального стеноза и устьевой локализацией; безболевой ишемией миокарда (вследствие автономной дисфункции вегетативной нервной системы с уменьшенным восприятием ангинозной боли); поражением левой коронарной артерии, передней нисходящей артерии и правой коронарной артерии (ПКА). Данные изменения связаны с вовлечением этих областей в поле радиационного воздействия во время лучевой терапии при медиастинальных лимфомах или, например, при раке молочной железы [15].
В данной статье приводим клиническое наблюдение постлучевого поражения сердечно-сосудистой системы вследствие лучевой терапии по по.
Читайте также:
- Желудочковая тахикардия при ишемической болезни сердца (ИБС)
- Лабиринтопатии и специфические вестибулярные реакции при шейном остеохондрозе
- Кровоснабжение тонкой кишки. Верхняя брыжеечная артерия. Топография верхней брыжеечной артерии. Аркады кишки.
- Меланома радужки: признаки, гистология, лечение, прогноз
- Поддерживающий аппарат матки. Подвешивающий аппарат матки. Кровоснабжение матки.
