Советы по антибиотикопрофилактике в хирургии
Добавил пользователь Alex Обновлено: 30.01.2026
Для цитирования: Лоран О.Б., Синякова Л.А., Косова И.В., Дементьева А.В. Антибактериальная профилактика и терапия при урогинекологических операциях. РМЖ. 2007;7:620.
Актуальность проблемы гнойно–септических осложнений в урологии обусловлена высокой частотой их возникновения (10–40%), что требует своевременной диагностики и проведения адекватного лечения. Характер, клинические проявления и методы лечения данных осложнений принципиально изменились за последние годы. Это связано с усовершенствованием хирургической техники, созданием нового шовного материала и инструментария, новыми подходами к асептике и антисептике, а также наличием современных антибактериальных препаратов.
Существуют факторы, предрасполагающие к развитию гнойно–септических осложнений: инструментальные (инвазивные) методы обследования и лечения; эндоскопические хирургические вмешательства; традиционные оперативные вмешательства на почках и мочевых путях с оставлением дренажей; нозокомиальные инфекции, полирезистентные к антибактериальным препаратам; преобладание среди пациентов лиц пожилого и старческого возраста; сопутствующие заболевания (сахарный диабет, иммуносупрессивные состояния, почечная и почечно–печеночная недостаточность и др.).
Факторы, связанные с состоянием больного, свойствами возбудителя и состоянием окружающей среды также способствуют развитию гнойно–воспалительных осложнений в послеоперационном периоде:
1. «Факторы» больного – возраст, нарушение питания, снижение иммунного статуса, курение, алкоголизм, сопутствующие заболевания.
2. «Факторы» возбудителя – степень контаминации раны, вирулентность возбудителя.
3. «Факторы» окружающей среды – санитарно–гигиеническое состояние операционной, отделений реанимации, интенсивной терапии, палат.
Ряд факторов обусловлены особенностями самого оперативного вмешательства: продолжительность операции, тип предоперационной подготовки (использование антисептиков, виды обработки кожи и др.), протяженность разреза (нарушение анатомических барьеров), кровопотеря, использование чужеродных материалов (протезы, дренажи, шовный материал), степень травматичности операции, переливание крови, тип перевязочного материала и др.
В зависимости от риска развития раневых инфекционных осложнений хирургические вмешательства могут быть условно–контаминированные (не травматичные, затрагивающие пищеварительный тракт, мочеполовые пути) и контаминированные (травматичные, в области воспалительного процесса, урологические операции при уроинфекции).
Среди всех видов госпитальной инфекции первое место в мире занимают госпитальные инфекции мочевых путей (29–44%). Это связано с необходимостью дренирования мочевых путей. Частота случаев бактериурии, связанной с введением катетеров, колеблется от 28 до 69%. У пациентов с постоянными уретральными катетерами частота бессимптомной бактериурии приближается к 100%. По данным Garribaldi R.A. (1982) и Krieger J.N. (1983), примерно у 30% больных с бактериурией возникают симптомы инфекции мочевых путей, а у 3% развивается вторичная бактериемия. Многочисленные исследования показали, что за каждую неделю пребывания в стационаре около 10% больных приобретают госпитальный штамм, выделяемый во внешнюю среду длительно находящимися в больнице пациентами. Колонизация госпитального, резистентного к антибиотикам штамма наблюдается чаще у больных, получавших соответствующие антибиотики, однако отмечается и у больных, не получавших их.
Высокий риск гнойно–септических осложнений делает необходимой антибактериальную профилактику, которая должна осуществляться в соответствии с определенными требованиями.
Вид антибиотикопрофилактики:
1. Ультракороткая – 1 доза однократно внутривенно до операции.
2. Короткая – 1 доза внутривенно до операции и 1 доза внутривенно после операции.
3. Средней продолжительности – 1 доза внутривенно до операции и 3 дозы после операции в течение 24 часов.
4. Длительная – 1 доза внутривенно до операции и 6–9 доз после операции в течение 48–72 часов.
Первичная антибактериальная профилактика подразумевает предотвращение продвижения инфекции из источника вне мочевых путей (инструмент, катетер, ирригационная жидкость, периуретральная флора).
Вторичная профилактика – снижение риска инфицирования в пределах мочевых путей (очаги инфекции в простате, почке, мочевом пузыре, уретре, микробные пленки на камнях, катетерах).
Принципы антибактериальной профилактики:
1. Антибиотик необходимо вводить до разреза кожи (т.е. до момента бактериальной контаминации) с тем, чтобы бактерицидная концентрация поддерживалась в тканях в течение всего операционного периода. Введение антибактериального средства через 3–4 часа после контаминации неэффективно и не играет никакой профилактической роли в отношении раневой инфекции.
2. При большинстве чистых и условно–чистых оперативных вмешательств достаточно использования цефалоспоринов I–II поколения (цефазолин или цефуроксим) или защищенных пенициллинов (амоксициллин/клавуланат). Эти препараты имеют достаточный спектр антимикробного действия, адекватные фармакокинетические характеристики, низкую токсичность и невысокую стоимость.
3. Цефалоспорины III поколения не являются рутинным средством профилактики, их применение должно быть резервировано для случаев риска полимикробного инфицирования. Это не относится к резервному использованию защищенных пенициллинов и комбинации аминогликозидов с метронидазолом.
4. Продолжительность профилактического применения антибиотиков в большинстве случаев не превышает 24 часов. Более длительное введение антибиотика носит терапевтический характер или связано с другими факторами риска, не относящимися к раневой инфекции.
5. При оперативных вмешательствах длительностью более 3 часов необходимо повторное введение антибиотика (через интервал времени, соответствующий периоду полувыведения лекарственного препарата).
6. В случаях высокого риска инфицирования метициллин–резистентными стафилококками и другими проблемными микроорганизмами (их выявление входит в задачу службы профилактики и лечения инфекций в хирургическом стационаре) для профилактики оправдано применение антибиотиков резерва (в частности, ванкомицина) (табл.1).
Эмпирическая антибактериальная терапия подразумевает охват всех потенциальных возбудителей инфекции выбранным режимом терапии, а также учет риска мультирезистентности возбудителей при выборе антибактериального препарата.
В урологической клинике больницы им. С.П. Боткина в 2006 году прооперировано 77 больных в возрасте от 18 до 82 лет по поводу следующих урогинекологических заболеваний: cтрессовое недержание мочи 56 (73%); мочеполовые свищи 10 (12,9%); влагалищная эктопия уретры 6 (7,8%); парауретральная киста 5 (6,5%). Больным выполнены следующие виды операций: имплантация свободной синтетической петли трансобтураторным доступом; Prolift Total; Prolift anterior; пластика пузырно–влагалищного свища; транспозиция наружного отверстия уретры; экстирпация парауретральной кисты; операция Боари.
Всем больным перед операцией (на вводном наркозе) проводилось введение антибиотиков, при этом препаратами выбора являлись ципрофлоксацин (Ципринол) и метронидазол по 400 мг и 500 мг соответственно. Основные характеристики биологического действия фторхинолонов представлены в таблице 2.
Применение препаратов продолжалось в послеоперационном периоде в виде ступенчатой терапии (в течение 2–3 суток парентерально, затем Ципринол по 500 мг 2 раза в сутки per os в течение 7 дней).
У 18 больных в качестве профилактики перед эндоскопическими операциями и манипуляциями на нижних мочевых путях, а также для профилактики гнойно–воспалительных осложнений при некоторых урогинекологических операциях (пластика цистоцеле, установка свободной синтетической петли) использовался фосфомицин трометамол. Препарат назначался в дозе 3 г накануне операции и 3 г однократно после операции или манипуляции, при этом осложнений гнойно–воспалительного характера не отмечено ни в одном случае.
Факторы рецидивирования инфекций нижних мочевых путей у женщин:
1. Анатомо–физиологические особенности женского организма (короткая и широкая уретра, близость к естественным резервуарам инфекции – анус, влагалище; аномалии развития – дистопия, гипермобильность уретры).
2. Способность грамотрицательных микроорганизмов, вызывающих инфекционный процесс в уретре и мочевом пузыре, к адгезии к клеткам эпителия вследствие наличия фимбрий и ворсин.
3. Частые сопутствующие гинекологические заболевания – воспалительные процессы во влагалище, гормональные нарушения (в том числе гипоэстрогенемия), приводящие к дисбиозу влагалища и размножению в нем патогенной микрофлоры.
4. Генетическая предрасположенность.
5. Частота половых актов (наличие ИППП) и характер применяемых контрацептивов.
Необходимо учитывать особенности течения воспаления мочевого пузыря и почек на фоне урогенитальных инфекций:
1. Особенности течения циститов на фоне урогенитальных инфекций:
– наличие поллакиурии до 11–14 раз в сутки вне периода обострения;
– постоянные выраженные болей над лоном, в области уретры, влагалища, которые приводили к сексуальной и социальной дезадаптации;
– длительность заболевания более 2 лет;
– неэффективность проводимой традиционной терапии.
2. Особенности течения пиелонефрита на фоне урогенитальных инфекций:
– в 87,2% случаев ему предшествовал эпизод цистита;
– в 44,3% случаев начало заболевания было связано со сменой полового партнера или началом половой жизни;
– у 25 (35,8%) пациенток присутствовали жалобы на наличие выделений из влагалища различного характера.
Алгоритм диагностики рецидивирующих инфекций нижних мочевых путей и необструктивного пиелонефрита включает:
1. Тщательно собранный анамнез с выявлением таких факторов риска, как раннее начало половой жизни, большое количество половых партнеров, наличие инвазивных манипуляций, сопутствующие хронические гинекологические заболевания, дисбиозы влагалища.
2. Осмотр в «зеркалах».
3. Общий анализ мочи, общий и биохимический анализы крови, посев мочи, обследование на наличие ИППП.
4. УЗИ мочевого пузыря с определением остаточной мочи.
5. УЗИ почек с использованием ЦДК, энергетического допплера.
6. Цистоскопия с биопсией.
7. Рентгенологические методы исследования.
8. Осмотр гинекологом.
Выводы
1. Необходимо комплексное обследование больных перед урогинекологическими операциями для выявления факторов риска.
2. Учитывая наличие факторов риска у всех урогинекологических больных (необходимость дренирования мочевых путей, наличие воспалительных заболеваний половых органов), для профилактики гнойно–воспалительных осложнений после операции больным показана как антибиотикопрофилактика, так и продолжение антибиотикотерапии в послеоперационном периоде до удаления дренажей.
3. Препаратом выбора для антибиотикопрофилактики с учетом факторов риска, спектра действия, влияния на внутриклеточные микроорганизмы и госпитальную флору (Pseudomonas aeruginosa) является ципрофлоксацин (Ципринол).
Литература
1. Бубнов А.Н., Лебедева Т.П., Трунин Е.М., Старосельцев К.Л. // Материалы научно–практической конференции «Антибиотико–профилактика в хирургии». – СПбМАПО,1997. – С. 4–7.
2. Кира Е.Ф. // Материалы научно–практической конференции «Антибиотико–профилактика в хирургии». – СПбМАПО,1997. – С. 13–16.
3. Uncomplicated UTIS in adults. //E.A.U. Guidlines on urinary tract and male genital tract infections, 2006.
4. Косова И.В. Роль урогенитальных инфекций в этиологии циститов и необструктивных пиелонефритов у женщин: Автореф. дисс. канд. мед. наук. – М., 2005.– С. 25.
5. Белобородова Н.В., Богданов М.Б., Черненькая Т.В. Алгоритмы антибиотикотерапии. – М., 1999. – С.125–128.
6. Переверзев А.С. Клиническая урогинекология. – Харьков, 2000. – С. 365
7. Hooton T.M., Scholes D., Hughes J et. al.// New Engl. J. Med. 1996.–Vol.335.–P.468–474.
8. Naber RG, Morrissey I, Ambler JE. Urinary tract infections and fluoroquinolones. Science Press, 2000.
9. Падейская Е.Н., Яковлев В.П. Антимикробные препараты группы фторхинолоноы в клинической практике. М.:ЛОГАТА, 1998:13.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Профилактика в хирургии
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Возбудители
- Коагулазонегативные стафилококки (особенно в кардиохирургической практике, а также и при установке имплантов и протезов)
- Staphylococcus aureus
- Streptococcus spp
- Enterobacteriaceae (ЖКТ)
- Анаробы (ЖКТ)
- Предоперационная профилактика проводится антимикробными препаратами, пациентам без признаков инфекционного воспаления, для уменьшения риска постоперационной раневой инфекции.
- Антибиотик может также вводится до проведения процедур, сопровождающихся высоким риском контаминации (например, в абдоминальной хирургии) или когда последствия инфекции могут привести к очень серьезным последствиям (например, в кардиохирургии)
- Антибактериальный препарат должен перекрывать всю преобладающую микрофлору (см. возбудителей). Стрептококки и стафилококки являются возбудителями в абсолютном большинстве случаев развития инфекции в области хирургического вмешательства (ИОХВ). Анаэробы и энтеробактерии – в абдоминальной хирургии.
- Эффективность антибактериальных препаратов в большинстве случаев зависит от уровня их пенетрации в ткани и времени введения до начала оперативного вмешательства. При длительном оперативном вмешательстве, введение антибактериального препарата необходимо повторить.
- Большинство руководств указывают на то, что в стационарах с высоким риском MRSAпредпочтение должно отдаваться ванкомицину перед цефазолином.
Лечение
Общие положение
- Для правильной дозировки препаратов смотри главу «заключение»
- Обычно, при чистых операциях (например, пластическая хирургия или вмешательства в дерматологии), антибиотикопрофилактика не используется.
- Эффективность препаратов основывается на способности препаратов проникать в кожу и ткани, а также времени введения препарата до начала первого разреза
- Все антибиотики, используемые для антибиотикопрофилактики, должны быть введены не позднее, чем за 1 час до первого разреза (исключении, ванкомицин, который вводится за 2 часа до разреза)
- Специфика назначения антибиотиков: бета-лактамы (цефазолин, другие цефалоспорины и ампициллин/сульбактам) назначаются внутривенно, обеспечивая адекватный уровень в коже через несколько минут – следовательно, могут быть назначены непосредственно перед оперативным вмешательством. (только в стационарах с высоким риском MRSA) – в/в инфузия в течение 1 часа (2 часа для высоких дозировок) за 2 часа до оперативного вмешательства. Рекомендации по дозированию: 100 кг – 1,5 г; все вводится внутривенно каждые 12 часов
- Клиндамицин: инфузия в течение 10-20 минут
- Ципрофлоксацин: инфузия в течение 1 часа.
- Аминогликозиды могут быть использованы для профилактики грамотрицательной инфекции
Общая хирургия:
- Цефотетан снова доступен в США, но альтернативно могут быть использованы цефокситин 1 г в/в или цефазолин2 г + метронидазол 500 мг в/в, или ампициллин/сульбактам 3 г в/в.
- Аппендэктомия: цефотетан 2 г в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Паховая грыжа: не ущемленная - операция является чистой, антибиотикопрофилактика не рекомендуется. Не ущемленная, с установкой сетки – цефазолин 2 г в/в. Ущемленная, экстренное вмешательство: цефотетан 2 г в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Чрескожная эндоскопическая гастростомия: цефазолин 2 г в/в или цефотетан 2 г в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Проникающая абдоминальная травма: цефотетан 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Мастэктомия: антибиотикопрофилактика не рекомендуется. Мастэктомия с лимфодиссекцией: цефазолин 2 г в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Малая хирургия тонкого или толстого кишечника: цефотетан 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
Гинекологические операции
- Кесарево сечение: цефазолин 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Гистерэктомия (абдоминальная или вагинальная) неосложненная: цефазолин 2 г; осложненная цефотетан 2 г в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Выпадение мочевого пузыря или прямой кишки: цефазолин 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Аборт: не осложненный, не нуждается в антибиотикопрофилактике. Осложненный: цефазолин 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
Ортопедия
- Эндопротезирование суставов: цефазолин 2 г в/в. При аллергии на пенициллин: ванкомицин в/в.
- Открытая репозиция: цефазолин 2 гр в/в переоперационно, продолжить 24 часа (открытый перелом может лечиться как инфицированный -цефазолин 2 гр в/в каждые 8 часов х 10 дней). При аллергии на пенициллин: ванкомицин в/в.
- Ампутация нижней конечности: цефотетан 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в плюс гентамицин 5 мг/кг
- Ляминэктомия: цефазолин 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в
- Спондилодез: цефазолин 2 гр в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в или ванкомицин в/в
- Артроскопическая хирургия: нет данных за антибиотикопрофилактику.
Кардиоваскулярная хирургия
- Неосложненная срединная стернотомия/ неосложненный сердечный транслантат: цефазолин 2 гр в/в. При аллергии на пенициллины: ванкомицин в/в +/- гентамицин в/в
- Сердечный трансплантат с предшествующим LVAD, колонизацией MRSA: цефазолин 2 г в/в + ванкомицин в/в. При аддергии на пенициллин: ванкомицин в/в +/- гентамицин в/в
- Установка пейсмейкеров/автоматических кардиовертеров: цефазолин 2 гр в/в. При наличии MRSA инфекции или колонизации необходимо использовать ванкомицин + цефазолин 2,0 в/в. При аллергии на пенициллины: клиндамицин 600 мг в/в или ванкомицин в/в
- Установка LVAD/BIVAD: ванкомицинв/в + ципрофлоксацин 400 мг в/в + флуконазол 400 мг в/в в течение 8 часов.
- Можно продлить антибиотикопрофилактику до 24 часов только при срединной стернотомии.
Дополнительную информацию по периоперационной антибиотикопрофилактике см в таблице главы «дополнительная информация»
Советы по антибиотикопрофилактике в хирургии
Да, они удивительны. Вы хотите знать, будут ли они работать, будут ли приносить больше пользы, чем вреда, а также, не окажется ли следующее поколение антибиотиков неэффективным и токсичным.
Скептицизм — это нормальное явление в отношении любой процедуры или лекарственного препарата, но особенно в отношении антибиотиков, которые применяются почти универсально как агенты, способные предупреждать и лечить инфекции. В этом процессе явное преимущество остается за иммунитетом и лекарственными препаратами, имеющими хорошую репутацию в борьбе с инфекцией.
Антибиотики должны играть ограниченную роль в здравоохранении и нужно сдерживать их необоснованное применение, которое приносит даже больше вреда, чем лишних расходов.
2. Что вы имеете в виду, когда говорите о поколениях антибиотиков, например о цефалоспоринах третьего поколения?
Наиболее ранние антибиотики были бактериостатическими, в значительной степени из-за влияния на синтез белка; поэтому они могли сдерживать размножение микроорганизма, даже если не убивали его. Понятия инвазия (присутствие живых микробов в организме) и инфекция (размножение и распространение микроорганизмов в микроорганизме) помогают понять, как первые антибиотики могли препятствовать развитию инфекции, по были практически неспособны элиминировать микроорганизмы за короткий период лечения.
Пенициллин изменил все. Это, возможно, первый антибиотик, законно претендующий на титул "чудесного лекарства", поскольку обладал бактерицидной способностью в отношении чувствительных микроорганизмов. Пенициллины являются первым поколением бета-лактамных антибиотиков, родственно связанных с цефалоспоринами первого поколения (например, цефазолиином).
Они имеют бета-лактамную структуру, высокоактивны в отношении всего спектра грамположительных микроорганизмов и менее активны в отношении грамотрицательпых микробов. Бета-лактамные антибиотики второго поколения (например, цефокситин) помимо грамположительных аэробов перекрывают новые группы микробов, такие как Bacteroides, но малоэффективны в отношении грамотрицательпых аэробных возбудителей. Поскольку цефалоспорины третьего поколения воздействуют па некоторые грамотрицательные микробы, они были рекомендованы в качестве монотерапевтических средств для всех основных возбудителей.
В отличие от пенициллина, действительно чудодейственного лекарства, новые антибиотики быстро вызывают резистентность микроорганизмов. Наиболее легко определяемым различием между поколениями антибиотиков является их стоимость: оптовая цепа препаратов первого поколения составляет примерно 2 $/г, препаратов второго поколения 5 $/г и препаратов третьего поколения 30 $/г .
Несмотря па такую разницу в цепе, антибиотики более высокого поколения теряют часть своей потенциальной активности против первоначальных грамположительных возбудителей, для которых препараты первого поколения были действительно чудодейственными. Поэтому необходимо два грамма моксалактама чтобы достигнуть эффекта одного грамма цефазолина в отношении грамположителыюьной флоры. Не нужно быть экономистом, чтобы задать вопрос: "Что я получаю в результате 60-кратной переплаты?"
3. Какую роль играют цефалоспорины третьего поколения в профилактике хирургической инфекции?
Никакую. Здесь нет ничего удивительного! Если основной возбудитель — грамположительная флора, лучше применять препараты первого поколения. При значительном риске анаэробного заражения предпочтительны цефалоспорипы второго поколения. Оба класса этих антибиотиков гораздо дешевле, и, как считается, вызывают меньшую резистентность, чем цефалоспорипы третьего поколения, которые неоправданно дороги для профилактического применения и редко столь же эффективны, как другие средства монотерапии при установленной хирургической инфекции.
Конечно, по особым показаниям, например, при менингите в педиатрии, внутрибольничной пневмонии или других специфических инфекциях, не относящихся к хирургическим, цефалоспорины третьего поколения могут включаться или исключаться из схемы лечения.
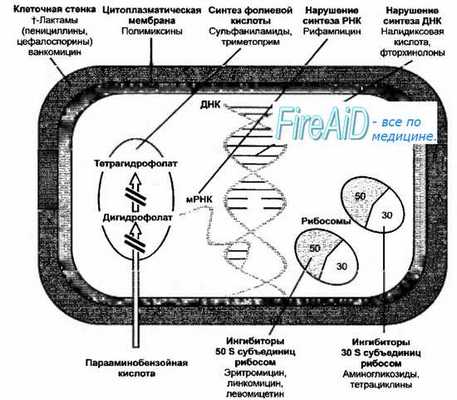
Механизм действия основных группы антибиотиков
4. Как ингибиторы ферментов в комбинации с антибиотиками повышают их антимикробный диапазон?
Микроорганизмы обладают собственными механизмами защиты. На фоне широкого использования антибиотиков микробы, способные вырабатывать ферменты, разрушающие антибактериальные препараты, достигают необычных селекционных результатов. Это именно го, что случилось с пенициллином. Появились пенициллиназы. Но умные фармацевты изменили с помощью метиловой группы структуру пенициллина, сделав новый антибиотик устойчивым к пеиициллиназам, что позволило уничтожать выживавшие за счет пенициллиназы микробы.
В результате появился метициллин, по из-за дальнейшей селекции микробов теперь мы встречаем колонии метициллин-резистентных Staphylococcus aureus. Кроме того, микробы численно превосходят фармацевтические производства и имеют более короткий жизненный цикл, чем время апробации нового препарата Управлением по контролю за качеством пищевых продуктов и лекарственных средств США (Food and Drug Administration (FDA)). Микробы будут всегда опережать нас в своей "изобретательности" только благодаря своему количеству.
В последнее время бактерии стали вырабатывать бега-лактамазы. Ответом фармацевтической промышленности стала группа ингибиторов бета-лактамаз, таких как клавулановая кислота или сульбактам. Комбинация ингибитора бета-лактамаз с модифицированным пенициллином, таким как ампициллин, позволяет успешно бороться с бактериями, вырабатывающими бета-лактамазы, при условии, что изначально они были чувствительны к ампициллину. Повышенные дозы обычного ампициллина в течение короткого времени могут обеспечить тот же эффект и часто по более низкой цене, поскольку комбинированные препараты были разработаны гораздо позже и запатентованы.
5. Когда антибактериальная терапия является наиболее дорогой?
а) Когда антибиотики назначаются без необходимости.
б) Когда антибиотики крайне необходимы, но не действуют.
в) Когда из-за токсического воздействия па макроорганизм антибиотики приносят больше вреда, чем пользы, независимо от их антибактериального потенциала.
6. Можно ли при тяжелой хирургической патологии вместо внутривенных антибиотиков применять пероральные антибиотики?
Да, если только больные могут принимать антибиотики внутрь per os! Больные, о которых мы говорим, почти всегда ничего не могут принимать перорально; они часто находятся без сознания и, скорее всего, па искусственной вентиляции легких. Кроме того, кишечник у таких больных не работает в результате основного заболевания, последующей лапаротомии и атонии кишечника; в желудке стоит разгрузочный зонд. Антибиотики больному могли назначить для лечения панкреатита и сепсиса. Обычно в таких случаях кишечнику предоставляется полный отдых, а больные получают парентеральное питание.
Попытка использовать некоторые виды всасывающихся в кишечнике антибиотиков основана па особенностях фармакокинетики и антибактериальном спектре хинолонов, которые можно сначала вводить внутривенно, а сразу после возобновления естественного кормления перейти па пероральную форму. Почти у всех таких больных лечение начинается с внутривенного введения антибиотиков, а само начало антибактериальной терапии имеет гораздо более важное значение, чем ее окончание и фармакологическая форма, на которую переходят перед отменой.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Советы по профилактике хирургической инфекции и сепсиса
1. Верно ли утверждение, что современные антибиотики позволяют излечивать многие, если не большинство, хирургических инфекций?
Абсолютно неверно! У тяжелых хирургических больных, находящихся в отделении интенсивной терапии, частота септических осложнений возросла, и они остаются одной из основных причин смертности пациентов с полиорганной недостаточностью и иммунодефицитом. Антибактериальная терапия может ослабить смертоносную флору, но не способна компенсировать резкое снижение сопротивляемости организма инфекции: нарушение барьеров против микробной инвазии воспалительными и иммунологическими реакциями на “обычных” возбудителей.
2. При каких типах повреждений защитных барьеров микробная инвазия способна вызвать хирургическую инфекцию?
Кожа и слизистые служат барьером между окружающим миром, населенным множеством микробов, и стерильной внутренней средой тканей и органов (даже если окружающий мир представляет собой насыщенную микрофлорой трубку среди обычно стерильных полостей организма, как, например, желудочно-кишечный тракт (ЖКТ)). Легко проследить разрушение барьерной функции кожи, когда нож рассекает ее и “открывает” путь флоре внутрь или когда нож перфорирует кишечник и контаминированное содержимое вытекает в брюшную полость.
Менее очевидные дефекты в барьерах слизистой происходят при застое в кишечнике содержимого, разрушении токсинами защитных иммуноглобулинов или уменьшении синтеза последних при неадекватном питании ослабленных больных. Сообщества микробов могут проникнуть через поврежденные барьеры особенно легко, если нарушается третья линия защиты — гуморальный и клеточный иммунитет.
3. Чем отличается контаминация от инфекции?
Постоянно присутствующие на поверхности тела резидентные микробные сообщества не приносят большого вреда, а кишечная микрофлора абсолютно полезна, пока находится в кишке. В здоровом организме даже преходящее обнаружение бактерий вне их обычного местонахождения не говорит об инфекции. Например, если вы сегодня утром энергично чистили зубы, различные резидентные грамотрицательные бактерии из полости рта попали в ваш кровоток и были очень быстро элиминированы нормальными механизмами защиты — если только бактерии не столкнулись с пониженным иммунитетом или створками протеза клапана сердца.
4. Какую пользу приносит огромная масса бактерий нижних отделов ЖКТ?
Микробы могут приносить большую пользу. Это те самые бактерии, которые тысячелетиями живут в симбиозе с человеком. Они синтезируют витамин К (что мы делать без них не можем), а также своим подавляющим количеством вытесняют патогенные микроорганизмы. Они также помогают метаболизировать желчные соли и играют роль в детоксикации некоторых вредных факторов окружающей среды.
5. В случае загрязнения брюшной полости кишечным содержимым необходимо микробиологическое исследование фекальных масс с определением чувствительности к антибиотикам всех установленных микроорганизмов — правильно?
Если из-за ошибки, допущенной при заборе лабораторного материала, вам дали заключение о смешанной внутрибольничной флоре, как это изменит вашу терапию? Если, к примеру, анаэробы в фекалиях не обнаружены, будете ли вы столь уверены в их отсутствии в ране, чтобы не включать эти микроорганизмы в спектр антибактериальной терапии?
Необходимо согласиться, что микробиологическое исследование бытовых контаминантов является дорогим, неполным и неинформативным; микробиологическое исследование инфекционных возбудителей в очаге нагноения (особенно внутрибольничных, сохраняющихся после лечения) может предоставить очень важную информацию и экономически более оправдано.

6. Правила асептики; как готовить к операции кишечник?
Предоперационная подготовка включает процедуры, направленные на уменьшение количества резидентной микрофлоры перед плановым инвазивным вмешательством. Она может заключаться в простой обработке кожи тампоном со спиртом перед подкожной инъекцией или обработке хирургического поля перед разрезом.
Аналогично предоперационная подготовка кишечника направлена на уменьшение количества резидентной микрофлоры в кишке и может осуществляться путем:
(1) механического очищения (например, при помощи слабительного);
(2) осмотического или объемного разведения через клизму большим количеством физиологического и других электролитных растворов или маннитолом;
(3) приема внутрь невсасывающихся антибиотиков. Очевидно наиболее важным из этих методов является механическое очищение, поскольку оно позволяет вывести огромное количество микрофлоры, иногда составляющей две трети сухого веса содержимого толстой кишки. Одной из наиболее убедительных причин для назначения определенных пероральных антибиотиков при предоперационной подготовке кишечника является их активное очищающее действие.
7. Стерилизуем ли мы кожу или слизистые полости больного при подготовке хирургического поля к разрезу?
Я знаю единственный способ сделать больных "стерильными", который едва ли можно рекомендовать, — поместить их в автоклав вместе с хирургическими инструментами и салфетками. Но не принимая во внимание этот абсурдный пример, кожу сделать стерильной нельзя. Деконтаминационные процессы несовершенны, особенно в такой сложной ткани, как кожа, с ее бороздами и добавочными структурами, населенными бактериями. Кожа и слизистые оболочки, в отличие от рук в перчатках, не стерильны.
8. Какими способами можно уменьшить количество резидентной микрофлоры без дополнительного повреждения кожи или слизистой?
а) Объемное промывание.
б) Обезжиривание — растворяет секрет сальных желез, который может задерживать микробы.
в) Бактерицидное воздействие бактериостатических агентов.
К большому удивлению, одна дешевая, простая жидкость одновременно является растворителем, жирорастворителем и антимикробным средством — это спирт. Спирт представляет собой почти идеальный препарат для подготовки операционного поля. К его небольшим недостаткам относятся дегидратирующие свойства и небольшая вероятность воспламенения. Поскольку спирт бесследно испаряется, микробы могут распространяться с соседних участков кожи или воздушно-капельным путем, поэтому требуется дополнительная обработка операционного поля длительно действующими бактериостатиками.
Йод также убивает бактерии, но более опасен для чувствительных клеток млекопитающих. Более низкой первоначальной концентрацией йода и более длительным действием обладает йодоформ, который почти всегда применяется для обработки операционного поля. Применение влаго- и воздухопроницаемых импрегнированных “разрезаемых пленок” или предотвращающих высыхание “кольцевых салфеток” может в дальнейшем замедлять повторное загрязнение микрофлорой обработанного (но по-прежнему нестерильного) поля.
9. Какие антибиотики применяются для "санации кишечника"?
Для "санации кишечника" применяются пероральные антибиотики, которые плохо абсорбируются и уменьшают содержание микрофлоры в ЖКТ. Они являются почти идеальным компонентом для предоперационной подготовки кишечника, поскольку относятся к сильным слабительным средствам и в большинстве случаев завершают “очистку” механическим слабительным действием. Наиболее популярны препараты па основе неомиципа/эритромицина.
10. Что такое селективная деконтаминация кишечника? Как она действует?
Она не действует. Этот метод применяется у больных с высоким риском развития сепсиса от полиорганной недостаточности и направлен на поддержание барьерной функции ЖКТ и уменьшение риска “заражения” кишечной флорой. Широкие экспериментальные исследования показали, что этот метод снижает уровень летальности среди тяжелых больных с высоким риском хирургического сепсиса. Однако после длительного клинического исследования продемонстрировать улучшение показателей выживаемости не удалось. Вероятно, причина заключается в том, что лабораторные исследования проводились на здоровых животных с функционирующей защитной системой. В то же время снижение иммунитета, помимо нарушения барьерной функции ЖКТ, позволяет объяснить, почему селективная деконтаминация кишечника не приносит пользы тяжелым больным. Более того, через некоторое время микрофлора вновь заселяет очищенный кишечник, но уже вирулентными формами микробов, устойчивыми к антибиотикам широкого спектра действия. Деконтаминация все еще применяется у больных, получающих высокие дозы химиопрепаратов, перенесших пересадку костного мозга, и у некоторых пациентов, изолированных в "стерильные боксы" (например, пациенты с иммунодефицитными заболеваниями или обожженные больные).
Видео патофизиология сепсиса
Периоперационная антибиотикопрофилактика
В этой статье мы затронем одну из самых интересных тем антимикробной терапии, а именно периоперационную антибиотикопрофилактику. О нее за крайние годы сломано огромное количество копий и они, как ни странно, до сих пор продолжают ломаться.
- особенностями преподавания принципов антибактериальной терапии в ВУЗах
- и достаточно легкого отношения к самим антимикробным препаратам бесконечно меняющиеся концепции антибактериальной терапии так же накладывают свой серьезный отпечаток.
Вы, наверное, помните, не так уж давно это было, как нас учили, что за неделю до операции пациент должен получить курс антибиотиков в качестве «подготовки к оперативном вмешательству. Потом передумали и стали проводить подобный курс уже после операции, причем абсолютно всем пациентам и вне зависимости от того, есть там инфекция или ее нет. Для профилактики. Чтобы было и не думалось. И этот подход так укоренился в сознании, что за 10 лет его никак не удается переломить.
Итак, чего бояться хирурги и почему они назначают антибактериальные препараты? А бояться они нагноения раны или говоря академическим языком – инфекции в области хирургического вмешательства (ИОХВ)
ИОХВ – это инфекция разреза, органа или полости, возникающая в течение 30 дней (без имплантата) или 1 года (с имплантатом) послеоперационного периода.
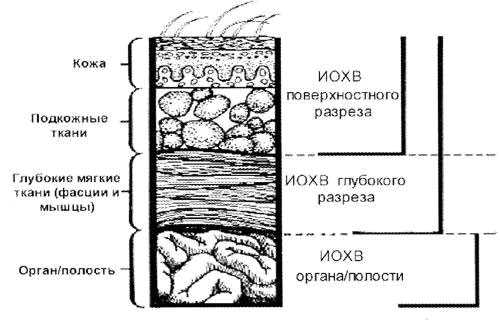
- Поверхностную ИОХВ разреза (кожа, подкожная клетчатка)
- Глубокую – ИОХВ разреза (фасция, мышцы)
- ИОХВ органа или полости
- Симптомов воспаления
- Гнойного отделяемого и лабораторное подтверждение наличия воспаления
- Достоверное микробиологическое подтверждение (окраска мазока по Граму, посев)
- необходимости вмешательство хирурга.
- Гнойное отделяемое из глубины разреза
- УЗИ и RG признаки поражения в сочетании с визуальной симптоматикой
- Спонтанное расхождение краев раны
- Присоединение глубокого поражения к поверхностному
- Необходимость хирургического вмешательства.
- Гнойного отделяемого по дренажам
- Достоверное микробиологическое подтверждение (окраска мазка по Граму, посев)
- Наличие абсцесса
Группу риска по развитию ИОХВ составляют:
- пациенты с пожилого возраста и новорожденные
- пациенты с недостатком массы тела
- больные СД
- ожирение
- сопутствующая инфекция другой локализации
- колонизация носоглотки S.aureus
- снижение местного и общего иммунитета, в т.ч. и в результате лечения.
- Особенности предоперационной подготовки – не надо брить операционное поле, это приводит к микротравматизации и увеличению риска ИОХВ
- Техника выполнения операции – при выполнении операции интернами, ординаторами и молодыми врачами, а так же в ситуациях, когда техника оперативного вмешательства еще не отточена, риски инфекции возрастают очень значительным образом.
- Несоблюдение правил асептики и антисептики
- Большая длительность операции.
- Большая кровопотеря в следствие оперативного вмешательства
- Отсутствие периоперационной антибиотикопрофилактики
- Дренирование раны
- Инфекции хирургического персонала (в том числе колонизация S.aureus)
- Степень микробной обсемененности раны
- Резистентность бактерий к антимикробной терапии.
- чистые,
- условно-чистые,
- контаминированные,
- грязные.
Чистая рана – характеризуется отсутствием признаков воспаления и вовлечения ЖКТ, МВП, дыхательных путей, а так же отсутствием технических нарушений при выполнении оперативного вмешательства.
Условно-чистая рана характеризуется вовлечением ЖКТ, мочеполовых и дыхательных путей; низкой вероятностью контаминации или незначительными техническими нарушениями при выполнении оперативного вмешательства
Контаминированная рана – имеет признаки острого негнойного воспаления; кроме того могут иметь место серьезные технические нарушения в ходе вмешательства (раны пациентов, оперированных начинающими врачами изначально должны считаться контаминированными из-за того, что техникой они еще не владеют в должном объеме)
Сюда же относится большой выброс содержимого полых органов, а также проникающие ранения со сроком менее 4 часов.
Грязные раны – характеризуются наличием гноя, предоперационной перфорацией органов и проникающими ранениями старше 4-х часов.
Итак, мы подошли к главному вопросу – когда же мы должны применить периоперационную антибиотикопрофилактику.
Периоперационную антибиотикопрофилактику мы применяем в первых трех видах ран, а в случае грязной мы с самого начала идем на антибиотикотерапию.
Почему именно тогда? В случае грязной раны возбудители могут быть какие угодно, а вот в случае первых трех, что доказано результатами многочисленных крупномасштабных исследований, ИОХВ вызовут в основном:
- Стафилококки
- Энтеробактер
- Коагулазонегативные стафилококки
- Энтерококки
- Стрептококки
- Кишечная палочка
А что же такое периоперационная антибиотикопрофилактика (ПАП) и какие цели мы перед ней ставим? Это предоперационное в/в введение антибиотика для уменьшения риска развития раневой инфекции, благодаря созданию в ране концентрации, достаточной для снижения уровня микробной контаминации тканей по ходу операционного разреза.
Давайте обратимся к очень известной картинке, которую всегда демонстрируют, когда речь идет о профилактике инфекций в хирургии:
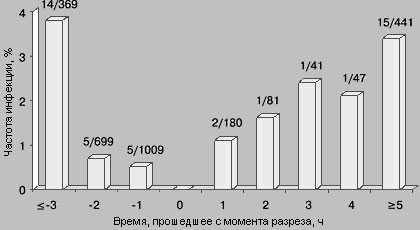
Обратите внимание, что с момента разреза контаминация тканей начинает расти в геометрической прогрессии. И введение антибиотика после операции выглядит как пальба из пушки по воробьям. При этом введение антибиотика не должно быть заблаговременным, ибо через 2-3 часа он уже будет выведен из организма, а значит и не подавит размножение микробов в ране. Таким образом, оптимальным интервалом введения, является введение антимикробного препарата за 30-40 минут до операционного разреза.
- В каких случаях следует проводить антибиотикопрофилактику?
- Какие препараты следует использовать?
- Когда необходимо начинать введение антибиотиков?
- Сколько препаратов необходимо назначить?
- Какова должна быть продолжительность антибиотикопрофилактики?
По первому пункту и третьему пунктам мы уже разобрались – профилактируем мы чистые, условно-чистые и контаминированные раны. Грязные мы начинаем сразу же лечить. А препарат вводим за 30-40 минут до разреза.
- Избирательность применения антимикробных препаратов. Т.е. препараты, применяющиеся с целью ПАП не должны больше использоваться ни в одной схеме антимикробной терапии в стационаре. Это делается для того, чтобы на максимально долгое время отсрочить развитие антибиотикорезистентности у микроорганизмов, вызывающих ИОХВ.
- Препарат должен вводится непосредственно перед операцией, за 30-40 минут до первого разреза.
- Пациентам с высокой массой тела необходимо пересчитывать дозу в сторону ее увеличения
- При длительных операциях препарат должен вводиться дважды, исходя из наиболее часто использующихся препаратов, повторная доза должна быть введена через 3-4 часа от начала оперативного вмешательства, так как это напрямую связано с фармакокинетикой антибиотика, конкретно с его периодом полувыведения (Т1/2)
- Применение ПАП более чем через 24 ч не приводит к увеличению ее эффективности. Исключением в данной ситуации являются оперативные вмешательства, проводимые молодыми врачами, осваивающими технику оперативных вмешательств. В этой ситуации антибиотикопрофилактика продляется до 72 часов.
- пациентов с трахеостомой или интубированных (для профилактики инфекций дыхательных путей);
- пациентов с постоянным мочевым катетером;
- пациентов с центральными венозными катетерами или дренажами плевральной полости;
- большинства пациентов с открытыми ранами, в том числе и ожоговыми.
Связано это с тем, что раны подвергаются постоянной контаминации и добиться там эрадикации не представляется возможным. За такими за пациентами необходим тщательный уход и контроль состояния, для того чтобы немедленно начать антибактериальную при первых же признаках инфекции
- По спектру активности – он должен включать всех наиболее часто встречающихся возбудителей
- Доза препарата должна быть обычной терапевтической (исключение – лица с ожирением)
- Время введения препарата 30-40 мин до разреза, строго!
- Кратность введения определяется Т1/2 и длительностью операции. Для основных препаратов для ПАП справедливо правило о повторном введении антибиотика через 3-4 часа от начала операции.
- легко доступен,
- дешев,
- не использоваться в схемах антибиотикотерапии в стационаре.
Почему только там? Цефазолин относится к препаратам с грам(+) активностью, он отлично воюет с грамположительными кокками, но совершенно непригоден в случае грамминус возбудителей.
Кроме того, применяя этот препарат следует помнить об общем класс-эффекте всех цефалоспоринов – лекарственные гипертермии. Примерно каждый сотый пациент выдает на цефазолин гипертермию, которая от истинной отличается тем, что проходит на фоне относительной брадикардии. Таким образом, если после АБП цефазолином у вашего пациента поднялась температура тела, а операция была чистой и в своей технике вы уверены, прежде чем паниковать и бросаться лечить его мощными антибиотиками – осмотрите рану, возьмите клинические анализы и посчитайте пульс!
Прекраснейший антибактериальный препарат, перекрывающий всех возбудителей ИОХВ и как следствие могущий использоваться при всех 3-х видах оперативных вмешательств в дозе 1,2 г в/в за 30-40 мин до разреза…
Во-вторых, его крайне сложно вывести из оборота в стационаре, так как он входит в схемы лечения многих инфекций, а что актуально конкретно для вас, так то, что он является препаратом первой линии в лечении сепсиса, тяжелых пневмоний и нейтропенических лихорадок, так же он является препаратом выбора в практике оториноларингологов. И если пациенты с подобными состояниями проходят лечение в ваших стационарах, использование амкоксициллин/клавуланата с целью ПАП принесет больше проблем, чем пользы, так как вызовет селекцию резистентных к нему штаммов. Если же подобные состояния у вас не встречаются – смело можете выводить данный препарат из общебольничной практики и использовать его в качестве периоперационной профилактики ИОХВ.
3) Ампициллин/сульбактам – перекрывает все тех же возбудителей, что и амоксициллин/клавуланат, но более дешев, легче выводится из общего оборота стационара.
Вводится по 3 г в/в за 30-40 мин до разреза. Повторная доза, если она потребуется, вводится через 3-4 часа от начала оперативного вмешательства
Отдельно следует упомянуть, что если пациент имеет в анамнезе данные об аллергических реакциях на препараты пенициллинового ряда, препаратом выбора в данной ситуации становится Клиндамицин в дозе 0,6 г.
Более подробно о методах и схемах периоперационной антибиотикопрофилактики вы можете познакомиться в следующих руководствах:
5) Антибактериальная профилактика инфекций в области хирургического вмешательства в колоректальной хирургии.
Читайте также:
- Заболевания артерий с болевым синдромом. Первичные поражения артериальной стенки.
- Диагностика аневризмы сонной артерии верхушки пирамиды височной кости
- Враги беременности. Внутриутробные инфекции
- Лекарства в терапии предменструального синдрома (ПМС). Медикаменты
- Поражение мышцы сердца при отравлении. Токсическая миокардиодистрофия
