Враги беременности. Внутриутробные инфекции
Добавил пользователь Евгений Кузнецов Обновлено: 30.01.2026
В чем трудности диагностики ЦМВ? Каков механизм заражения ЦМВИ? В последние годы отмечена тенденция к увеличению среди беременных частоты вирусных инфекций и возросла их способность, при определенных условиях, к эпидемическому распространению.
В чем трудности диагностики ЦМВ?
Каков механизм заражения ЦМВИ?
В последние годы отмечена тенденция к увеличению среди беременных частоты вирусных инфекций и возросла их способность, при определенных условиях, к эпидемическому распространению.
Особое значение приобретает проблема цитомегаловирусной инфекции (ЦМВИ) при беременности, вследствие того что цитомегаловирус (ЦМВ) может явиться причиной акушерской патологии, эмбрио- и фетопатий, внутриутробной и перинатальной инфекции [1].
Наличие латентных форм ЦМВИ с атипичным течением, инаппарантными проявлениями и поражением тканей органов представляет большие трудности для своевременного распознавания инфекции и является причиной диагностических ошибок.
Среди родившихся живыми 0,2-2,2% детей внутриутробно инфицированы цитомегаловирусом. Внутриутробная ЦМВИ, вне зависимости от формы заболевания, может представлять опасность вследствие поражения ЦНС и привести к возникновению психомоторных нарушений, умственной отсталости детей даже через несколько лет после родов [2].
Беременным принадлежит значительный процент в эпидемиологии ЦМВИ, которая обнаруживается у них в два раза чаще, чем краснуха.
ЦМВИ может способствовать развитию осложнений во время беременности, родов и в послеродовом периоде. Акушерская патология наиболее часто проявляется в виде спонтанных выкидышей, мертворождений, рождения нежизнеспособных детей [3, 4, 11].
Проблема изучения цитомегаловирусной инфекции и ее влияния на течение и исход беременности, разработка основ комплексной профилактики и лечения крайне актуальны и особенно важны для практического здравоохранения.
Цитомегаловирус является крупным ДНК-геном со сравнительно низкой вирулентностью и особой способностью к резкому подавлению клеточного иммунитета.
Воздействия экзо- и эндогенных факторов приводят к снижению иммунитета и, соответственно, к активации хронической цитомегаловирусной инфекции.
Источниками инфекции могут являться носители ЦМВ, их биологические жидкости и выделения: кровь, моча, слезы, слюна, грудное молоко, спинномозговая жидкость, амниотическая жидкость, вагинальное отделяемое, слизь из носоглотки, сперма, фекалии и др.
Особый тропизм ЦМВ проявляет к слюнным железам. Отсюда реальная возможность передачи ЦМВ от матери к ребенку при поцелуях. Имеется прямая корреляционная зависимость между инфицированием цитомегаловирусом и сексуальной активностью партнеров.
С учетом возраста и интимности контактов между людьми выявляются две волны атаки ЦМВИ: первая достигается к трехлетнему возрасту, вторая — к периоду половой зрелости.
В большинстве случаев имеет место бессимптомное вирусоносительство или субклиническая, инаппарантная, хроническая инфекция, которая вне иммунодепрессии не вызывает никаких субъективных нарушений или объективных клинических проявлений. Длительной (нередко пожизненной) латенции способствует внутриклеточное сохранение ЦМВ в лимфоцитах, где он надежно защищен от действия специфических антител и интерферона.
Морфологические изменения проявляются в виде комплексов из цитомегалических клеток (ЦМК) и интерстициальной лимфогистиоцитарной инфильтрации [3].
Происходит специфическая трансформация цитомегалических клеток, приобретающая характерный вид типичных гигантских клеток («совиного глаза») диаметром от 35 до 65 мк с включениями в ядре и светлой перинуклеарной зоной.
Цитомегалические изменения наиболее часто наблюдаются в слюнных железах, легких, почках и головном мозге.
Описаны локальные цитомегалические повреждения глаз (хореоретиниты), кишечника (колиты), кожи (дерматиты), надпочечников, легких, почек, головного мозга [3].
Вопрос о влиянии срока беременности на передачу инфекции от матери к плоду остается открытым. Считается, что наибольшую угрозу для плода представляет развитие цитомегаловирусной инфекции в первой половине беременности.
Реактивация латентной инфекции ведет к передаче вируса от матери к плоду в 0,15%–0,36% случаев [5].
ЦМВИ и иммунодепрессия — наиболее важная особенность патогенеза цитомегалии. Это связано с тем, что для ЦМВ характерна реактивация в условиях иммунодефицита, в частности при так называемой «физиологической иммунодепрессии», которая сопутствует беременности.
Возможно несколько путей передачи инфекции от матери к плоду:
- трансплацентарный;
- через инфицированные выделения в родовом канале;
- кормление инфицированным материнским молоком.
Трансплацентарная передача ЦМВИ наиболее часто приводит к инфицированию плода [7].
Цитомегаловирус от матери может проникать через плаценту в любом сроке беременности и вызывать поражение плода.
Цитомегаловирусная инфекция у беременных может быть первичной или рецидивирующей. Первичное материнское заражение ЦМВ, возникшее во время беременности, лучше всего диагностируется при изучении сероконверсии антител к ЦМВ. Присутствие антител IgG и IgM можно считать свидетельством первичной материнской инфекции. Рецидивирующая ЦМВ-инфекция во время беременности включает в себя как реактивацию собственного штамма ЦМВ, так и возможную реинфекцию новым штаммом вируса [9].
В большинстве случаев, в популяциях с высоким превалированием антител к ЦМВ, развитие ЦМВИ во время беременности скорее происходит в результате реинфицирования.
Врожденная ЦМВИ возникает либо после первичной инфекции, либо в результате обострения хронической. Более тяжелые последствия наблюдаются в период беременности при первичной инфекции.
При беременности в условиях иммунодефицита возникает неспецифическая депрессия иммунной системы. При ЦМВИ больше всего страдает клеточный иммунитет. Именно характер сдвигов в системе клеточного иммунитета во многом определяет течение и исход цитомегалии.
В ответ на внедрение вируса происходит выработка антител. При цитомегалии комплиментсвязывающие антитела сохраняются на протяжении всей жизни, что позволяет установить случаи имевшего в прошлом заболевания. Очевидно, что специфические антитела важны при защите против цитомегаловируса.
Антитела класса IgG свидетельствуют о том, что женщина ранее встречалась с инфекцией. Беременные имеют более интенсивную и длительную реакцию IgG. Высокие показатели титров антител свидетельствуют об активизации хронического процесса.
Отсутствие IgG в пуповинной сыворотке или сыворотке крови новорожденного исключает врожденную ЦМВИ, в то время как их присутствие может означать пассивный перенос от матери к плоду.
Значительно более высокий уровень IgG у новорожденного, чем у матери, может свидетельствовать о врожденной инфекции.
При исследовании в первые шесть месяцев жизни ребенка врожденная ЦМВИ исключается, если уровень IgG будет постепенно снижаться. Наличие IgМ в сыворотке крови характеризует первичную инфекцию. Антитела IgМ сохраняются в крови от 12 до 18 недель от начала первичной инфекции.
Антитела IgM к ЦМВ являются маркером «свежей» первичной инфекции.
Антитела класса IgM через плаценту не переходят, их синтез осуществляется плодом и новорожденным в ответ на антигенное раздражение.
Механизм передачи ЦМВ предполагает тесный контакт между беременной (родильницей) и плодом (новорожденным). После беременности и родов ЦМВ можно найти почти во всех жидкостях тела, особенно в цервико-вагинальных выделениях и в грудном молоке, что может явиться источником пери- и постнатальной передачи ЦМВ от матери к новорожденному.
Передача инфекции может произойти с кровью при гемотрансфузиях и парентеральных манипуляциях, а также через поврежденную кожу и мацерированные слизистые. Установлено, что интранатальная или ранняя постнатальная передача ЦМВИ происходит в 10 раз чаще, чем трансплацентарная.
В послеродовом периоде эпидемиологическая опасность для новорожденного сохраняется в случаях нарушения женщиной гигиенических норм, а также вследствие передачи вируса с грудным молоком (20% серопозитивных матерей имеют ЦМВ в грудном молоке и 30% из них могут выделять вирус в молоко в течение года после родов) [8].
Перинатальные и постнатальные проявления ЦМВИ у детей почти всегда протекают в легкой форме и асимптоматично.
Многообразие вариантов течения ЦМВИ у беременных связано в большинстве случаев с бессимптомной латенцией и полиморфизмом клинических проявлений заболевания.
Варианты течения ЦМВИ и широкий спектр их проявлений обусловлены сложностью взаимоотношений между ЦМВ и клеткой хозяина.
Нередко клинические симптомы проявляются в виде субфебрильной температуры, ринофарингита, кашля, развития мононуклеозоподобного синдрома.
Диапазон клинических вариантов варьирует от слабо выраженного сиалоаденита и благоприятно текущего мононуклеозоподобного заболевания (лимфоцитоз, атипичные мононуклеары) до тяжелых поражений печени, легких и мозга.
У беременных симптоматическая ЦМВИ обычно проявляется в форме синдрома мононуклеоза, что подтверждается наличием лимфоцитоза, присутствием антител ЦМВ IgG и IgM в сыворотке и культуры ЦМВ в крови, моче, слюне, цервикальных выделениях.
Мононуклеозоподобный синдром характеризуется продолжительной лихорадкой, ознобами, быстрой утомляемостью, болями в мышцах, головными болями, встречается чаще у молодых людей [6].
У беременной женщины наиболее часто происходит обострение хронической ЦМВИ, которая, как правило, не имеет явных клинических проявлений. Однако у данной категории женщин в анамнезе нередко имеются указания на привычное невынашивание или неразвивающуюся беременность, мертворождения, рождение нежизнеспособных детей, а также детей-инвалидов с врожденными пороками развития [11].
Инфицирование возможно в любом триместре, тем не менее наиболее тяжелые последствия возникают при первичной инфекции, возникшей у матери в течение первых 20 недель беременности. Вместе с тем даже при развитии первичной ЦМВИ во время беременности 90-95% женщин имеют шанс родить здорового ребенка [12].
Внутриутробная цитомегаловирусная инфекция может приводить к рождению детей с тяжелыми неврологическими расстройствами, поражениями зрительного и слухового нервов.
Степень поражения плода зависит от срока инфицирования. Заражение на ранних сроках беременности чаще ведет к гибели плода и самопроизвольным выкидышам.
Дети с ЦМВИ (положительным IgM) от серопозитивных матерей имеют более низкий вес и рост при рождении, чем дети серонегативных матерей.
ЦМВ может инфицировать плаценту, плод, амниотическую жидкость. Вирусная культура и характерные цитомегалические клетки могут быть выявлены у плодов от женщин с активной первичной ЦМВИ. Однако наличие признаков или симптомов ЦМВ у плода не всегда является предвестником серьезного заболевания при рождении и в постнатальном периоде.
При выявлении симптомов болезни в течение первых трех недель жизни ребенка ЦМВИ может рассматриваться как врожденная, возникновение заболевания в более поздние сроки чаще характеризует приобретенную форму ЦМВИ (постнатальное инфицирование).
Врожденная ЦМВИ характеризуется, как правило, генерализованным поражением органов плода и целым комплексом клинических симптомов.
Для приобретенной формы ЦМВИ характерно латентное течение, преимущественно с локальным поражением слюнных желез.
У новорожденных, инфицированных внутриутробно, в 90% случаев не бывает симптомов при рождении, у 5-17% их них развиваются осложнения в более позднем периоде [6].
Развитие симптоматики у новорожденного с ЦМВИ коррелируется с симптомами, присутствующими при рождении.
Остальные дети с врожденной ЦМВИ совершенно асимптоматичны и выглядят при рождении здоровыми.
Клинические формы ЦМВИ могут иметь острое или хроническое течение.
По степени тяжести заболевания ЦМВИ выявляют:
- легкую (в том числе стертые и субклинические формы инфекции), при которой поражения внутренних органов незначительны и не сопровождаются функциональными нарушениями (компенсация);
- среднетяжелую, при которой имеется поражение внутренних органов, сопровождаемое функциональными нарушениями различной степени (субкомпенсация);
- тяжелую, при которой резко выражена интоксикация и поражение внутренних органов сопровождается тяжелыми функциональными нарушениями (декомпенсация);
При тяжелом течении врожденной ЦМВИ смерть ребенка чаще наступает в первые дни и недели жизни; при легком — болезнь принимает волнообразное течение.
Следует отметить, что дети с врожденной или перинатальной активной цитомегалией чрезвычайно предрасположены к развитию бактериальных суперинфекций, что обусловлено в первую очередь иммунной недостаточностью.
Симптомы врожденной ЦМВИ включают признаки замедления внутриутробного развития, внутриутробную гипотрофию, конъюгационную желтуху, гепатоспленомегалию, интерстициальную пневмонию, нарушения мозгового кровообращения. Осложнения со стороны ЦНС также очень часты и проявляются у новорожденных повышенной сонливостью, плохим сосательным рефлексом, макро- и микроцефалией, гидроцефалией, порэнцефалией, хориоретинитом, сенсоневральной глухотой [4, 11].
Врожденная ЦМВИ может также иметь необычные проявления, такие как вентрикуломегалия, перивентрикулит или образование кист, гемолитическая анемия, петехии, геморрагическая пурпура, тромбоцитопения, хронический гепатит и асцит [3, 8].
Однако, несмотря на очень большое количество симптомов и осложнений, ассоциируемых с врожденной ЦМВИ, трудно предсказать физическое и интеллектуальное развитие ребенка, основываясь на симптомах, присутствующих при рождении.
Каждое из перечисленных клинических проявлений ЦМВИ заслуживает отдельного рассмотрения.
Гепатомегалия вместе со спленомегалией и петехиями является самым убедительным подтверждением болезни у детей с врожденной ЦМВИ. Обычно присутствуют явления гепатита с нарушениями функции печени (желтуха, гипербилирубинемия).
Функция печени, как правило, нормализуются в первые недели жизни.
Спленомегалия нередко может явиться единственным показателем врожденной ЦМВИ при рождении.
Петехии обычно носят преходящий характер и наблюдаются в течение двух-трех суток после рождения. При врожденной ЦМВИ чаще встречается комбинация петехий с гепатоспленомегалией и тромбоцитопенией.
При исследовании крови выявляется картина гипохромной анемии, эритробластоз, тромбоцитопения.
Врожденная ЦМВИ приводит к ухудшению зрения у 20% детей. Чаще всего наблюдается хориоретинит (односторонний или двусторонний), который может привести к слепоте. Однако врожденная ЦМВИ обычно не вызывает микроофтальмию или катаркту.
Микроцефалия может быть частично причиной замедленного развития новорожденного и сочетаться с внутричерепными кальцификатами, которые локализуются в перивентрикулярной структуре и ликворе.
Компьютерная томография является наиболее чувствительным методом для их определения. Ультразвук и рентгенография черепа относятся к менее чувствительным методам.
Многие дети с микроцефалией и внутричерепными кальцификатами имеют неврологические проявления.
У 10% детей с асимптоматичными проявлениями инфекции могут наблюдаться осложнения, даже в возрасте пяти–семи лет, чаще в виде сенсорной потери слуха, неврологических расстройств или умственного отставания. Половина детей с врожденной ЦМВИ имеют сочетанную потерю слуха. Глухота носит двухсторонний сенсоневральный характер. Нередко также диагностируются врожденные сердечно-сосудистые, гастроинтестинальные, мышечно-скелетные аномалии развития органов [7].
Таким образом, для беременных с цитомегаловирусной инфекцией должен быть предусмотрен комплекс диагностических, профилактических и лечебных мероприятий, направленных на уменьшение случаев возникновения врожденной цитомегаловирусной инфекции, что должно быть обязательным условием создания эффективной системы профилактики и охраны здоровья матери и ребенка.
Враги беременности. Внутриутробные инфекции
Вокруг нас всегда кишат микробы. И ежедневно они вторгаются в наш организм. Но иммунитет человека устроен так, что он контролирует жизнедеятельность этих микробов. Но это правило не распространяется на женщин, ждущих появления на свет малыша. Даже если беременная женщина чувствует себя абсолютно здоровой, она обязана сдавать анализы на множество инфекций. И если вдруг какие-то возбудители болезни обнаружены, надо срочно бить тревогу.
Внутриутробные инфекционные заболевания представляют большую опасность. Они являются одной из важных причин высокого уровня заболеваний и смертности у младенцев и у беременных женщин.
Внутриутробные инфекции плода и новорожденного формируются под влиянием нескольких неблагоприятных факторов. Одним из таких факторов является наличие инфекции в организме беременной женщины, которая распространяется на околоплодные воды, плаценту, плод. Инфекция в организме женщины приводит к изменениям иммунной системы новорожденного.
Специалисты выделяют несколько возбудителей внутриутробных инфекций. Самые распространенные - краснуха, вирус гепатита B, герпес, сифилис, грибки, хламидиоз и другие.
Сейчас, в медицинской практике на этапе планирования и наблюдения беременности у женщин диагностируется около восьми видов возбудителей инфекций.

Очень важная заметка. В 1971 году среди всех возбудителей инфекций были выявлены отдельно вирусные, бактериальные и другие инфекции. Все они отличаются друг о друга. Но, к какой группе бы они не относились, они способны вызывать у плода похожие друг на друга клинические проявления, которые выражаются в виде дефектов многих органов (чаще всего центральной нервной системы).
Для обозначения таких инфекций принята аббревиатура TORCH - комплекс внутриутробных инфекций. Согласно этой аббревиатуре: T - тoксоплазмоз, О - сифилис, туреркулез, листериоз, гонорея, а также корь и ветряная оспа, R - кpаснуха, С - циамегаловирус, Н - герпес, вирус гепатита В, иммунодефицита.
Почему и откуда возникают эти инфекции? Условно факторы риска можно разделить на три группы. Первая - наличие очага инфекции в самом организме. Это и заболевания легких (в том числе курение), хронические заболевания органов пищеварения, урогенитальные инфекции, хронический тонзиллит. Даже обыкновенный кариес может стать очагом инфекции.
Вторая группа факторов - осложнения, возникающие во время беременности (анемия, ОРВИ, невынашивание во второй половине беременности).

Третья группа факторов риска - это осложнения во время родов. К ним следует отнести многократные исследования влагалища, акушерские операции, несвоевременное излитие вод.
Следствием вирусных инфекций является задержка внутриутробного развития, а бактериальных инфекций - гипотрофия и гипоксия плода.
Инфекции от матери к ребенку могут передаваться несколькими способами. Первый - трансплацентарный (через плаценту к плоду). Далее - восходящий (через оболочку плодного яйца) и нисходящий (через маточные трубы), а также трансмуральный - через ткань матки.
До планирования беременности женщина обязательно должна пройти полное обследование на наличие инфекций. Если у женщины выделены антитела, то она попадает в группу риска. В таком случае рекомендуется вакцинация от краснухи примерно за 3-6 месяцев до наступления беременности. При наступлении беременности женщина постоянно должна наблюдаться у гинеколога и инфекциониста на предмет динамики инфекций.
Внутриутробное инфицирование имеет страшные последствия. Например, у женщины, перенесшей во время беременности краснуху, ребенок может родиться глухим, либо с диагнозами гидроцефалия, микроцефалия, с врожденными пороками сердца, диабет.
При обнаружении серьезных нарушений у беременной, необходима также консультация врача-генетика, полная узи-диагностика. в некоторых случаях может быть поставлен вопрос о продолжении беременности.
- Вернуться в оглавление раздела "Акушерство."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Врожденные инфекции у плода и новорожденного ребенка: виды, возбудители, клиника, диагностика
Передача врождённых и перинатальных инфекций плоду происходит через плаценту (внутриутробные инфекции), во время родов или при контакте с физиологическими жидкостями матери. Длительное разрушение плодных оболочек также способствует развитию внутриутробных заболеваний. Кроме того, заражение может произойти и после рождения (при контакте с матерью и другими людьми).
Врожденная краснуха
Первый признак врождённой краснухи — желтуха, как следствие развития гепатита. Часто возникает гемолиз и тромбоцитопеническая пурпура, а также слабовыраженные клинические проявления менингоэнцефалита. У некоторых новорождённых обнаруживают признаки метафизарной дисплазии. Инфицированные дети при рождении обычно имеют сниженную массу тела и отстают в физическом развитии.
В тяжёлых случаях болезнь обычно заканчивается летальным исходом. Наиболее грозные осложнения — незаращение артериального протока, катаракта, глухота, ретинопатия.
Тест на антитела к краснухе (IgM), которые можно обнаружить в крови детей до 3-го мес жизни, даёт положительный результат. При заболевании матери в I триместре вероятность развития патологии у ребёнка составляет 60%, поэтому некоторые женщины предпочитают прерывать беременность. В дальнейшем риск заметно снижается (2% после 20-й нед), в связи с чем выбор между рождением ребенка с вероятными нарушениями в развитии и прерыванием беременности необходимо делать крайне осторожно.
Цитомегаловирус у плода и новорожденного
Инфекция проявляется примерно в 1% случаев, при этом тяжёлая форма заболевания развивается только у 1% инфицированных. Наиболее высокий риск заражения плода отмечают на сроке гестации, соответствующем I триместру беременности. Симптомы заболевания у новорождённых — сниженная масса тела, гепатомегалия, спленомегалия, тромбоцитопения, продолжительная желтуха, повышенная возбудимость, судорожный синдром, аномальный мышечный тонус и двигательные расстройства.
Наиболее частые осложнения — микроцефалия, нейросенсорная глухота. Нередко обнаруживают кальцификацию головного мозга, гемиплегию (паралич мышц одной стороны тела), замедление психомоторных реакций, хориоретинит и миопатию. Диагностика основана на обнаружении антител к цитомегаловирусу (IgM) или определении экскреции вируса в течение первых двадцати дней жизни.
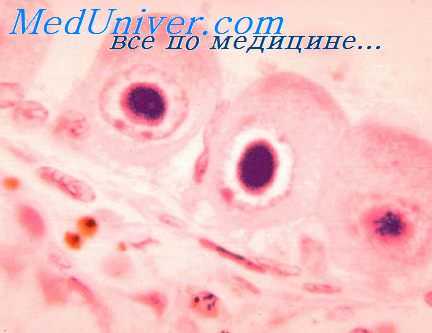
Возбудитель ЦМВ инфекции
Врожденная инфекция вируса простого герпеса
Первичная инфекция, вызванная вирусом простого герпеса, сопровождается виремией. При этом может произойти трансплацентарное заражение плода. При врождённом инфицировании дети рождаются с тяжёлыми отклонениями (пневмония, менингоэнцефалит, гепатоспленомегалия, цитопения), но лишь у некоторых из них присутствуют герпетические очаги на коже и слизистых оболочках. Лечение ацикловиром позволяет снизить смертность с 80—90% до 10—15%.
Терапию следует начинать до получения результатов лабораторного анализа. Первичная инфекция также возникает при заражении от матери, страдающей генитальным герпесом. При этом в первые дни жизни ребёнка возникают очаги на коже, конъюнктиве, слизистой оболочке рта и половых органов, а в 50% случаев наблюдают генерализованное течение инфекции. Лечение: внутривенное введение ацикловира.
Ветряная оспа плода
Инфицирование плода ветряной оспой возникает при заражении беременной в I—II триместре беременности, при этом вероятность передачи инфекции плоду составляет 3%. Заболевание характеризуется развитием рубцовой контрактуры в области лимбических структур головного мозга, микроцефалии или офтальмомикрии. Непривитые беременные в течение десяти дней после возможного заражения (контакта) должны пройти профилактический курс введения иммуноглобулина (содержащим антитела к вирусу ветряной оспы).
Ветряная оспа новорождённых возникает при заболевании матери в течение одной недели до родов. Смертность составляет 40%, поэтому в первые 48 ч жизни ребёнку необходимо ввести специфический иммуноглобулин. При ухудшении состояния следует незамедлительно начать лечение ацикловиром. Применение нормального иммуноглобулина человека не защищает новорождённого от заражения. В некоторых странах применяется вакцина.
Врожденный листериоз
Трансплацентарная передача Listeria monocytogenes происходит при заражении матери инфекцией, протекающей бессимптомно. Заболевание матери на ранних стадиях беременности обычно приводит к смерти плода, а на более поздних — к преждевременным родам. Инфекцию новорождённых обычно осложняет бактериемия, гепатоспленомегалия, менингоэнцефалит, тромбоцитопения и пневмония. При интранатальном заражении инфекция развивается в течение первых двух недель жизни ребенка и сопровождается менингитом и бактериемией.
Для выделения возбудителя на анализ отбирают кровь, спинномозговую жидкость, плацентарную ткань и послеродовую жидкость из матки. Инфицированную мать и ребёнка помещают в отдельную палату, так как они могут стать причиной вспышки заболевания в родильном отделении. Препарат выбора — ампициллин (иногда в комплексе с гентамицином); длительность лечения 2—6 нед.
Врожденный сифилис
Благодаря эффективным пренатальным исследованиям случаи врождённого сифилиса в настоящее время достаточно редки. У заражённых детей обнаруживают лихорадку, а также симптомы, свойственные вторичному сифилису, сыпь, кондиломы и трещины на слизистых оболочках. При развитии остеохондритов возникает выраженный болевой синдром. Очень часто отмечают постоянный насморк (сопение, гнусавость).
Для подтверждения диагноза применяют темнопольную микроскопию образцов поражённой кожи и слизистых оболочек. Специфические IgM или другие антитела персистируют в организме свыше 6 мес после перенесённой инфекции. Поздние симптомы (глухота, атрофия зрительного нерва, паретический нейросифилис) наблюдают в возрасте 12—20 лет. Нередко возникают бугристые образования на лобных костях, хронический большеберцовый периостит, перфорация передних зубов, деформация первых постоянных коренных зубов и высокий изгиб нёба. Препарат выбора — пенициллин.
Врожденный токсоплазмоз
Вероятность врождённого токсоплазмоза варьирует в разных регионах. Например, в Великобритании его регистрируют достаточно редко, а во Франции — часто. При заражении беременной трансплацентарную передачу инфекции плоду наблюдают в каждом третьем случае. Наиболее высок риск развития патологии плода (мертворождение, смерть после рождения, кальцификация головного мозга, церебральный паралич и эпилепсия) при заражении женщины в I и II триместре беременности.
Хориоретинит может возникать только спустя некоторое время после рождения и быть единственным симптомом болезни. Токсоплазмоз у матери подтверждают при обнаружении специфических антител (IgM) или сероконверсии. IgM также обнаруживают у инфицированных новорождённых. Применение спирамицина позволяет снизить риск трансплацентарного заражения, но не влияет на исход заболевания у новорождённых.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Внутриутробные инфекции ( TORCH-инфекции )
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.
Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.
Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Антенатальная гибель плода - симптомы и лечение
Что такое антенатальная гибель плода? Причины возникновения, диагностику и методы лечения разберем в статье доктора Кондратенко Юлии Николаевны, гинеколога со стажем в 17 лет.
Над статьей доктора Кондратенко Юлии Николаевны работали литературный редактор Маргарита Тихонова , научный редактор Светлана Симанина и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Антенатальная гибель плода — это внутриутробная смерть плода, наступившая до начала родов, но после 21 недели беременности. Является причиной 39-42 % мертворождений. У таких детей отсутствует сердцебиение, дыхание, движения и пульсация сосудов пуповины [12] .
Согласно первым комплексным оценкам, каждый год на свет появляется более 7200 мертворождённых детей. Даже в высокоразвитых странах Европы и Северной Америки показатель мертворождения не опускается ниже 1,3 % [9] . Уровень мертворождения в России в 2018 году был равен 5,51 %. При этом доля антенатальной гибели плода составила 91,8 %. Однако за последние пять лет показатель перинатальной смертности (гибели ребёнка до и после родов) стал снижаться [13] .
Чаще внутриутробная гибель плода наблюдается у девочек-подростков в силу незрелости организма, а также у беременных 35 лет и старше. К этому возрасту у женщины , как правило, возникает ряд хронических заболеваний, снижается овариальный резерв — запас фолликулов в яичниках. Всё это является риском неразвивающейся беременности по причине хромосомной патологии плода.
Также риск антенатальной потери выше у женщин с более чем двумя родами в анамнезе, привычным невынашиванием беременности , искусственными абортами, многоплодными беременностями, наличием послеоперационного рубца на матке и при экстракорпоральном оплодотворении (ЭКО) [23] .
Существует множество причин внутриутробной гибели плода. Они могут быть как со стороны самого плода, так и стороны матери [8] .
Непосредственной причиной смерти является дистресс-синдром плода . Он подразумевает под собой все нарушения функционального состояния плода, в первую очередь, его движений и сердцебиения.
Опосредованные причины антенатальной гибели плода :
- Врождённые аномалии развития плода — синдром Дауна, синдром Патау, синдром Эдвардса и др. . Чаще всего это происходит при:
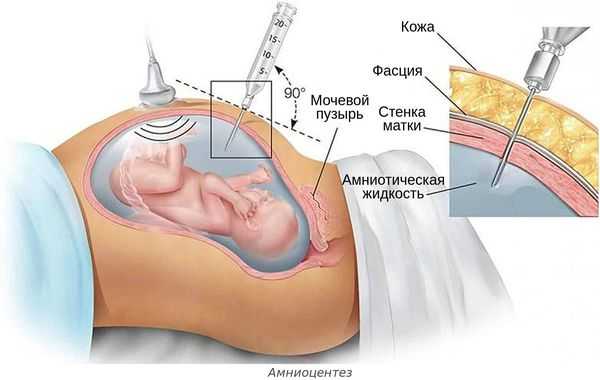
- инвазивной диагностике и лечении беременной — амниоцентезе (во время удаления излишков околоплодных вод, введения лекарств или пункции амниотической оболочки), пунктировании сосудов пуповины и др.;
- нарушении стерильности во время введения препаратов крови внутрь матки через сосуды пуповины (например, при переливании эритроцитарной массы плоду с гемолитической болезнью);
- преждевременном разрыве околоплодных оболочек в случае пролонгированной беременности;
- общих инфекциях беременной — TORCH-инфекциях, сифилисе , туберкулёзе, урогенитальном хламидиозе и ВИЧ-инфекции[13] .
- Экстрагенитальные заболевания матери — сахарный диабет, нарушения работы щитовидной железы, почек и надпочечников, травмы, злоупотребление алкоголем и курение , особенно при наличии воспалений урогенитального тракта.
- Особенности течения беременности :
- различные формы позднего токсикоза;
- угроза прерывания беременности;
- истмико-цервикальная и фетоплацентарная недостаточность ;
- инфекционные заболевания;
- нарушение кровотока в матке и плаценте;
- тазовое предлежании плода.
- Неустановленные причины .
Инфекция может быть вирусной (цитомегаловирусы, вирусы простого герпеса, краснухи, Коксаки, ВИЧ), бактериальной (хламидии, микоплазмы, уреаплазмы, стрептококки группы В, энтеробактерии, кишечная палочка) и грибковой (кандидоз).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы антенатальной гибели плода
Процесс внутриутробной гибели плода далеко не всегда может сопровождаться изменениями в самочувствии женщины. Иногда беременная отмечает более частые шевеления плода, но позже происходит их полное прекращение. Это говорит об острой гипоксии плода — снижении содержания кислорода в организме [2] . Однако часто гибель малыша наступает незаметно для матери и врача, что приводит к поздней диагностике антенатальной смерти плода [4] .
В течение первых трёх дней гибели малыша пациентка может обратить внимание на изменения своего состояния:
- прекращаются шевеления плода;
- уменьшается размер молочных желёз, снижается их напряжение;
- живот перестаёт увеличиваться в объёме;
- возникает слабость, недомогание, тяжесть внизу живота.
Если с момента гибели плода в утробе матери прошло несколько недель, могут присоединяться признаки воспалительной реакции:
- повышение температуры до 38 ℃;
- сильные тянущие боли внизу живота;
- головная боль и головокружение;
- сонливость;
- нарушение сознания [16] .
Патогенез антенатальной гибели плода
Несмотря на то, что внутриутробная гибель плода является общемировой проблемой, вопросы её патогенеза остаются нерешёнными [5] [14] [21] [25] . В связи с этим проводится множество исследований, в частности исследования плаценты — предполагается, что её изменения являются основной или одной из главных причин смерти плода. Установить фактическую причину при аутопсии (вскрытии) мертворождённого довольно трудно [3] [6] [15] [22] [24] .
Суть патогенеза заключается в нарушении функции плаценты, развитии хронической плацентарной недостаточности, нарушении кровоснабжения плода, его росте и развитии. Поражаются внутренние органы плода — развивается внутриутробная пневмония, менингит и др. В какой-то момент происходит нарушение нормального функционирования плаценты, развивается острая плацентарная недостаточность и плод погибает.
Профессором И. В. Бариновой в 2015 году были представлены два типа плодовых потерь при внутриутробной гипоксии. Каждому из них характерно своеобразное сочетание патогенетических факторов, связанных с матерью, плацентой и плодом.
Патогенез первого типа отличается комплексом таких признаков, как ранняя тяжёлая преэклампсия и васкулопатия, т. е. патологическое изменение сосудов базальной пластинки плаценты (неполноценная перестройка спиральных артерий, необходимая для улучшения кровоснабжения плода, острый атероз, тромбоз и кровотечения). Всё это нарушает циркуляцию материнской крови в плаценте [1] .
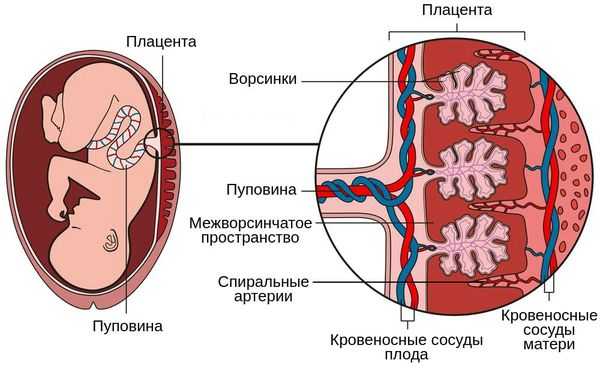
Патогенез второго типа обусловлен нарушением циркуляции в плодовой части плаценты, незрелостью ворсин относительно срока беременности, а также васкулопатией сосудов плода и тромбозом ворсин.
Эти основные звенья патогенеза антенатальной гибели позволяют своевременно профилактировать и назначать патогенетическую терапию фетоплацентарной недостаточности [1] .
Классификация и стадии развития антенатальной гибели плода
Пока не существует общепринятой классификации внутриутробной гибели плода. Однако изучение причин перинатальной смертности привело к появлению двух понятий:
- "Необъяснимое" мертворождение — внезапная гибель малыша наступает по неизвестным причинам. Установить их можно только после анатомического вскрытия плода и исследования плаценты. Зачастую выявляются аномалии опорно-двигательной и нервной системы, несовместимые с жизнью, а также поражения сердечно-сосудистой системы, в частности фатальная аритмия — нарушение сердечного ритма.
- Мертворождение, связанное с задержкой роста плода — гибель плода обусловлена нарушениями обмена веществ, поступления кислорода и кровоснабжения плода из-за материнских факторов, а также факторов, связанных с плодом и плацентой [8] .
Полноценное гистологическое исследование внутриутробно погибшего плода необходимо для установления причины его смерти. Некоторые матери отказываются от него, но это неправильно. Дело в том, что у многих женщин с гибелью плода в анамнезе повышается риск повторных потерь при следующих беременностях [26] . Поэтому исследование причин мертворождения позволит предотвратить повторение этой трагедии в будущем.
Осложнения антенатальной гибели плода
При своевременном обращении к доктору антенатальная гибель плода не приводит к осложнениям. Если же пациентка обратилась за медицинской помощью спустя больше двух недель после смерти ребёнка, то у неё с большой вероятностью могут развиваться такие осложнения, как:
- Кровотечение во время и после родов.
- Гнойно-септические осложнения:
- хориоамнионит — воспаление стенок плодного пузыря и заражение инфекцией околоплодных вод;
- послеродовой метроэндометрит — воспаление мышечной и слизистой оболочки стенки матки;
- инфекции послеоперационной раны — может возникнуть, если роды проходили путём кесарева сечения, например, при раннем отделении плаценты;
- послеродовой сепсис — заражение крови.
Чтобы избежать их, необходимо тщательно наблюдать за состоянием пациентки и выполнять профилактические мероприятия:
- плановое проведение родов при высоком риске кровотечения;
- профилактика анемии ;
- гемостатическая терапия;
- пережатие пуповины ребёнка не раньше первой минуты после рождения;
- строгое соблюдение стерильности при выполнении кесарева сечения и вагинальных исследований во время родов;
- использование индивидуальных комплектов при родоразрешении;
- отказ от катетеризации мочевого пузыря и эпизиотомии (рассечения задней стенки влагалища) без явной необходимости;
- профилактический приём антибиотиков после выполнения инвазивной диагностики или при длительном безводном периоде;
- ранняя выписка из родильного дома (на третьи сутки после родов) [16] .
Антенатальная гибель плода является серьёзным состоянием при многоплодной беременности . В случае дихориальной беременности (когда малыши развиваются независимо друг от друга: каждый имеет свои жизненно важные структуры — плодный мешок и плаценту) гибель близнеца не влияет на другого ребёнка. При монохориальной беременности (когда у малышей одна плацента на двоих) риски повреждения второго плода существенно выше:
- в 12 % случаев происходит гибель второго ребёнка;
- в 18 % случаев у него диагностируются неврологические нарушения.
В связи с этим рекомендован контроль показателей эхокардиографии (УЗИ сердца), оценка мозгового кровотока (УЗИ головного мозга) и МРТ выжившего плода [18] .
Помимо прочих осложнений у женщины может возникнуть депрессия , тревожное и посттравматическое расстройство на почве пережитой трагедии или чувства вины. У неё может развиться страх перед будущей беременностью, желание избежать её [26] . В этих случаях пациентке требуется психотерапевтическая помощь.
Диагностика антенатальной гибели плода
После того как женщина обращается к врачу с жалобами на недомогание и отсутствие шевеления плода, врач направляет пациентку на диагностическое обследование. Оно позволяет поставить точный диагноз.
Постановка диагноза внутриутробной гибели плода включает следующие этапы обследования:
- Выслушивание сердечных сокращений плода специальным стетоскопом. Обычным медицинским стетоскопом в данном случае услышать сердцебиение невозможно. Для этого существует деревянный акушерский стетоскоп. Он отличается широкой воронкой, которая плотно прикладывается к животу беременной.
- Выслушивание сердечных сокращений фетальным аудиодопплером и/или монитором . Фетальный допплер можно использовать даже в домашних условиях, начиная с 12-ой недели беременности. Для этого женщине нужно лечь на спину и для чёткого сигнала нанести гель на те участки живота, которые будут соприкасаться с датчиком. Сам допплер нужно передвигать медленно, без резких движений. Длительность исследования — 3-7 минут.
- Ультразвуковое исследование плода (УЗИ). Этот метод является одним из самых достоверных для диагностики внутриутробной гибели плода. С его помощью доктор констатирует отсутствие сердцебиения у малыша [16] .

Анализы для диагностики внутриутробной гибели плода на позднем сроке беременности не так важны. Отсутствия шевелений плода в течение нескольких дней и сердцебиения по данным УЗИ достаточно для правильной постановки диагноза.
Лечение антенатальной гибели плода
При подтверждённом диагнозе антенатальной гибели плода показана экстренная госпитализация и принятие решения о методе и сроке родоразрешения. Чем меньше интервал между установленным диагнозом и родоразрешением, тем меньше риск возникновения осложнений во время и после родов.
Выбор метода определяется индивидуально, на основании клинических данных и особенностей акушерской ситуации. Оптимальным вариантом родоразрешения при антенатальной гибели плода являются роды через родовые пути. Но иногда выполняется кесарево сечение, например при раннем отделении плаценты от стенок матки, обильном или продолжающемся кровотечении из половых путей.
При родоразрешении беременных с антенатальной гибелью плода, осложнившейся септическим состоянием, показано экстренное оперативное вмешательство. Объём операции решается индивидуально, возможна удаление матки с плодом (экстирпация).
После родов важно тщательно наблюдать за состоянием роженицы, провести профилактику послеродового кровотечения и гнойно-септических осложнений. Необходимо обратить внимание на выделения из половых путей (гнойные или кровянистые ), температуру тела, появление озноба, слабости, тянущих болей внизу живота.
Во всех случаях внутриутробной гибели плода показано патологоанатомическое исследование плода и последа (его оболочки). Отказ от исследования по желанию родственников оформляется в соответствии с нормами действующего законодательства [19] .
Самым тяжёлым остаётся вопрос о том, когда же произошла гибель плода. Раньше считалось, что в основе определения времени гибели лежит оценка выраженности процессов мацерации — размягчения и разрыхления тканей плода [20] . Однако наличие признаков мацерации не всегда позволяет достоверно судить о давности наступления гибели, т. к. время её развития зависит от причин гибели малыша.
Прогноз. Профилактика
Потеря беременности является показанием к проведению медицинской, психологической и социальной реабилитации пациенток. Необходим полный комплекс диагностических исследований для выяснения причины гибели плода. Выбор алгоритма обследования базируется на данных анамнеза, особенностях течения беременности и результатах патологоанатомического исследования плода и последа.
Женщины с внутриутробной гибелью плода в анамнезе входят в группу риска данного осложнения при последующих беременностях. Поэтому наступление беременности у таких пациенток требует выполнения комплекса мероприятий по подготовке организма женщины к полноценному зачатию, вынашиванию и рождению здорового ребёнка [10] . Оптимальный интервал между беременностями должен составлять не менее 6 месяцев, чтобы минимизировать потенциальные сложности течения последующей беременности [26] .
При неустановленной причине гибели плода в анамнезе необходимо учитывать данный факт при выработке тактики родоразрешения последующих беременностей.
Профилактика антенатальной гибели плода предполагает:
- ведение здорового образа жизни;
- диагностику и адекватное лечение соматических и хронических инфекционных заболеваний;
- своевременное выявление генетической патологии;
- лечение высокого артериального давления;
- контроль уровня глюкозы в крови при сахарном диабете [26] ;
- предупреждение травм живота;
- прекращение контакта с бытовыми токсичными веществами;
- ликвидацию профессиональных вредностей (переход на другую работу);
- адекватное назначение лекарств в период беременности;
- приём фолиевой кислоты до зачатия;
- комплексное антенатальное наблюдение за состоянием плода [7] ;
- регистрацию шевелений плода на 28 неделе беременности;
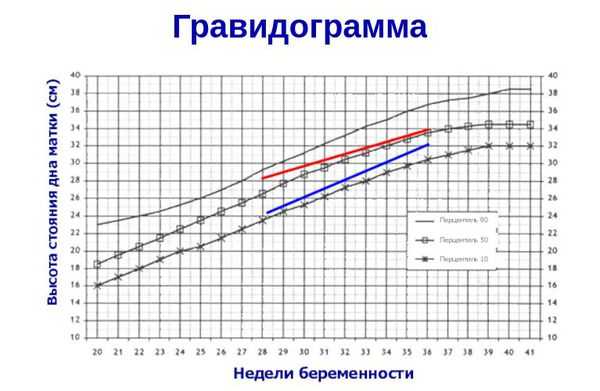
- ведение гравидограммы с 24 недели беременности (сводной таблицы данных, регистрирующей динамику течения беременности) — повышает качество диагностики задержки развития плода и снижает риск потери малыша в 1,8 раз [11] .
Курение увеличивает риск перинатальной смертности на 27 % [17] . Однако чаще антенатальная гибель плода наблюдается у беременных, употребляющих алкоголь — в 6,25 % случаев [8] . Поэтому отказ от вредных привычек значительно увеличивает шансы родить здорового ребёнка.
Читайте также:
