Специфические поражения ротоглотки. Сифилис и туберкулез ротоглотки
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Цитомегаловирус (ЦМВ) или вирус герпеса 5 типа, – ДНК-содержащий вирус Cytomegalovirus hominis семейства Herpesviridae подсемейства Betaherpesvirinae. Цитомегаловирусная инфекция (ЦМВИ) человека – хроническая антропонозная болезнь вирусной этиологии, характеризующаяся многообразием форм патологического процесса и клинических проявлений – от латентной инфекции до клинически выраженного генерализованного заболевания. Заболевание ЦМВИ классифицируют в зависимости от сроков и механизмов заражения (врожденная и приобретенная инфекция, пренатальная, интранатальная и постнатальная), степени активности вируса (латентная, персистирующая и реактивированная инфекция), первичного или повторного заражения (острая инфекция, реактивация вируса и реинфекция).
Отличительными особенностями инфекции являются возможность ЦМВ персистировать во многих органах и способность его к инфицированию практически всех клеток организма человека, что предопределяет многообразие клинических проявлений, как при врожденной, так и приобретенной формах инфекции. ЦМВ рассматривается в качестве основного возбудителя внутриутробной инфекции, имеющей самые различные исходы: от инфицирования без реализации инфекции, формирования пороков развития и заболевания новорожденных до гибели плода и мертворождения.
ЦМВИ – типичный антропоноз. Источником инфекции является больной человек либо вирусоноситель. Пути передачи: вертикальный, половой, воздушнокапельный, фекально-оральный, артифициальный (парентеральный). Факторами передачи являются кровь, цервикальный и вагинальный секреты, сперма, женское молоко. Вирус выделяется с мочой, фекалиями, слюной, мокротой, в меньшей степени – со слезной жидкостью. Заражение может происходить также при переливании крови, трансплантации органов и тканей. Цитомегалия — широко распространенная инфекция, среди взрослого населения РФ у 73–98% обнаружены АТ-ЦМВ.
ЦМВИ относится к оппортунистическим инфекциям, особую опасность представляет для больных с иммунодефицитами различной природы. Иммуносупрессия приводит к реактивации латентной инфекции и развитию манифестных вариантов болезни с поражением различных органов и систем, способных привести к летальному исходу. Манифестная ЦМВИ занимает одно из первых мест в структуре оппортунистических заболеваний у ВИЧ-инфицированных пациентов. Данная патология встречается у 20–40% больных СПИДом, не получающих антиретровирусной терапии. Клинически выраженная ЦМВИ — одно из серьезных инфекционных осложнений при трансплантации органов, инфекция обостряет процессы, приводящие к реакции отторжения трансплантата.
При персистенции ЦМВ в организме человека выделяют две стадии, которые сменяют друг друга – продуктивную (с репликацией вируса) и латентную. Выход вируса из латентной стадии означает реактивацию, что может быть предопределено снижением иммунорезистентности либо появлением иных факторов, способствующих его репродукции. Выявление прямых маркеров репликации вируса (виремия, ДНК или АГ) свидетельствует о наличии инфекции.
При первичном заражении на 5–7 день вырабатываются АТ IgM, через 10–14 дней – низкоавидные АТ IgG, затем постепенно авидность этих АТ увеличивается, они становятся высокоавидными. АТ IgM исчезают через один месяц, низкоавидные АТ IgG – через 1–3 месяца, высокоавидные АТ IgG циркулируют в крови носителя пожизненно. При первичном инфицировании в стадии “серологического окна”, до начала синтеза АТ, происходит активная репликация вируса, в этот период единственным маркером инфекции является ДНК вируса в крови. При реактивации возможно появление АТ IgM и/или IgA, а также низкоавидных АТ IgG; в пик реактивации выявляются ДНК либо АГ ЦМВ в плазме крови.
ЦМВ обладает преимущественно нейротропным, эпителиотропным, гепатотропным и кардиотропным действием на плод. Его воздействие может быть и опосредованным, приводящим к различным нарушениям в плаценте: расстройству маточно- плацентарного кровообращения, отклонению в эволюционном формировании плаценты. Клиническим эквивалентом этих расстройств могут быть сокращение продолжительности беременности и преждевременное родоразрешение, рождение детей с симптомами перенесенной гипоксии или признаками внутриутробной гипотрофии, общая задержка внутриутробного развития.
Наибольшее значение для развития ранних перинатальных поражений плода имеет гематогенный путь инфицирования. Кроме того, для интранатальных и более поздних поражений характерными являются вертикальный и контактный пути передачи ЦМВ, нередки также случаи смешанного инфицирования. Острая ЦМВИ может протекать в виде генерализованной формы с присоединением вторичных инфекций и иметь летальный исход уже в первые недели жизни ребенка. При инфицировании плода во время реактивации латентной ЦМВИ чаще имеют место поздние проявления инфекции в виде нарушений зрения, слуха, задержки психического развития, двигательных нарушений. При отсутствии выраженных иммунологических нарушений острая ЦМВИ переходит в латентную с пожизненным присутствием вируса в организме человека. Развитие иммуносупрессии, в частности связанной с ВИЧ-инфекцией, ведет к возобновлению репликации ЦМВ, появлению вируса в крови и манифестации заболевания. Летальность больных ВИЧ-инфекцией, страдающих ЦМВИ, составляет 25–27%.
Клинический диагноз ЦМВ-инфекции требует обязательного лабораторного подтверждения. Выявление в крови пациента АТ-ЦМВ IgМ и/или IgG недостаточно ни для установления факта активной репликации ЦМВ, ни для подтверждения манифестной формы заболевания.
Показания к обследованию
- Женщины, планирующие беременность;
- женщины с отягощенным акушерским анамнезом (перинатальные потери, рождение ребенка с врожденными пороками развития);
- беременные женщины (в первую очередь имеющие УЗИ-признаки внутриутробной инфекции, лимфаденопатии, лихорадку, гепатит и гепатоспленомегалию неясного генеза);
- беременные женщины с иммунодефицитом, в т. ч. с ВИЧ-инфекцией;
- матери, родившие ребенка с признаками внутриутробной инфекцией или врожденными пороками развития;
- дети, имеющие симптоматику врожденной инфекции, пороки развития или рожденные женщинами из группы риска по внутриутробной передаче ЦМВ;
- пациенты (в первую очередь новорожденные) с сепсисом, гепатитами, менингоэнцефалитом, пневмонией, поражением ЖКТ;
- пациенты с наличием иммунодефицита с клинической картиной органных или генерализованных поражений.
Дифференциальная диагностика
- Врожденная ЦМВИ – краснуха, токсоплазмоз, неонатальный герпес, сифилис, бактериальная инфекция, гемолитическая болезнь новорожденных, родовая травма, наследственные синдромы;
- мононуклеозоподобное заболевание – инфекции, вызываемые вирусом Эпштейна-Барр, герпес-вирусами 6 и 7 типов, острая ВИЧ-инфекция, стрептококковый тонзиллит, дебют острого лейкоза;
- заболевание органов дыхания у детей раннего возраста – коклюш, бактериальный трахеит или трахеобронхит, РС-вирусной инфекция, герпетический трахеобронхит;
- у больных с иммунодефицитом – пневмоцистная пневмония, туберкулез, токсоплазмоз, микоплазменная пневмония, грибковые и герпетические инфекции, бактериальный сепсис, лимфопролиферативные заболевания, ВИЧ-энцефалит, нейросифилис, прогрессирующая многоочаговая лейкоэнцефалопатия;
- полинейропатия и полирадикулопатия – полирадикулопатия, вызванная герпесвирусами 2 и 6 типов, синдром Гийена-Барре, токсическая полинейропатия, связанная с приемом лекарственных средств, алкоголя, наркотических психотропных веществ.
Этиологическая лабораторная диагностика включает микроскопические исследования, выявление возбудителя в культуре клеток, обнаружение АГ или ДНК, определение АТ IgM, IgА, IgG, авидности АТ IgG.
Материал для исследования
- Кровь (сыворотка, плазма), лейкоциты крови, моча, слюна, СМЖ – культуральные исследования, выявление ДНК;
- пуповинная кровь, амниотическая жидкость – выявление ДНК;
- слюна, моча – выявление АГ;
- сыворотка/плазма крови – определение АТ.
Сравнительная характеристика методов лабораторной диагностики. Использование метода ПЦР позволяет определить наличие ДНК вируса в тканях и биологических жидкостях. Исследование обладает высокой специфичностью (100%) и чувствительностью (85–100%). ДНК ЦМВ может быть выявлено и при латентной ЦМВИ, указывая на продолжающуюся репликацию вируса даже при полном отсутствии клинических симптомов болезни. Использование ПЦР в реальном времени позволяет определить уровень виремии («вирусную нагрузку») в крови и СМЖ.
Выделение вируса из лейкоцитов крови, мочи, слюны, ликвора, спермы и др. в культуре клеток долгое время называли «золотым стандартом» в диагностике ЦМВИ. В настоящее время, с появлением высокочувствительных и специфичных молекулярно-биологических методов, вирусологические исследования уже не занимают главного места в лабораторной диагностике ЦМВИ. Это обусловлено как особенностями вируса – на результат культивирования влияет неустойчивость ЦМВ к изменению температуры и замораживанию, так и необходимостью выполнения исследований в специально оборудованной вирусологической лаборатории, которыми обычно не располагают лечебно-профилактические учреждения. Кроме того, вирусологическое исследование не позволяет отличить первичное инфицирование от рецидивирующей формы ЦМВИ, особенно при бессимптомном течении. Некоторые лаборатории используют “быстрый культуральный метод” с предварительным внесением биоматериала в культуру фибробластов и выявлением цитопатического действия ЦМВ при применении РИФ.
Для обнаружения АГ вируса в слюне и моче используют метод РИФ, по количеству светящихся клеток можно приблизительно оценить интенсивность выделения вируса. В связи с персистенцией ЦМВ обнаружение АГ не указывает на активность инфекционного процесса, для ее оценки требуются дополнительные исследования – выявление отдельных АГ вируса (р55, рр65 и др.).
При проведении микроскопического исследования (световая микроскопия) основными морфологическими признаками ЦМВИ являются гигантские клетки с внутриядерными включениями (цитомегалы). Их можно обнаружить в эпителии почечных канальцев, желчных протоках, выводных протоках слюнных желез, поджелудочной железы, ткани легких, клетках глии, нейронах, эндотелиоцитах. Наличие таких клеток указывает на репродукцию вируса, однако они обнаруживаются не во всех случаях активной инфекции. Диагностическая чувствительность метода не превышает 50%.
Для определения АТ-ЦМВ обычно используют метод ИФА. Наличие АТ IgM свидетельствует в пользу острой инфекции или реактивации. Реактивация гораздо чаще сопровождается гиперпродукцией АТ IgА, чем IgM. Выявление АТ IgG имеет низкое диагностическое значение. Диагностическую ценность теста повышает определение авидности АТ IgG: выявление низкоавидных АТ IgG свидетельствует о текущей или недавно перенесенной ЦМВИ, снижение индекса авидности возможно и при реактивации. Обнаружение высокоавидных АТ позволяет исключить первичную инфекцию, однако реактивация может протекать при наличии высокоавидных АТ, что подтверждается обнаружением ЦМВ, его АГ («ранних белков») или ДНК, а также выявлением АТ IgА.
Определение специфических АТ к вирусу помогает в распознавании заражения человека ЦМВ, но ввиду длительного периода нарастания титра АТ от момента инфицирования, последующего долгого сохранения их в крови, трансплацентарного перехода АТ IgG от матери к плоду (выявляются у ребенка до 1,5 лет) диагностическая ценность исследования ограничена. При наблюдении в динамике (2–4 недели) повышение титра АТ IgG в 4 раза указывает на активную ЦМВИ. Однако необходимость длительного периода наблюдения (до 4 недель) и возможность сохранения повышенного титра АТ на протяжении ряда лет лимитирует использование такого подхода к диагностике.
Дополнительным исследованием при поражении мозга, вызванного ЦМВ, может быть параллельное обнаружение АТ IgG в периферической крови и СМЖ методом ИФА с последующим расчетом их соотношения. Значение соотношения позволяет выявить интратекальную продукцию АТ и соответственно вовлечение в инфекционный процесс ЦНС.
Иммуноблот позволяет детектировать АТ IgM и IgG к отдельным белкам ЦМВ, подтвердить специфичность исследования, следить в динамике за появлением и исчезновением отдельных белков, что имеет высокое диагностическое и прогностическое значение. Наличие АТ к отдельным АГ вируса подтверждает формирование иммунного ответа к ЦМВ.
Показания к применению различных лабораторных исследований и интерпретация их результатов у разных категорий обследуемых
Диагностика первичного заражения, в т. ч. в период беременности, возможна только у пациентов, в крови которых отсутствуют АТ-ЦМВ. Независимо от клинических вариантов заболевания, при первичной ЦМВИ выявляются прямые (присутствие вируса, его ДНК или АГ) и косвенные (АТ-ЦМВ) лабораторные маркеры активной репликации ЦМВ. При обследовании больных при подозрении на активную ЦМВИ и манифестную форму заболевания (ЦМВ-болезнь) необходимо количественное определение содержания ДНК ЦМВ в крови. Определение ДНК ЦМВ в ликворе, плевральной жидкости, БАЛЖ, биоптатах бронхов, биоптатов органов выполняют при наличии соответствующей органной патологии.
Выявление прямых маркеров репликации вируса (виремия, ДНК или АГ) свидетельствует о наличии инфекции. Выявление ДНК ЦМВ или АГ вируса в крови беременной женщины – основной маркер высокого риска заражения плода и развития врожденной ЦМВИ.
Отсутствие АТ-ЦМВ IgM, IgА и IgG означает отсутствие ЦМВ в организме. Однако у лиц с выраженным иммунодефицитом при активной репликации ЦМВ продукция специфических АТ может быть снижена до неопределяемого уровня.
Выявление АТ-ЦМВ разных классов позволяет определить фазы инфекционного процесса (репликативная или латентная). АТ IgM чаще оценивают как маркер первичной герпес-вирусной инфекции. При выявлении АТ IgM для подтверждения инфицирования ЦМВ рекомендуются дополнительные исследования: определение АТ IgА или авидности АТ IgG, выявление АТ к отдельным белкам с использованием иммуноблота; повторное обследование женщины или ребенка через 2 недели. Выявление АТ IgА и(или) низкоавидных АТ IgG подтверждает наличие инфекции. При повторном выявлении АТ IgM и отсутствии IgА и(или) низкоавидных IgG результат выявления АТ IgM считают ложноположительным.
Выявление АТ IgM и IgG к предранним белкам-антигенам и низкоавидных АТ IgG свидетельствует о первичном инфекционном процессе.
Обнаружение только АТ IgG не позволяет охарактеризовать период заболевания. При наличии иммуносупрессии классического (4-х кратного) увеличения АТ IgG во время рецидива не наблюдают.
Установление факта инфицирования плода осуществляется на основании обнаружения ДНК ЦМВ. Выбор биологического материала определяется с учетом срока гестации, обусловливающего возможность проведения того или иного метода инвазивной пренатальной диагностики: амниотическая жидкость – 16–23 недели, пуповинная кровь – 20–24 недели. Косвенным подтверждением факта инфицирования плода является обнаружение АТ IgM и/или АТ IgА в пуповинной крови (проведение исследования возможно с 22 недели беременности).
Лабораторная диагностика врожденной ЦМВИ основана на обнаружении ЦМВ, его ДНК или АГ в различном биологическом материале (периферическая кровь, моча, слюна, смывы и мазки от ротоглотки, СМЖ) и выявлении в сыворотке или плазме крови АТ IgМ и IgА в течение первых 7 дней после рождения. Проведение исследования в более поздние сроки не позволяет дифференцировать врожденную и приобретенную инфекцию. Выявление ДНК ЦМВ или АГ вируса в крови, моче, соскобах со слизистой ротовой полости через 4–6 недель жизни ребенка при отсутствии вируса в первые 2 недели говорит об интранатальном или раннем постанатальном заражении. Подтверждением манифестной ЦМВИ у детей первых месяцев жизни является наличие ДНК ЦМВ в крови.
При сомнительных результатах дополнительную диагностическую информацию может дать выявление АТ IgМ к отдельным белкам-антигенам вируса методом иммуноблота. Отсутствие АТ-ЦМВ у детей с врожденной ЦМВИ может быть связано с развитием иммунологической толерантности к АГ вируса цитомегалии (инфицирование ЦМВ не сопровождается эффективным синтезом АТ-ЦМВ).
При обследовании детей в постнеонатальном возрасте показано выявление возбудителя (классический или модифицированный вирусологический метод), его ДНК или АГ («ранних белков») и АТ IgМ и IgА. Выявление анти-ЦМВ IgМ у детей первых недель жизни считают критерием внутриутробного заражения вирусом. Недостатком определения АТ IgМ служит их частое отсутствие в крови при наличии активного инфекционного процесса и не менее частые ложноположительные результаты. При обследовании детей в возрасте до 4–6 месяцев жизни целесообразно одновременное определение АТ у ребенка и матери с последующим сопоставлением величины их уровня (титра) и характера авидности. При обследовании ребенка в возрасте старше 6 месяцев может быть исследована только кровь ребенка. Для исключения ЦМВИ у детей первого года жизни рекомендуется определение ДНК или АГ в моче.
Выявление АТ IgG в сыворотке крови новорожденного без сопоставления с уровнем АТ в крови матери не является диагностически значимым вследствие возможности их трансплацентарного переноса из материнского организма. Только при динамическом (с интервалом в 14–21 день) сравнении уровня АТ IgG новорожденного ребенка с уровнем АТ IgG в крови матери можно судить об их природе. Если титры АТ IgG у ребенка при рождении равны материнским, а при повторном исследовании через 3–4 недели снижаются приблизительно в 1,5–2 раза, то АТ, выявленные у ребенка, являются материнскими.
Скрининг беременных женщин – выявление АТ IgМ и низкоавидных АТ IgG. Для исключения реактивации целесообразно определение АТ IgА и низкоавидных АТ IgG.
Обследование больных с наличием иммунодефицита при подозрении на активную ЦМВИ и манифестную форму заболевания (ЦМВ-болезнь) включает гистологическое исследование биопсийных материалов для выявление цитомегалов (окраска гематоксилином и эозином), обнаружение ДНК ЦМВ в ликворе, плевральной жидкости, БАЛ, биоптатах бронхов, биоптатов внутренних органов при наличии соответствующей органной патологии; выявление АГ ЦМВ в крови, определение концентрации ДНК ЦМВ в крови методом ПЦР. В диагностике ЦМВИ у ВИЧинфицированных наиболее информативно наличие в крови ДНК ЦМВ в высокой концентрации (в плазме крови >10000 копий/мл, в лейкоцитах > 1000 копий/ 105 лейкоцитов).
Специфические поражения ротоглотки. Сифилис и туберкулез ротоглотки
Специфические поражения ротоглотки. Сифилис и туберкулез ротоглотки
Сифилитические поражения ротоглотки неодинаковы на разных стадиях болезни. При первичном сифилисе на слизистой оболочке ротоглотки вначале появляется небольшое красноватое пятно или папула. Через 5-10 дней элемент увеличивается до размера горошины с плотным склеротическим инфильтратом в основании.
В центральной части элемента происходит поверхностный некроз с образованием первичной эрозии или язвы (первичный аффект, или твердый шанкр). Первичные сифиломы чаще всего локализуются на губах, языке, миндалинах, деснах, на небе и на слизистой оболочке щеки. Шанкры миндалин обычно одиночные и односторонние. При язвенных формах дно язвы темно-красного или опалового цвета, покрыто грязно-серым налетом, в основании язвы плотный инфильтрат.
Отмечается болезненность при глотании, но отсутствуют симптомы интоксикации (нет лихорадки, головной боли и др.) и всегда имеется одностороннее увеличение подчелюстных и шейных, иногда околоушных ЛУ, слегка болезненных при пальпации. Первичная сифилома и регионарный лимфаденит
- единственные клинические симптомы первичного сифилиса, которые сохраняются 6-7 недель, до появления свежих высыпаний на коже
- вторичного сифилиса. Высыпания во рту, ротоглотке и гортани появляются одновременно с кожными сыпями или изолированно, как это имеет место при рецидивах. Различают пятнистые, папулезные и пустулезные сифилиды слизистых оболочек; они резко очерчены, плотные, синюшно-красноватого цвета с серовато-беловатым (опаловым) оттенком, изолированные или сливные. Высыпания на голосовых связках вызывают затруднение при глотании, охриплость, реже афонию.
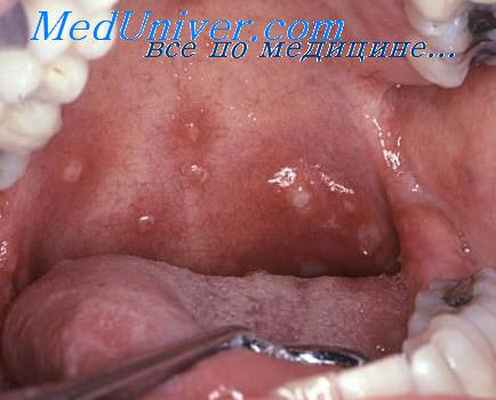
Третичный сифилис слизистых оболочек проявляется появлением малоболезненных гуммозных инфильтратов, расположенных на мягком и твердом небе, в полости носа, реже на задней стенке глотки и языке. Гуммозные инфильтраты быстро распадаются и изъязвляются, приводя к разрушению костной и хрящевой ткани. Язвы оставляют после себя втянутые рубцы белого цвета.
Туберкулезные поражения ротоглотки локализуются преимущественно в миндалине и являются компонентом первичного туберкулезного комплекса. Чаще, чем глотка, поражаются слизистые оболочки носа и (или) гортани. Обнаруживают инфильтраты в виде скопления узелков серовато-желтого или красного цвета, которые придают поверхности зернистый вид. Они могут изъязвляться. Туберкулезные язвы фестончатой формы, края их слегка подрыты, дно бледно-красное, с вялыми грануляциями, по краям видны бугорки.
Нередко этиология туберкулезного поражения устанавливается только при гистологическом исследовании миндалин, удаленных по поводу хронического тонзиллита. Первичный очаг быстро ликвидируется, но длительно сохраняется туберкулезное поражение регионарных ЛУ, иногда с их воспалением, изъязвлением и образованием свища («золотуха», по определению старых авторов).
При проказе часто поражается слизистая оболочка перегородки носа, что приводит, так же как и при сифилисе, к перфорации перегородки носа и его деформации. В запущенных случаях лепромы располагаются на слизистой оболочке языка, неба. Образующиеся после их распада рубцы подтягивают небную занавеску. Нередко развивается хронический фарингит, ларингит, приводящие к охриплости, афонии, стенозу гортани и даже асфиксии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Туберкулез гортани
Туберкулёз гортани характеризуется образованием в пораженных тканях очагов специфического воспаления. Это неизменный спутник туберкулёза легких. Он возникает из-за проникновения туберкулезной палочки из очагов заболевания. Туберкулёз гортани заразен, к потенциальным бактериовыделителям относятся больные активным туберкулезом, которые игнорируют лечение. Даже при благоприятном течении и применении современных методов лечения туберкулез гортани сложно поддается лечению.
Причины
В основном заражение происходит воздушно-капельным путем. Отдельные больные выделяют за сутки несколько миллиардов микобактерий. Находящиеся поблизости люди вдыхают их и заражаются.
Можно также заразиться через кровь или лимфу.
Благоприятствуют возникновению туберкулёза гортани:
- хронические заболевания лёгких;
- сахарный диабет;
- курение;
- алкоголизм;
- работа в загрязнённом воздухе.
Классификация туберкулёза гортани
Туберкулёзное поражение гортани встречается только у взрослых. Ему всегда сопутствует туберкулёз легких или других органов. Туберкулёз гортани классифицируется по местоположению и распространённости процесса и фазы в гортани, а также наличию бактериовыделения.
В соответствии с локализацией и распространённостью процесса в гортани
- надгортанника. У больного начинают синеть кончики пальцев, появляется синюшность вокруг рта из-за нехватки кислорода;
- подголосового пространства. Это поражение негативно влияет на образование звука. Голосовые складки теряют упругость, утолщаются и укорачиваются;
- гортанных желудочков. Это поражение долгое время никак не проявляется;
- вестибулярных складок. Ограничивается их подвижность, поэтому дыхание становится затруднённым;
- межчерпаловидного пространства. Характеризуется резкими болями при глотании;
- черпаловидных хрящей. Это повреждение затрудняет вдох и выдох.
Также появляется монохордит – утомляемость голоса. Изменяется его тембр, со временем больному становится сложно говорить.
В соответствии с фазой туберкулёзного процесса
можно определить период болезни:
- на этапе инфильтрации начинает утолщаться слизистый слой глотки, появляются небольшие бугорки;
- на этапе изъязвления образуются зловонные опухолевые язвы с обильными кровавыми выделениями;
- на этапе распада появляется кашель со слизисто-гнойной мокротой, булькающие хрипы в легких, кровохарканье и выделение МВТ;
- затем следует этап уплотнения. Если уплотнение не происходит, болезнь находится в фазе ремиссии;
- рубцевание ведет к стойкому сужению просвета гортани.
У некоторых больных замечены случаи быстрого заживления туберкулеза гортани при своевременно начатом лечении. После проведенного курса начинает разрастаться молодая соединительная ткань, и туберкулезные изменения полностью исчезают.
По наличию бактериовыделения
Наличие бактериовыделения (МБТ+) – необходимый показатель опасности, заразиться туберкулезом можно только от больного, который выделяет микобактерии. Больные, не выделяющие микобактерии (МБТ-), не опасны для окружающих, так как болезнь проходит в закрытой форме.
Патогенез туберкулёза гортани
Туберкулез гортани начинается при общей интоксикации организма. В гортань возбудитель болезни в основном попадает аэрогенным путем, но нередко заражение происходит алиментарным путем. Инфекция при туберкулезе гортани проникает из мокроты легочного очага. Часто заражение происходит гематогенным путем, т. е. передается через кровь. Иногда инфицирование гортани происходит из лимфатических узлов.
Развитие туберкулёза гортани
Туберкулезный процесс в гортани принимает различные формы. Микобактерии внедряются слизистую ткань гортани и поражают организм человека.
Образование инфильтрата
При инфильтративных формах туберкулеза гортани утолщается слизистая оболочка гортани. Пораженный надгортанник опухает и нависает над входом в гортань в виде чалмы, закрывая проход. Жалобы на этой стадии случаются редко.
Формирование язвы
При прогрессировании инфильтративного туберкулеза гортани появляются воспаления, переходящие в язвы, постоянно увеличивающиеся в размерах.
Поражение хрящей
При прогрессировании болезни происходит патологический процесс с поражением хрящей и мышц. В отдельных случаях надгортанник может быть полностью разрушен.
Симптомы туберкулеза гортани
Чтобы своевременно распознать туберкулёз гортани, следует знать симптомы болезни. Уже в начале развития заболевания у больного появляются сухость и першение в горле, а также боли во время еды. Часто больной испытывает сильную одышку. Кашель весьма характерный: хриплый и беззвучный.
Через некоторое время у больного появляется озноб, повышается температура, дыхание становится затрудненным. Со временем начинает меняться голос, он становится сиплым, неприятным. Начинается кровохарканье, но это нехарактерный признак туберкулёза гортани.
Пациенты сильно худеют, так как прием пищи становится очень болезненным.
Если лечение не начато, начинается поражение хрящевых суставов.
Диагностика
Диагностику туберкулёза гортани проводит отоларинголог. После проведения ларингоскопии, прежде чем поставить окончательный диагноз, врач направляет пациента на лабораторные исследования, такие как:
- микроларингоскопия;
- анализ мокроты на КУБ;
- общий анализ крови;
- туберкулиновые пробы;
- RPR-тест;
- патоморфологическое исследование биоптатов из гортани, для определения эпителиоидных клеток.
В сомнительных случаях направляют на эндоскопическую биопсию и гистологические исследования.
Также врач-отоларинголог исследует голосовую функцию, проводит фонетографию, УЗИ, чтобы оценить деструктивные процессы и дифференцировать туберкулёз гортани от других схожих заболеваний: сифилиса, рака гортани, дифтерии, гранулематоза или доброкачественной опухоли.
Лечение туберкулёза гортани
Правильная диагностика этого заболевания вызывает большие сложности. Но в медицинском центре «Клиника К+31» благодаря современному высокоточному оборудованию для диагностики и лечения туберкулёза таких сложностей не возникает. Поэтому врачи могут поставить правильный диагноз, даже на ранней стадии заболевания и своевременно ликвидировать очаги болезни.
Врачи подбирают индивидуальное лечение для каждого пациента. Благодаря профессиональному и внимательному отношению докторов клиники «Клиника К+31» после проведённого курса лечения у пациентов восстанавливается голосовая и дыхательная функция и возвращение к нормальной жизни.
24.Хронические инфекционные заболевания глотки (туберкулез, сифилис, склерома).
Туберкулезные поражения в глотке разнообразны: от поверхностных ограниченных язвочек с незначительной инфильтрацией до обширного бугристого папилломатозного вида инфильтрата с характерными язвами. При язве появляется патогномоничный признак - резкая болезненность при глотании не только твердой пищи, но и воды. Присоединение вторичной инфекции приводит к возникновению неприятного гнилостного запаха изо рта. Туберкулезные язвы располагаются в основном на нёбных дужках и на слизистой оболочке задней стенки глотки, имеют неровные фестончатые подрытые края и бледно-розовую окраску; поверхность их довольно часто покрыта гнойным налетом, под которым определяются бледные, вялые грануляции. Язвы могут увеличиваться в размерах, захватывая большие участки слизистой оболочки, распространяясь в глубину.
Диагностика. В начале заболевания поставить диагноз относительно трудно. В первую очередь необходимо обращать внимание на состояние легких как место первичной локализации. Данное заболевание следует дифференцировать с сифилисом, раком. В более поздней стадии диагноз ставят на основании клинической картины,
Лечение. Общее и местное. Наиболее эффективны и считаются обязательными составляющими курса химиотерапии изониазид и рифампицин; также применяются пиразинамид, этамбутол, стрептомицин, флоримицин, циклосерин. Наилучший эффект дает комбинированное применение этих препаратов. ПАСК назначают редко ввиду низкой противотуберкулезной активности препарата. Назначаются также щадящий общий режим, полноценное питание. Основой местного лечения является прижигание инфильтратов и язв различными кислотами (трихлоруксусная кислота, 80% молочная кислота и др.). Применяют 10-20% мазь из пирогалловой кислоты. Положительный эффект дает облучение пораженного участка слизистой оболочки кварцем через тубус.
Назначают частые полоскания ротоглотки теплым отваром ромашки, шалфея или перекисью водорода. С целью уменьшения болевых ощущений при глотании следует применять смазывание язвенных поверхностей мазью с анестезином. Пища должна быть теплой, жидкой, нераздражающей.
Сифилис глотки и гортани наблюдается как проявление общего заболевания организма и может возникнуть в любой стадии процесса. Твердый шанкр проявляется в виде эритематозной, эрозивной и язвенной форм. Процесс в глотке, как правило, односторонний и сопровождается односторонним лимфаденитом регионарных лимфатических узлов.
Во второй стадии сифилиса поражение слизистых оболочек глотки и гортани чаще возникает одновременно и нередко сопровождается кожными высыпаниями в виде розеол и папул. Вторичные сифилиды обычно не сопровождаются субъективными ощущениями, поэтому могут остаться незамеченными и больной продолжительное время является источником заражения.
Специфический процесс в нёбной миндалине отличается от банальной ангины нормальной или незначительно повышенной температурой, отсутствием болезненности при глотании. При фарингоскопии вторичный сифилис глотки характеризуется разлитой припухлостью на фоне гиперемии медно-красного цвета, которая распространяется на нёбные дужки, слизистую оболочку мягкого и твердого нёба. В гортани вторичная стадия проявляется в виде эритемы, симулирующей катаральный ларингит с вовлечением в процесс голосовых складок, черпаловидных хрящей и надгортанника. Возможно также образование папул с локализацией в различных отделах глотки и гортани. Папулы представляют собой сероватобелые высыпания округлой или овальной формы, возвышающиеся над поверхностью и окруженные по краю красной каймой. Такие высыпания, или бляшки, нередко с изъязвленной поверхностью располагаются на кончике и по краям языка, на слизистой оболочке щек и твердого нёба, на голосовых, вестибулярных, черпалонадгортанных складках и надгортаннике
Третичный сифилис проявляется ограниченной гуммозной опухолью, причем гуммы в глотке локализуются в основном в области твердого и мягкого нёба, а в гортани - на надгортаннике, реже в межчерпаловидном пространстве и на вестибулярных складках. Располагаясь в подголосовой области, гумма приобретает вид симметричного инфильтрата (рис. 6.3 б, в), при ее распаде появляется язва с ровными краями и сальным дном, покрытая некротическим налетом. Присоединение вторичной инфекции сопровождается выраженной воспалительной реакцией с отеком, развитием флегмоны, хондроперихондрита.
Специфическое воспаление хрящей ведет к образованию эндоларингеальных свищей. При своевременном проведении лечения на месте гумм образуются плотные рубцы звездчатой формы, беловатожелтого цвета. Рубцевание может привести в глотке к сращениям мягкого нёба с задней стенкой, а в гортани - к деформации, вызывающей стенозирование.
Жалобы больного в стадии образования гуммы зависят от ее размеров, локализации и вторичных реактивных процессов. Рубцы в глотке вызывают появление закрытой гнусавости, ухудшение слуха в результате поражения слуховых труб, нарушение носового дыхания и обоняния. Процесс в гортани сопровождается охриплостью или афонией; при развитии рубцового процесса появляется затруднение дыхания.
Диагностика. Поражение глотки и гортани сифилисом распознается на основании данных осмотра, положительной серологической реакции Вассермана, обнаружения в отделяемом язв папул бледной спирохеты.
При вторичном сифилисе глотки проводится дифференциация с катаральной, фолликулярной, язвенно-пленчатой ангиной, туберкулезом и лейкоплакией. Лейкоплакия - ограниченное уплотнение эпителия серовато-белого цвета, располагающееся на слизистой оболочке щек и языка, возникает в результате длительного воздействия неспецифических раздражителей (курение и т.п.). Третичный сифилис гортани следует дифференцировать с туберкулезом, злокачественной опухолью. В этом случае определенную помощь оказывает обследование больного на туберкулез, реакция Вассермана, гистологическое исследование кусочка ткани из пораженного участка.
Лечение при сифилисе специфическое, под наблюдением дерматовенеролога. Проводится этиотропная терапия препаратами пенициллина, макролидами, цефалоспоринами; при поздних формах - препараты висмута (бийохинол, бисмоверол). Местно при поражении носа рекомендуется носовой душ раствором гидрокарбоната натрия, промывание полости носа 0,1% раствором перманганата калия. При поражении глотки применяют полоскание слабодезинфицирующими растворами перекиси водорода, отвара ромашки и др.
СКЛЕРОМА ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Это хроническое инфекционное заболевание верхних дыхательных путей, в виде ограниченных или диффузных инфильтратов на фоне атрофии слизистой оболочки, на месте которых формируется рубцовая ткань, приводящая к сужению различных отделов дыхательного тракта.
Склерома вызывается капсульным диплококком - клебсиеллой склеромы (палочка Волковича-Фриша). Данное эндемическое заболевание наиболее распространено в Западной Белоруссии и Украине, Польше, Италии и Германии; очаги склеромы отмечены в Индонезии, Бразилии, Мексике и т.д. существуют данные о возможной контагиозности склеромы.
Патоморфологическим субстратом заболевания является инфильтрат, состоящий из фиброзной соединительной ткани с большим количеством плазматических клеток и сосудов. Среди этих образований находятся специфические для склеромы клетки Микулича, в вакуолях протоплазмы и вне их располагаются палочки Волковича-Фриша. Кроме того, в инфильтрате встречаются гиалиновые шары - тельца Русселя. В рубцовой ткани отмечается большое количество фиброзных волокон, среди которых встречаются плазматические клетки и единичные клетки Микулича; бациллы здесь отсутствуют, гиалиновых шаров нет, сосудов мало.
Инкубационный период заболевания длительный, при внедрении инфекции возникают катаральные явления, а через 3-5 лет обнаруживаются признаки заболевания, причем у молодых этот период короче, чем у людей старшего возраста.
Наиболее частая локализация поражения при склероме - передние отделы носа, область хоан, подголосовое пространство гортани, бифуркации трахеи и бронхов.
Клиническая картина. Заболевание развивается медленно, с самого начала принимая хроническое течение, без болей и повышения температуры; специфические склеромные инфильтраты располагаются, как правило, симметрично и не проявляют склонности к распаду и изъязвлению, а подвергаются рубцеванию.
Различают три основные формы склеромы, которые в определенной степени отражают стадийность течения патологического процесса:
• рубцовую, или регрессивную.
Кроме того, наблюдают также смешанную и атипичную формы склеромы.
В настоящее время атрофическая форма наблюдается у 70% больных склеромой. Начало заболевания характеризуется атрофией слизистой оболочки носа. На ее поверхности появляется вязкая слизь, которая, подсыхая, образует плотные корки. Корки и вязкая слизь приводят к сужению просвета носовых ходов, что сопровождается нарушением дыхания. Одновременно снижается обоняние и появляется нерезкий специфический запах из носа, напоминающий запах гнилых фруктов. Атрофия распространяется на слизистую оболочку задней стенки глотки, которая истончается и выглядит как лакированная, покрытая вязкой слизью и корками. В этот период реакция связывания комплемента со склеромным антигеном обычно положительная, часто высевается клебсиелла склеромы.
При инфильтративной форме склеромы в верхних дыхательных путях наблюдаются ограниченные или распространенные инфильтраты красного или серовато-розового цвета. Чаще всего инфильтраты обнаруживаются по дну полости носа, в области передних концов нижних носовых раковин и перегородки носа. Инфильтраты имеют вид плоских или бугристых возвышений, безболезненных при дотрагивании; они суживают просвет полости носа, вход в нос, хоаны, просвет носоглотки, гортани, а несколько позже и трахею в области бифуркации и бронхи у разветвлений.
Следует отметить, что склеромные инфильтраты возникают главным образом в местах физиологических сужений.
При рубцовой форме на местах инфильтратов постепенно развивается плотная рубцовая ткань, которая, стягивая окружающие ткани, приводит к сужению различных отделов дыхательного тракта.
В полости носа рубцы обычно располагаются в передних отделах, где выявляется рубцовая приподнятость на границе преддверия и полости носа. Иногда рубцы оставляют лишь отверстия овальной или круглой формы, суживая просвет полости носа. Распространяясь на мягкое нёбо, рубцовый процесс приводит к концентрическому сужению, а в ряде случаев почти к полному заращению носоглотки; язычок при этом подтягивается кверху или заворачивается за заднюю поверхность мягкого нёба.
При смешанной форме склеромы клиническая картина отличается полиморфизмом. Наряду с атрофией слизистой оболочки и обилием корок при их удалении можно обнаружить красного цвета узелки, рубцовое концентрическое сужение на границе преддверия и полости носа. В гортани наряду с подскладочными инфильтратами выявляется рубцовая ткань или атрофия, т.е. наблюдается сочетание различных форм склеромы.
Диагностика.Втипичныхслучаях при наличии соответствующих анамнестических данных диагноз не труден. Как правило, эндоскопическая картина весьма характерна. Определенную помощь в диагностике оказывает трахеобронхоскопия. Обычно прибегают к постановке серологических реакций Вассермана и Борде-Жангу со склеромным антигеном. Подспорьем в диагностике является гистологическое исследование удаленного инфильтрата, в ткани которого обнаруживаются бациллы Волковича-Фриша и клетки Микулича. На слизистой оболочке верхних дыхательных путей наряду с инфильтратами обнаруживается рубцовая ткань.
Атрофическую форму склеромы следует дифференцировать с озеной и атрофическим ринофарингитом. Эти заболевания имеют три общих симптома: атрофия слизистой оболочки, образование корок и неприятный запах. Однако при озене инфильтративные и рубцовые процессы отсутствуют; атрофия касается более глубоких отделов слизистой оболочки носа; имеется резкое истончение раковин и костной ткани. Корки при озене бывают в виде слепков и располагаются в глубине, у средней раковины и удаляются легче, чем при склероме. Специфический приторный нестерпимый запах при озене иногда ощущается даже на расстоянии от больного, причем сам больной его обычно не ощущает из-за аносмии. При атрофической форме
склеромы также иногда бывает сладковатый запах, но выражен он значительно меньше. Окончательный диагноз устанавливается по бактериологическим (клебсиелла склеромы и клебсиелла озены) и серологическим (со склеромным и озенозным антигеном) исследованиям.
Инфильтративную форму склеромы следует дифференцировать с туберкулезом и сифилисом. При туберкулезе инфильтраты бывают в хрящевом отделе перегородки носа с последующим распадом, изъязвлением и перфорацией. В гортани поражение асимметричное и практически не бывает изолированным, первичным, сопровождается туберкулезом легких.
При сифилисе в гортани чаще поражается верхний этаж, надгортанник; гуммозный инфильтрат подвергается распаду, образуя язвы с сальным дном. Выявляются увеличенные лимфоузлы, что не характерно для склеромы. Диагноз сифилиса и склеромы подтверждается серологическими реакциями.
Лечение консервативное и хирургическое. Среди средств этиотропной терапии ведущее место занимает стрептомицин - внутримышечно по 500 000 ЕД 2 раза в сут, курс 40-80 г. Назначают и другие антибиотики: левомицетин, тетрациклин, олеандомицин и др. Для лучшего проникновения антибиотика в глубь пораженных тканей одновременно назначаются препараты гиалуроновой кислоты: лидаза, гиалуронидаза, ронидаза.
Для удаления корок и увлажнения слизистой оболочки назначают масляные капли (оливковое, шиповниковое масло и др.), смазывание раствором Люголя, ингаляции растворами протеолитических ферментов, щелочными растворами.
Хирургическое лечение заключается в иссечении инфильтратов, рубцов и удалении их путем электрокоагуляции, лазерного воздействия, криодеструкции жидким азотом и т.д. При стенозах иногда применяют бужирование гортани.
Прогноз в начальной стадии заболевания благоприятный, в более поздних стадиях тяжелый, особенно при поражении трахеи и бронхов.
Туберкулез (Mycobacterium tuberculosis) (суммарные антитела IgG, IgM, IgA)
Антитела к возбудителю туберкулеза (M. tuberculosis) – это специфические иммуноглобулины, вырабатываемые иммунной системой в ответ на инфицирование возбудителем туберкулеза.Туберкулез – это инфекционное заболевание, возбудителями которого являются аэробные микобактерии (M. tuberculosis, M. bovis, M. africanus, M. microti), распространенные в почве, воде и у животных. Mycobacterium tuberculosis – это вид микобактерий, который вызывает туберкулез у человека в 92 % случаев.
M. tuberculosis передается воздушно-капельным путем от больных туберкулезом в активной форме. У 90 % людей после первичного инфицирования микобактерии оседают в нижних отделах легких и не приводят к развитию заболевания, так как вырабатывается иммунный ответ, не допускающий увеличения количества бактерий. Однако в случае сильного ослабления иммунной системы туберкулезные палочки начинают активно размножаться и туберкулез переходит из латентной формы в активную. Возможно поражение легких, костей, суставов, мочеполовых органов, лимфатической системы, кожи, глаз и нервной системы.
Микроскопическое исследование возбудителя в посеве мокроты по-прежнему считается «золотым стандартом» в диагностике туберкулеза. Однако данный метод имеет как свои достоинства (высокая специфичность), так и недостатки (низкая чувствительность, т. к. необходима определенная концентрация бактерий в образце). Эффективность метода ниже в отношении специфических категорий лиц (ВИЧ-инфицированных, людей старше 60 лет и детей, у которых к тому же существуют сложности со сбором мокроты). Кроме того, данное исследование занимает продолжительное время, т. к. для роста бактерий требуется 6-8 недель. Наряду с бактериологическим методом широко распространено рентгенологическое исследование. Оба метода применимы только к легочным формам туберкулеза. С другой стороны, при помощи метода туберкулиновой пробы практически невозможно дифференцировать латентную и активную формы туберкулеза.
Дифференциальная скрининговая диагностика активного туберкулеза возможна при помощи определения специфических антител к М. tuberculosis методом иммуноферментного анализа.
На активной стадии туберкулеза начинается интенсивная выработка IgG и IgM антител к специфическим антигенам, которые могут быть выявлены в сыворотке крови уже через месяц с начала активизации микобактерий. Высокая специфичность теста достигается использованием специфических для M. tuberculosis антигенов, что исключает ложноположительные результаты у вакцинированных и инфицированных другими микобактериями лиц. Чувствительность данной тест-системы составляет от 61 % (туберкулез лимфатических узлов) до 100 % (туберкулезный экссудативный плеврит) в зависимости от локализации инфекции; специфичность – 95 %.
Используется анализ:
- Для выявления активного туберкулеза, в особенности внелегочных форм.
- Для мониторинга эффективности лечения туберкулеза.
- Для выявления инфицированных лиц.
- Для подтверждения диагноза (наряду с использованием дополнительных диагностических исследований).
Назначается анализ:
- Когда известно, что пациент имел длительный контакт с больными туберкулезом или что его работа связана с постоянным контактом с людьми из групп риска (бездомными, инъекционными наркопотребителями, лицами, находившимися в местах лишения свободы).
- При соответствующих симптомах: слабости, быстрой утомляемости, субфебрильной температуре тела, ночной потливости, персистирующем кашле в течение 2-3 недель, боли в грудной клетке (легочном туберкулезе), хронических болях в спине, суставах, брюшной области с невыясненной этиологией.
- При длительном безрезультатном лечении хронического простатита, цистита, пиелонефритов и при воспалении эндометрия (туберкулезе мочеполовых органов).
- При анемии, лейкоцитозе.
Этот тест особенно важен, когда при отрицательном результате рентгенологического исследования, микроскопии и методе ПЦР есть симптомы неясного происхождения, схожие с проявлениями туберкулеза внелегочных форм.
Положительный результат – недостаточное основание для постановки диагноза «активный туберкулез», так как данный анализ должен сопровождаться другими диагностическими тестами (микроскопией бактериальных культур, ПЦР) в соответствии с клинической картиной и предполагаемыми очагами локализации инфекции для более углубленного обследования.
На ранней стадии инфекции тест может дать отрицательный результат из-за того, что еще не выработалось достаточное количество антител. В таких случаях при симптомах инфекции рекомендуется повторить исследование через 2-7 недель или провести другие виды тестирования.
Тест нечувствителен к БЦЖ-вакцинации, так какв нем задействованы антигены, специфичные для M. Tuberculosis и нехарактерные для M. Bovis.
Возможность ложноположительных результатов данного анализа исключена в связи с отсутствием взаимовлияния с другими видами микобактерий.
Тест рассчитан на выявление только активной формы туберкулеза вне зависимости от его локализации.
Данное исследование подходит для пациентов с иммунодефицитами различного происхождения (ВИЧ, онкологией), так как тест-система позволяет обнаружить иммуноглобулины всех трех классов (G, M, A).
Читайте также:
