Стадии дифференцировки эритроцитов. Влияние эритропоэтина на эритропоэз
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата.
Владелец регистрационного удостоверения:
Лекарственные формы
Форма выпуска, упаковка и состав препарата Эритропоэтин
Раствор для в/в и п/к введения в виде прозрачной, бесцветной жидкости.
| 1 мл (1 амп.) | |
| эпоэтин бета | 500 МЕ |
Вспомогательные вещества: альбумина раствор 10%, буфер изотонический, цитратный, натрий лимоннокислый 5,5-водный, натрия хлорид, кислота лимонная моногидрат, вода д/и.
1 мл (500 МЕ) - ампулы (5) - упаковки ячейковые контурные (1) - пачки картонные.
1 мл (500 МЕ) - ампулы (5) - упаковки ячейковые контурные (2) - пачки картонные.
Раствор для в/в и п/к введения в виде прозрачной, бесцветной жидкости.
| 1 мл (1 амп.) | |
| эпоэтин бета | 2000 МЕ |
Вспомогательные вещества: альбумина раствор 10%, буфер изотонический, цитратный, натрий лимоннокислый 5,5-водный, натрия хлорид, кислота лимонная моногидрат, вода д/и.
1 мл (500 МЕ) - ампулы (5) - упаковки ячейковые контурные (1) - пачки картонные.
1 мл (500 МЕ) - ампулы (5) - упаковки ячейковые контурные (2) - пачки картонные.
Фармакологическое действие
Рекомбинантный эритропоэтин человека (очищенный гликопротеин), состоящий из 165 аминокислот, который, являясь митогенным фактором и гормоном дифференцировки, способствует образованию эритроцитов из частично детерминированных клеток-предшественников эритропоэза. Рекомбинантный эпоэтин бета, полученный методом генной инженерии, по своему аминокислотному и углеводному составу идентичен эритропоэтину человека.
Эпоэтин бета после в/в и п/к введения увеличивает число эритроцитов, ретикулоцитов и уровень гемоглобина, а также скорость включения железа ( 59 Fe) в клетки, специфически стимулирует эритропоэз, не влияя на лейкопоэз. Цитотоксического действия эпоэтина бета на костный мозг или на клетки кожи человека не выявлено.
Фармакокинетика
После п/к введения C max в плазме достигается через 12-28 ч. Биодоступность эпоэтина бета при п/к введении - 23-42% по сравнению с в/в введением. V d равен ОЦК или в 2 раза превышает его. T 1/2 в конечной фазе - 13-28 ч. После в/в введения T 1/2 активного вещества составляет 4-12 ч. T 1/2 терминальной фазы при п/к введении больше, чем после в/в введения, и составляет в среднем 13-28 ч.
Показания активных веществ препарата Эритропоэтин
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Дозы, схема и продолжительность лечения устанавливаются индивидуально, зависят от выраженности анемии, тяжести состояния больного, характера заболевания, возраста пациента. Вводят п/к и в/в.
Побочное действие
Со стороны сердечно-сосудистой системы: артериальная гипертензия, гипертонический криз, тромбозы шунтов.
Со стороны нервной системы: энцефалопатия (чаще при гипертонических кризах), головная боль, спутанность сознания.
Со стороны свертывающей системы крови: редко - тромбоцитоз, тромботические осложнения.
Со стороны системы кроветворения: парциальная красноклеточная аплазия (ПККА).
Аллергические реакции: редко - кожная сыпь, зуд, крапивница, анафилактоидные реакции.
Со стороны кожи и подкожных тканей: синдром Стивенса-Джонсона.
Со стороны лабораторных показателей: снижение содержания ферритина в плазме с одновременным повышением показателя гемоглобина, увеличение уровня калия и фосфатов в плазме.
Прочие: гриппоподобный синдром, местные реакции.
Противопоказания к применению
Повышенная чувствительность к эпоэтину бета в анамнезе; неконтролируемая артериальная гипертензия; инфаркт миокарда или инсульт в течение предшествующего месяца, нестабильная стенокардия или повышенный риск тромбоза глубоких вен (при венозной тромбоэмболии в анамнезе) - при назначении для увеличения объема донорской крови для аутогемотрансфузии.
Рефрактерная анемия при наличии бласттрансформированных клеток, тромбоцитоз, эпилепсия и хроническая печеночная недостаточность. Масса тела менее 50 кг для увеличения объема донорской крови для последующей аутотрансфузии.
Применение при беременности и кормлении грудью
При беременности и в период грудного вскармливания эпоэтин бета применяют только в том случае, когда предполагаемая польза для матери превышает потенциальный риск для плода или ребенка.
В экспериментальных исследованиях тератогенного действия не выявлено.
Применение при нарушениях функции печени
С осторожностью применяют при хронической печеночной недостаточности.
Применение при нарушениях функции почек
С осторожностью применяют у пациентов с нефросклерозом, не получающим гемодиализ, поскольку возможно более быстрое ухудшение функции почек.
Применение у детей
Возможно применение у детей по показаниям, в рекомендуемых соответственно возрасту дозах и схемах.
При лечении анемии, ассоциированной с хроническим заболеванием почек, эпоэтин бета не следует назначать детям в возрасте до 2 лет.
Особые указания
На фоне терапии эпоэтином бета следует регулярно контролировать показатели тромбоцитов, гематокрита и гемоглобина.
Следует с осторожностью применять эпоэтин бета при рефрактерной анемии при наличии бласттрансформированных клеток, эпилепсии, тромбоцитозе и хронической печеночной недостаточности.
Терапевтическая эффективность эпоэтина бета может уменьшиться при дефиците железа, фолиевой кислоты, витамина B 12 .
Следует исключить дефицит железа до начала лечения эпоэтином бета, а также в течение всего периода терапии. При необходимости может быть назначена дополнительная терапия препаратами железа в соответствии с клиническими рекомендациями.
Эффективность лечения уменьшается при дефиците железа в организме, при инфекционных и воспалительных заболеваниях, гемолизе.
Нельзя полностью исключить возможность влияния эпоэтина бета на рост некоторых типов опухолей, особенно на злокачественные новообразования костного мозга.
На фоне применения эпоэтина бета необходимо контролировать уровень АД, обращая внимание на возникновение или усиление необычных головных болей. При этом может потребоваться коррекция проводимой терапии или назначение антигипертензивных средств.
С осторожностью применяют при эпилепсии, тромбоцитозе, печеночной недостаточности, сосудистой недостаточности, при злокачественных новообразованиях; у пациентов с нефросклерозом, не получающим гемодиализ, поскольку возможно более быстрое ухудшение функции почек.
Решение о применении эпоэтина бета у пациентов с нефросклерозом, не получающих диализ, необходимо принимать индивидуально, так как нельзя полностью исключить возможность более быстрого ухудшения функции почек. В большинстве случаев одновременно с повышением гемоглобина снижается концентрация ферритина в сыворотке. Уровень ферритина необходимо определять в течение всего курса лечения. Если он составляет менее 100 нг/мл, рекомендуется заместительная терапия препаратами железа.
Пациенты, сдающие аутологичную кровь и находящиеся в пред- или послеоперационном периоде, также должны получать дополнительно адекватное количество железа до нормализации показателей ферритина.
Лекарственное взаимодействие
При одновременном применении препаратов, влияющих на кроветворение (например, препаратов железа), может усиливаться стимулирующее действие эпоэтина бета.
Стадии дифференцировки эритроцитов. Влияние эритропоэтина на эритропоэз
Стадии дифференцировки эритроцитов. Влияние эритропоэтина на эритропоэз
Стадии дифференцировки красных клеток крови. Первой клеткой, которую можно идентифицировать как принадлежащую к группе красных клеток крови, является проэритробласт, показанный как отправная точка на рисунке ниже.
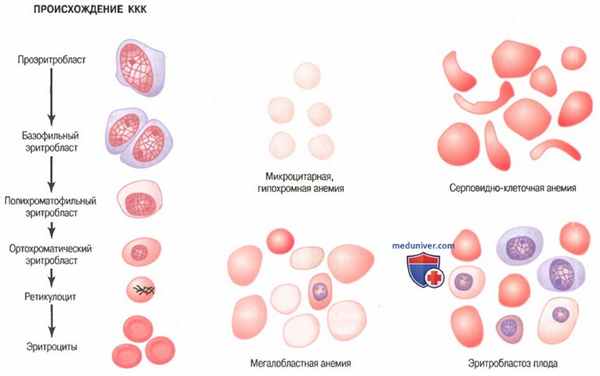
Происхождение нормальных красных клеток крови (ККК) и их особенности при разных типах анемий
При соответствующей стимуляции большие количества этих клеток формируются из стволовых клеток КОЕ-Э.
Сразу после образования проэритробласт делится много раз, в результате формируются много зрелых красных клеток крови. Клетки первой генерации называют базофилъными эритробластами, поскольку они окрашиваются основными красителями; к этому времени клетка накапливает очень мало гемоглобина.
В последующих генерациях, как показано на рисунке, клетки наполняются гемоглобином до концентрации, равной примерно 34%, ядро сжимается до небольшого размера, и его конечный остаток абсорбируется или выдавливается из клетки. В то же время абсорбируется эндоплазматический ретикулум. На этом этапе клетку называют ретикулоцитому поскольку она все еще содержит небольшое количество базофильного материала, состоящего из остатков аппарата Гольджи, митохондрий и некоторых других цитоплазматических органелл.
Во время этой ретикулоцитарной стадии клетки выходят из костного мозга в кровеносные капилляры путем диапедеза (просачиваясь сквозь поры капиллярной мембраны).
Остаточный базофильный материал ретикулоцита в норме исчезает в течение 1-2 сут, и после этого клетка становится зрелым эритроцитом. В связи с короткой жизнью ретикулоцитов их концентрация среди всех клеток крови обычно немного ниже 1%.
Регуляция продукции красных клеток крови. Роль эритропоэтина
Общая масса эритроцитов в системе кровообращения регулируется в узких пределах, поэтому, с одной стороны, (1) всегда имеется адекватное количество красных клеток крови для обеспечения достаточного транспорта кислорода из легких к тканям, с другой стороны, (2) клеток не становится так много, чтобы они мешали кровотоку. Известные в настоящее время данные об этом контроле представлены в виде схемы на рисунке ниже и заключаются в следующем.
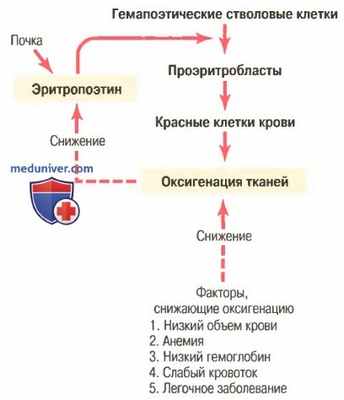
Увеличение продукции красных клеток крови, связанное с функцией механизма эритропоэтина при снижении оксигенации тканей
а) Оксигенация тканей является наиболее важным регулятором продукции красных клеток крови. Любое состояние, ведущее к уменьшению доставки кислорода тканям, обычно увеличивает скорость образования эритроцитов. Следовательно, если в результате кровотечения или любого другого состояния у человека развивается анемия, костный мозг немедленно усиливает продукцию красных клеток крови. Кроме того, разрушение значительной части костного мозга по любой причине, особенно при рентгенотерапии, ведет к гиперплазии оставшегося костного мозга, что отражает попытку удовлетворить потребности организма в эритроцитах.
На очень больших высотах, где количество кислорода в воздухе сильно снижено, снабжение тканей кислородом становится недостаточным, и продукция красных клеток крови резко возрастает. В этом случае образование эритроцитов регулирует не их концентрация в крови, а несоответствие между доставкой кислорода тканям и потребностями тканей в кислороде.
Скорость продукции красных клеток крови возрастает также при различных болезнях системы кровообращения, сопровождаемых снижением кровотока через периферические сосуды, особенно на фоне недостаточности поглощения кислорода при прохождении крови через легкие. Так, тканевая гипоксия, характерная для хронической сердечной недостаточности и многих легочных заболеваний, стимулирует продукцию красных клеток крови, что ведет к увеличению гематокрита и, как правило, общего объема крови.
б) Эритропоэтин стимулирует продукцию красных клеток крови, а его образование возрастает в ответ на гипоксию. Главным стимулом для продукции эритроцитов при состояниях с низким содержанием кислорода является циркулирующий в крови гормон эритропоэтин — гликопротеин с молекулярной массой около 34000. При отсутствии эритропоэтина гипоксия практически не стимулирует продукцию эритроцитов. Но когда система эритропоэтина функционирует, гипоксия вызывает заметное увеличение секреции эритропоэтина, а он, в свою очередь, усиливает образование красных клеток крови до тех пор, пока гипоксия не исчезнет.
в) Роль почек в формировании эритропоэтина. У здорового человека примерно 90% всего эритропоэтина синтезируется в почках; остальная часть образуется в основном в печени. Пока точно не известно, где именно в почках синтезируется эритропоэтин. Одним из возможных мест секреции эритропоэтина являются эпителиальные клетки почечных канальцев, поскольку анемичная кровь околоканальцевых капилляров не способна удовлетворить их высокую потребность в кислороде, что стимулирует продукцию эритропоэтина.
Иногда секрецию эритропоэтина почками стимулирует гипоксия не в почках, а в других частях тела, что позволяет предположить возможное существование некоего внепочечного сенсора, который посылает к почкам дополнительный сигнал, стимулирующий продукцию этого гормона. В частности, норадреналин, адреналин и некоторые из простагландинов стимулируют продукцию эритропоэтина.
Когда у человека удаляют обе почки или если они разрушены болезнью, у человека неминуемо развивается тяжелая анемия, поскольку эритропоэтин, синтезируемый другими тканями (в основном печенью), составляет лишь 10% нормы и может обеспечить формирование не более половины красных клеток крови, необходимых организму.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Стадии дифференцировки эритроцитов. Влияние эритропоэтина на эритропоэз
1 ГБОУ ВПО «Саратовский Государственный медицинский университет им. В.И. Разумовского Минздрава России»
2. Нормальная физиология: учебник [Н.А. Агаджанян, Н.А. Барабаш, А.Ф. Белов и др.] / Под ред. проф. В.М. Смирнова. – 3-е изд. – М.: Издательский центр «Академия», 2010. – 480 с.
3. Физиология человека / В.Ф. Киричук, О.Н. Антипова, Н.Е. Бабиченко, В.М. Головченко, Е.В. Понукалина, И.В. Смышлеева, Л.К. Токаева / Под ред В.Ф. Киричука. 2-е изд. – Саратов: Изд-во Саратовского медицинского университета, 2009. – 343 с.
4. Физиология и патофизиология красной крови: учеб. пособие / Н.П. Чеснокова, В.В. Моррисон, Е.В. Понукалина, Т.А.Невважай; под общ. ред. проф. Н.П. Чесноковой. – Саратов: Изд-во Сарат. мед. ун-та, 2013. – 80 с.
5. Патофизиология крови. Пер. с англ. – М. – СПб.: «Издательство БИНОМ» – «Невский Диалект», 2000. – 448 с., ил.
6. Механизмы развития болезней и синдромов / А.Ш. Зайчик, Л.П. Чурилов. Книга 1-я: учебник для студентов медицинских вузов. – СПб., 2007, ЭЛБИ. – 507 с.
7. Гематологический атлас. С.. Луговская, М.Е. Почтар. 3-е изд. – Москва – Тверь: ООО «Изд-во Триада», 2011. – С. 3–23.
8. Клеточные и молекулярные механизмы регуляции системы гемостаза в норме и патологии: монография / Б.И. Кузник. – Чита: Экспресс-издательство, 2010. – С. 261–368.
9. Гематология / Под ред проф. О.А. Рукавицына, А.Д. Павлова, Е.Ф. Морщаковой и др. – Изд–во СПб.: ООО «Д.П.», 2007. – С. 29–34.
Эритропоэз и механизмы его регуляции
В эмбриональном периоде кроветворение осуществляется вначале в кровяных островках желточного мешка, затем примерно спустя 5 недель эмбрионального развития – в печени. Селезенка включается в процесс кроветворения с 16 недели внутриутробного развития. Первые гемопоэтические элементы появляются в костном мозге на 2-ом месяце эмбрионального развития, однако миелоидный период кроветворения начинается на 4-5-м месяцах эмбрионального развития, вытесняя постепенно кроветворение в печени и селезенке. Костномозговой эритропоэз осуществляется вне синусов, в строме костного мозга, то есть эктраваскуляторно. К моменту рождения ребенка костный мозг развивается полностью, а экстрамедуллярное кроветворение практически завершается. Постэмбриональный период кроветворения начинается после рождения ребенка и продолжается на протяжении всей жизни. Гемопоэз осуществляется в специализированных гемопоэтических тканях: миелоидной (эпифизы трубчатых костей и полости многих губчатых костей) и лимфоидной (тимус, селезенка, лимфатические узлы). В миелоидной ткани образуются эритроциты, лейкоциты, тромбоциты. В лимфоидной ткани идет дальнейшая дифференцировка и созревание лимфоцитов, а также плазматических клеток – основных продуцентов антител.
Постэмбриональный гемопоэз обеспечивает процессы физиологической регенерации крови, то есть её обновление, что компенсирует физиологические процессы разрушения дифференцированных клеток крови.
В условиях нормы функциональная активность органов кроветворения и кроверазрушения строго сбалансирована, что обеспечивает относительное постоянство содержания эритроцитов и других клеток в периферической крови. Разрушение эритроцитов происходит примерно после 120-дневного пребывания их в системной циркуляции при участии тканевых макрофагов селезенки, лимфатических узлов, печени. Гемоглобин, освобождающийся в процессе распада эритроцитов, трансформируется в билирубин в клетках моноцитарно-макрофагальной системы, а затем в гембилирубин (непрямой билирубин), вступая во взаимодействие с белками крови или липопротеидами. Гембилирубин в свою очередь элиминируется из системного кровотока печеночными клетками, где превращается в прямой билирубин (соединение билирубина с глюкуроновой кислотой). Прямой билирубин вместе с желчью поступает в кишечник, постепенно превращается в другие желчные пигменты (стеркобилиноген, уробилиноген) которые, выделяясь с калом и мочой, придают им окраску. При внутриклеточном разрушении эритроцитов основным продуктом, образующимся после распада гемоглобина, является билирубин, а при внутрисосудистом гемолизе большие количества гемоглобина соединяются с α2-гликопротеином-гаптоглобином, который не проникает в мочу.
Основным регулятором эритропоэза является эритропоэтин – гликопротеид, интенсивно вырабатывающийся в условиях гипоксии. При гипоксических состояниях различного генеза концентрация эритропоэтина возрастает в десятки раз по сравнению с нормой. Основным источником синтеза эритропоэтина являются почки (до 90 %), печень (около 10 %), а также макрофаги костного мозга и селезенки. Для эритропоэтина характерен мембранный тип рецепции эритропоэтинчувствительными клетками костного мозга с последующими активацией митоза и дифференцировки клеток, в частности, стимуляцией транспорта железа в эритрокариоцитах, синтеза цепей глобина, ферментов образования гема, синтеза мембранных белков и эритроцитарных антигенов.
Эритропоэз стимулируется под влиянием катехоламинов, глюкокортикоидов, андрогенов, гормонов щитовидной железы, инсулина, плацентарного пролактина, ИЛ-3, ИЛ-6, ИЛ-9, ИЛ-11, КСФ, фолиевой кислоты, витаминов С, В12, железосодержащих препаратов.
Эритропоэз угнетается при повышенной оксигенации тканей, когда снижается образование эритропоэтина, а также под влиянием эстрогенов, глюкагона, ацетилхолина, интерферонов, ФНО-а, ИЛ-1, ИЛ-5, эритроцитарных кейлонов.
После рождения у ребенка в течение нескольких дней отмечают эритроцитоз – содержание эритроцитов составляет 5,5⋅1012/л, в то же время имеется высокое содержание гемоглобина (156-200 г/л). В течение первого года жизни изменяется антигенная структура эритроцитов, возникает прогрессирующее снижение фетального гемоглобина. К концу первого года жизни содержание фетального гемоглобина не превышает 1 %.
Общая характеристика эритроцитов
Эритроциты – самая многочисленная популяция клеток крови, обладающих разнообразными функциями, в частности дыхательной, трофической, детоксицирующей. Количество эритроцитов довольно вариабельно в условиях нормы: так, у женщин оно колеблется от 3,7⋅1012/л до 4,7⋅1012 /л, а у мужчин – от 4,5⋅1012/л до 5,5⋅1012 /л. Сдвиг этих показателей до нижней или верхней границы нормы может быть одним из признаков болезни.
Около 85 % всех эритроцитов имеют форму двояковогнутого диска, то есть являются дискоцитами. Форма эритроцита определяет цепь ауторегулирующих процессов, направленных на поддержание движения крови, её реологических свойств. В условиях патологии появляются эритроциты различной формы, такие состояния именуют пойкилоцитозом. Среди аномальных по форме эритроцитов различают овалоциты, аннулоциты, сфероциты, акантоциты, стоматоциты, щизоциты и другие формы, имеющие в ряде случаев определённое диагностическое значение.
Обычная в условиях нормы форма дискоцита значительно увеличивает площадь диффузии газов, электролитов и других субстратов. Средний диаметр эритроцита (нормоцита) в области краёв составляет 7,5 мкм, а максимальная толщина эритроцита в области краёв составляет 2 мкм. Эритроциты с диаметром от 2 до 6 мкм – микроциты, а с диаметром от 9 до 16 мкм – макроциты. Количество макро- и микроцитов в крови здорового человека в среднем составляет 15–20 %. Резкое увеличение содержания в крови микро- и макроцитов, именуемое анизоцитозом, является одним из признаков нарушения гемопоэза, характерным для анемий, лейкоцитозов, заболеваний инфекционно-аллергической природы. За время свой жизни в периферической крови эритроцит совершает кругооборот более 1 млн. раз, что вызывает развитие механических и метаболических изменений в эритроцитах. Эритроциты обладают пластичностью, то есть способностью к деформации при прохождении через узкие извитые капилляры диаметром 2,5–7,5 мкм. По мере старения их способность к деформации снижается, они застревают в капиллярах красной пульпы селезенки и там разрушаются в процессе фагоцитоза тканевыми макрофагами. Эластичность эритроцитов определяется особенностями структуры белка спектрина, гемоглобина, а также соотношением различных фракций липидов в мембране клеток.
Эритроциты играют важную роль в регуляции кислотно-основного состояния организма, в процессах свертывания крови и фибринолиза за счет адсорбции на их мембране разнообразных ферментных факторов этих систем. Эритроциты являются регуляторами водно-солевого обмена в связи со способностью депонировать воду и минеральные соли при нахождении их в венозной крови. Одной из главных функций эритроцитов является участие в иммунологических реакциях организма за счет наличия в мембранах эритроцитов комплекса полисахаридо-аминокислотных соединений, обладающих свойствами антигенов. Следует помнить, что суммарный объем эритроцитов приблизительно в 160 раз превышает таковой лейкоцитов и тромбоцитов, а потому кровь можно рассматривать как двухфазную систему, представляющую собой взвесь (суспензию) эритроцитов в плазме. При этом эритроцит подвергается в токе крови действию напряжения сдвига – оно более значительно у края и направлено в сторону стенки и менее выражено в центре сосуда. Разница действующих векторов силы у разных краёв обеспечивает вращательное движение эритроцитов в текущей жидкости, что при столкновении с тромбоцитами, имеющими меньший размер и худшую деформируемость по сравнению с эритроцитами, приводит к отбрасыванию кровяных пластинок к стенке сосуда. Благодаря этому пристеночный слой оказывается обогащенным тромбоцитами. Указанный эффект обусловлен величиной гематокрита, размером эритроцитов и тромбоцитов и ригидностью их мембран. Увеличение любого из указанных параметров сопровождается усилением передвижения кровяных пластинок к стенке сосуда, а при наличии повреждения эндотелия – адгезией к субэндотелию.
Буферные свойства эритроцитов. Как известно, на единицу объема эритроцит связывает в 60 раз большее количество О2, чем плазма крови. О2 хорошо растворим в воде, поэтому диффузия его в растворе происходит очень быстро. Связывание О2 с эритроцитами определяется парциальным давлением газа в плазме и сорбционными свойствами Нв. В капиллярах легких, где давление О2 высоко (рО2 = 133 гПа), высоко и сродство Нв к О2, что обеспечивает трансмембранный перенос газа и связывание его с гемоглобином. В капиллярах тканей, где рО2 равно 40-50 гПа, сродство Нв к О2 резко снижается. При этом происходит выход кислорода из эритроцитов.
Транспорт СО2 через мембрану эритроцита также осуществляется за счет диффузного давления (в капиллярах легких рСО2 = 53гПа, а в капиллярах тканей – 61 гПа). Диффузия СО2 в растворах происходит примерно в 20 раз быстрее, чем О2.
Высокая скорость равновесия содержания СО2 в системе эритроцит – плазма крови обеспечивается наличием в эритроцитах особого фермента – карбоангидразы, катализирующего реакции трансформации СО2 и Н2О в углекислоту (Н2СО3), а также мощными системами трансмембранного обмена анионами.
При понижении концентрации СО2 в эритроцитах возникает отрицательный заряд Нв, что приводит к уменьшению содержания внутриклеточной воды, а при увеличении содержания СО2 в эритроцитах – они набухают.
Известно, что осмотическое давление в эритроцитах несколько выше, чем в плазме крови, что связанно с высокой внутриклеточной концентрацией белков по сравнению с плазмой крови. При этом содержание низкомолекулярных осмотически активных веществ (ионов натрия) в эритроцитах значительно меньше, чем в плазме крови. Величина осмотического давления в эритроцитах обеспечивает достаточный или нормальный тургор этих клеток. Осмотическое давление плазмы и эритроцитов в условиях нормы находится в динамическом равновесии, что обуславливает стабильность структуры эритроцитов.
При помещении эритроцитов в коллоидно-осмотическую среду с более низким осмотическим давлением (гипотонические растворы) может наступить осмотический или коллоидно-осмотический гемолиз. Последний обусловлен тем, что вода поступает в эритроциты до того момента, пока не разрывается мембрана и гемоглобин выходит в окружающую среду.
В умеренногипотонической среде эритроциты приобретают сферическую форму, их называют в связи с этим сфероцитами. Способность эритроцитов сохранять свою структуру при развитии гипоосмотических состояний или в гипоосмотической среде получила название осмотической устойчивости, или резистентности эритроцитов. Верхняя граница резистентности или максимальная устойчивость эритроцитов соответствует примерно 0,5–0,4 % раствора хлорида натрия.
При помещении эритроцитов в гипертоническую среду происходит их сморщивание в связи с потерей воды и уменьшением объема.
Эритроцитам свойственна способность к оседанию. Удельная масса цельной крови в норме для взрослого составляет в среднем 1,05–1,06. Удельная масса эритроцитов (1,085–1,096) выше, чем плазмы крови (1,02–1,027), поэтому эритроциты в пробирке с кровью, лишенной возможности свертываться, способны медленно оседать на дно. Скорость оседания эритроцитов в значительной мере определяется белковым составом плазмы крови, в частности уровнем мелкодисперсных белков-альбуминов. В связи с этим важная роль в обеспечении величины СОЭ отводится соотношению альбуминово-глобулиновых фракций белков крови. СОЭ у мужчин в среднем составляет 1–10 мм/ч, у небеременных женщин 2-15 мм/ч. При некоторых патологических процессах и заболеваниях, а также во второй половине беременности СОЭ повышается, так как увеличивается содержание в крови грубодисперсных белков глобулиновой фракции, получивших название аггломеринов, а также за счет усиления образования фибриногена.
При замедлении скорости кровотока и повышении вязкости крови эритроциты проявляют способность к агрегации. Вначале агрегация носит обратимый характер, при этом образуются ложные агрегаты, или монетные столбики. В случае быстрого восстановления кровотока они распадаются на полноценные клетки с сохраненной мембраной и внутриклеточной структурой.
Пластичность или деформируемость – это способность эритроцитов к обратимой деформации при прохождении через узкие извитые капилляры, микропоры. Данное свойство определяется особенностями структуры мембраны эритроциты, наличием в ней особого белка спектрина.
Таким образом, основными физиологическими и физико-химическими свойствами эритроцитов являются следующие:
– способность к оседанию;
– способность к агрегации;
– деструкция после определенного периода циркуляции в кровотоке.
1. Дыхательная функция заключается в захвате и переносе кислорода к тканям и экскреции СО2 из организма. Это обеспечивается содержащимся в эритроцитах белком гемоглобином. Гемоглобин – сложный белок состоит из групп гема и белкового остатка – глобина. Содержание гемоглобина у мужчин составляет 130-160 г/л, у женщин 120-140 г/л.
2. Трофическая функция эритроцитов связана с их способностью транспортировать аминокислоты, нуклеотиды, пептиды к различным органам и тканям, способствуя обеспечению репаративных процессов. В ряде случаев эту функцию называют транспортной.
3. Детоксиксицирующая функция эритроцитов обусловлена их способностью адсорбировать токсические продукты эндогенного или экзогенного происхождения и частично инактивировать их.
4. Участие в процессах свертывания крови за счет адсорбции на их мембране плазменных факторов свертывания крови
5. Участие в регуляции кислотно-основного состояния организма (буферная функция) за счет гемоглобина обеспечивающего до 70 % буферной ёмкости крови.
6.– Ферментативная функция связана с наличием в эритроцитах большого количества ферментов, в частности карбоангидразы, метгемоглобинредуктазы, ферментов гликолиза.
Эритропоэз и механизмы регуляции уровня железа плазмы крови
Авторы: В.И. Филимонов, Запорожский государственный медицинский университет
Версия для печати
Одной из проблем современной гематологии являются железодефицитные анемии, так как многие из них до сих пор плохо поддаются лечению. Нам представляется, что это вызвано неясностью некоторых механизмов их патогенеза, обусловленной недостаточной глубиной изученности процессов регуляции гомеостаза железа, его хранения в депо и доставки к костному мозгу — основному месту использования железа для синтеза гемоглобина.
Из 4–5 г железа, которое находится в организме, 20 % составля ет резервное железо, а остальное — функционально активное. Из этого количества в состав гемоглобина эритроцитов входит 62–70 %, 5–10 % содержится в скелетных мышцах (в миоглобине). Остальное железо находится в тканях, где оно принимает участие во многих метаболических процессах: в составе металлосодержащих энзимов обеспечивает митохондриальный транспорт электронов, синтез ДНК и деление клеток, метаболизм катехоламинов, детоксикационные механизмы, в обеспечении которых принимает участие, в частности, цитохром Р 450 , содержащий железо.
В обычных условиях для эритропоэза ежесуточно необходимо 20–25 мг железа. Практически все это железо костный мозг получает за счет его повторного использования. Основным местом резервного железа является ретикулоэндотелиальная система (РЭС) печени, откуда Fe поступает в эритробласты костного мозга с белком плазмы крови трансферрином (гликопротеином MB 76000), мигрирующим при электрофорезе белков плазмы вместе с b -глобулином. Поступившее в эритробласт железо используется для синтеза гема и депонируется в эритробласт в виде резерва. В макрофагах печени и костного мозга резервное железо депонируется в молекуле ферритина, в состав которой входит белок апоферритина, образующий подобие скорлупы, в центре которой аккумулируется железо. Молекулы ферритина, в свою очередь, образуют внутри лизосом большие аморфные нерастворимые агрегаты — гемосидерин. Таким образом, ферритин и гемосидерин — это формы резервного железа в клетках. При освобождении железа из клеточного резерва оно переводится в двухвалентное состояние (благодаря энзиму ксантиноксидазе, аскорбиновой кислоте и др.), соединяется с трансферрином и транспортируется через плазму крови к эритробластам костного мозга [1].
В настоящее время основным регулятором уровня железа в плазме крови большинство исследователей считает гепсидин (hepcidin). Гепсидин — небольшой протеин (25 аминокислот), который синтезируется в печени и здесь же на уровне купферовских клеток регулирует выход железа в русло крови. Впервые он был описан в 2001 году как один из стимуляторов антимикробного иммунитета [2, 3]. Но вскоре было показано и его участие в гомеостазе железа [4, 5].
Обстоятельно описаны также и механизмы его действия как одного из основных регуляторов гомеостаза железа на уровне обеспечения всасывания в энтероцитах тонкого кишечника [11], а также резорбции из клеток РЭС [11]. При поражении печени содержание гепсидина в плазме крови снижается, что приводит к дефициту усвоения железа из кишечника [8, 9].
Гепсидин стимулирует синтез РНК, что в конечном итоге связывает ферропортин и тем самым уменьшает поступление ионов железа в общий кровоток [11]. Одним из регуляторов уровня самого гепсидина является метриптаза-2 — фермент, расщепляющий гепсидин [12].
В то же время еще совсем неясным остается механизм, с помощью которого осуществляется взаимодействие системы эритропоэза (а это основной «потребитель» железа) и гомеостаза его в организме [6]. Лишь постулируeтся наличие какого-то еще неизвестного фактора-посредника [5, 7, 10]. Предполагается, что таким фактором может быть эритропоэтин [13].
Позволю себе напомнить некоторые положения современной науки об эритропоэзе и его основном стимуляторе — эритропоэтине, основным местом синтеза которого являются перитубулярные клетки почки [14], а также гепатоциты, окружающие венозные синусы печени [15]. В настоящее время при использовании различных методов культур тканей костного мозга показано, что эритропоэз осуществляется в так называемых эритробластических островках [16]. Превращение общей родоначальной клетки в эритроидные предшественники происходит при тесном межклеточном взаимодействии структур костного мозга и специфических регуляторов, а их дальнейшее созревание в зрелый эритроцит происходит при обязательном участии макрофагов костного мозга.
Эритроидный островок представляет собой центральный макрофаг, окруженный, как короной, эритробластами, находящимися на различной стадии своего созревания. Эти макрофаги обеспечивают модуляцию эритроидных колоний, продуцируя разнообразные специфические регуляторы активности влияния основного стимулятора пролиферации и созревания эритробластов — эритропоэтина [18]. Они же могут синтезировать некоторое количество эритропоэтина. В эритробластических островках развитие нормобластов заканчивается их денуклеацией (выталкиванием ядра) и превращением в ретикулоциты с последующим высвобождением этих клеток и поступлением их в синусоиды костного мозга. Ретикулоцит — это юный эритроцит, содержащий иРНК, благодаря которой еще в течение почти двух суток продолжается синтез гемоглобина: в первые сутки ретикулоцит находится в костном мозге, а во вторые — уже в русле крови. По их концентрации в периферической крови судят об интенсивности эритропоэза.
Главным стимулом продукции эритропоэтина является тканевая гипоксия, что подтверждается быстрым накоплением иРНК эритропоэтина после возникновения дефицита кислорода, к которому высоко чувствительны соответствующие клетки почек. Поэтому секреция эритропоэтина зависит от содержания кислорода в альвеолярном воздухе, функции легких (вентиляция, диффузия и перфузия), сердечного выброса, общей кислородной емкости крови, уровня гемоглобина, его способности связывать и отдавать кислород и определяется количеством кислорода в крови и потребностью тканей в нем [19, 20]. Между уровнями гемоглобина или гематокрита и плазменного эритропоэтина существует обратная линейная корреляция [20, 21]. Следовательно, уровень эритропоэтина в плазме может служить маркером тканевой оксигенации. По мнению некоторых исследователей, печень и почки выделяют неактивный эритропоэтин, так называемый эритроген, который в плазме крови под влиянием специфического фермента эритрогенина превращается в эритропоэтин. Эритропоэтин обладает рядом уникальных свойств [22–24]. Он не имеет сходства с каким-либо другим плазменным белком, а в плазме крови циркулирует только одна его форма. Плазменный клиренс эритропоэтина не зависит от его концентрации в плазме и от клеточности костного мозга. Исследователи не обнаружили преформированных мест его депонирования. Эритропоэтин оказывает влияние на различные звенья эритропоэза, начиная с реактивных клеток, позволяя им дифференцироваться в узнаваемые под микроскопом предшественники эритроцитов, в которых начинается синтез гемоглобина. Особенно активно он влияет на созревание эритроидных клеток-предшественников и, увеличивая их резерв, стимулирует пролиферацию созревающих клеток.
Суть исследования
Целью эксперимента явилось выяснение того факта, почему в норме при активации эритропоэза в плазме крови повышается концентрация железа; то есть является ли это ответом на уровень эритропоэтина плазмы, содержание в крови которого увеличивается, или нет. Указание на эритропоэтин как на стимулятор уровня железа в плазме крови возникает по аналогии с другими гормональными регуляторами. К примеру, гомеостаз йода, его всасывание стимулируется ТТГ, а концентрация кальция крови регулируется кальцитонином, паратгормоном и витамином D 3 .
Для этого нами использован многоступенчатый эксперимент. Сначала животных (крысы линии Вистар) на 18 часов помещали в барокамеру при пониженном содержании кислорода (аналог высоты 4000 м над уровнем моря). Это широко используемая модель стимуляции образования эритропоэтина. После этого крыс забивали кровопотерей, а сыворотку крови (по 2 мл) вводили реципиентам (№ 1). Спустя сутки, когда из их крови эритропоэтин уже исчезал [7], у этих животных также забирали кровь, а сыворотку вводили (по 2 мл) следующим реципиентам (№ 2). Спустя сутки кровь данных реципиентов исследовалась на содержание железа. В каждой серии также исследовалась концентрация железа у контрольных крыс (им вводился физиологический раствор).
Уровень железа и его производных в плазме крови исследовалися с помощью стандартного набора BIOTEST Fe70. Конечное определение экстинкции производилось на спектрофотометре на базе ЦНИЛа университета. Концентрация ретикулоцитов в крови определялась окраской мазков 1% спиртовым раствором бриллиант крезилблау.
Результаты и их обсуждение
Приведенная выше схема эксперимента позволила нам использовать два типа сыворотки: реципиентам № 1 вводилась сыворотка, содержащая эритропоэтин, а у реципиентов № 2 в сыворотке он уже отсутствовал, поскольку известно, что Т 1/2 вводимого с сывороткой эритропоэтин составляет всего 1,5 часа [7].
Полученные результаты исследований приведены в табл. 1. Прежде всего необходимо обратить внимание на то, что концентрация ретикулоцитов в крови животных отражает вышесказанное о наличии или отсутствии эритропоэтина во вводимой реципиентам сыворотке. У реципиентов № 1, так же как у животных после пребывания в гипоксической барокамере, как и должно быть под влиянием эритропоэтина, содержание ретикулоцитов возрастало. В отличие от этого у реципиентов № 2 оно оставалось без изменения, что свидетельствует об отсутствии у них повышенного уровня стимулятора.
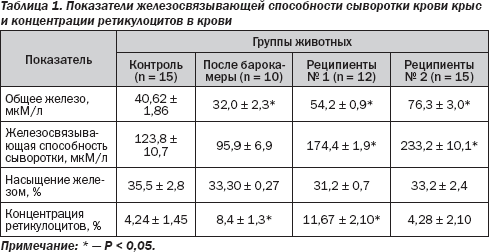
Как видно из приведенных данных, после пребывания в барокамере, которое приводит к стимуляции образования эритропоэтина и началу интенсификации кроветворения под его действием, уровень железа и железосвязывающая способность сыворотки крови достоверно понижались.
В отличие от этого введение сыворотки реципиентам № 1 приводит к росту уровня транспортного железа в их крови. Но наиболее важно то, что в еще большей степени возросли как уровень транспортируемого железа, так и железосвязывающая способность сыворотки крови у реципиентов № 2, причем отличие было достоверным даже по отношению к реципиентам № 1. Примечательно, что во всех группах животных процент насыщения железом транспортной системы плазмы был одинаковым.
Полученные результаты можно трактовать таким образом. Под воздействием стимулированного кроветворения у реципиентов № 1 увеличивается доставка железа к костному мозгу. Это обусловлено тем, что в их крови появляется какой-то фактор-посредник (его мы назвали фактором Fе), который информирует клетки-депо железа о необходимости выброса микроэлемента в кровь для обеспечения увеличенных потребностей костного мозга. Эффект этого посредника еще более четко проявляется у реципиентов № 2. Очень важно то, что он не является эритропоэтином, поскольку проявляет свой эффект и после исчезновения последнего.
Снижение показателей транспорта железа после пребывания в барокамере можно объяснить тем, что к моменту исследования данный фактор-посредник еще не образовался (или его еще очень мало), а активированное кроветворение уже забирает больше железа из плазмы крови.
Нельзя исключать того, что выявленный нами фактор является тем посредником, который информирует систему гепсидина об интенсивности кроветворения. Весьма важно то, что он не является эритропоэтином, вопреки мнению D.R. Asby et al. [ 13 ] . Косвенным подтверждением нашей точки зрения являются и результаты лечения недоношенных новорожденных с низким содержанием гемоглобина в эритроцитах, получавших эритропоэтин. При этом отмечена тенденция к снижению содержания сывороточного железа, ферритина, трансферрина даже при одновременном введении эритропоэтина и препаратов железа (от 2 до 6 мг/кг/сутки) и витамина Е (5– 15 мг/день) [25, 26]. Большинство исследователей отрицают преимущества повышенных лечебных доз железа для повышения эффективности терапии эритропоэтином и при других железодифицитных состояниях [27–29]. То есть можно предположить, что здесь имеет место недостаток образования фактора (фактора Fе), существование которого постулируется нами.
Выводы
1. При стимулированном эритропоэзе в плазме крови растет уровень железа и повышаются показатели железотранспортных систем плазмы крови.
2. Мобилизация железа из депо происходит под воздействием какого-то фактора, который мы обозначили рабочим названием «фактор Fe».
3. Фактор Fе не является стимулятором кроветворения эритропоэтином.
1. Руководство по гематологии / Под ред. А.И. Воробьева. — Т. 2. — М.: Медицина, 1985. — 366 с.
2. Krause А., Neitz S., Magert H.J., Sc hulz А., Forssmann WG., Schulz-Knappe P., Adermann К. LEAP-1, а novel highly disulfide-bonded human peptide, exhibits antimicrobial activity // FEBS Lett. — 2001. — 480. — 147-150.
3. Parc C.H., Valore E.V., Waring A.J., Ganz T. Hepcidin, а urinary antimicrobial peptide sinthsized in liver // J. Biol. Chem. — 2001. — 276. — 7806-7810.
4. Andrews N.C. Anemia of inflammation: the cytokine-hepcidin link // J. Clin. Invest. — 2004. — 113. — 1251-1253.
5. Peyssonnaux C., Zinkernagel A.S., Schuepbach R.A. Regulation of iron homeostasis by the hypoxia-inducible transcripcion factors (HIFs) // J. Clin. Invest. — 2007 Jul. — 117(7). — 1926-1932.
6. Wrighting D.M., Andrews N.C. Iron homeostasis and erythropoiesis // Curr. Top. Dev. Biol. — 2008. — 82. — 141-167.
7. Wieczorek L., Hirth P., Schope K.B. Molecular biology of Eryth ropoietin // Prod. Develop. Pharmac. — 1991. — Vol. 2. — Р. 13-16.
8. Toledano M., Kozer E., Goldstein L.H., Abu-Kishk I., Bar-Haim A., Siman-Tov Y., Rechavi M., Rechavi G., Weizer-Stern O., Berkovitch M. Hepcidin in acute iron tox icity // Am. J. Emerg. Med. — 2009. — 27(7). — 761-4.
10. Beguin Y. Soluble transferrin receptor for the evaluation of erythropoiesis and iron status // Clin. Chim. Acta. — 2003. — 329(1–2). — 9-22.
11. Ramey G. et al. Heptidin targets ferroportin for degradation in hepatocytes // Hematologica. — 2009 Sep. — 22. — 235-242.
12. Knutson M.D. Into the matrix: regulation of the iron regulatory hormone heptidin by metriptase-2 // Nutr. Rev. — 2009. —67(5). — 284-288.
13. Ashdy D.R. et al. Plasma heptidin levels are elevated but responsive to erythropoietin therapy in renal dis ease // Kidney Int. — 2009. — 75(9). — 976-81.
14. Lacombe C., Da Silva J.-L., Bruneval P. et al. Peritubular cells are the site of erythropoietin synthesis in the murine hypoxic kidney // J. Clin.Invers. — 1988. — Vol. 81. — P. 620-623.
15. Koury S.T., Bondarant M.C., Koury H.J. Localization of cells producing erythropoietin in murine liver by in situu hybridization // Blood. — 1991. — Vol. 77, № 11. — P. 2497-2506.
16. Bessis M. Ultrastructural aspects of erythropoiesis // International Conf. on Hematopoiesis. — Capri, 1971. — P. 7-20.
17. Захаров Ю.М., Тишевская Н.В. О взаимосвязи функциональной активности центральных макрофагов с кинетикой эритропоэза в эритробластических островках // Вопросы экспериментальной физиологии. — M.; Екатеринбург, 1997. — 95-103.
18. Захаров Ю.М., Рассохин А.Г. Эритробластический островок. — М.: Медицина, 2002. — 280 с.
19. Juul S.E. Erythropoietin in the neonate // Curr. Probl. Pediatr. — 1999. — Vol. 5. — P. 129-149.
20. Морщакова Е.Ф. Анемия недоношенных и эритропоэтин // Педиатрия. — 1997. — № 4. — С. 49-54.
21. Павлов А.Д., Морщакова Е.Ф., Румянцев А.Г. Эритропоэтин: биологические свойства и при менение в клинической практике. — М.: Гэотар Медицина, 2001.
22. Chen J. Anemia of premature // Amer. J. Perinatol. — 1995. — Vol. 5. — P. 314-318.
23. Ермоленко В.М., Николаев А.Ю. Эритропоэтин: биологические свойства и применение в клинической практике // Терапевтический архив. — 1991. — № 6. — С. 81-86.
24. Koenig J.M., Christensen R.D. Effect of erythropoietin on granulocytopoieiesis: in vitro and vivo studies in weanling rats // Pediatr. Res. — 1990. — Vol. 27. — P. 583-587.
25. Ohls R.K. The use of erythropoietin in neonates // Clin. Perinatol. — 2000. — Vol. 3. — P. 681-696.
26. Spencer M.K., Khong T.Y., Matthews B.L. et al. Haematopoietic indicators of fetal metabolic acidosis // Aust. NZJ Obstet. Gynaecol. — 2000. — Vol. 40. — P. 286-289.
27. Bader D., Kugelman A., Maor-Rogin N. et al. The role of high-dose oral iron supplementation during erythropoietin therapy for anemia of prematurity // J. Perinatol. — 2001. — Vol. 21. — P. 215-220.
28. Picaud J.C., Putet G., Salle B.L., Claris A.D. Iron supplementation in preterm infants treated with erythropoietin // Arch. Pediatr. — 1999. — Vol. 6. — P. 657-664.
29. Dani C., Reali M.F., Bertini G. et al. The role of blood transfusions and iron intake on retinopathy of pre maturity // Early Hum. Dev. — 2001. — Vol. 62. — P. 57-63.
Гемоцитопоэз и его регуляция
Гемопоэз — процесс образования форменных элементов крови: эритроцитов (эритропоэз), лейкоцитов (лейкопоэз) и тромбоцитов (тромбоцитопоэз).
У взрослых животных он совершается в красном костном мозге, где образуются эритроциты, все зернистые лейкоциты, моноциты, тромбоциты, В-лимфоциты и предшественники Т-лимфоцитов. В тимусе проходит дифференцировка Т-лимфоцитов, в селезенке и лимфатических узлах — дифференцировка В-лимфоцитов и размножение Т-лимфоцитов.
Общей родоначальной клеткой всех клеток крови является полипотентная стволовая клетка крови, которая способна к дифференцировке и может дать начало роста любым форменным элементам крови и способна к длительному самоподдержанию. Каждая стволовая кроветворная клетка при своем делении превращается в две дочерние клетки, одна из которых включается в процесс пролиферации, а вторая идет на продолжение класса полипотентных клеток. Дифференцировка стволовой кроветворной клетки происходит под влиянием гуморальных факторов. В результате развития и дифференцировки разные клетки приобретают морфологические и функциональные особенности.
Эритропоэз проходит в миелоидной ткани костного мозга. Средняя продолжительность жизни эритроцитов составляет 100-120 сут. В сутки образуется до 2 * 10 11 клеток.
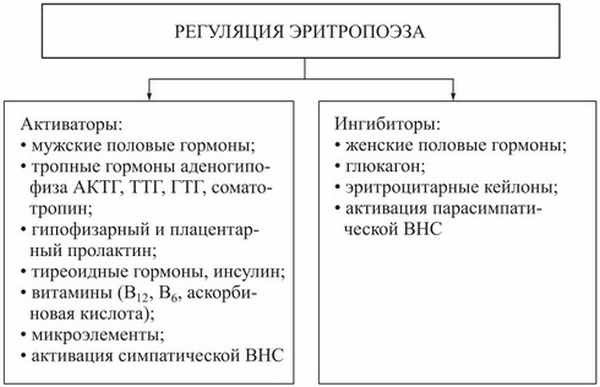
Рис. Регуляция эритропоэза
Регуляция эритропоэза осуществляется эритропоэтинами, образующимися в почках. Эритропоэз стимулируется мужскими половыми гормонами, тироксином и катехоламинами. Для образования эритроцитов нужны витамин В12 и фолиевая кислота, а также внутренний фактор кроветворения, который образуется в слизистой оболочке желудка, железо, медь, кобальт, витамины. В нормальных условиях продуцируется небольшое количество эритропоэтина, который достигает клеток красного мозга и взаимодействует с рецепторами эритропоэтина, в результате чего изменяется концентрация в клетке цАМФ, что повышает синтез гемоглобина. Стимуляция эритропоэза осуществляется также под влиянием таких неспецифических факторов, как АКТГ, глюкокортикоиды, катехоламины, андрогены, а также при активации симпатической нервной системы.
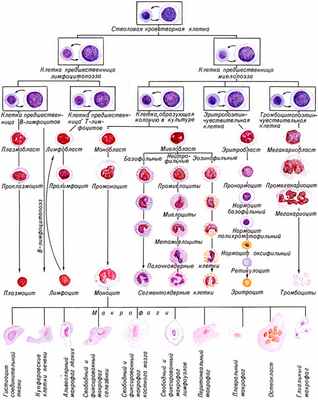
Разрушаются эритроциты путем внутриклеточного гемолиза мононуклеарами в селезенке и внутри сосудов.
Лейкопоэз происходит в красном костном мозге и лимфоидной ткани. Этот процесс стимулируется специфическими ростовыми факторами, или лейкопоэтинами, которые воздействуют на определенные предшественники. Важную роль в лейкопоэзе играют интерлейкины, которые усиливают рост базофилов и эозинофилов. Лейкопоэз также стимулируется продуктами распада лейкоцитов и тканей, микроорганизмами, токсинами.
Тромбоцитопоэз регулируется тромбоцитопоэтинами, образующимися в костном мозге, селезенке, печени, а также интерлейкинами. Благодаря тромбоцитопоэтинам регулируется оптимальное соотношение между процессами разрушения и образования кровяных пластинок.
Гемоцитопоэз и его регуляция
Гемоцитопоэз (гемопоэз, кроветворение) — совокупность процессов преобразования стволовых гемопоэтических клеток в разные типы зрелых клеток крови (эритроцитов — эритропоэз, лейкоцитов — лейкопоэз и тромбоцитов — тромбоцитопоэз), обеспечивающих их естественную убыль в организме.
Современные представления о гемопоэзе, включающие пути дифференциации полипотентных стволовых гемопоэтических клеток, важнейшие цитокины и гормоны, регулирующие процессы самообновления, пролиферации и дифференциации полипотентных стволовых клеток в зрелые клетки крови представлены на рис. 1.
Полипотентные стволовые гемопоэтические клетки находятся в красном костном мозге и способны к самообновлению. Они могут также циркулировать в крови вне органов кроветворения. ПСГК костного мозга при обычной дифференциации дают начало всем типам зрелых клеток крови — эритроцитам, тромбоцитам, базофилам, эозинофилам, нейтрофилам, моноцитам, В- и Т-лимфоцитам. Для поддержания клеточного состава крови на должном уровне в организме человека ежесуточно образуется в среднем 2,00 • 10 11 эритроцитов, 0,45 • 10 11 нейтрофилов, 0,01 • 10 11 моноцитов, 1,75 • 10 11 тромбоцитов. У здоровых людей эти показатели достаточно стабильны, хотя в условиях повышенной потребности (адаптация к высокогорью, острая кровопотеря, инфекция) процессы созревания костномозговых предшественников ускоряются. Высокая пролиферативная активность стволовых гемопоэтических клеток перекрывается физиологической гибелью (апоптозом) их избыточного потомства (в костном мозге, селезенке или других органах), а в случае необходимости и их самих.
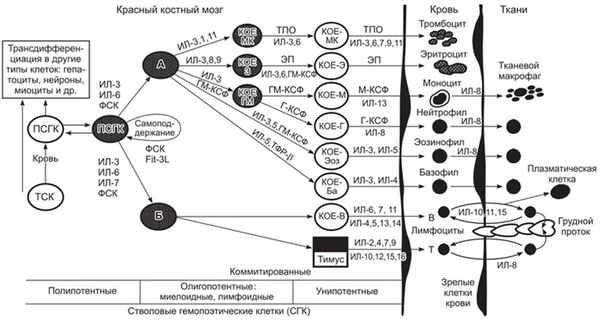
Рис. 1. Иерархическая модель гемоцитопоэза, включающая пути дифференциации (ПСГК) и важнейшие цитокины и гормоны, регулирующие процессы самообновления, пролиферации и дифференциации ПСГК в зрелые клетки крови: А — миелоидная стволовая клетка (КОЕ-ГЭММ), являющаяся предшественницей моноцитов, гранулоцитов, тромбоцитов и эротроцитов; Б — лимфоидная стволовая клетка-предшественница лимфоцитов
Подсчитано, что каждый день в организме человека теряется (2-5) • 10 11 клеток крови, которые замешаются на равное количество новых. Чтобы удовлетворить эту огромную постоянную потребность организма в новых клетках, гемоцитопоэз не прерывается в течение всей жизни. В среднем у человека за 70 лет жизни (при массе тела 70 кг) образуется: эритроцитов — 460 кг, гранулоцитов и моноцитов — 5400 кг, тромбоцитов — 40 кг, лимфоцитов — 275 кг. Поэтому кроветворные ткани рассматриваются как одни из наиболее митотически активных.
Гемоцитопоэз контролируется сложными механизмами, которые могут поддерживать его относительно постоянным, ускорять или тормозить, угнетая пролиферацию и дифферен- цировку клеток вплоть до инициирования апоптоза коммитированных клеток-предшественниц и даже отдельных ПСГК.
Регуляция гемопоэза — это изменение интенсивности гемопоэза в соответствии с меняющимися потребностями организма, осуществляемое посредством его ускорения или торможения.
Для полноценного гемоцитопоэза необходимо:
- поступление сигнальной информации (цитокинов, гормонов, нейромедиаторов) о состоянии клеточного состава крови и ее функций;
- обеспечение этого процесса достаточным количеством энергетических и пластических веществ, витаминов, минеральных макро- и микроэлементов, воды. Регуляция гемопоэза основана на том, что все типы взрослых клеток крови образуются из гемопоэтических стволовых клеток костного мозга, направление дифференцировки которых в различные типы клеток крови определяется действием на их рецепторы локальных и системных сигнальных молекул.
Роль внешней сигнальной информации для пролиферации и апоптоза СГК выполняют цитокины, гормоны, нейромедиаторы и факторы микроокружения. Среди них выделяют раннедействующие и позднедействующие, мультилинейные и монолинейные факторы. Одни из них стимулируют гемопоэз, другие — тормозят. Роль внутренних регуляторов плюрипотентности или дифференцировки СК играют транскрипционные факторы, действующие в ядрах клеток.
Читайте также:
- Вазодилататоры при хронической систолической сердечной недостаточности
- Лекарства при инфаркте миокарда
- Нистагмоскопия при огнестрельных ранениях. Травматические отиты и мастоидиты
- Укладка при рентгенограмме голеностопного сустава в боковой проекции (медиолатеральной)
- Гиперреактивность при воспалении.
