Стресс-реакция. Морфология стресса
Добавил пользователь Валентин П. Обновлено: 29.01.2026
Мы привыкли употреблять слово «стресс», интуитивно используя его для обозначения сильного нервно-психического напряжения. Однако такое значение не совсем верно.
Стресс — это общая реакция организма на воздействие различных факторов (например, удар, переохлаждение, инфекция, смерть близкого, потеря работы), нарушающих его равновесие. Главная функция стресса — это адаптация к изменившимся условиям среды.
Таким образом, эмоциональная реакция — это лишь часть общего ответа организма на стрессор.
Факторы, вызывающие стресс, могут быть абсолютно любыми - как негативными, так и позитивными (свадьба, переезд, новая работа). Имеет значение лишь то, что они приводят к изменениям в жизни человека на том или ином уровне. Для человека характерно наличие стрессоров психологического характера: стресс вызывается не самой ситуацией, а тем, как человек её субъективно оценивает, воспринимает. Или даже фантазией, воспоминанием о какой-то ситуации.
Механизм стресса
Выделяют три основных этапа в развитии стресса.
Стадия мобилизации. На данном этапе активируется реакция тревоги. Она мобилизует все адаптивные ресурсы организма, готовит его к срочным действиям. Усиливается энергообмен, увеличивается частота сердечных сокращений, поднимается кровяное давление, учащается дыхание, замедляется пищеварение, кровь приливает к мышцам. В чрезвычайных ситуациях, например, при пожаре, реакция тревоги может оказаться очень полезной.
Стадия сопротивления. Все системы организма возвращаются к нормальному режиму работы, и начинается разработка новых программ действий (приспособления, адаптации к новым обстоятельствам). У организма есть определённый резерв устойчивости к воздействию стрессора и адаптации.
Стадия истощения. В том случае, когда организм не смог адаптироваться к новым условиям среды, выработать новую программу действий, происходит истощение ресурсов. В этом случае человек (да и любой организм) может заболеть и даже умереть.
При развитии стресса в организме происходят гормональные преобразования, которые и регулируют работу всех систем организма и обуславливают активацию ресурсов сопротивления. Механизмы стресса задействуют, в частности, и подкорковые отделы головного мозга, которые также ответственны и за эмоции. Таким образом, во время стресса одно из самых типичных эмоциональных состояний — это тревога, беспокойство.
Проявляются реакции легко сопоставимые с симптомами, характерными почти для любого заболевания, такими, как чувство недомогания, разлитые болевые ощущения и чувство ломоты в суставах и мышцах, желудочно-кишечные расстройства с потерей аппетита и уменьшением веса тела.
Таким образом, сильный или хронический стресс является основой для возникновения психосоматических заболеваний
Польза от стресса
Воздействие несильных стрессоров отчасти полезно. Во-первых, несильный кратковременный стресс помогает активировать ресурсы, мобилизоваться для выполнения какой-то конкретной задачи (например, для сдачи экзамена). Во-вторых, с каждым стрессом у психики появляется несколько новых программ деятельности, т.е. человек расширяет и пополняет свой поведенческий «репертуар» новыми способами взаимодействия с окружающим миром, повышает уверенность в себе с каждым преодолённым препятствием. Насыщается природная потребность в обновлении эмоций. Важно, чтобы у организма хватило резервов для адаптации.
Помощь психолога при стрессе
Помощь психолога можно использовать в двух направлениях:
Если для Вас любая новая ситуация — это стресс. Вы часто испытываете состояние беспричинной тревоги, подавлены, раздражительны, угнетены в отсутствие объективных причин. Для Вас существует большое число факторов развития стресса именно психологического происхождения. Стресс вызван не объективными причинами, а Вашей субъективной оценкой происходящего, ожиданием наихудших последствий и т.д. Занятия с психологом в этом случае помогут изменить оценку происходящего и снизить количество стрессов психологического происхождения.
Нейтрализация последствий стресса. Занятия с психологом в этом направлении помогут, если Вы уже пережили сильное потрясение, энергетические запасы истощились, и Вы чувствуете потребность в восстановлении. Также важно проработать, осознать эмоциональные причины возникшего психосоматического заболевания для того, чтобы предотвратить его дальнейшее развитие.
Клинический психолог медицинского центра «Белая клиника» Нестеренко Т.И.
Согласие на обработку персональных данных
Три стадии стресса
Стресс — одно из нормальных состояний организма, поскольку связан с повышением адаптационных механизмов. Стресс является неотъемлемым проявлением жизни. Стрессовые реакции филогенетически помогали человеку справляться с трудностями, поэтому в этом аспекте стрессовые реакции полезны. Однако, когда стресс имеет яркое выражение и длительное проявление, в таком случае он причиняет вред здоровью человека.
Виды стресса
По типу воздействия стресс бывает системным и психическим. Системный стресс отражает ответную реакцию организма на травмы, воспаление, инфекции и проч. Психический стресс сначала вызывает изменения в психо-эмоциональной сфере, а затем проявляется на биологическом уровне.
Ганс Селье считается родоначальником теории биологического стресса. Модель общего адаптационного синдрома Ганса Селье представляет чёткое биологическое объяснение того, как организм реагирует и приспосабливается к стрессу.
В своих исследованиях Селье заметил, что организм приспосабливается к внешним стрессорам с точки зрения биологической модели, которая пытается восстановить и сохранить внутренний баланс. В своей попытке сохранить гомеостаз организм использует гормональную ответную реакцию, которая непосредственно осуществляет борьбу со стрессором. Борьба организма против стресса является главной темой общего адаптационного синдрома.
Еще одно наблюдение, которое обнаружил Селье, заключалось в том, что стрессовые реакции имеют свои пределы. Ограниченный запас энергии организма для адаптации к стрессовой среде истощается, когда организм постоянно подвергается воздействию стрессора.
Общий адаптационный синдром — это модель, которая состоит из трёх элементов или фаз, которые описывают реакцию организма на стресс:
1. Стадия тревоги
На стадии реакции тревоги, сигнал бедствия посылается в часть мозга, которая называется гипоталамус. Гипоталамус обеспечивает высвобождение гормонов, называемых глюкокортикоидами.
Глюкокортикоиды запускают выброс адреналина и кортизола. Адреналин дает человеку заряд энергии: сердечный ритм увеличивается, кровяное давление повышается, уровень сахара крови также повышается. Эти физиологические изменения регулируются частью вегетативной нервной системы человека, называемой симпатической ветвью.
Надпочечники начинают активно вырабатывать повышенное количество кортизола и находятся в состоянии гиперфункции. Это состояние можно подтвердить, используя паттерн изменений в гормональном профиле слюны, при котором будут следующие показатели: повышенный уровень кортизола/нормальный уровень DHEA.
2. Стадия сопротивления
Во время стадии сопротивления организм пытается противодействовать физиологическим изменениям, которые произошли во время стадии реакции тревоги. Стадия сопротивления регулируется частью вегетативной нервной системой, которая называется парасимпатической.
Парасимпатическая нервная система пытается вернуть тело в норму: уменьшается количество вырабатываемого кортизола, частота сердечных сокращений и артериальное давление начинают возвращаться к норме. Уровень сопротивляемости организма значительно выше обычного. На этой стадии осуществляется сбалансированное расходование адаптационных ресурсов.
Если стрессовая ситуация заканчивается, на этапе сопротивления тело возвращается в нормальное состояние. Однако, если стрессогенный фактор остаётся, организм остаётся настороже, чтобы бороться с его проявлениями.
Надпочечники адаптируются к этой стадии, уже используя механизм, называемый «захват прегненолона». Прегненолон является метаболитом холестерина и представляет собой исходное химическое вещество для производства как кортизола, так и половых гормонов, включая тестостерон. При изменении метаболизма прегненолона, уровень тестостерона, вырабатываемого в организме, снижается. При этой стадии, паттерн гормонального профиля в слюне будет представлен следующими показателями: повышенный уровень кортизола/низкий уровень DHEA.
3. Стадия истощения
На этом этапе стресс сохраняется в течение длительного периода. Организм начинает терять способность бороться со стрессором и уменьшать его вредное воздействие, поскольку истощается вся адаптивная способность. Стадия истощения может приводить к стрессовым перегрузкам и к проблемам со здоровьем, если они не будут решены немедленно.
В этой стадии надпочечники больше не способны адаптироваться к стрессу и исчерпали свои функциональные возможности. Сначала при исследовании гормонального профиля в слюне будут выявляться нормальный уровень кортизола/низкий уровень DHEA (или уровень кортизола, характерный для гиперфункции и сниженной функции будет сочетаться с нормальным уровнем DHEA). Когда надпочечники исчерпают свои возможности, будут определяться: низкий уровень кортизола/низкий уровень DHEA.
Если стресс продолжает воздействовать и далее, истощаются запасы кофакторов, которые необходимы для производства кортизола, вследствие чего организм разрывает механизм шунтирования прегненолона и вновь переключается на выработку DHEA. Такой паттерн будет представлен низким уровнем кортизола/нормальным уровнем DHEA.
4.3. Стресс (патогенетические и структурные основы)
Стресс - напряжение - неспецифическая реакция организма на любое предъявленное ему требование. Причины, вызывающие стресс, чрезвычайно многообразны. Это и действие низких температур, и быстрый бег, и кровопотеря, и боль, и сильные отрицательные и положительные эмоции и пр. Стресс, вызванный сверхсильными отрицательными факторами. называют дистресс, а положительными - эустресс. В результате увеличивается частота сердечных сокращений, повышается артериальное давление, увеличивается скорость свертывания крови и т.д. Впервые
описан в 1936 г. молодым канадским ученым Г.Селье как "синдром, вызываемый различными повреждающими вредоносными агентами". Будучи студентом-медиком, в 1925 г; вскрывая животных, подвергнутых самым различным воздействиям, он обнаружил один и тот же комплекс неспецифических изменений, объединенных в триаду:
1) гипертрофия надпочечников,
2) уменьшение веса лимфоидных органов,
3) кровоизлияния и эрозии слизистой оболочки желудка.
Последовавшие за этим открытием работы позволили Селье определять стресс как совокупность стереотипных, филогенетически запрограммированных неспецифических реакций организма, первично подготовляющих его к физической активности, т.е. сопротивлению, борьбе или бегству. Длительные наблюдения позволили установить, что главным и первичным в вышеназванной триаде является гипертрофия надпочечников. Каков механизм данной гипертрофии? Для того, чтобы его объяснить, необходимо рассмотреть все звенья стрессорных реакций. Они легко укладываются в обычную схему функционирования НЭС.
Следовательно, усиленное выделение глюкокортикоидов и других БАВ (катехоламины, адреналин) являются завершающим этапом этого напряжения. Стимуляция выделения глюкокортикоидов приводит к увеличению глюкозы в крови, легко мобилизуемого энергетического сырья и холестерина и повышению АД. Ответная реакция организма носит фазовый характер особенно при хроническом стрессе.
Различают 3 стадии:
А - стадия тревога.
Б - стадия резистентности (сопротивления).
В - стадия истощения (гибель организма).
Схема развития стресса по Селъе Г.
норм.уровень сопротивления
Глюкокортикоиды, вначале необходимые для адаптации во время реакции тревоги, не обеспечивают приспособления организма в стадии резистентности.
Для стадии тревоги характерно уменьшение размеров тимуса, селезенки, лимфатических узлов появление язв желудка, исчезновение липидов из надпочечника.
Для стадии резистентности характерно увеличение массы и размеров надпочечников, появление в них гранул липидов, усиленная секреция кортикостероидов.
Для стадии истощения - патологические изменения, альтерация клеток и тканей, приводящие к гибели.
Стресс оказывает значительное воздействие на функции иммунной системы. Цена стресса для организма, механизмов его резистентности может быть достаточно велика и выражаться в снижении механизмов резистентности к инфекциям и опухолям, "снятии запрета" на возникновение аллергических заболеваний. Наиболее уязвимы нормальные киллеры, которые являются первым эшелоном, осуществляющим защиту от чужеродных клеток, в том числе и опухолевых клеток, путем их лизиса. Депрессия цитолитической активности НК возникает после операционного и травматического стресса. Одним из ранних проявлений стресса является перераспределение и мобилизация лимфоцитов, что обусловливает опустошение тимуса и селезенки и приводит к формированию срочной ответной реакции. Угнетение функции иммунной системы при стрессе связывают с подавлением активности Т-системы. Происходит уменьшение пула рециркулирующих Т-клеток, изменение удельного их количества, т.е. соотношения между Т и В клетками и макрофагами, что вызывает иммуннопатологические процессы.
Воздействие чрезвычайных раздражителей приводит к угнетению клеточного деления. Уменьшение числа митозов при стрессе обусловлено усиленной секрецией глюкокортикоидов и катехоламинов.
Одновременно с уменьшением числа митозов отмечено появление патологических митозов. Нарушение нормального течения митоза при действии на организм экстремальных факторов и появление клеток с несбалансированным кариотипом могут стать при определенных условиях важным звеном развития ряда патологических процессов.
С одной стороны, увеличение числа патологических митозов обусловливает появление такой мутации, которая бы обеспечила адаптацию к новым условиям среды и путем естественного отбора закрепилась в ряде поколений,
С другой стороны, торможение митозов при стрессе обеспечивает выживание и препятствует повреждению генетического аппарата клеток,
уменьшая отрицательные последствия экстремальных воздействий на организм.
С третьей стороны, торможение митозов приводит к нарушению клеточного обновления и нарушению процессов регенерации, наблюдающееся при стрессе.
При изучении болевой чувствительности при стрессе отмечено возрастание порога болевой чувствительности, т.е. стресс обладает обезболивающим действием. Механизм связан с выделением гипофизом бета-эндорфина, обладающего обезболивающим "морфиноподобным" действием. Это рассматривается как целесообразная реакция, направленная на приспособление организма к изменению условий среды и способствующая сохранению вида.
Язвенные поражения желудка при самых различных стрессорных воздействиях возникают постоянно. Во время стресса происходит спазм артериол мышечной оболочки желудка, который влечет к стазу и далее кровоизлияниям в слизистую оболочку или подслизистый слой. При этом возможно повреждение эпителиоцитов, а, учитывая замедление процессов регенерации, это может способствовать развитию длительно незаживающих хронических язв.
В последние годы проблема эмоционального стресса приобрела актуальное значение для практической медицины. Это обусловлено тем, что в условиях эмоционального перенапряжения даже у практически здоровых людей могут возникать артериальная гипертензия и выраженные изменения сердечной деятельности. Более того, стрессорные воздействия могут приводить к гибели от фибрилляции желудочков или острой сердечно-сосудистой недостаточности.
При стрессе повышается уровень катехоламинов (КА). Это сопровождается выраженными нарушениями метаболизма миокарда, снижением энергообразующей функции митохондрий, нарушением активного транспорта и изменением внутриклеточного содержания Na и К (по Селье - "биологическое самоубийство"). При развитии хронического эмоционального стресса эффективность работы дыхательной цепи митохондрий значительна уменьшается. В большинстве случаев наступает полное разобщение окислительного фосфорилирования. Могут также происходить нарушения сократительной функции миокарда. Об этом свидетельствует уменьшение амплитуды сокращений изолированных папиллярных мышц левого желудочка у животных при хроническом стрессе.
Катехоламины стимулируют также распад жировой ткани, в результате чего в крови резко возрастает концентрация свободных жирных кислот. И если организм их не утилизирует, то создаются условия для развития атеросклероза.
Точка приложения стрессорных повреждений различна. В первую очередь следует обратить внимание на возможность хронического повреждения МЦР, испытывающего прежде всего действие постоянно выделяющихся БАВ. Происходит нарушение транспортных процессов, затем идет поражение системы стволовых клеток. Постоянное нарушение МЦР реализуется не только на уровне органов-мишеней, но и прежде всего в самой эндокринной системе, что закрепляет и делает более стойким возникающий дисгормоноз при стрессе. Таким образом, стресс представляет собой производное от функции нервной и эндокринной системы.
Стрессорные ситуации, постоянно возникающие в онтогенезе, и являются тем вариантом отклонения эндокринной системы, который мы клинически определяем как форму дисгормоноза.
Структурно-метаболическая организация основных звеньев эндокринной системы исключает возможность изолированных изменений любой из эндокринных функций. Отклонение эндокринной системы от определенного функционирования может автоматически вызывать нарушение постоянства внутренней среды, приводить к нарушению целостности организма и быть в основе многих патологических расстройств. Поэтому рассматривать стресс как общий адаптационный синдром вряд
ли целесообразно. В настоящее время значительно шире распространена формула:
стресс - нарушение нейроэндокринной функции - болезнь.
Каковы же возможные варианты проявлений нарушения регуляции? Для этого необходимо еще раз вспомнить механизм действия гормонов.
1) Изменения пролиферативной активности клеток (переход в фазу митоза) и, соответственно, их дифференцировки (активация или ингибиция).
2) Изменение метаболизма и, соответственно, изменение специализированной функции.
Следовательно, нарушение регуляции может приводить: а) к избыточному разрастанию ткани (морфологически - это гиперплазия) и к нарушению дифференцировки тканей (метаплазия, дисплазия);
б) к недостаточности и извращению регенерации: морфологически - это либо (+) ткань - воспалительные разрастания эпителия, либо (-) ткань - эрозии, язвы;
в) к нарушению функции клеток - усилению и уменьшению ее (морфологически - объемные изменения тканей: гипертрофия, атрофия).
Стресс-реакция. Морфология стресса
Стресс-реакция. Морфология стресса
По своей биологической сущности стресс-реакция является адаптацией к чрезвычайным условиям существования организма. Ее вызывают многие повреждающие факторы. В зависимости от силы и условий воздействия интенсивность стресс-реакции различна. В развитии стресс-реакции прослеживают определенную фазность (стадийность). Сразу после воздействия, когда создается угроза нарушения гомеостаза, развивается стадия тревоги. Происходит активация нейроэндокринной системы и в первую очередь системы гипоталамус — гипофиз — кора надпочечников.
Продолжительное состояние стерсса вызывает вначале относительную стабилизацию функциональной активности нейроэндокринной системы — стадию резистентности, а затем, если не происходит адаптация организма к раздражителю, наступает стадия истощения гормональных функций.
Смерть может наступить в стадии резистентности, если повреждающее воздействие было настолько сильным, что адаптация к нему оказалась невозможной, но обычно эго происходит в стадии истощения.
Морфологические проявления стресс-реакции, в первую очередь в гипоталамо-гипофизарно-надпочечнпковои системе, используют для оценки танатогенеза.
Гипоталамо-гипофизарная нейросекреторная система (ГГНС). Наиболее рано, уже в случаях быстрой смерти, в ГГНС возникает нарушение микроциркуляции. Эндотелий капилляров набухает, значительно суживая просвет, перикапиллярные пространства разрыхлены. Отмечается спазм части мелких артерий, сочетающийся с явлениями стаза, нарушается соотношение плазмы и эритроцитов. Однако степень кровенаполнения сосудов гипоталамуса и гипофиза в целом возрастает.
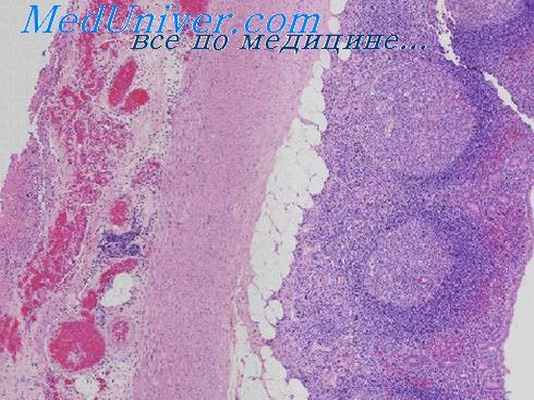
Это обеспечивается запирательными механизмами регионарных артерий и открытием дополнительных сосудов. Гипоталамус. В цитологическом составе супраоптических и паравентрикулярных ядер гипоталамуса при стресс-реакции отмечается количественная и качественная перестройка. Наряду с изменением процентного соотношения функционирующих и нефункциопнрующих клеток появляются невроциты с необратимыми дистрофическими изменениями по типу клеток-теней и в состоянии «тяжелого заболевания». В одних клетках изменения начинаются с базофильного вещества, в других — с ядра, в третьих — с нейроплазмы.
Различают 4 типа невроцитов в зависимости от фазы секреции супраоптических и паравентрикулярных ядер. Невроциты I типа — активно секретирующие. Они крупные, округлой и овальной или грушевидной формы, с хорошо выраженными аксонами и бледно окрашенной цитоплазмой; ядра крупные, округлые, светлые. В цитоплазме имеются мелкие вакуоли и большое количество нейросекреторных гранул, выявляющихся путем окраски паральдегидфуксином по Гомори — Майоровой и основным коричневым-световым зеленым; содержание РНК и полисахаридов в таких клетках значительное.
Невроциты II типа (фаза опустошения или истощения секреции) меньших размеров, полигональной или округлой формы, со светлой цитоплазмой, слабо окрашиваются при выявлении РНК и полисахаридов, нейросекреторное вещество содержится в них в виде отдельных гранул, ядра гиперхромные или светлые, расположены эксцентрично. К невроцитам III типа (фаза умеренной секреции) относятся клетки с крупными глыбкамн интенсивно окрашенного базофильного вещества.
Цитоплазма в них базофильная, гранулы нейросекрета расположены перинуклеарно в виде небольших скоплений, ядра мелкие, гиперхромные, при выявлении ДНК хроматин окрашивается интенсивно. К IV типу невроцитов относятся нейросекреторные клетки, имеющие вид пикноморфных. По данным В С. Локтева, в процентном отношении у практически здоровых лиц, погибших мгновенно, преобладают секреторные клетки III типа (до 70%), клетки IV типа составляют 1—2%; количество активно секретирующих клеток и невроцитов в фазе опустошения составляет по 10—15%.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Стресс-реакция. Морфология стресса
1 ФГБОУ ВО «Курский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Хронический эмоционально-болевой стресс по результатам морфометрического исследования печени вызывал развитие дегенеративных и деструктивных процессов, сопровождающихся полнокровием, застойными явлениями и холестазом в печеночной ткани, а также увеличением текущей (относительно кратковременной) интенсивности функционирования гепатоцитов и снижением глубины репаративных резервов. Введение в дозах 40, 120, 360 и 1080 мкг/кг дельта-сон индуцирующего пептида (ДСИП) стрессированным животным вызывало уменьшение выраженности дегенеративных и деструктивных процессов, снижение полнокровия, застойных явлений и холестаза. Кроме этого, после введения пептида в дозах 120 и 1080 мкг/кг массы тела отмечалась тенденция к активации пролиферативных процессов и нарастанию интенсивности функционирования ткани печени. У стрессированных животных наблюдалось увеличение относительной массы печени по сравнению с интактными крысами. Данный показатель снижался после введения ДСИП во всех исследуемых дозах, нивелируя отмеченный стресс-индуцированный сдвиг.
1. Белых А.Е. Дельта-сон индуцирующий пептид: отдельные биологические эффекты и механизмы их развития / А.Е. Белых, И.И. Бобынцев // Человек и его здоровье : Курский научно-практический вестник. – 2016. – № 1. – С. 79-90.
2. Белякова Е.И. Влияние пептида дельта-сна на моноаминергические системы мозга крыс в начальный период ноцицептивного воздействия / Е.И. Белякова, Т.С. Колмакова // Нейрохимия. — 2007. — Т. 24, № 2. — С. 156-160.
3. Мастицкий С.Э. Статистический анализ и визуализация данных с помощью R. - Черно-белое издание / С.Э. Мастицкий, В.К. Шитиков. — М. : ДМК Пресс, 2015. — 496 с.
4. Способ оценки восстановительных процессов печени : пат. 2308031 Рос. Федерация : МПК G01N 33/48, A61B 10/00 / Е.В. Антопольская, И.А. Швейнов, А.И. Конопля, А.В. Ушкалов; патентообладатель: Курск. гос. мед. ун-т. — № 2005141259/14 ; заявл. 28.12.2005; опубл 10.10.2007, Бюл. № 28. — 6 с.
5. Стрекалова Т.В. Дельта-сон индуцирующий пептид (ДСИП): проблемы эндогенного происхождения и биологической активности // Нейрохимия. — 1998. — Т. 15, № 3. — С. 227-238.
6. Acute mild footshock alters ethanol drinking and plasma corticosterone levels in C57BL/6J male mice, but not DBA/2J or A/J male mice / D.B. Matthews, A.L. Morrow, T. O’Buckley [et al.]. // Alcohol. — 2008. — Vol. 42, N 6. — P. 469-476. — doi:10.1016/j.alcohol.2008.05.001.
7. Chronic stress induces steatohepatitis while decreases visceral fat mass in mice / Y.Z. Liu [et al.]. // BMC Gastroenterol. — 2014. — Vol. 14. — P. 106. — doi: 10.1186/1471-230X-14-106.
8. Decreased hepatic contents of coenzyme A molecular species in mice after subchronic mild social defeat stress / Kubota Y. [et al.] // Stress. — 2016. — Vol. 19, N 2. — P. 192-197. — doi: 10.3109/10253890.2015.1137558.
9. Electric foot shock stress-induced exacerbation of alpha-galactosylceramide-triggered apoptosis in mouse liver / Y. Chida [et al.] // Hepatology. — 2004. — Vol. 39, N 4. — P. 1131-1140.
10. Hranilovic D. Emotional response in dopamine DL receptor-deficient mice / D. Hranilovic, M. Bucan, Y. Wang // Behav Brain Res. — 2008. — Vol. 195, N 2. — P. 246-250. — doi: 10.1016/j.bbr.2008.09.007.
11. Konstandi M. Psychophysiological stress: a significant parameter in drug pharmacokinetics // Expert Opin Drug Metab Toxicol. — 2013. — Vol. 9, N. 10. — P. 1317-1334. — doi: 10.1517/17425255.2013.816283.
12. Role of oxidative stress and molecular changes in liver fibrosis: a review / V. Sánchez-Valle, N.C. Chávez-Tapia, M. Uribe, N. Méndez-Sánchez // Curr Med Chem. — 2012. — Vol. 19, N 28. — P. 4850-4860.
13. Structural-functional organization of neurons in the cerebral cortex of rats with different levels of resistance to emotional stress in conditions of exposure to delta sleep-inducing peptide / N.N. Bogolepov, E.N. Popova, E.V. Koplik [et al.] // Neurosci Behav Physiol. — 2004. — Vol. 34, N 6. — P. 611-616.
14. The effects of delta sleep-inducing peptide on the intensity of lipid peroxidation and xanthine oxidase activity in rat tissues during cold stress / T.I. Bondarenko, N.P. Milyutina, T.A. Shustanova, I.I. Mikhaleva // Neurosci Behav Physiol. — 2001. — Vol. 31, N 1. — P. 83-86.
15. The Liver: Biology and Pathobiology: Fifth Edition / I.M. Arias [et al.]. — Chichester, UK ; Hoboken, NJ : Wiley-Blackwell, 2009. — 1191 p.
Известно, что длительное стрессорное воздействие способно оказывать существенное влияние на показатели гомеостаза всего организма, в поддержании которого важную роль играет печень. При этом развивающиеся стресс-индуцированные изменения метаболических процессов отражаются на функциональном состоянии данного органа как за счет мобилизации его резервов, так и вследствие повреждающего воздействия целого ряда факторов, в том числе активных метаболитов кислорода [12; 15]. Необходимо отметить, что при различных видах стрессорного воздействия важную роль для дальнейшего развития стрессорной реакции играет эмоционально-негативное напряжение, при котором изменяется метаболизм печеночных ферментов, принадлежащих к семье цитохрома Р450 (CYP) [11] и производных кофермента А [8], развивается стеатоз и неалкогольная жировая болезнь печени [7], запускается апоптоз гепатоцитов [9]. Частой причиной стрессорных реакций является болевое раздражение, вызывающее значительную активацию систем эмоционально-негативного подкрепления.
Модулирующее влияние на выраженность стрессорных сдвигов оказывают стресс-лимитирующие системы организма. К числу регуляторных пептидов, играющих важную роль в функционировании данных механизмов, относится дельта-сон индуцирующий пептид (ДСИП), обладающий анальгетическими [5], стресс-лимитирующими [13], нейромодулирующими [2] и мембраностабилизирующими [14] эффектами.
На основании вышеизложенных данных целью данной работы явилось изучение влияния дельта-сон индуцирующего пептида при внутрибрюшинном введении на морфологию печени в условиях хронического эмоционально-болевого стресса.
Материал и методы исследования
Эксперименты выполнены на 60 крысах-самцах Вистар массой 310-340 г, разделенных на группы по 10 животных, которые содержались в стандартных условиях вивария со свободным доступом к воде и пище при 12-часовом световом режиме и контролируемой температуре (22±2 °С). Исследования проводили в промежуток времени с 9 до 14 часов.
Все исследования проводились с соблюдением принципов Хельсинкской декларации о гуманном отношении к животным и в соответствии с решением регионального этического комитета.
В работе использовали дельта-сон индицирующий пептид, имеющий формулу (NH2)Trp-Ala-Gly-Gly-Asp-Ala-Ser-Gly-Glu(COOH), синтезированный в НИИ химии Санкт-Петербургского государственного университета. Пептид растворяли в физиологическом растворе и вводили внутрибрюшинно за 60 мин до начала каждого стрессорного воздействия в дозах 40, 120, 360 и 1080 мкг/кг массы тела. Контрольным животным вводили эквивалентные объемы физиологического раствора из расчета 1 мл на 1 кг массы тела. Интактные животные не получали стрессорного воздействия, на протяжении эксперимента им вводили объемы физиологического раствора, эквивалентные таковым у контрольных стрессированных крыс.
Хронический эмоционально-болевой стресс создавали электрокожным раздражением лап попарно сгруппированных животных в камере с электрифицированным решетчатым полом. С помощью программируемого электростимулятора на пол камеры в течение 30 минут подавались импульсы тока силой 0,2-0,3 mА продолжительностью 5 секунд с межимпульсным интервалом 15 секунд в течение 5 дней подряд [6; 10].
Животных выводили из эксперимента путем обескровливания под эфирным наркозом. При заборе органов осуществляли взвешивание печени и с учетом массы животного вычисляли индекс ее относительной массы («печень/тело»). Для этого рассчитывали отношение массы органа к массе тела соответствующего животного и умножали полученный результат на 1000.
После выведения животных из эксперимента для морфологического исследования атравматично забирали печень. Для фиксации кусочков изучаемых органов использовали формалин 10% в фосфатном буфере, затем проводили заливку тканей в парафин, готовили гистологические срезы толщиной 6-7 мкм и окрашивали гематоксилином и эозином.
Морфологическое исследование гистологических препаратов проводили на микроскопе Nikon Eclipse Ci со штатной цифровой цветной камерой. Морфологическую оценку состояния печеночной ткани осуществляли на основе морфометрического исследования гистологических срезов [4]. При помощи калиброванной окулярной сетки определяли следующие показатели: число митозов (ЧМ), число двухъядерных клеток (ЧДК), число целых ядросодержащих клеток (ЧК) и число точек пересечения сетки (ЧСТ), не попадающих на срезы гепатоцитов и их ядер. По результатам этих измерений рассчитывали: показатель паренхиматозной плотности (ПП=1-ЧСТ/Nузл) функциональной клеточной массы (ФКМ=(ЧК/Sсет)*ПП*100000), характеризующий паренхиматозно-стромальные отношения в единице объема ткани; показатель ядерной массы (ЯМ=(ЧК+ЧДК)/Sсет)*ПП*100000), отражающий ядерно-цитоплазматические отношения в единице объема ткани; индекс массы двухъядерных клеток (ИМДК=((ЧДК/ЧК)/Sсет)*ПП*100000), свидетельствующий о степени реализации восстановительных резервов единицы объема печеночной ткани; масс-митотический индекс (ММИ=((ЧМ/ЧК)/Sсет)*ПП*100000), показывающий пролиферативную активность единицы объема печеночной ткани; показатель функционального кариоклеточного индекса (ФККИ=ЯМ/ФКМ), характеризующий количество ядерного материала в клетке единицы объема печеночной ткани; показатель средней площади среза гепатоцитов (СПСГ=(Sсет/ЧК)*ПП), пропорциональной его функциональной активности.
Характер распределения признаков в статистической выборке определяли с использованием критерия Колмогорова-Смирнова. Значимость полученных результатов оценивали с помощью непарного параметрического t-критерия Стьюдента и непараметрического критерия Манна-Уитни в зависимости от типа распределения признаков. Статистическую обработку проводили с использованием программного пакета MS Excel и программной среды вычислений R [3]. Результаты считали достоверными при p
Результаты исследования и их обсуждение
Дисперсионный анализ выявил достоверные различия при сравнении исследуемых показателей внутри всех исследуемых групп животных для всех анализируемых показателей (p<0,01-0,005), кроме паренхиматозной плотности.
Влияние ДСИП на показатели восстановительных процессов печени и относительную массу органов при хроническом эмоционально-болевом стрессе (M±m)
Читайте также:
