Строение и функции селектинов
Добавил пользователь Skiper Обновлено: 28.01.2026
Селектины — белки из семейства молекул клеточной адгезии. Селектины являются трансмембранными гликопротеинами и состоят из единственной полипептидной цепи. Имеют характерное сходство с лектинами типа C благодаря амино-терминальной последовательности и кальций-зависимого связывания [1] . Селектины связываются с олигосахарами и, таким образом, могут рассматриваться как тип лектинов (отсюда название). [2]
Содержание
Существует 3 подгруппы селектинов:
- (в эндотелиальных клетках) (в лейкоцитах) (в эндотелиальных клетках и тромбоцитах)
Функции
Селектины играют роль в процессе трансмиграции лейкоцитов в участок повреждения при воспалительной реакции. P-селектин локализуется в особых гранулах — «тельцах Вейбеля—Паладе» эндотелиальных клеток и секретируется на поверхность клетки в течение минут после клеточной активации. E-селектин синтезируется клетками под действием таких цитокинов как фактор некроза опухоли или интерлейкин 1β. Основным и наиболее изученным лигандом селектинов является белок лейкоцитов PSGL-1 („гликопротеиновый лиганд P-селектина 1“).
См. также
Примечания
- ↑Cotran Robbins Pathologic Basis of Disease. — Philadelphia: W.B Saunders Company, 1998. — ISBN 0-7216-7335-X
- ↑ Parham,Peter.The Immune System. 2nd ed. Garland Science: New York, 2005. pg. 244-245
Ссылки
- Белки клеточной адгезии
- Кластеры дифференцировки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Селектин" в других словарях:
P-селектин — Обозначения Символы SELP; CD62, PSEL, PADGEM, GMP140, CD62P Entrez Gene … Википедия
E-селектин — Обозначения Символы SELE; ESEL, CD62E Entrez Gene … Википедия
L-селектин — Обозначения Символы SELL; LSEL, LAM1, LAM 1, hLHRc, Leu 8, Lyam 1, PLNHR, CD62L Entrez Gene … Википедия
Тельца Вейбеля–Паладе — Тельца Вейбеля Паладе особые везикулы в клетках сосудистого эндотелия, которые содержат фактор фон Виллебранда и P селектин и секретируют их в случае активации эндотелия при повреждении ткани. Могут быть сферической, овальной или продолговатой… … Википедия
1-я хромосома человека — Идиограмма 1 й хромосомы человека 1 я хромосома человека самая большая из 23 человеческих хромосом, одна из 22 аутосом человека. Хромосома содержит около 248 млн пар оснований … Википедия
Тельца Вейбеля — Паладе особые везикулы в клетках сосудистого эндотелия, которые содержат фактор фон Виллебранда и P селектин и секретируют их в случае активации эндотелия при повреждении ткани. Могут быть сферической, овальной или продолговатой формы. Содержание … Википедия
Т-клетки памяти — Лимфоцит показан в центре изображения Т клетки памяти хранят информацию о ранее действовавших антигенах и формируют вторичный иммунный ответ, осуществляющийся в более короткие сроки, чем первичный иммунный ответ, так как минует основные стадии… … Википедия
Селектины: характеристики, виды и функции
В селектины Они представляют собой семейство гликопротеинов, состоящих из полипептидных цепей, которые распознают определенные конформации сахаров (углеводов), расположенных на поверхности других клеток, и связываются с ними. По этой причине их еще называют молекулами адгезии.
Эти рецепторы адгезии известны своей консервативной структурой. У них есть три домена и три разных гликопротеина. Они могут быть выражены как поверхностные молекулы в дополнение к хранению или функционированию как растворимые молекулы.
В отличие от других молекул адгезии, селектины действуют только на взаимодействия лейкоцитов с эндотелием сосудов.
характеристики
Все белки селектины содержат олигосахариды цепей, ковалентно связанные с боковыми цепями аминокислот (гликопротеины). Они являются трансмембранными молекулами, что означает, что они пересекают липидный бислой клетки либо за один этап (один этап), либо за несколько этапов (многоступенчатый).
Они имеют общие характеристики, очень похожие на белки CLEC или лектины типа C. Поскольку, как и лектины типа C, селектинам для связывания требуются ионы кальция.
Происхождение слова «селектин» относится к тому факту, что эти белки избирательно экспрессируются в клетках сосудистой системы, а также содержат лектиновый домен.
Некоторые авторы включают селектины (гликопротеины) в состав лектинов, потому что это молекулы, которые связываются с сахарами. Однако другие авторы разделяют их на основании концепции, согласно которой лектины только распознают углеводы и связываются с ними, в то время как селектины не только распознают и связывают сахара, но также состоят из углеводов.
Регуляция селектинов происходит на уровне транскрипции через протеолитический процессинг, классификацию клеток и регулируемую экспрессию гликозилтрансфераз.
Селектины имеют короткий внутриклеточный домен. Однако они имеют три внеклеточных домена, домен, подобный эпидермальному фактору роста, домен, подобный лектину, и консенсусные повторяющиеся единицы, аналогичные регуляторным белкам комплемента.
Типы
Семейство селектинов состоит из трех различных типов гликопротеинов. Каждый из них обозначен буквой, обозначающей место, где они были впервые идентифицированы. Мы увидим каждого из них ниже.
L-селектин
Он также известен как SELL, CD62L, LAM1, LEU8, LNHR, LSEL или TQ1. Он содержится в лейкоцитах, отсюда «L» для L-селектина. Это компонент клеточной поверхности. Этими тремя доменами являются: гомолог лектина, фактор роста эпидермиса и две согласованные повторяющиеся единицы.
У него есть несколько лигандов, то есть обычно небольшие молекулы, которые образуют комплексы с биомолекулой, в данном случае с белком. Известны следующие лиганды L-селектина.
GLYCAM1
Известная как зависимая от гликозилирования молекула клеточной адгезии -1, это протеогликановый лиганд, который экспрессируется при посткапиллярных венозных воспалениях и позволяет лимфоцитам выходить из кровотока в лимфоидные ткани.
CD34
Это фосфогликопротеин, обнаруживаемый в различных группах млекопитающих, таких как человек, крысы и мыши. Впервые он был описан в гемопоэтических стволовых клетках. Они обнаруживаются в большом количестве клеток, но почти исключительно связаны с гемопоэтическими клетками.
MAdCAM-1
Известен как адрезин или молекула клеточной адгезии в направлении слизистой оболочки сосудов (на английском языке, адгезия сосудов слизистой оболочки 1 молекула клеточной адгезии). Это внеклеточный белок эндотелия, который отвечает за определение того, в какую ткань войдут лимфоциты, в дополнение к переносу сахаров, так что они распознаются L-селектином.
ПСГЛ-1
Известный среди других синонимов как SELPLG или CD162, это гликопротеин, обнаруженный в эндотелиальных клетках и лейкоцитах. Он может связываться с двумя другими типами селектинов. Однако, по-видимому, он имеет лучшее сродство к P-селектину.
Р-селектин
P-селектин известен под другими названиями, такими как SELP, CD62, CD62P, GMP140, GRMP или LECAM3, среди других. Он находится на поверхности эндотелиальных клеток, выстилающих внутренние границы кровеносных сосудов и тромбоцитов.
Р-селектин был впервые обнаружен в тромбоцитах. Вот почему в названии белка стоит буква «Р».
Структура P-селектина состоит из домена, очень похожего на лектин C-типа на N-конце, EGF-подобного домена; то есть консервативный белковый домен из примерно 30-40 аминокислотных остатков с двухцепочечным β-листом, за которым следует петля к короткому C-концевому двухцепочечному β-листу.
Он представляет собой третий домен, подобный комплемент-связывающим белкам, называемый CUB-доменом, который характеризуется тем, что является эволюционно консервативным белковым доменом и содержит около 110 аминокислотных остатков.
Лиганд с наивысшим сродством к P-селектину - это PSGL-1, как ранее описано для лигандов L-селектина. С другой стороны, этот белок также может образовывать комплексы с другими молекулами, такими как сульфатированный полисахарид, называемый фукоиданом и гепарансульфатом.
E-selectin
Этот белок селектина также известен под следующими названиями: SELE, CD62E, ELAM, ELAM1, ESEL, LECAM2 и другие. Он экспрессируется исключительно в эндотелиальных клетках, которые активируются небольшими белками, которые не могут пересекать липидный бислой клетки, называемыми цитокинами.
Структура этого белка состоит из 3 доменов (как и остальные селектины): EGF-подобного домена, 6 единиц модулей белка, контролирующего повторение SCR (также называемых суши-доменами), и трансмембранного домена.
Лиганды, которые образуют комплексы с Е-селективными агентами, весьма разнообразны, но выделяются следующие.
Сиалил-Льюис А
Также называется SLe A или CA19-9. Это тетрасахарид, обнаруженный в сыворотках больных раком. Известно, что он участвует в процессе распознавания клеток. Он конститутивно экспрессируется в гранулоцитах, моноцитах и Т-лимфоцитах.
Сиалил-Льюис Икс
Он также является тетратасахаридом, как Сиалил-Льюис А, и имеет аналогичные функции. Он экспрессируется в гранулоцитах и моноцитах и контролирует нежелательную утечку или утечку этих клеток во время воспаления.
Хотя он, по-видимому, более эффективен для P-селектина, некоторые авторы считают, что производная форма нейтрофила человека также весьма эффективна для E-селектина. Фактически, они считают, что в целом этот лиганд необходим для трех типов селектинов.
Функция
Основная функция селектинов - участвовать в образовании белых кровяных телец (лимфоцитов). Они также участвуют в иммунном ответе при хронических и острых воспалениях в различных органах тела, таких как почки, сердце и кожа. Они даже действуют при воспалительных процессах метастазирования рака.
Интегрины: характеристики, структура и функции
Видео: Интегрины: характеристики, структура и функции
Содержание:
В интегрины они представляют собой большую группу или семейство белков клеточной поверхности, очевидно, уникальных для животного мира. Они являются основным ресурсом клеток для поддержания взаимодействия (в форме адгезии) с другими клетками и с клеточным матриксом.
Его структура состоит из двух субъединиц, называемых альфа и бета. Известно, что у млекопитающих существует от 16 до 18 альфа-единиц и от 3 до 8 бета, которые действуют в зависимости от их комбинации, а также от физиологического состояния конкретной клетки или ткани.
Есть несколько белков, которые выполняют адгезивные функции. Однако группа интегринов является наиболее распределенной и взаимодействует со всеми ключевыми белками клеточного матрикса. Интегрины участвуют в фагоцитозе, миграции клеток и заживлении ран и даже хорошо изучены на предмет их участия в метастазировании.
Это белки, которые характеризуются механическим соединением клеточного цитоскелета одной клетки с другой и / или с внеклеточным матриксом (во взаимодействии клетка-клетка и / или клетка-матрица). Биохимически они определяют, произошла ли адгезия, и передают клеточные сигналы, связывающие внеклеточную среду с внутриклеточной в обоих направлениях.
Они работают или функционируют с другими рецепторами, такими как иммуноглобиллины, кадгерин, селектины и синдеканды. Что касается лигандов интегринов, они, среди прочих, состоят из фибронектина, фибриногена, коллагена и витронектина.
Их объединение с лигандами происходит за счет внеклеточных двухвалентных катионов, таких как кальций или магний. Использование того или другого будет зависеть от конкретного интегрина.
Интегрины имеют удлиненную форму, оканчивающуюся головкой в форме шара, которая, согласно наблюдениям электронной микроскопии, выступает из липидного бислоя более чем на 20 нанометров.
Состав
Интегрины - гетеродимеры, то есть молекулы, всегда состоящие из двух белков. Оба белка считаются субъединицами или протомерами и дифференцируются как альфа-субъединицы и бета-субъединицы. Обе субъединицы связаны нековалентно. Они имеют молекулярную массу от 90 до 160 кДа.
Количество альфа- и бета-субъединиц варьируется между различными группами организмов в животном мире. У таких насекомых, как плодовая муха (Дрозофила), например, имеется 5 альфа и 2 бета субъединиц, тогда как у нематодных червей рода Caenorhabditis есть 2 альфы и одна бета.
Исследователи предполагают, что у млекопитающих существует фиксированное количество субъединиц и их комбинаций; однако в литературе нет единого мнения относительно этого числа. Например, некоторые упоминают, что существует 18 альфа-субъединиц, 8 бета и 24 комбинации, в то время как другие говорят о 16 альфа и 8 бета для 22 комбинаций.
Каждая субъединица имеет следующую структуру.
Альфа-субъединица
Альфа-субъединица представляет собой структуру с доменом β-спирали из семи листов или листов, которые образуют голову, доменом бедра, двумя доменами теленка, одним трансмембранным доменом, а также коротким цитоплазматическим хвостом, который не представляет собой ферментативный или связывание с актином.
В нем представлены цепи примерно с 1000 до 1200 остатков. Он может связывать двухвалентные катионы.
У млекопитающих, интегрины которых были изучены больше всего, альфа-субъединицы можно сгруппировать в зависимости от того, содержат ли они встроенный домен (альфа I).
Со вставленным доменом Alpha I
Домен с вставкой альфа I состоит из области из 200 аминокислот. Присутствие этого домена в интегринах указывает на то, что они являются рецепторами коллагена и лейкоцитов.
Домен не вставлен
Альфа-интегрины, не имеющие интегрированного домена, подразделяются на 4 подсемейства, которые мы увидим ниже.
PS1
Рецепторы гликопротеинов, также называемые ламининами, жизненно важны для интеграции тканей мышц, почек и кожи.
PS2
Это подсемейство является рецептором аргинилглициласпарагиновой кислоты, также известной как RGD или Arg-Gly-Asp.
PS3
Это подсемейство наблюдалось у беспозвоночных, особенно у насекомых. Хотя о нем мало что известно, существуют исследования, оценивающие его важную роль в функциональной активности гена интегрина лейкоцитов CD11d у людей.
PS4
Это подсемейство известно как группа альфа 4 / альфа 9 и включает субъединицы с такими же названиями.
Эти субъединицы способны спариваться с субъединицами бета 1 и бета 7. Кроме того, они имеют общие лиганды, очень похожие на альфа-субъединицы, которые представляют вставленный домен альфа I, такие как молекулы адгезии сосудистых клеток, растворимые в крови лиганды, фибриноген и другие. включая даже патогены.
Бета-субъединица
Структурно бета-субъединица состоит из головки, секции, называемой ножкой / ножкой, трансмембранного домена и цитоплазматического хвоста. Головка состоит из домена бета I, который вставляется в гибридный домен, который связывается с доменом плексин-семафор-интегрин, также известным как PSI.
Секция стебля / ножки содержит четыре модуля, одинаковых или очень похожих на богатый цистеином интегрин эпидермального фактора роста и, как уже упоминалось, цитоплазматический хвост. Этот цитоплазматический хвост, как и альфа-субъединица, не обладает ферментативной или актин-связывающей активностью.
Они представляют собой цепи с числом остатков, колеблющимся между 760 и 790, и они могут связывать, как альфа-субъединицы, двухвалентные катионы.
Интегрины имеют несколько функций, однако в основном они известны тем, что мы увидим ниже.
Прикрепление или сцепление клетки с внеклеточным матриксом
Связь, которая существует между клеткой и внеклеточным матриксом благодаря интегринам, способствует устойчивости клетки к механическому давлению, предотвращая их отрыв от матрицы.
Некоторые исследования предполагают, что соединение с клеточным матриксом является основным требованием для развития многоклеточных эукариотических организмов.
Миграция клеток - это процесс, в который интегрины вмешиваются путем связывания или связывания с различными субстратами. Благодаря этому они вмешиваются в иммунный ответ и заживление ран.
Передача сигнала от внеклеточного матрикса к клетке
Интегрины участвуют в процессе передачи сигнала. Это означает, что они вмешиваются в получение информации из внеклеточной жидкости, они ее кодируют, а затем в качестве реакции начинается изменение внутриклеточных молекул.
Эта сигнальная трансдукция участвует в большом количестве физиологических процессов, таких как запрограммированное разрушение клеток, дифференциация клеток, мейоз и митоз (деление клеток), а также рост клеток, среди прочего.
Интегрины и рак
Несколько исследований показывают, что интегрины играют важную роль в развитии опухолей, особенно в метастазировании и ангиогенезе. Примером этого являются, среди прочего, интегрины αVβ3 и α1β1.
Эти интегрины связаны с раком, повышенной терапевтической резистентностью и гематопоэтическими новообразованиями.
Эволюционная перспектива
Эффективная адгезия между клетками для образования тканей была, без сомнения, важнейшей характеристикой, которая должна была присутствовать в эволюционном развитии многоклеточных организмов.
Возникновение семейства интегринов восходит к появлению многоклеточных животных около 600 миллионов лет назад.
Группа животных с гистологическими характеристиками предков - это пористые, обычно называемые морскими губками. У этих животных клеточная адгезия происходит за счет внеклеточного протеогликанового матрикса. Рецепторы, которые связываются с этой матрицей, имеют типичный интегрин-связывающий мотив.
Фактически, в этой группе животных были идентифицированы гены, относящиеся к определенным субъединицам некоторых интегринов.
В ходе эволюции предок многоклеточных животных приобрел интегрин и интегрин-связывающий домен, который со временем сохранялся у этой огромной группы животных.
В структурном отношении максимальная сложность интегринов наблюдается в группе позвоночных. Существуют различные интегрины, которых нет у беспозвоночных, с новыми доменами. Действительно, у людей было идентифицировано более 24 различных функциональных интегринов, а у плодовых мушек Drosophila melanogaster их всего 5.
Строение и функции селектинов
Механизмы адгезии нейронов нейрональными молекулами клеточной адгезии (NCAM)
• Нейрональные молекулы клеточной адгезии (NCAM) экспрессируются только в нейронах и в основном принимают участие в межклеточной гомотипической адгезии, а также функционируют в качестве сигнальных рецепторов
• В нейронах экспрессируются три разных типа белков NCAM, которые являются продуктами альтернативного сплайсинга единственного гена
• Некоторые NCAM ковалентно модифицируются путем присоединения к ним длинных цепей полисиаловой кислоты (PSA), что ослабляет гомотипическое связывание. Ослабление адгезии может играть важную роль в процессе развития нейронов при образовании и разрыве контактов между ними
Хотя такие белки, как кадгерины и интегрины, для выполнения своих функций должны связываться с внеклеточными ионами кальция, это не имеет места для всех белков клеточной адгезии. Основной класс белков адгезии, независимых от кальция, представляют собой нейрональные молекулы клеточной адгезии (NCAM). Они в основном функционируют в качестве рецепторов межклеточной адгезии, хотя также способны связываться с гепарансульфат протеогликанами. NCAM экспрессируются только в нейронах. Они расположены в местах контактов между соседними клетками органов центральной и периферической нервной системы, особенно в нервных волокнах.
В нервных клетках экспрессируются три различных белка NCAM, которые являются продуктами альтернативного сплайсинга единственного гена. Эти белки относятся к суперсемейству иммуноглобулинов (Ig) и содержат характерный структурный элемент, известный под названием домен иммуноглобулина. Домен включает примерно 100 аминокислот, которые образуют петлю, имеющую форму двух b-слоев.
Как показано на рисунке ниже, все три NCAM на амино-конце содержат пять таких петель Ig-доменов, а также два домена фибронектина типа III. NCAM-180 и NCAM-140 (цифры обозначают размер молекулы в килодальтонах) содержат по одному трансмембранному домену и различаются С-концевыми цитоплазматическими участками. Напротив, NCAM-120 своим гликозилфосфатидилинозитоловым концом прикрепляется к клеточной поверхности. Все три формы NCAM могут диссоциировать с поверхности клеток — NCAM-180 и NCAM-140 за счет протеолиза, NCAM-120 при действии фосфолипаз — и высвобождаться в виде растворимых молекул, диффундирующих в спинномозговую жидкость и плазму. Растворимые NCAM способствуют адгезии нейронов и образованию нейритов (представляющих собой аксоны).
NCAM клеточной поверхности могут функционировать в качестве сигнальных рецепторов, связываясь со специфической областью на рецепторах фактора роста фибробластов. Образование на поверхности клеток таких латеральных ассоциатов приводит к открытию кальциевых каналов, по-видимому, в результате протекания сигнальных процессов с участием фосфолипазы С, диацилглицерина и арахидоновой кислоты. По крайней мере, одна форма NCAM, NCAM-140, также связывается с тирозинкиназой нерецепторного происхождения — p59fyn, которая обеспечивает связь рецептора с активацией киназы фокальной адгезии. Таким образом, рецепторы NCAM активируют те же сигнальные процессы, которые активируют и другие рецепторы. Эти процессы подробно не изучены.
После образования в эндоплазматическом ретикулуме, на пути к поверхности клеток, NCAM подвергаются различным посттрансляционным модификациям, которые происходят в аппарате Гольджи. Эти модификации включают фосфорилирование, сульфатирование и гликозилирование. К наиболее значительной из этих модификаций относится добавление к молекуле длинных линейных цепей, состоящих из сиаловых кислот. Они называются полисиаловые кислоты (PSA) и присоединяются к N-сахарам, расположенным на двух аспарагиновых остатках пятого домена Ig.
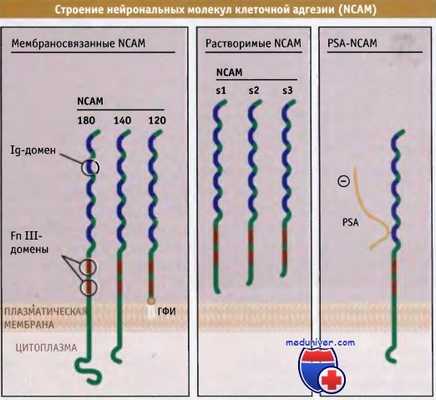
NCAM образуются как в виде мембраносвязанных, так и растворимых белков различной величины.
Представлена доменная организация NCAM. Внеклеточные участки молекулы NCAM могут модифицироваться при добавлении полисиаловой кислоты (PSA),
которая присоединяется к остатку аспарагиновой кислоты при прохождении белка по секреторному пути (представлена модель трансмембранной формы PSA-NCAM, размером 140 кДа).
Добавление PSA существенно меняет форму и функции NCAM. Поскольку сиаловые кислоты несут отрицательный заряд, их цепи распространяются в стороны от молекулы белка, притягивают к себе катионы, и, подобно цепям гликозаминогликанов в протеогликанах, связываются с молекулами воды. Присоединение PSA к NCAM оказывает наиболее сильное влияние на адгезивную функцию рецепторов. В основном мембраносвязанные NCAM связываются с такими же рецепторами, расположенными на соседних клетках. Подробности механизма этого гомофильного связывания неизвестны, однако в нем принимают участие Ig-домены на амино-концевых участках каждого рецептора.
Согласно представлениям современной модели, все пять Ig-доменов рецепторов NCAM перекрываются, что приводит к формированию сильной и прочной адгезии между примыкающими клетками. Однако рецепторы PSA-NCAM перекрываются неполностью, вероятно, из-за большого объема гидратации и отрицательного заряда на цепях PSA. Это вызывает отталкивание Ig-доменов комплементарных рецепторов, расположенных на примыкающих клетках. В результате клетки, содержащие PSA-NCAM, менее прочно связываются друг с другом, чем клетки, в которых NCAM не модифицирован PSA.
В чем заключаются преимущества существования сильно и слабо связывающихся форм одного и того же рецептора? Вспомним, что в процессе развития клетки должны расти и проявлять подвижность с тем чтобы возможно было формирование тканей. В течение этого периода клетки неоднократно образуют между собой контакты и разрушают их. Это особенно характерно для таких клеток, как нейроны, которые в зрелом организме должны сформировать множественные и в высшей степени специфичные межклеточные контакты.
Поэтому для развивающихся нейронов крайне необходимы межклеточные взаимодействия, которые осуществляются с участием PSA-NCAM и характеризуются низким сродством, но высокой специфичностью.
Прямые подтверждения того, что PSA необходимы для контроля развития нейронов, получить крайне трудно, однако несколько групп данных говорят в пользу этого предположения:
• Иммуногистохимическими методами с применением антител, специфичных к NCAM, содержащим и не содержащим цепи PSA, показано, что около 30% NCAM в клетках мышиных эмбрионов содержат PSA, причем в клетках взрослых животных это количество снижается до 10%.
• Два фермента, принимающие участие в образовании PSA, полисиалилтрансфераза и сиалилтрансфераза-X экспрессируются, главным образом, в эмбриональной нервной ткани.
• Нарушение функций PSA-NCAM в процессе развития животных или с помощью ферментов, отщепляющих PSA, или антител, блокирующих PSA-NCAM, вызывает формирование пороков развития головного мозга.
• Аналогичные дефекты обнаруживаются у мышей с нокаутом генов NCAM.
NCAM также могут играть важную роль в структурных перестройках нейронов, происходящих у взрослых животных. Поскольку они участвуют в перестройке нейронных связей, PSA-NCAM могут отвечать за физическое ремоделирование головного мозга, происходящее в процессах запоминания и обучения. В под держку этого предположения свидетельствуют данные о том, что у грызунов уровень PSA-NCAM после обучения увеличивается, и отщепление PSA от NCAM (при действии эндосиалидазы) снижает скорость и точность выполнения тестов памяти.
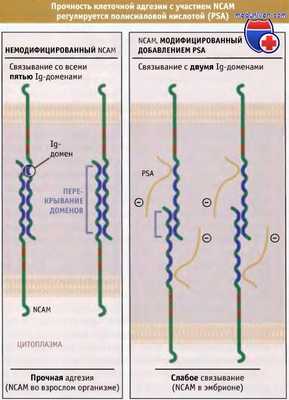
Немодифицированные NCAM связываются между собой посредством пяти Ig-доменов, что обеспечивает прочную адгезию.
NCAM, модифицированный при присоединении PSA, связывается только с двумя Ig-доменами,
и это снижает прочность адгезии.
В присутствии PSA нарушается перекрывание молекул селектинов,
что приводит к слабой адгезии в процессе развития организма.
У взрослых организмов не происходит присоединения PSA к селектинам,
и, таким образом, у них обеспечивается прочность межклеточных взаимодействий.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Селектины представляют собой рецепторы межклеточной адгезии, которые экспрессируются исключительно в клетках присутствующих в сосудистой системе. Идентифицировано три группы селектинов, которые обозначаются как L-, Р- и Е-селектины
• Функция селектинов состоит в фиксации лейкоцитов, циркулирующих в кровеносных сосудах, с тем чтобы они смогли мигрировать в окружающие ткани
• В процессе, называемом непрерывной межклеточной адгезией, селектины лейкоцитов связываются с гликопротеинами клеток эндотелия сосудов слабой связью, носящей временный характер. В результате этого связывания лейкоцит переходит в состояние «роллинга» вдоль стенки сосуда
Селектины являются высокоспециализированными рецепторами клеточной поверхности и экспрессируются исключительно в клетках, присутствующих в сосудистой системе. Пока известно три типа селектинов, получившие свои названия по клеткам, в которых они экспрессируются: L-селектин (лейкоциты), Р-селектин (тромбоциты) и Е-селектин (эндотелиальные клетки).
Клетки эндотелия, после активации цитокинами при воспалительном процессе, могут экспрессировать на своей поверхности Е- и Р-селектины.
Функция селектинов заключается в обеспечении миграции лейкоцитов из кровеносного сосуда (процесс называемый экстравазацией) к очагу воспаления в ткани, где они обеспечивают иммунный ответ организма. Это непростая задача: для экстравазации лейкоцит вначале должен преодолеть силу кровотока и зафиксироваться на стенке сосуда. Каким образом ее можно выполнить?
Ответ очень прост: лейкоциты задерживаются на поверхности эндотелия, т. е. при участии селектинов переходят в состояние «прокатывания» или «роллинга». Таким образом они постепенно снижают скорость своего движения в кровеносном сосуде. Как только лейкоциты полностью останавливаются, они начинают использовать интегриновые рецепторы на эндотелиальных клетках. Эти рецепторы увеличивают адгезию и способствуют миграции лейкоцитов из кровеносных сосудов.
Как «роллинг» приводит к остановке клетки в кровеносном сосуде? Клетка должна быть способна к временному обратимому адгезивному взаимодействию с клетками эндотелия. Как только это взаимодействие произошло, лейкоцит начинает медленно перемещаться (прокатываться) по стенке сосуда до тех пор, пока не сформируется достаточное для полной остановки количество связей. Этот процесс известен под названием непрерывная межклеточная адгезия.
Как следует из рисунка ниже, лейкоциты экспрессируют селектиновые лиганды так, что они связываются только с эндотелиальными клетками, экспрессирующими на своей поверхности Е- и Р-селектины, и, таким образом, при отсутствии воспалительного процесса лейкоциты не связываются с сосудистой стенкой.
Такая селективная адгезия достигается за счет взаимодействий белка с сахарными остатками. Они напоминают взаимодействия между протеогликанами и их рецепторами. Селектины получили свое название потому, что у них часть рецепторов, связывающая лиганд, напоминает эту же часть в лектинах, белках специфически связывающихся с олигосахаридами клеточной поверхности.
В селектинах область связывания лиганда находится на N-концевом участке молекулы белка и связана с серией коротких консенсусных повторов, за которыми расположен единственный трансмембранный домен и небольшой цитоплазматический домен С-концевого участка. Так же как для кадгериновых и интегриновых рецепторов, для сворачивания селектинов и их связывания с лигандами необходимо присутствие внеклеточных ионов кальция.
Селектины связываются со специфическим комплексом сиаловых кислот и фукозы, который называется сиалированным антигеном Льюиса (х) (sLex) и присоединяется к «белкам переносчикам» на поверхности клеток-мишеней. Селектины опознают различные формы sLex, связанные с разными коровыми белками, и, таким образом, проявляют высокую специфичность связывания. К числу основных селектиновых лигандов относятся Р-селектиновый лиганд-1 гликопротеина (PSGL-1), молекулы-1 клеточной адгезии, зависимые от гликозилирования (GlyCAM-1), и клеточная адгезивная молекула-1-мукозный адрессин (MadCAM-1).
Высказывается предположение о том, что связывание этих лигандов стимулирует внутриклеточные пути передачи сигнала, способствующие активации интегриновых рецепторов, участвующих в более поздних стадиях процесса экстравазации, однако пока оно не доказано.
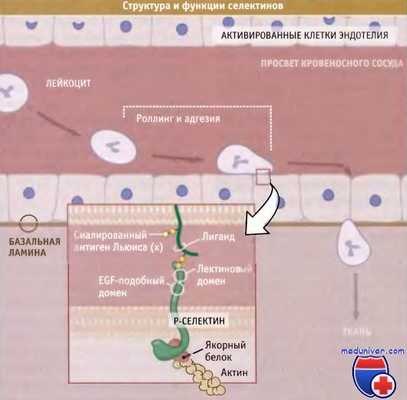
Схема, иллюстрирующая функцию селектинов в «роллинге».
На врезке: модель структурной организации селектина и его связывание с лигандом лейкоцитов.
Читайте также:
