Строение саркомера и сокращение мышцы
Добавил пользователь Alex Обновлено: 28.01.2026
Рыбалко Яна Викторовна 1 , Королева Валерия Игоревна 1
1 Курский государственный медицинский университет, студентка 5 курса лечебного факультета
Аннотация
Представление о механизме мышечного сокращения на сегодняшний день не является полным. Хотя давно открыта "классическая" модель сокращения, она полностью не может охарактеризовать осуществление процесса. Кроме того на сегодняшний день значительно изменилось представление о белковом составе саркомера и роли каждой из этих структур в осуществлении сокращения.
Как известно, человек не может жить без мимики, передвижений и других функций организма, основой которых является сокращение мышц. Вопрос о механизме мышечного сокращения на сегодняшний момент достаточно актуален. Ведь несмотря на то, что этой проблемой ученые интересуются довольно давно, и к середине прошлого века была сформулирована модель, объясняющая как происходит мышечное сокращение, механизм функционирования этой модели до конца открыт не был.
Классической признана модель мышечного сокращения на клеточном уровне, предложенная в 1954 г., названная «кросс – мост». Ее одновременно разрабатывали несколько ученых независимо друг от друга. Как известно, суть этой теории заключается в скольжении актина по миозину, при участии ионов кальция, АТФ и ряда белков. При этом длина самих нитей не меняется, меняется лишь расстояние между ними[2].
Однако при удлинении саркомера более чем на 4 мкм модель кросс- мост не может объяснить природу сил, обеспечивающих дальнейшее растяжение саркомера, кроме того не учитывается полный белковый и ферментный состав структурной единицы миофибрилл, хотя доказано, что помимо актина и миозина в сокращении мышечного волокна весомую роль играют белки титин и небулин, ферменты Akt и креатинкиназа[1].
На сегодняшний день доказано, что в основном растяжение саркомера более чем на 4 мкм регулирует гигантский белок титин. Титин (другое название тайтин или коннектин) — самый большой одиночный полипептид. Титин – составляет 9% всех белков миофибрилл; он локализуется между z- линией и м- линией саркомера; состоит главным образом из линейных блоков модулей двух типов – тип I (фибронектиновый домен) и тип II (иммуноглобулиноподобный домен).
Выявлено, что титин изменяет свои свойства в присутствии кальция, путем связывания кальция в так называемых PEVK местах и некоторых участках иммуноглобулинов. Это обеспечивает определенный прирост силы. Тем не менее, эти изменения являются недостаточными, чтобы объяснить массовый прирост силы при длительных изменениях длины саркомера[4,7].
Есть несколько теорий, которые могли бы объяснить этот механизм:
- Теория намотки нити – обмотка титином вращающихся актиновых филаментов или связывание проксимальных отделов титина и актина, что уменьшает длину свободной пружины в несколько раз. Комплекс актин – титин активен только при активности миофибрилл. Предположительно, за счет этого комплекса обеспечивается определенный уровень сцепления между актином и миозином и активируются силовые воздействия, необходимые для повышенного растяжения.
- Теория нитей огрубления – титин жестко связывается с актином, сокращая длину свободной пружины в несколько раз, в результате этого будет наблюдаться применение большей силы при растяжении по сравнению с пассивным растяжением саркомеров [1].
Высокая изменчивость присуща участкам молекулы титина, находящимся в I-полосе, М-линии, Z-диске. Изменчивость участка I-полосы определяет различия в степени эластичности изоформ титина, и, как следствие, различия в эластичности разных типов мышц. Из многих известных вариантов титина только для пяти изоформ полностью расшифрована последовательность аминокислот [3,7].
Небулин – длинный нерастяжимый белок, связанный с Z-диском и идущий параллельно актиновым филаментам. Множество изоформ небулина, образующихся за счет альтернативного сплайсинга гена NEB, определяют молекулярное разнообразие Z-дисков. Около 90% первичной структуры небулина состоит из примерно 35 остатков α-спиральных доменов, которые образуют суперповторы, связывающие актин с высоким сродством. Каждый из таких повторов является местом связывания актина с тропомиозином[5,6].
При разного рода мутациях в гене небулина образовавшийся белок либо не связывается с актином и тропомиозином, либо связывается, но не выполняет своих функций в полной мере. В связи с этим возможны дефекты мышечного сокращения. Мутации гена небулина являются основной причиной немалиновой миопатии у людей [8].
Также в состав саркомера входит белок тропонин. Благодаря тропонину осуществляется скольжение актина и миозина относительно друг друга. В саркомере образуется комплекс, состоящий из трёх взаимосвязанных единиц: тропонина Т, тропонина С и тропонина I в соотношении 2:1:1. Тропонин Т обеспечивает связь тропонинового комплекса с волокнами тропомиозина. Тропонин С связывается с ионами кальция, необходимыми для осуществления сокращения. Тропонин I подавляет сократительный акт во время восстановительной фазы[1,4,6].
Немалую роль в осуществлении сокращения саркомера играет фермент Akt. Активированный Akt участвует в ряде метаболических реакций посредством фосфорилирования многочисленных субстратов. Далее фермент фосфорилириует белки ядра и здесь же происходит его инактивация.
Регуляция метаболизма глюкозы происходит при участии Akt. Глюкоза как источник энергии поступает в мышечные клетки под действием инсулина. Инсулин может стимулировать активацию Akt. Экспериментально доказано, что сократительная активность мышц повышает скорость поступления глюкозы в мышцы, т.е физическая нагрузка является стимулом для поступления глюкозы в мышцы и выработки инсулина соответственно. С другой стороны, Akt оказывает влияние на синтез гликогена[2].
Кроме того, данный фермент оказывает непосредственное влияние на сократительную активность мышц – увеличение синтеза белков, связанных с Z-диском (регуляция состава миофибриллярной системы цитоскелета); участие в увеличении размера мышечных волокон; контроль процесса распада белков; увеличение сократительной активности мышц [3].
Креатинкиназа – это фермент, который катализирует реакцию переноса фосфорильного остатка с АТФ на креатинин с образованием креатинфосфата и АДФ. Реакция, катализируемая креатинкиназой, обеспечивает энергией мышечные сокращения. Различают креатинкиназу, содержащуюся в митохондриях и цитоплазме клеток. Таким образом, в организме человека креатинкиназа есть в виде трёх изомеров: ММ, МВ, ВВ. ММ-изомер содержится в скелетной мускулатуре и миокарде, МВ – в основном в миокарде, ВВ – в тканях головного мозга, в небольшом количестве в любых клетках организма [5] .
Запас креатинфосфата в мышцах необходим для восстановления АТФ при сокращениях саркомера. Это осуществялется посредством следующей реакции:
АДФ + креатинфосфат = АТФ + креатин[7]
Креатинфосфата в мышце содержится значительно больше (около 30 ммоль/л), чем АТФ. При интенсивной или длительной работе запасы креатинфосфата быстро истощаются, и в этих условиях ресинтез АТФ может осуществляться только за счет реакций гликолиза и тканевого дыхания. В период покоя в мышцах идет накопление креатинфосфата в результае реакции перефосфорилирования между АТФ и креатином
АТФ + креатин →креатинфосфат + АДФ [4].
Исходя из вышесказанного можно сделать вывод, что белковый состав саркомера на сегодняшний день изучен достаточно полно, выяснена структура и функция ферментов, участвующих в сокращении мышечного волокна. Однако стоит отметить, что теории, полностью объясняющей механизм сокращения и энергетическое обеспечение этого процесса, до сих пор не существует, но этот вопрос активно изучается в современном мире.
© Если вы обнаружили нарушение авторских или смежных прав, пожалуйста, незамедлительно сообщите нам об этом по электронной почте или через форму обратной связи.
Строение саркомера и сокращение мышцы
• Миозин II представляет собой мотор, обеспечивающий сокращение мышц
• Актин и миозин II являются основными компонентами саркомера, основной единицей сокращения поперечнополосатых мышц
Мышцы представляют собой ткань, способную к сокращению, которая обеспечивает движение тела и подвижность органов. В соответствии с внешним видом сократительных волокон, мышцы можно подразделить на две основных группы: поперечнополосатые и гладкие. Волокна поперечнополосатых мышц называются так потому, что при большом увеличении можно видеть их характерную исчерченность. К этой группе относятся скелетные и сердечная мышцы.
Скелетные мышцы обеспечивают подвижность скелета, а сердечная сокращение сердца. Волокна гладких мышц не исчерченные и имеют веретенообразную форму. Эти мышцы образуют стенки органов, например мочевого пузыря, кровеносных сосудов и желудочно-кишечного тракта.
Белковый мотор, который обеспечивает сокращение мышц, относится к семейству миозина II. Этот миозин принадлежит к числу наиболее распространенных белков позвоночных, он легко выделяется и поэтому является одним из хорошо изученных белков.
На рисунке ниже представлено строение молекулы миозина II, состоящей из шести полипептидных цепей: двух тяжелых и двух наборов, каждый из которых состоит из двух легких цепей.
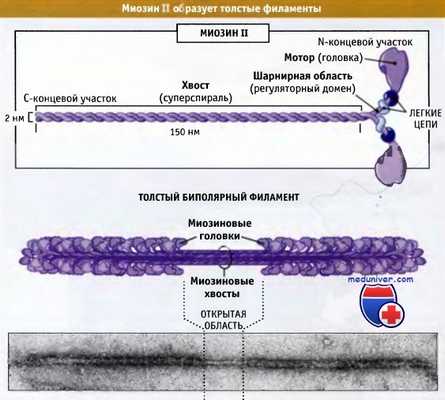
Миозин II представляет собой гексамерный комплекс,
состоящий из двух тяжелых цепей и двух пар различных легких цепей.
Эти комплексы собираются в биполярные толстые филаменты.
Дистальный участок хвоста мышечного миозина II связан с другими молекулами миозина II, образуя волокна, состоящие примерно из 300 молекул миозина. Эти волокна биполярны, и моторные домены всех миозинов направлены от центральной зоны. Эти волокна называются толстые биполярные филаменты. В настоящем разделе мы обсудим организацию и роль миозина II в сокращении поперечнополосатых мышц. Эти вопросы хорошо изучены.
Поперечнополосатые мышцы состоят из пучков мышечных волокон. Последние представляют собой крупные многоядерные клетки, длина которых варьирует от нескольких миллиметров до нескольких сантиметров, а диаметр составляет 20-100 мкм. Рисунок ниже показывает, что каждое мышечное волокно состоит более чем из 1000 миофибрилл, которые представляют собой палочковидные органеллы, способные к сокращению. Миофибриллы состоят из повторяющихся единиц, которые называются саркомеры. Саркомеры расположены друг за другом и обусловливают характерную исчерченность мышц.
Саркомеры представляют собой основные сокращающиеся единицы поперечнополосатых мышц; при сокращении и расслаблении мышцы их длина изменяется. Как показано на рисунке ниже, саркомеры содержат толстые филаменты, состоящие, главным образом, из биполярных филаментов миозина II, и тонких филаментов, которые содержат актиновые нити и регуляторные белки. Оперенные концы актиновых филаментов с одной стороны прикреплены к структуре саркомера, которая носит название Z-диск. При этом все актиновые филаменты с одной стороны Z-диска имеют одинаковую полярность.
Актиновые филаменты прикрепляются к Z-диску и копируются за счет связывания с копирующим белком (CapZ), что предотвращает деполимеризацию актиновых филаментов. Заостренные концы актиновых филаментов ориентированы к центру саркомера и копированы тропомодулином. С актиновыми филаментами также взаимодействует белок небулин; он может регулировать сборку волокон и длину тонких филаментов.
Толстые филаменты находятся в центре, на М-линии, между Z-дисками. М-линия представляет собой структуру, состоящую из гибко связанных биполярных толстых филаментов; эти связи скрепляют толстые филаменты, гексагонально расположенные внутри. Наряду с М-линией, белок филаментов, который называется титаном, образует эластичные связи между Z-дисками и миозиновыми волокнами. Титин обеспечивает центровку толстых филаментов в саркомере и действует как пружина, которая не допускает растягиваться саркомеру.
Тонкие и толстые филаменты переплетаются, образуя трехмерную решетчатую структуру. Поскольку саркомер биполярен, в обеих половинах миозиновые моторы по отношению к актину ориентированы одинаково. При сокращении моторные домены миозина толстых филаментов взаимодействуют с актином тонких филаментов. При сокращении саркомер укорачивается за счет скольжения тонких и толстых филаментов относительно друг друга, что сближает соседние Z-диски к центру саркомера. По мере продвижения головок миозина к зазубренным концам актиновых филаментов, длина толстых и тонких филаментов остается постянной.
Ширина саркомера в расслабленной мышце позвоночных составляет около 3 мкм, а при сокращении она становится около 2,4 мкм.
В мышечном волокне укорачиваются группы, состоящие из тысяч саркомеров, что приводит к укорачиванию всей мышцы. Общая длина укороченного мышечного волокна определяется двумя факторами: длиной, на которую укорачивается каждый саркомер, и количеством саркомеров в группе. Процентная величина, на которую происходит укорачивание мышечных волокон, одна и та же, независимо от их длины.
Величина усилия, генерируемого саркомером, пропорционально числу акто-миозиновых взаимодействий в половине саркомера, а величина усилия, которое развивает мышчное волокно, пропорционально числу параллельно расположенных саркомеров. Таким образом, штангисты увеличивают свою силу за счет увеличения площади поперечного сечения мышц, а не за счет их длины.
Как показано на рисунке ниже, сокращение поперечнополосатых мышц регулируется с участием тропонин-тропомиозинового комплекса, который связан с актином в тонких филаментах. Молекулы тропомиозина представляют собой суперспирализованные полипептиды длиной 40 нм. Она располагаются друг за другом вдоль актиновых спиралей. Тропонин представляете собой комплекс из трех различных белков: тропонина С, тропонина I и тропонина Т. Один комплекс связывается с тропомиозином так, что они располагаются вдоль тонких филаментов через 40 нм интервалы.
При низких концентрациях ионов кальция тропомиозин находится в таком состоянии, что пространственно блокирует сайт связывания миозина на актине, так что мышца расслабляется и гидролиз АТФ под действием миозина происходит очень медленно. За счет взаимодействия актина с миозином релаксированные саркомеры способны к пассивному растяжению, оказывая небольшое сопротивление.
Нервные импульсы вызывают выход кальция в цитозоль из саркоплазматического ретикулума. Последний представляет собой органеллу, которая депонирует кальций в мышце. Повышение уровня кальция в цитозоле приводит к его связыванию с тропонином-С и к конформационным изменениям в молекуле белка. В результате этих изменений тропомиозин отходит от миозин-связывающего сайта в актине, и миозин получает возможность взаимодействовать с актином и генернировать усилия за счет механохимического цикла.
Скелетные мышцы состоят из мышечных волокон, содержащих миофибриллы и представляющих собой удлиненные клетки.
Миофибриллы способны к сокращению и содержат повторяющиеся структурные единицы, называемые саркомерами. На конце каждого саркомера находится Z-диск, к которому через CapZ (кэпирующий белок) присоединяются актиновые филаменты.
Толстые миозиновые филаменты соединяются с Z-диском через белок титин и вплетаются между актиновыми филментами.
Небулин проходит от Z-диска к тропомодулину. Однако как он связывает актин, пока неизвестно. Сокращение мышцы происходит, когда толстые миозиновые филаменты присоединяются к актиновым и перемещают их таким образом,
что Z-диски сдвигаются относительно друг друга. При этом длина саркомера уменьшается. Чем длиннее миофибрилла (т. е. чем больше саркомеров), тем более она укорачивается при сокращении.
Однако в процентном отношении величина укорачивания не зависит от числа саркомеров. Сокращение поперечнополосатых мышц регулируется уровнем Са2+ в цитозоле,
который определяет положение комплекса тропонин/тропомиозин относительно миозина и актина.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Состав и структура саркомера
Описаны состав и структура саркомеров — структурных единиц миофибрилл. Показано, что саркомер состоит из большого количества (более 1000) структурных элементов — сот. Описано строение структурного элемента саркомера — сота.
После того, как мы ознакомились из чего состоят скелетные мышцы, мышечные волокна и миофибриллы, давайте разберемся из чего состоит саркомер и каково его строение.
Характеристика саркомера
Саркомер – это структурная единица миофибриллы, главная функция которого – превращение химической энергии в мышечное сокращение.
Установлено, что каждая миофибрилла состоит из структурных элементов – саркомеров. Это очень маленькие элементы. Они похожи на микроцилиндры, которые расположены вдоль миофибриллы. Однако это, конечно, не металлические цилиндры. Саркомеры состоят из белковых элементов, которые принимают активное участие в сокращении скелетной мышцы. Друг от друга эти микроцилиндры разделяют Z-диски, основу которых составляют белки: α-актинин, десмин, дистофин и другие.
Еще миофибриллу можно сравнить со стеблем бамбука. При этом саркомеры похожи на длинные секции, а Z-диски – это диски, разделяющие эти секции. Длина саркомеров лежит в пределах 2-3 мкм (напоминаю, что 1 мкм – это одна миллионная метра). Поэтому в миофибрилле, длина которой составляет 5 см содержится около 20000 саркомеров.
Состав саркомера
Чаще всего при описании состава саркомера указывается, что саркомер состоит из толстых и тонких филаментов, и приводится следующий рисунок (рис.1).
Однако этот рисунок не дает полное представление как о составе, так и о структуре саркомера. Не будем забывать, что саркомер – это объемный объект, маленький цилиндр.
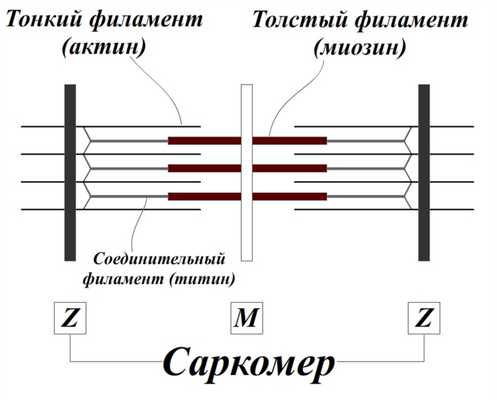
Рис.1. Схема строения саркомера (G.H. Pollak, 1990) Длина саркомера ограничена Z-дисками. В середине саркомера располагается М-диск, который представляет собой «сцепление хвостов миозиновых молекул».
Если мысленно разрезать саркомер поперек, то в месте, где пересекаются толстые и тонкие филаменты, мы увидим следующую картину (рис.2).
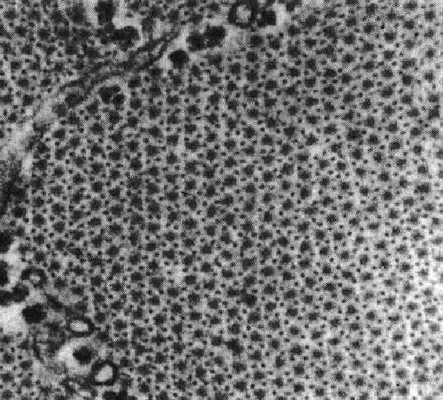
Рис. 2. Решетчатая структура филаментов актина и миозина (H.E. Huxley, 1972)
Отчетливо видно, что каждый толстый филамент окружен шестью тонкими филаментами, то есть видно большое количество структурных элементов. Еще в 1972 году известный гистолог А.Н. Студитский выделил эти структурные элементы в составе саркомера. Для их описания он использовал следующее образное сравнение: «На поперечных срезах в миофибриллах открывается картина взаимного расположения филамент, гексогональная упаковка, напоминающая связку карандашей, повернутую концами к зрителю». Из этого образного сравнения следует, что А.Н. Студитский сравнивает эти структурные элементы с карандашами, а саркомер, в свою очередь, представляет связку таких «карандашей».
В нашей статье (А.В. Самсонова, Г.А. Самсонов, 2016) мы предложили называть такие элементы, из которых состоят саркомеры – сотами по аналогии с пчелиными сотами.
Сот – структурная единица саркомера, в состав которой входит один толстый и 12 тонких филаментов, шесть из которых прикреплены к Z-диску с одной стороны от толстого филамента, а другие шесть – с другой стороны от толстого филамента (рис. 3).
Длина сота равна длине саркомера, так как длина сота ограничена с двух сторон Z-дисками. На рис. 3 представлены основные элементы, входящие в состав сота: один толстый филамент и шесть тонких филаментов, расположенных справа и слева от толстого филамента, а также часть Z – диска, к которому прикреплены тонкие филаменты. Следует отметить, что состав и строение этого элемента значительно сложнее. Например, на рисунке не указано, что белок титин (тайтин) соединяет каждый толстый филамент с Z-дисками. Данная схема предназначена для того, чтобы выделить этот структурный элемент в составе саркомера.

Рис. 3. Схема строения сота. Толстый филамент, подобно грифелю карандаша расположен в середине, на ребрах карандаша расположены тонкие филаменты. Шесть тонких филаментов прикреплены к Z-диску с одной стороны от толстого филамента, а другие шесть – с другой стороны. Часть Z- диска показана схематично. Не показано прикрепление толстого филамента к Z- диску при помощи белка титина (А.В. Самсонова, 2011)
Установлено (Г. А. Самсонов, А.В. Самсонова, 2016), что в одном саркомере, имеющем диаметр 1 мкм находится более 1000 таких структурных элементов – сот. То есть в связке «карандашей» более 1000. Площадь одного сота равна 6,225 10 -4 мкм 2 .
В 2000 году математик Томас Хелс доказал, что шестиугольники, лежащие в основе пчелиных сот, лучше других геометрических фигур подходят для максимального использования пространства, при этом используется минимум строительного материала (воска). По-видимому, это свойство гексагональной структуры сотов также используется и при «строительстве» саркомеров.
A-диск саркомера, I-диск саркомера и М-диск саркомера
Достаточно часто читателей интересует, что такое А-диск саркомера или что такое I-диск саркомера. Честно говоря, когда я сама разбиралась со структурой саркомера, я долго не могла запомнить, что это за диски. Появление названий этих дисков связано с тем, что раньше электронные микроскопы были достаточно слабыми. Поэтому исследователи не видели структуру саркомера, а видели только чередующиеся светлые и темные участки, которые они назвали дисками. Чтобы понять, что это за диски, посмотрим на рис. 4.
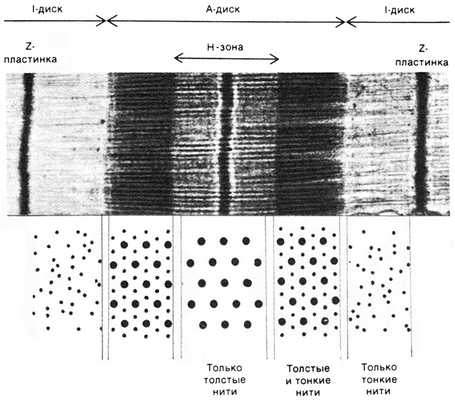
Рис.4. Вверху. Микрофотография продольного среза саркомера. Внизу — поперечный срез саркомера в его различных участках (H.E. Huxley, 1972)
А-диск саркомера
Итак, А-диск (анизотропный диск) – это темный диск на рис. 4. Этот «диск» образован перекрытием толстых и тонких филаментов.
А-диски (анизотропные, темные диски) вызваны двойным лучепреломлением обычного света. Двойное лучепреломление в свою очередь связано с различными свойствами среды. Это называется анизотропией. По-видимому, анизотропность среды связана с тем, что в этих местах пересекаются толстые и тонкие филаменты.
I-диск саркомера
I-диски (изотропные диски) – это светлые «диски» справа и слева от А-диска (рис. 4). Эти «диски» соответствуют тому участку саркомера, где располагаются только тонкие филаменты.
I-дискам (изотропные, светлые диски) не свойственно двойное лучепреломление. Среда изотропна (одинакова во всех направлениях). Изотропность среды связана с тем, что в этих местах саркомера имеются только тонкие филаменты.
М-диск саркомера
В центре саркомера имеется светлая полоса – Н-зона. Эта зона соответствует тому участку саркомера, где располагаются только толстые филаменты. В середине Н-зоны имеется участок, который называется М-зоной или М-диском (от немецкого слова mittelscheibe – центральный диск). Этот участок образован толстыми филаментами и структурами, которые соединяют их поперечно между собой.
Влияние тренировки на изменение площади саркомера
Установлено, что тренировка не влияет на расстояние между толстым и тонкими филаментами. Это означает, что площадь сота не меняется. Однако силовая тренировка значительно изменяет площадь поперечного сечения саркомера. Доказано, что толстые и тонкие филаменты при увеличении площади саркомера добавляются на его наружной поверхности. Увеличение площади поперечного сечения саркомеров (миофибрилл) приводит к гипертрофии скелетных мышц (увеличению их объема).
Мышечное сокращение. Характеристика и механизм мышечного сокращения
Выделяют несколько последовательных этапов запуска и осуществления мышечного сокращения.
1. Потенциал действия распространяется вдоль двигательного нервного волокна до его окончаний на мышечных волокнах.
2. Каждое нервное окончание секретирует небольшое количество нейромедиатора ацетилхолина.
3. Ацетилхолин действует на ограниченную область мембраны мышечного волокна, открывая многочисленные управляемые ацетилхолином каналы, проходящие сквозь белковые молекулы, встроенные в мембрану.
4. Открытие управляемых ацетилхолином каналов позволяет большому количеству ионов натрия диффундировать внутрь мышечного волокна, что ведет к возникновению на мембране потенциала действия.
5. Потенциал действия проводится вдоль мембраны мышечного волокна так же, как и по мембране нервного волокна.
6. Потенциал действия деполяризует мышечную мембрану, и большая часть возникающего при этом электричества течет через центр мышечного волокна. Это ведет к выделению из саркоплазматического ретикулума большого количества ионов кальция, которые в нем хранятся.
7. Ионы кальция инициируют силы сцепления между актиновыми и миозиновыми нитями, вызывающие скольжение их относительно друг друга, что и составляет основу процесса сокращения мыщц.
8. Спустя долю секунды с помощью кальциевого насоса в мембране саркоплазматического ретикулума ионы кальция закачиваются обратно и сохраняются в ретикулуме до прихода нового потенциала действия. Удаление ионов кальция от миофибрилл ведет к прекращению мышечного сокращения.
Далее мы обсудим молекулярные механизмы этого процесса.
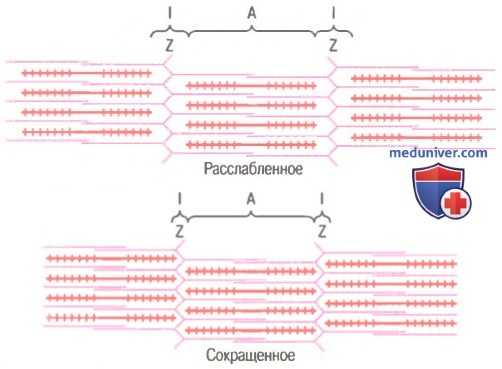
Миофибрилла в расслабленном и сокращенном состоянии. Показано (вверху), что актиновые нити (розовые) вдвинуты в пространства между миозиновыми нитями (красные). Сближение Z-дисков друг с другом (внизу).
Молекулярные механизмы мышечного сокращения
Механизм скольжения нитей для мышечного сокращения. На рисунке показан основной механизм мышечного сокращения. Показано расслабленное состояние саркомера (вверху) и сокращенное состояние (внизу). В расслабленном состоянии концы актиновых нитей, отходящие от двух последовательных Z-дисков, лишь незначительно перекрываются. Наоборот, в сокращенном состоянии актиновые нити втягиваются внутрь между миозиновыми так сильно, что их концы максимально перекрывают друг друга. При этом Z-диски притягиваются актиновыми нитями к концам миозиновых. Таким образом, мышечное сокращение осуществляется путем механизма скольжения нитей.
Что заставляет нити актина скользить внутрь среди нитей миозина? Это связано с действием сил, генерируемых при взаимодействии поперечных мостиков, исходящих от нитей миозина, с нитями актина. В условиях покоя эти силы не проявляются, однако распространение потенциала действия вдоль мышечного волокна приводит к выделению из саркоплазматическо-го ретикулума большого количества ионов кальция, которые быстро окружают миофи-бриллы. В свою очередь, ионы кальция активируют силы взаимодействия между нитями актина и миозина, в результате начинается сокращение. Для осуществления процесса сокращения необходима энергия. Ее источником являются высокоэнергетические связи молекулы АТФ, которая разрушается до АДФ с высвобождением энергии. В следующих разделах мы приведем известные детали молекулярных процессов сокращения.
Молекулярные особенности сократительных нитей
Миозиновая нить. Она состоит из множества молекул миозина, молекулярная масса каждой составляет около 480000. На рисунке показана отдельная молекула; и также — объединение многих молекул миозина в миозиновую нить, а также взаимодействие одной стороны этой нити с концами двух актиновых нитей.
В состав молекулы миозина входят 6 полипептидных цепей: 2 тяжелые цепи с молекулярной массой около 200000 каждая и 4 легкие цепи с молекулярной массой около 20000 каждая. Две тяжелые цепи спирально закручиваются вокруг друг друга, формируя двойную спираль, которую называют миозиновым хвостом. С одного конца обе цепи изгибаются в противоположных направлениях, формируя глобулярную полипептидную структуру, называемую миозиновой головкой. Таким образом, на одном конце двойной спирали молекулы миозина образуются 2 свободные головки; 4 легкие цепи также включены в состав миозиновой головки (по 2 в каждой). Они помогают регулировать функцию головки во время мышечного сокращения.
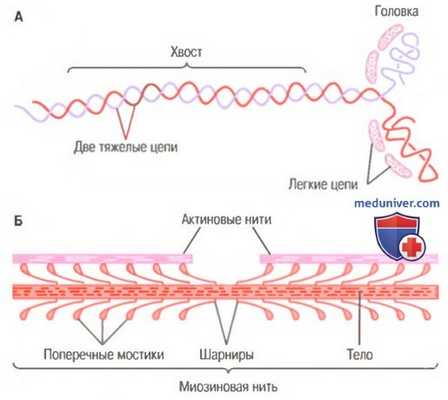
А. Молекула миозина.
Б. Объединение многих молекул миозина в одну миозиновую нить.
Показаны также тысячи миозиновых поперечных мостиков и взаимодействие их головок с прилежащими актиновыми нитями.
Миозиновая нить состоит из 200 или более отдельных молекул миозина. Видно, что хвосты молекул миозина объединяются, формируя тело нити, а многочисленные головки молекул выдаются наружу по сторонам тела. Кроме того, наряду с головкой в сторону выступает часть хвоста каждой миозиновой молекулы, образуя плечОу которое выдвигает головку наружу от тела, как показано на рисунке. Выступающие плечи и головки вместе называют поперечными мостиками. Каждый поперечный мостик может сгибаться в двух точках, называемых шарнирами. Один из них расположен в месте, где плечо отходит от тела миозиновой нити, а другой — где головка крепится к плечу. Движение плеча позволяет головке или выдвигаться далеко наружу от тела миозиновой нити, или приближаться к телу. В свою очередь, повороты головки участвуют в процессе сокращения, что обсуждается в следующих разделах.
Общая длина каждой миозиновой нити остается постоянной и равна почти 1,6 мкм. В самом центре миозиновой нити на протяжении 0,2 мкм поперечных мостиков нет, поскольку снабженные шарнирами плечи отходят в стороны от центра.
Сама миозиновая нить сплетена таким образом, что каждая последующая пара поперечных мостиков смещена в продольном направлении относительно предыдущей на 120°, что обеспечивает распределение поперечных мостиков во всех направлениях вокруг нити.
АТФ-азная активность миозиновой головки. Есть и другая особенность миозиновой головки, необходимая для мышечного сокращения: миозиновая головка функционирует как фермент АТФ-аза. Как объясняется далее, это свойство позволяет головке расщеплять АТФ и использовать энергию расщепления высокоэнергетической связи для процесса сокращения.
Актиновая нить. Актиновая нить состоит из трех белковых компонентов: актина, тропомиозина и тропонина.
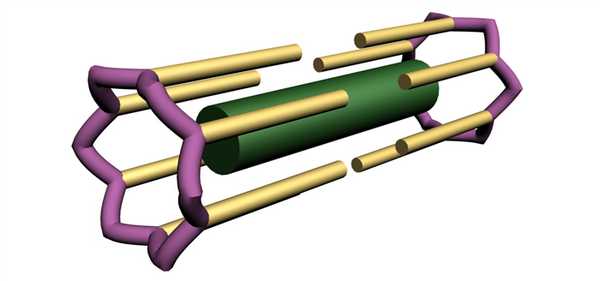
Актиновая нить, состоящая из двух спиралевидных цепочек молекул F-актина и двух цепочек молекул тропомиозина, расположенных в желобках между цепочками актина.
К одному концу каждой молекулы тропомиозина прикреплен тропониновый комплекс, который запускает сокращение.
Основой актиновой нити являются две цепи белковой молекулы F-актина. Обе цепи закручиваются в спираль так же, как и молекула миозина.
Каждая цепь двойной спирали F-актина состоит из полимеризованных молекул G-актина с молекулярной массой около 42000. К каждой молекуле G-актина прикреплена 1 молекула АДФ. Полагают, что эти молекулы АДФ являются активными участками на актиновых нитях, с которыми взаимодействуют поперечные мостики миозиновых нитей, обеспечивая мышечное сокращение. Активные участки на обеих цепях F-актина двойной спирали расположены со смещением таким образом, что вдоль всей поверхности актиновой нити встречается один активный участок примерно через каждые 2,7 нм.
Длина каждой актиновой нити — около 1 мкм. Основания актиновых нитей прочно встроены в Z-диски; концы этих нитей выступают в обоих направлениях, располагаясь в пространствах между миозиновыми молекулами.
Молекулы тропомиозина. Актиновая нить также содержит другой белок — тропомиозин. Каждая молекула тропомиозина имеет молекулярную массу 70000 и длину 40 нм. Эти молекулы спирально оплетают спираль из F-актина. В состоянии покоя молекулы тропомиозина располагаются поверх активных участков актиновых нитей, препятствуя их взаимодействию с миозиновыми нитями, лежащему в основе сокращения.
Тропонин и его роль в мышечном сокращении. По ходу молекул тропомиозина к ним периодически прикреплены другие белковые молекулы, называемые тропонином. Они представляют собой комплексы трех слабосвязанных белковых субъединиц, каждая из которых играет специфическую роль в регуляции мышечного сокращения. Одна из субъединиц (тропонин I) имеет высокое сродство к актину, другая (тропонин Т) — к тропомиозину, третья (тропонин С) — к ионам кальция. Считают, что этот комплекс прикрепляет тропомиозин к актину. Высокое сродство тропонина к ионам кальция, как полагают, инициирует процесс сокращения, о чем говорится в следующей статье.
Видео физиология мышц и мышечного сокращения - профессор, д.м.н. П.Е. Умрюхин
Длина мышцы и сила сокращения. Источники энергии для мышечного сокращения
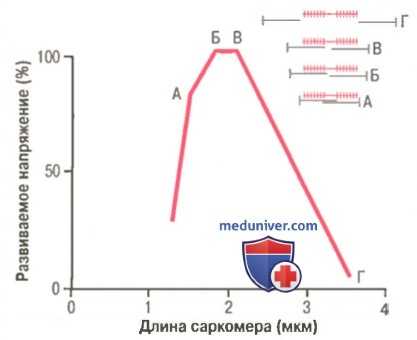
Кривая «длина-напряжение» для одиночного саркомера в условиях изометрического сокращения.
Видно, что максимальная сила сокращения развивается при длине саркомера 2,0-2,2 мкм.
Вверху справа показано относительное расположение актиновых и миозиновых нитей при разной длине саркомера, соответственно точкам от А до Г.
Верхняя кривая на рисунке выше подобна кривой на рисунке ниже, но показывает напряжение целой интактной мышцы, а не одиночного мышечного волокна. Целая мышца содержит большое количество соединительной ткани; кроме того, саркомеры в разных частях мышцы не всегда сокращаются с одинаковой силой. В результате данная кривая по сравнению с кривой для отдельного мышечного волокна имеет в определенной степени иные размерности, но демонстрирует ту же основную форму наклона в области нормального диапазона сокращения.
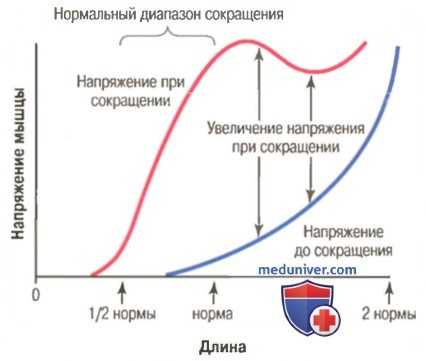
Связь между длиной и напряжением мышцы до мышечного сокращения и во время него.
На рисунке выше видно, что при длине мышцы, соответствующей ее состоянию покоя (т.е. когда длина саркомера около 2 мкм), активация мышцы приводит к ее сокращению, сила которого близка к максимальной. Однако увеличение напряжения, происходящее во время сокращения и называемое активным напряжением, снижается по мере растяжения мышцы за пределы ее нормальной длины (т.е. за пределы длины саркомера примерно в 2,2 мкм). Это демонстрируется на рисунке уменьшением длины стрелки при длине мышцы больше нормы.
Без нагрузки скелетная мышца сокращается чрезвычайно быстро, достигая максимума примерно за 0,1 сек для усредненной мышцы. При наличии нагрузки по мере ее возрастания скорость сокращения постепенно снижается. Когда нагрузка возрастает до величины, равной максимальной силе, которую способна развить мышца, скорость сокращения становится нулевой, и в результате укорочения мышцы нет, несмотря на ее активацию.
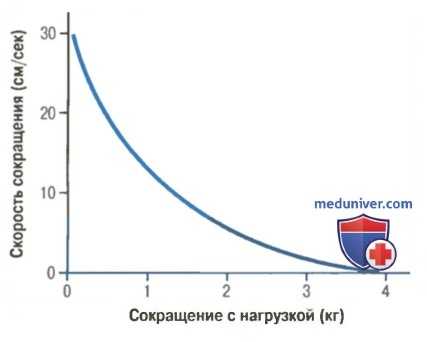
Связь между нагрузкой и скоростью сокращения в скелетной мышце с поперечным сечением 1 см 2 и длиной 8 см.
Снижение скорости сокращения при увеличении нагрузки связано с тем фактом, что нагрузка на сокращающуюся мышцу противостоит силе, развиваемой мышцей при сокращении. Следовательно, общая сила, доступная для развития скорости укорочения, соответственно уменьшается.
При сокращении против нагрузки мышца выполняет работу. Это значит, что энергия перемещается от мышцы к внешней нагрузке, чтобы поднять объект до большей высоты или преодолеть сопротивление движению.
В математическом выражении работа определяется следующим уравнением:
где W — производимая работа, L — нагрузка и D — расстояние движения против нагрузки.
Источником энергии, необходимой для выполнения работы, являются химические реакции в мышечных клетках во время сокращения, которые приведены в следующих разделах.
Источники энергии для мышечного сокращения
Мы уже знаем, что мышечное сокращение зависит от энергии, поставляемой АТФ. Большая часть этой энергии тратится на приведение в действие храпового механизма, с помощью которого поперечные мостики тянут актиновые нити. Однако небольшое количество энергии необходимо: (1) для откачивания ионов кальция из саркоплазмы в саркоплазматический ретикулум после завершения сокращения; (2) на активное перемещение ионов натрия и калия через мембрану мышечного волокна с целью поддержания соответствующей ионной среды для распространения потенциалов действия по волокну.
Концентрация АТФ в мышечном волокне (примерно 4 ммоль/л) достаточна для поддержания максимального сокращения в течение не более 1-2 сек. АТФ расщепляется с формированием АДФ и выделением энергии, которая передается механизму сокращения мышечного волокна. В течение следующей доли секунды АДФ рефосфорилируется, формируя новую молекулу АТФ, что позволяет мышце продолжать свое сокращение. Существуют несколько источников энергии для восстановления АТФ.
Первым источником энергии, используемым для восстановления АТФ, является креатинфосфат — вещество с высокоэнергетической фосфатной связью, подобной связям АТФ. Высокоэнергетическая фосфатная связь креатинфосфата имеет несколько большее количество свободной энергии, чем каждая связь АТФ. Креатинфосфат немедленно расщепляется, и освобожденная энергия вызывает связывание нового фосфата с АДФ, восстанавливая АТФ. Однако общее количество креатинфосфата в мышечном волокне также очень незначительно — примерно в 5 раз больше, чем АТФ. Следовательно, общий запас энергии в виде АТФ и креатинфосфата в мышце способен обеспечить максимальное сокращение в течение лишь 5-8 сек.
Вторым важным источником энергии, используемым для восстановления как АТФ, так и креатинфосфата, является гликолиз гликогена, предварительно накопленного в мышечных клетках. Быстрое ферментативное разрушение гликогена до пировиноградной кислоты, а затем до молочной кислоты освобождает энергию, которая используется для превращения АДФ в АТФ. Затем АТФ может участвовать непосредственно в обеспечении энергией дополнительного мышечного сокращения, а также в восстановлении запасов креатинфосфата.
Механизм гликолиза имеет двойное значение. Во-первых, гликолитические реакции могут происходить даже при отсутствии кислорода, и мышечное сокращение может поддерживаться в течение нескольких секунд, а иногда более 1 мин, даже если доставка кислорода из крови не доступна. Во-вторых, скорость образования АТФ с помощью гликолиза примерно в 2,5 раза выше, чем при образовании АТФ в реакциях питательных веществ клетки с кислородом. Однако конечных продуктов гликолиза в мышечных клетках накапливается так много, что примерно через 1 мин гликолиз также теряет способность поддерживать максимальное мышечное сокращение.
Третьим и решающим источником энергии является окислительный метаболизм, т.е. комбинирование кислорода с конечными продуктами гликолиза и различными другими клеточными питательными веществами с освобождением энергии. Более 95% всей энергии, используемой мышцей для непрерывного длительного сокращения, извлекается из этого источника. Потребляемыми питательными веществами являются углеводы, жиры и белки. Для чрезвычайно длительной максимальной мышечной активности, продолжающейся в течение многих часов, основная часть энергии получается из жиров, но при мышечной активности длительностью 2-4 ч до половины энергии может получаться из накопленных углеводов.
Читайте также:
