Сурфактант. Поверхностное натяжение и спадение альвеол
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Сурфакта́нт (в переводе с английского — поверхностно-активное вещество [1] ) — смесь поверхностно-активных веществ, находящаяся на границе воздух-жидкость в лёгочных альвеолах, то есть выстилающая альвеолы изнутри. Препятствует спадению (слипанию) альвеол за счёт снижения поверхностного натяжения жидкости. Сурфактант секретируется специальной разновидностью альвеолоцитов II типа.
Содержание
Состав
Состав лёгочного сурфактанта [2] :
Свойства
Сурфактант синтезируется и секретируется пневмоцитами (альвеолоцитами) II типа. За счёт поверхностно-активного натяжения сурфактант понижает поверхностное натяжение в альвеоле, предупреждая её «спадение». Сурфактант также имеет защитное действие. Высокие поверхностно-активные свойства сурфактанта объясняются присутствием в нём дипальмитоилфосфатидилхолина, который образуется в лёгких доношенного плода непосредственно перед родами.
Система сурфактантов у недоношенных детей не развита, что часто является причиной гибели недоношенных детей без лечения. Система сурфактанта может повреждаться и у взрослых при травмах, в том числе химических и термических, а также при некоторых заболеваниях.
Сурфактант помогает лёгким всасывать, усваивать кислород. В последнее время мода на безжировое питание приводит к возникновению гипоксий у людей, которые не употребляют в пищу качественные жиры. В то же время сурфактант примерно на 90% состоит из жиров.
Строение
Располагающийся на поверхности альвеолярного эпителия сурфактант включает 2 фазы:
Гипофаза
Нижняя, состоит из тубулярного миелина, имеющего решетчатый вид и сглаживающего неровности эпителия.
Апофаза
Поверхностная мономолекулярная плёнка фосфолипидов, обращённая в полость альвеолы гидрофобными участками.
Функции
- Уменьшение поверхностного натяжения плёнки тканевой жидкости, покрывающей альвеолярный эпителий, что способствует расправлению альвеол и препятствует слипанию их стенок при дыхании.
- Бактерицидная.
- Иммуномодулирующая.
- Стимуляция активности альвеолярных макрофагов.
- Формирование противоотёчного барьера, который предупреждает проникновение жидкости в просвет альвеол из интерстиция.
Примечания
См. также
Литература
- Быков В. Л. Частная гистология человека. — СПб. : СОТИС, 1999. — С. 144. — ISBN 5-85503-116-0
Ссылки
- Проставить для статьи более точные категории.
- Добавить иллюстрации.
- Грудная клетка
- Дыхательная система
- Фосфолипиды
- Полисахариды
- Белки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Лёгочный сурфактант" в других словарях:
Лизофосфатидилхолинацилтрансфераза — Лизофосфатидилхолин ацилтрансфераза 1 Обозначения Символы AYTL2; LPCAT Entrez Gene … Википедия
ЗАБОЛЕВАНИЯ ЛЁГКИХ ХРОНИЧЕСКИЕ ОБСТРУКТИВНЫЕ — мед. Хронические обструктивные заболевания лёгких (ХОЗЛ) хроническая патология с прогрессирующей обструкцией дыхательных путей и развитием лёгочной гипертёнзии. Термин объединяет хронический обструктивный бронхит и эмфизему. • Хронический бронхит … Справочник по болезням
лёгкие — их; мн. (ед. лёгкое, ого; ср.). Орган дыхания (у человека и позвоночных животных), расположенный в грудной полости. Обследовать л. Рентген лёгких. Объём лёгких. Дышать лёгкими. ◁ Лёгочный, ая, ое. Л ая ткань. Л ая артерия. Л ые болезни. * * *… … Энциклопедический словарь
Острый респираторный дистресс-синдром — Рентгенограмма … Википедия
Сурфактант. Поверхностное натяжение и спадение альвеол
Сурфактант. Поверхностное натяжение и спадение альвеол
а) Принцип поверхностного натяжения. Молекулы воды на поверхности водной среды, граничащей с воздухом, имеют между собой особо прочную связь. В результате такая поверхность воды всегда стремится к сокращению. Именно это явление формирует дождевые капли: в них образуется плотная стягивающая мембрана из молекул воды по всей поверхности дождевой капли. Посмотрим на эту закономерность с обратной стороны и постараемся понять, что происходит на внутренних поверхностях альвеол. Здесь поверхность жидкости также стремится к сокращению.
Появляется стремление к выжиманию воздуха из альвеол к бронхам, в результате альвеолы начинают спадаться, и в легких образуется эластическая сила сокращения, которую называют эластической силой поверхностного натяжения.
б) Сурфактант и его влияние на поверхностное натяжение. Сурфактант — это поверхностно активное вещество, которое значительно уменьшает поверхностное натяжение воды. Оно секретируется специальными сурфактант-секретирующими эпителиальными клетками, которые составляют около 10% площади поверхности альвеол. Эти клетки называют альвеолярными эпителиальными клетками второго типа. Они являются гранулярными, т.к. содержат липидные включения, которые в составе сурфактанта секретируются в альвеолы.
Сурфактант представляет собой сложную смесь из нескольких фосфолипидов, белков и ионов. Наиболее важными его составляющими являются фосфолипид дипальмитоилфосфатидилхолин, апопротеины сурфактанта и ионы кальция. Именно дипальмитоилфосфатидилхолин наряду с некоторыми менее важными фосфолипидами вызывает снижение поверхностного натяжения. При этом в жидкостной мембране на поверхности альвеол растворяется только часть его молекулы, а остальная часть расплывается на поверхности жидкостного слоя в альвеоле.
Поверхностное натяжение такой поверхности составляет только от 1/12 до 1/2 по сравнению с таковым чистой воды.
Количественные соотношения поверхностного натяжения для разных жидкостей выглядят примерно так: чистая вода — 72 дин/см, нормальная альвеолярная жидкость без сурфактанта — 50 дин/см, нормальная альвеолярная жидкость, содержащая нормальное количество сурфактанта, — от 5 до 30 дин/см.
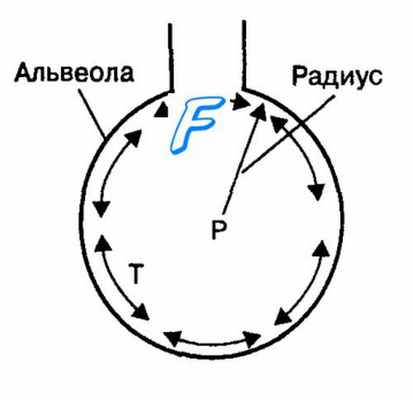
Приложение закона Лапласа к изменению поверхностного натяжения слоя жидкости, покрывающего поверхность альвеол.
Изменение радиуса альвеол изменяет в прямой зависимости величину поверхностного натяжения в альвеолах (Т).
Давление (Р) внутри альвеол также варьирует при изменении их радиуса: уменьшается при вдохе и увеличивается при выдохе.
в) Давление в закрытых альвеолах, вызванное поверхностным натяжением. Когда воздухоносные пути, ведущие от легочных альвеол, закрыты, поверхностное натяжение в альвеолах обусловливает спадение альвеол. Вследствие этого в альвеолах развивается положительное давление, действие которого направлено на выталкивание воздуха. Величину развивающегося таким путем давления в альвеоле можно вычислить по формуле:
Давление = 2 х Поверхностное натяжение / Радиус альвеолы.
Для альвеолы среднего размера, имеющей радиус около 100 мкм и выстланной нормальным сурфактантом, давление равно около 4 см вод. ст. Если альвеола была бы выстлана слоем чистой воды без сурфактанта, расчетное давление составляло бы около 18 см вод. ст., т.е. в 4,5 раз больше. Отсюда видно, насколько важным является сурфактант для снижения поверхностного натяжения в альвеолах и, следовательно, для снижения усилия, которое потребуется от дыхательных мышц для растяжения легких.
г) Влияние радиуса альвеолы на вызванное поверхностным натяжением давление. Из приведенной формулы следует, что давление, возникающее в альвеоле вследствие поверхностного натяжения, обратно пропорционально величине радиуса альвеолы, т.е. чем меньше альвеола, тем больше вызванное поверхностным натяжением давление. Таким образом, если радиус альвеолы окажется в 2 раза меньше нормального (50 мкм вместо 100), давление увеличивается в 2 раза.
Особое значение это имеет для недоношенных новорожденных, у многих из которых размеры радиуса альвеол составляют менее 1/4 таковых у взрослых. Обычно секреция сурфактанта в альвеолах начинается на 6-7 мес внутриутробного развития, в некоторых случаях даже позднее этого срока, поэтому у многих недоношенных детей в момент рождения в альвеолах еще нет сурфактанта или его очень мало, в результате их легкие имеют высокую тенденцию к спадению (иногда в 6-8 раз больше, чем у нормального взрослого). Такое состояние называют синдромом респираторного дистресса новорожденных. Без применения интенсивной терапии (продолжительного искусственного дыхания под положительным давлением) такое состояние приводит к смерти.
Видео физиология этапов дыхания, внешнего дыхания, спирометрии - профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Сурфактант. Поверхностное натяжение и спадение альвеол
7.1. Механизмы нарушения альвеолярного дыхания
Как известно, газообмен в легких происходит благодаря диффузии газов через альвеолярно-капиллярную мембрану по градиенту концентрации 02 и С02. Объемная скорость диффузии определяется по формуле:
(Р1 - Р2) - это трансмембранный градиент парциального давления газа. Для О2 он равен 60 мм рт.ст. (в альвеолярном воздухе давление О2 (Р1) равно 106 мм рт.ст.; в легочных капиллярах (Р2) - 46 мм рт.ст.) в начальном отрезке капилляра. Градиент парциального давления СО2 имеет противоположное направление (Р1 - 46 мм рт. ст. в легочных капиллярах, Р2- 40 мм рт. ст. в альвеолах) и равен 6 мм рт. ст. в начальном отрезке капилляра. Эти градиенты давлений служат движущей силой диффузии О2 и СО2, т.е. газообмена в легких;
α - растворимость газов в тканях. Поскольку, растворимость СО2 в мембране примерно в 20 раз больше, чем О2, то и скорость диффузии СО2 через альвеолярно-капиллярную мембрану в 20 раз выше;
К- константа диффузии;
S - площадь альвеол (или площадь газообмена, которая составляет 50-100 м2);
d - это толщина альвеолярно-капиллярной мембраны, которая препятствует диффузии газов. В организме здорового человека толщина альвеолярно-капиллярной мембраны варьирует от 0,3 до 2 мкм (рис.10).
Изнутри альвеолы выстланы сурфактантом. Сурфактант - это поверхностно-активное вещество (ПАВ), выстилающее альвеолы, продуцируется альвеолоцитами второго порядка и на 70-80% состоит из фосфолипидов (фосфатидилхолин, фосфатидилглицерол, дипальмитоилфосфатидилхолин и т.д.), а на 20-30% - из белков (апопротеины, сывороточные альбумины). В условиях нормы постоянно происходит обновление сурфактанта за счет фагоцитоза альвеолярными макрофагами и его синтеза альвеолоцитами 2-типа. Сурфактант выполняет следующие функции: снижает поверхностное натяжение альвеол и обеспечивает их стабилизацию, предупреждает спадение альвеол, обеспечивает несмачиваемость при вдохе, улучшает диффузию газов, увеличивает растяжимость легких, препятствует пенообразованию. В регуляции секреции сурфактанта участвуют различные гормоны, в частности, катехоламины, эстрогены, тироксин, глюкокортикоиды, которые усиливают выработку сурфактанта. В то же время инсулин, андрогены, а также атропин, белки и липиды сурфактанта угнетают его синтез. Уменьшение выработки сурфактанта наблюдается при гиповентиляции, хронической гипоксии, легочной гипертензии, при поражении альвеолоцитов 2-го типа, при вдыхании табачного дыма и чистого кислорода и т.д. При этом нарушается диффузия газов, развиваются ателектазы и отек легких, образуется пена.
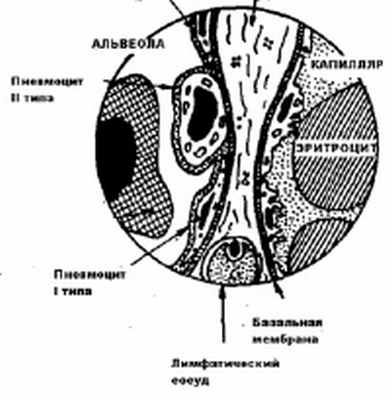
Рис.10. Схема альвеолярно- капиллярной мембраны ( Воложин А.И.,2000)
Недостаток внутрилегочного сурфактанта служит первопричиной развития респираторного дистресс-синдрома новорожденных у недоношенных детей.
Своеобразие патологии дыхательной системы у детей раннего возраста может быть обусловлено особенностями ее строения и функции. Наличие узких носовых ходов, а также длинных, узких и малоразветвленных бронхов, обилие межуточной ткани, кровеносных и лимфатических сосудов в легких способствуют возникновению разнообразных пневмопатий, которые лежат в основе синдрома дыхательных расстройств (СДР) у значительного числа новорожденных.
Наиболее частой и тяжелой формой пневмопатий являются гиалиновые мембраны, особенно у недоношенных детей, развивающихся в условиях патологического течения беременности и родов. В образовании гиалиновых мембран, состоящих из фибрина, сывороточных протеинов и клеточных элементов, патогенетическую роль играет недостаточность фибринолитической системы. К нарушению фибринолитических процессов и ретенции фибрина в альвеолах может предрасполагать дефицит плазминогена. Гиалиновые мембраны располагаются в просвете альвеолярных ходов, альвеол, легочных бронхов, лежат как уплотненные массы в просвете свободно или выстилают стенки дыхательных путей, способствуя их обтурации, нарушению легочной вентиляции, развитию гипоксемии, вазоконстрикции сосудов и гипоперфузии легких. В то же время возникают инактивация альвеолярного сурфактанта, ухудшение расправления легочной ткани и развиваются обструктивно-рестриктивные формы ДН у детей.
К не менее тяжелой разновидности пневмопатий относится отечно-геморрагический синдром. В легких отмечается резкое усиление кровенаполнения сосудов всех калибров, особенно капилляров. Просвет альвеолярных ходов и альвеолы заполнены отечной жидкостью и кровью; отечна межуточная ткань. Массивные легочные кровоизлияния могут быть обусловлены синдромом ДВС, развивающимся при асфиксии или внутриутробном инфицировании плода. В легких формируются ателектазы - от сегментарных до тотальных, сочетающиеся с отеком и другими гемодинамическими изменениями, а также признаками незрелости легких. У детей обнаруживаются одышка, хрипы, ослабление дыхания, респираторный или смешанный ацидоз.
Течение СДР может быть острым и подострым. В период восстановления исчезают признаки ДН и нарушения функции ЦНС, нормализуется кровообращение, исчезают отеки. Однако у детей, перенесших СДР, возможно развитие хронической легочной патологии. В ряде случаев развитие бронхолегочной дисплазии связано с незрелостью бронхоальвеолярной системы легких и изменениями, обусловленными гиалиновыми мембранами. К ним относятся бронхиолярный и интерстициальный фиброз, облитерирующий бронхиолит с интерстициальным некрозом. Возникающая при этом хроническая ДН сопровождается гипоксемией, гиперкапнией и гипоксией разных органов и тканей.
7.2. Респираторный дистрресс-синдром. Этиология и патогенез
В последние годы для оценки этиологии и патогенеза ДН используют термин острый респираторный дистресс-синдром (ОРДС), который может возникать у детей и взрослых.
Респираторный дистресс-синдром - патологический процесс, характеризующийся артериальной гипоксемией, резистентной к обычным методам кислородотерапии, первичным повреждением альвеолярно-капиллярной мембраны, интерстициальным отеком легких, микроателектазированием и образованием в альвеолах и бронхиолах гиалиновых мембран (рис.11).
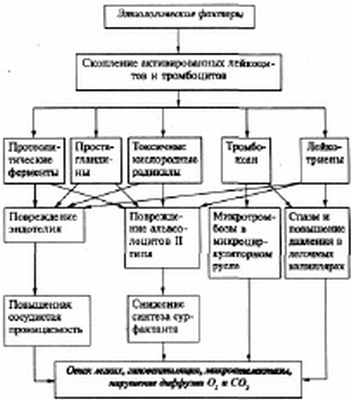
Рис.11. Патогенез РДСВ (А.Н. Окороков, 2005)
Он является завершающей фазой многообразных повреждений легких (инфекционными патологическими агентами, токсинами бактериального и небактериального происхождения, медиаторами альтерации. ОРДС может быть следствием травмы грудной клетки, ее длительного сдавления, аутоиммунных заболеваниях и т.д. Однако ОРДС клинически проявляется одышкой, кашлем, с выделением мокроты, имеющей примесь крови, мелкопузырчатыми влажными хрипами в легких, цианозом, не исчезающим даже при оксигенотерапии.
Первое описание клиники ОРДС было в 1946 году, однако название указанной патологии претерпело многочисленные изменения, включающие такие названия, как острое повреждение легких (ОПЛ), «мокрые легкие», «тяжелые легкие», «шоковые легкие», «фиброзирующий альвеолит», «некардиогенный отек легких». В 1967 Эсбахом было предложено название «острый респираторный дистресс синдром», характеризующийся крайне тяжелым острым повреждением легких. Отличительными признаками ОРДС являются:
1) острое начало;
2) снижение индекса оксигенации (PаO2/Fi O2 до 200 мм рт. ст., где Fi O2 - фракция кислорода во вдыхаемом воздухе);
3) двустороннее поражение легких на Ro;
4) давление заклинивания легочной артерии ≤ 18 мм. рт. ст.
ОРДС принято делить по степени тяжести, по величине индекса оксигенации (PаO2) на следующие формы:
– умеренное течение - PаO2/Fi O2 от 300 до 200 мм рт.ст.,
– течение средней тяжести - PаO2/Fi O2 от 200 мм.рт.ст.,
– тяжелый (критический) вариант патологии PаO2/Fi O2
Последний индекс оксигенации является достоверным показателем летального исхода.
Так, при умеренной степени ОРДС летальность достигает 30%, при средней степени возрастает до 34%, а при тяжелой – увеличивается до 45%.
Различают легочный, или первичный, ОРДС и внелегочный – неспецифический ОРДС.
Легочный или первичный ОРДС может развиться на терминальных стадиях первичных специфических поражений легких, в частности при астматическом статусе, остром респираторном синдроме, при пневмониях тяжелого течения, вызванных chlamidia, varicella, при системной красной волчанке, синдроме Гудпасчера. Одним из важных патогенетических факторов острого поражения легких при указанных формах патологии является искусственная вентиляция легких, вызывающая в ряде случаев перерастяжение альвеол, разрывы межальвеолярных перегородок, образование воздушных кист в легких, множественные микроателектазы. При этом повреждению в большей степени подвергаются менее поврежденные, сохранившие эластичность альвеолы.
Внелегочная форма ОРДС получила название «неспецифического поражения интактных легких», развивается на фоне длительных расстройств микроциркуляции в легких и тяжелой циркуляторной гипоксии.
Факторами риска развития внелегочной формы ОРДС являются:
1) различные по этиологии виды шока (травматический, геморрагический, септический, ожоговый);
2) синдром жировой эмболии;
3) острый деструктивный панкреатит;
4) длительное воздействие ряда лекарственных препаратов (сульфаниламиды, антибиотики, наркотики, кордарон);
5) длительная экстракорпоральная перфузия, массивная гемотрасфузия;
6) реперфузия ишемизированных тканей.
Развитие и тяжесть течения ОРДС зависит в определенной степени от характера генотипа, в частности от репликации гена FAAH, а также гена POPDC3.
Имеются данные, что у больных с одним из указанных факторов риска ОРДС развивается у 25% пациентов, а при наличии двух или более факторов риска частота развития ОРДС удваивается.
Для внелегочной формы ОРДС характерны следующие стадии развития:
1) экссудативная, острая, развивающаяся в течение 6 суток от начала процесса;
2) пролиферативная, подострая (4- 10 суток);
Различают три патоморфологических фазы РДСВ: острую, подострую и хроническую.
Острая фаза РДСВ длится 2-5 суток и характеризуется развитием интерстициального, а затем альвеолярного отека легких. В отечной жидкости содержатся белок, эритроциты, лейкоциты. Наряду с отеком выявляются поражение легочных капилляров и выраженное повреждение альвеолярного эпителия I и II типов. Повреждение альвеолоцитов II типа приводит к нарушению синтеза сурфактанта, вследствие чего развиваются микроателектазы. При благоприятном течении РДСВ через несколько дней острые явления стихают, отечная жидкость рассасывается. Однако такое благоприятное течение РДСВ наблюдается не всегда. У части больных РДСВ переходит в подострую и хроническую фазы.
Подострая фаза характеризуется интерстициальным и бронхоальвеолярным воспалением.
Хроническая фаза РДСВ — это фаза развития фиброзирующего альвеолита. В альвеолярно-капиллярной базальной мембране разрастается соединительная ткань, мембрана резко утолщается, уплощается, наблюдаются пролиферация фибробластов и усиленный синтез коллагена (его количество увеличивается в 2-3 раза). Выраженный интерстициальный фиброз может сформироваться уже через 2-3 недели. В хронической фазе имеют место изменения в сосудистом русле легких — запустевание сосудов, развитие микротромбозов. В конечном итоге развиваются хроническая легочная гипертензия и хроническая дыхательная недостаточность.
Сурфактант. Поверхностное натяжение и спадение альвеол
Легочные сурфактанты
Легочные сурфактанты
Сурфактант легких, состоящий преимущественно из фосфолипидов и белков, выполняет широкий спектр защитных функций, главной из которых является антиателектатическая. Выраженный недостаток сурфактанта приводит к спадению альвеол и развитию синдрома острой дыхательной недостаточности — РДСН (респираторный дистресс-синдром новорожденных). Сурфактант снижает поверхностное натяжение в альвеолах, обеспечивает их стабильность в процессе дыхания, предупреждает их спадение в конце фазы выдоха, обеспечивает адекватный газообмен, выполняет противоотечную функцию. Кроме того, он участвует в антибактериальной защите альвеол, повышает активность альвеолярных макрофагов, улучшает функцию мукоцилиарной системы, ингибирует ряд медиаторов воспаления при синдроме острого повреждения легких (СОПЛ) и остром дистресс-синдроме (ОРДС) взрослых.
При недостаточной продукции собственного (эндогенного) сурфактанта используются препараты экзогенного сурфактанта, полученные из легких человека, животных (быка, теленка, свиньи) или синтетическим путем.
Сурфактант, выделенный из легких человека, содержит в своем составе фосфолипиды — 80—85%, белки —10% и нейтральные липиды — 5—10%. До 80% фосфолипидов участвуют в процессе рециклирования и метаболизма в альвеолоцитах II типа. Cурфактант включает 4 класса белков (Sp-A, Sp-B, Sp-C, Sp-D), каждый из которых кодируется собственным геном, большую часть из которых составляет Sp-A.
Сурфактант синтезируется и секретируется альвеолоцитами II типа (а-II). На альвеолярной поверхности он состоит из тонкой фосфолипидной пленки и гипофазы, в которой располагаются мембранные образования. Это очень динамичная система — более 10% всего пула сурфактанта секретируется ежечасно.
Раннее использование препаратов сурфактанта при РДСН позволяет значительно снизить смертность на 40—60%, а также частоту полисистемных осложнений (пневмоторакс, интерстициальная эмфизема, кровотечения, бронхолегочная дисплазия и др.), связанных с неонатальным периодом у недоношенных детей.
Известные в настоящее время препараты легочного сурфактанта различаются по источнику получения и содержанию в них фосфолипидов и белков.
Механизм действия
ДПФХ — основной компонент сурфактанта, понижающий поверхностное натяжение в альвеолах. Фосфатидилглицерол (ФГл) играет важную роль в распространении сурфактанта по альвеолярной поверхности легких, способствуя его взаимодействию с кальцией и белками. Сурфактантный белок Sp-A прочно связывается с ДПФХ, принимает участие в формировании «тубулярного миелина» — мембранного компонента гипофазы сурфактанта, а также в иммунологической защите альвеол, связываясь с различными бактериями и вирусами. Sp-B также необходим для формирования решетчатых мембранных образований сурфактанта и активно участвует в доставке фосфолипидов на поверхность альвеол на границу раздела фаз «воздух—жидкость». Sp-C является компонентом только легочного сурфактанта, стабилизирует поверхностную пленку сурфактанта, является маркером а-II. Sp-D связывает фосфолипиды, выполняет важную защитную роль, активизирует функцию альвеолярных макрофагов.
Фармакокинетика
Фармакокинетика экзогенных сурфактантов изучена недостаточно. Каждый препарат является многокомпонентным соединением, что в значительной мере затрудняет исследование фармакокинетики как каждого его составляющего, так и препарата в целом. При прямой интратрахеальной инстилляции 70—90% вводимого сурфактанта достигает дистальных дыхательных путей и альвеол. Препарат равномерно и быстро распределяется по поверхности альвеол. При этом важную роль играют методика введения, доза препарата, свойства вводимого сурфактанта, положение больного, наличие или отсутствие бронхиальной обструкции, стадии болезни. Небольшое количество сурфактанта остается в верхних дыхательных путях и эндотрахеальной трубке. Введенный экзогенный сурфактант обнаруживается не только в альвеолах, но и в выстилающем жидкостном слое сурфактанта (гипофаза), а также в альвеолоцитах II типа. Следовательно, компоненты экзогенного сурфактанта имеют ту же фармакокинетику, что и составляющие природного сурфактанта. При интратрахеальном введении сурфактанта основное количество препарата обнаруживается в легких. Лишь следы липидов сурфактанта выявляются в сыворотке крови и в других органах через 48 ч после введения. Период полувыведения препаратов сурфактанта составляет 65—67 ч.
Место в терапии
Основное клиническое значение препаратов легочного сурфактанта определяется их эффективностью при тяжелых респираторных заболеваниях, связанных с первичным или вторичным дефицитом альвеолярного сурфактанта. К ним относятся следующие заболевания и синдромы:
Респираторный дистресс-синдром недоношенных новорожденных (РДСН), возникающий в результате незрелости легких и, как следствие, выраженного дефицита сурфактанта. Недостаточный синтез сурфактанта альвеолоцитами II типа и его быстрая инактивастного натяжения в альвеолах, их спадению (ателектазам), гиповентиляции и недостаточной оксигенации крови, развитию гиперкапнии и гипоксии. Нарушения в системе легочного кровотока вызывают повреждение всех составных компонентов аэрогематического барьера (эпителий, интерстиций, эндотелий), отек легких и присоединение инфекции. В результате эти изменения приводят к развитию РДС.
Синдром аспирации мекония (САМ) у новорожденных возникает в результате попадания мекония в дыхательные пути, что приводит к нарушению синтеза сурфактанта, его инактивации компонентами мекония, спадению альвеол и развитию воспаления. Назначение сурфактанта способствует уменьшению тяжести заболевания, предупреждает развитие острой дыхательной недостаточности (ОДН).
Синдром острого повреждения легких (СОПЛ) и острый респираторный дистресс-синдром (ОРДС) взрослых — как наиболее тяжелая форма проявления СОПЛ. Легкие всегда вовлекаются в патологический процесс у больных, находящихся в критическом состоянии, вне зависимости от его этиологии. СОПЛ является основным компонентом полиорганной недостаточности, развивается в результате вторичного повреждения легких, включая все компоненты аэрогематического барьера и альвеолярного сурфактанта. Важное место в патогенезе СОПЛ/ОРДС принадлежит воспалительной реакции и вторичному дефициту сурфактанта, который возникает в результате местного (пневмония, вдыхание токсических веществ) или системного (множественная травма, сепсис, длительная искусственной вентиляци легких (ИВЛ), осложнение после искусственного кровообращения и при посттрансфузионном синдроме) повреждения легких с развитием воспалительной реакции. Возникающий дефицит сурфактанта приводит к спадению альвеол, мелких дыхательных путей, отеку легких, развитию ОДН.
Пневмония сопровождается повреждением альвеолярной паренхимы, отеком легких с выходом белков плазмы крови в альвеолы, что оказывает угнетающее действие на активность сурфактанта и к спадению альвеол. Назначение сурфактанта в этих случаях приводит к улучшению газообмена, способствуя расправлению спавшихся альвеол, т.е. разрешению ателектазов.
Туберкулез легких, особенно его распространенные формы, вызывает глубокие нарушения в сурфактантной системе легких, обширные деструктивные и ателектатические изменения альвеолярной паренхимы, особенно в участках легкого, граничащих с крупными туберкулезными фокусами (инфильтраты, каверны и др.). Применение препаратов сурфактанта в комплексном лечении туберкулеза позволяет уменьшить частоту возникновения сурфактант-зависимых изменений в легких, повысить поверхностно активные свойства легочного сурфактанта и способствует более быстрому обратному развитию воспалительных изменений.
В настоящее время разработаны основные принципы сурфактантотерапии:
- исчерпывающая базовая терапия;
- использование принципов неповреждающей механической вентиляции;
- раннее начало сурфактантотерапии (первые часы, сутки с момента развития РДС), при индексе оксигенации РаО2/ FiО2 ниже 200 мм рт. ст.;
- эндобронхиальное болюсное введение препарата в оптимальной дозе и повторное введение через 6—8 ч в случае положительного ответа на первое введение;
- сурфактантотерапия при положительном ответе на первое введение должна проводиться до достижения индекса оксигенации более 300 мм рт. ст., стойкого клинико-рентгенологического улучшения.
Переносимость и побочные эффекты
Препараты легочного сурфактанта, как правило, хорошо переносятся. Для предупреждения осложнений введение сурфактанта должно проводиться в специализированном отделении и врачами, имеющими соответствующую подготовку и опыт применения препаратов сурфактанта. В отдельных случаях возможна закупорка эндотрахеальной трубки слизью. Быстрое введение эмульсии препарата может привести к обтурации не полностью раскрытых дыхательных путей, бронхиальной обструкции или вызвать рефлюкс сурфактанта. В редких случаях возможно легочное кровотечение, главным образом у новорожденных с выраженными признаками незрелости легких.
Сразу после введения препарата сурфактанта возможно быстрое увеличение растяжимости легких, что требует коррекции показателей вентиляции. Улучшение газообмена может привести к росту концентрации кислорода в крови. В этом случае необходимо уменьшить концентрацию кислорода в газовой смеси, чтобы предупредить гипероксемию.
Для получения максимального эффекта от сурфактантотерапии и снижения частоты осложнений, связанных с искусственной вентиляцией легких и осложненным неонтальным периодом у недоношенных новорожденных с РДС обязательна предварительная стабилизация центральной гемодинамики и показателей тканевой трансфузии (лечение гиповолемии, анемии, олигурии).
Противопоказания и предостережения
Противопоказания к применению сурфактанта отсутствуют, однако следует иметь в виду возможную повышенную чувствительность к компонентам препарата.
Механизм действия
ДПФХ — основной компонент сурфактанта, понижающий поверхностное натяжение в альвеолах. Фосфатидилглицерол (ФГл) играет важную роль в распространении сурфактанта по альвеолярной поверхности легких, способствуя его взаимодействию с кальцией и белками. Сурфактантный белок Sp-A прочно связывается с ДПФХ, принимает участие в формировании «тубулярного миелина» — мембранного компонента гипофазы сурфактанта, а также в иммунологической защите альвеол, связываясь с различными бактериями и вирусами. Sp-B также необходим для формирования решетчатых мембранных образований сурфактанта и активно участвует в доставке фосфолипидов на поверхность альвеол на границу раздела фаз «воздух—жидкость». Sp-C является компонентом только легочного сурфактанта, стабилизирует поверхностную пленку сурфактанта, является маркером а-II. Sp-D связывает фосфолипиды, выполняет важную защитную роль, активизирует функцию альвеолярных макрофагов.
Физики обнаружили фазовый переход в пленках внутри легких
Легочный сурфактант, покрывающий альвеолы, может изменять свою структуру при изменении кривизны поверхности. Происходящий при этом фазовый переход может объяснить механизм повышения устойчивости легких при дыхании, пишут ученые в Proceedings of the National Academy of Sciences.
Для повышения устойчивости легких во время дыхания специальные клетки на внутренней поверхности легочных альвеол выделяют из плазмы крови легочный сурфактант — смесь поверхностно-активных веществ, которая препятствует слипанию клеток и возникновению ателектаза. Утоньшение или разрывы в слое легочного сурфактанта в результате нарушения работы альвеол могут приводить к спадению легких, что опасно для жизни. Для объяснения механизмов работы легочных сурфактантов мономолекулярные слои таких веществ исследуют в лабораторных условиях. Обычно для таких анализов используются сурфактанты естественного или искусственного происхождения, которые наносят на плоские поверхности — считается, что кривизна альвеол достаточно маленькая и не может заметно влиять на взаимодействие молекул внутри пленки.
Амит Кумар Сахан (Amit Kumar Sachan) и Джозеф Засадзински (Joseph A. Zasadzinski) из Университета Миннесоты решили проверить, что на самом деле происходит с мономолекулярной пленкой из экзогенного легочного сурфактанта при увеличении кривизны поверхности до кривизны альвеол. Для этого ученые использовали легочный сурфактант Сурванта, полученный из легкого быка, который наносили на газовые пузыри различного размера. Для изучения структуры и динамики поверхности авторы работы использовали конфокальную флуоресцентную микроскопию.

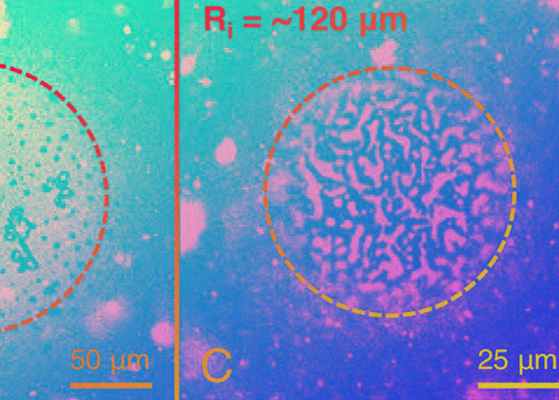
Зависимость структуры мономолекулярного слоя легочной сурфактанта на плоской поверхности (слева), и на двух пузырях различного радиуса
A. K. Sachan et al./ PNAS, 2017
Оказалось, что на поверхностях с небольшой кривизной (то есть плоских или почти плоских) сурфактант находится в состоянии, в котором сосуществуют две жидких фазы: основная односвязная среда с небольшими включениями второй фазы, существующих в виде доменов круглой формы. При увеличении кривизны поверхности (то есть уменьшения радиуса частицы, на которую происходит осаждение), структура пленки сильно перестраивается и происходит образование вытянутых линейных доменов. Для поверхностного натяжения всех межфазных границ порядка 45 миллиньютонов на метр, характерного для сурфактантов, такой переход происходит при радиусе кривизны около 100 микрон, то есть как раз порядка размера альвеолы легких.
Чтобы изучить динамические свойства образовавшейся структуры, авторы работы проанализировали изменения, которые происходят в пленке с течением времени или при изменении температуры. Оказалось, что повышение температуры от комнатной до температуры тела не приводит к структурным изменениям на поверхностях любой кривизны. При этом «старение» пленок с течением времени проходит на разных поверхностях по-разному. Так, на плоской поверхности структура полностью сохраняется, а на сферических поверхностях со временем происходит образование более анизотропных доменов за счет слияния нескольких круглых.
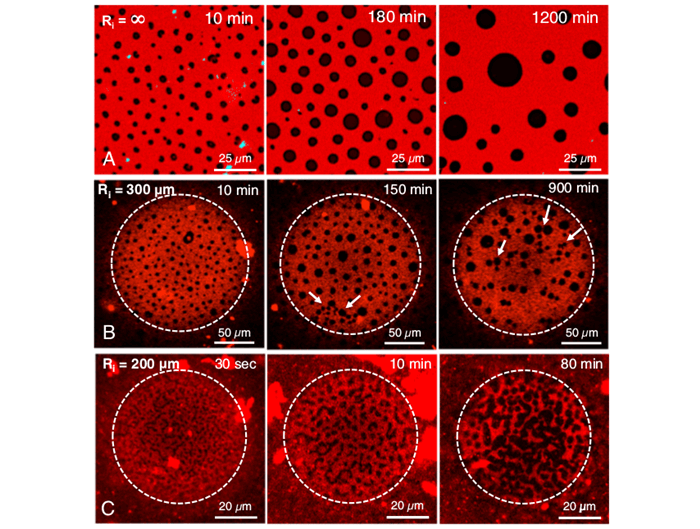
Изменение структуры мономолекулярного слоя сурфактанта с течением времени на поверхностях различной кривизны
A. K. Sachan et al./ PNAS, 2017
Ученые отмечают, что подобный фазовый переход не может быть объяснен в рамках существующей теории поведения жидких кристаллов с изотропными доменами. Вероятнее всего, к формированию фазы с линейными доменами приводит анизотропия энергии изгиба мономолекулярной пленки. При этом подобную структуру можно наблюдать не только в мономолекулярных слоях на искривленных поверхностях, но и в двухслойных везикулах, плавающих в растворе.
По словам авторов работы, обнаруженный эффект поможет объяснить поведение легочных альвеол во время их расширения, а также механизм повышения устойчивости легких при дыхании за счет легочного сурфактанта.
Стоит отметить, что в тонких упорядоченных пленках на искривленных поверхностях часто можно наблюдать образование необычных структур. Например, в жидкокристаллических холестерических фазы на искривленных поверхностях можно получать красивые хиральные структуры.
Читайте также:
