Свойства тромбоцитов. Тромбоцитарная пробка
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Тромбоциты являются безъядерными образованиями. В крови основная масса тромбоцитов имеет характерную дискоидную фор¬му. Дискоидная форма поддерживается у тромбоцита циркулярным микротубулярным кольцом. У тромбоцита имеется 4 основные функциональ¬ные зоны. Первая – периферическая зона, представляет собой двухслойную фосфолипидную мембрану и пространства, прилегающие к ней с двух сторон. Золь-гель зона, является вязким матриксом цитоп¬лазмы тромбоцита, прилегая к субмембранной области. Зона органелл, включает в себя органеллы, рас¬положенные по всей цитоплазме неактивных тромбоцитов. Зона мембран, состоит из каналов плотной тубулярной системы, напоминающей структуру миоцитарного саркоплазматического ретикулума. Тромбоциты являются основой всего первичного гемостаза за счет их способности путем агрегации тромбировать повреждения в сосудах. Формируя динамичные агрегаты, тромбоциты влияют на реологические свойства крови и тем самым на состояние трофики тканей во всем организме.
1. Громнацкий Н.И., Медведев И.Н. Тромбоцитарный гемостаз у больных артериальной гипертонией с метаболическим синдромом // Международный медицинский журнал. Клиника. Диагностика. Лечение. – 2002. – № 5. – С. 413.
2. Громнацкий Н.И., Медведев И.Н. Коррекция нарушений тромбоцитарного гемостаза немедикаментозными средствами у больных артериальной гипертонией с метаболическим синдромом // Клиническая медицина. – 2003. – Т.81, № 4. – С.31-34.
3. Громнацкий Н.И., Медведев И.Н., Кондратов И.В. Изменения внутрисосудистой активности тромбоцитов больных артериальной гипертонией с метаболическим синдромом и его коррекция ловастатином (медостатиномR) // Русский медицинский журнал. – 2003. – № 5. – С.258.
4. Краснова Е.Г., Медведев И.Н. Тромбоцитарная активность гемостаза у поросят молочного питания // Ветеринарная практика. – 2011. – № 3. – С.34.
6. Медведев И.Н., Громнацкий Н.И., Наумов М.М., Беспарточный Б.Д. Способ лечения тромбоцитовпатии при метаболическом синдроме. Патент на изобретение RUS 2261705 29.01.2004.
7. Медведев И.Н., Беспарточный Б.Д., Горяинова И.А. Способ профилактики тромбоцитарных нарушений у новорожденных телят с диспепсией. Патент на изобретение RUS 2323731 27.11.2006.
8. Медведев И.Н., Беспарточный Б.Д. Способ коррекции тромбоцитопатии у лиц с метаболическим синдромом. Патент на изобретение RUS 2333758 26.02.2007.
9. Медведев И.Н., Краснова Е.Г., Завалишина С.Ю. Тромбоцитарная активность у поросят в фазу молозивного и молочного питания // Ветеринарная практика. – 2011. – № 4. – С.30.
10. Симоненко В.Б., Медведев И.Н., Кумова Т.А. Воздействие эпросаратана на агрегационную способность тромбоцитов у больных артериальной гипертонией при метаболическом синдроме // Клиническая медицина. – 2008. – Т. 86, № 4. – С. 19-21.
Тромбоциты являются безъядерными форменными элементами крови, участвующими в процессе гемостаза [4]. В крови основная масса тромбоцитов имеет характерную дискоидную форму с почти гладкой поверхностью. Диаметр их составляет от 2 до 4 мкм, площадь поверхности около 8 мкм 2 , а объем - 6-9 фл (фл - фемтолитр=10 -15 л). Дискоидная форма поддерживается у тромбоцита циркулярным микротубулярным кольцом, локализующимся у внутренней поверхности мембраны. Тромбоциты обладают двухслойной мембраной, которая по своему составу и строению несколько отличается от мембран прочих форменных элементов крови тем, что в ней больше фосфолипидов расположено асимметрично [6].
В кровяных пластинках непосредственно у внутреннего слоя мембраны находится микротубулярное кольцо, образованное белком тубулином, локализованное вдоль максимальной окружности мембраны. Тубулин занимает относительно большую поверхность, вследствие чего сохраняется дискоидная форма интактных кровяных пластинок. У дискоидных форм микротрубочки локализуются по внутреннему периметру мембраны - в случае активации они разрушаются и хаотично распределяются по цитоплазме с последующим изменением формы клетки из дискоидной в сферическую.
Тромбоциты в результате стимуляции проявляют выраженную адгезию, агрегацию и секрецию. Так, в случае соприкосновения с чужеродной поверхностью тромбоцит активируется, превращается в сфероцит, имеющий множество отростков, размер которых может существенно превышать поперечник самих тромбоцитов. В основе данных изменений формы лежит нарастание уровня Са 2+ в их цитоплазме, что ведет к деполимеризации тубулина, приводя к растворению микротубулярного кольца и ультраструктурной перестройке внутренней части тромбоцитов с формированием нитей актина. Возникновение псевдоподий обеспечивает быстрый контакт отдельных тромбоцитов между собой, замедляя кровоток в месте их активации [10].
У тромбоцита имеется 4 основные функциональных зоны. Первая - периферическая зона, представляет собой двухслойную фосфолипидную мембрану и пространства, прилегающие к ней с двух сторон. Мембранные интегральные белки проникают сквозь мембрану и обеспечивают связь с цитоскелетом кровяной пластинки. Кроме того, они выполняют функции рецепторов, каналов, насосов, участвуя в процессе активации тромбоцита. Часть интегральных протеинов, имеющих массу полисахаридных молекул, на поверхности тромбоцитов образуют внешнее покрытие липидногобислоя - гликокалекс, способный адсорбировать на себе большое количество белков. В этой связи периферическая зона кровяных пластинок осуществляет барьерную функцию, способствуя обеспечению нормальной формы тромбоцита, реализуя сквозь неё обмен веществ, активацию и весь процесс участия тромбоцитов в гемостазе [7].
Вторая зона - золь-гель зона, является вязким матриксом цитоплазмы тромбоцита, прилегая к субмембранной области. В нее входят различные белки (до 50 % от всех белков тромбоцитов). Их состояние зависит от интактного или активного состояния самого тромбоцита. Внутри зоны золь-гель находится большое число зёрен гликогена, по сути, являющихся запасом энергетического субстраттромбоцита. Также в этой зоне локализованы сократительные протеины, в связи с чем она весьма важна для ретракции агрегировавших тромбоцитов и для их реакции высвобождения [5].
Третья зона - зона органелл, включает в себя органеллы, расположенные по всей цитоплазме неактивных тромбоцитов: пероксисомы, митохондрии, 3 типа гранул хранения (α -гранулы, плотные гранулы и γ-гранулы (лизосомы)) и аппарат Гольджи.
Наиболее многочисленными являются α-гранулы. В одной клетке их может быть от 40 до 80. В их состав входит более 30 белков, необходимых для гемостаза. α-гранулы - это основной источник прокоагулянтных веществ тромбоцитов, они могут экспрессировать на своей наружной поверхности фосфолипиды с отрицательным зарядом, фактор V, GpIIb/IIIа, CD63. Кроме того, они необходимы для образования микровезикул, обладающих прокоагулянтной активностью. В α-гранулах находятся вещества, имеющие прямо противоположные свойства (ингибиторы и активаторы фибринолиза; соединения, стимулирующие и тормозящие процесс ангиогенеза), входящие в состав различных субпопуляциях α-гранул.
Как и в α-гранулах, в плотных безбелковых гранулах, находятся вещества, необходимые для процесса тромбоцитарного гемостаза - серотонин, адениновые нуклеотиды, Са 2+ , фибриноген, адреналин, фактор Виллебранда, антигепариновый фактор. В лизосомах скрыты различные гидролитические ферменты [3,5].
Четверная - зона мембран, состоит из каналов плотной тубулярной системы (ПТС), весьма напоминающей структуру миоцитарного саркоплазматического ретикулума. В ней хранится и из нее идет секреция Са 2+ , что имеет большое значение для активации тромбоцита [6].
Большие концентрации АДФ (из поврежденных эритроцитов и стенок сосудов), а также оголенные субэндотелиальные структуры быстро активируют тромбоциты, меняя их форму, способствуя возникновению выростов и отростков (псевдоподий) с выделением гранул (дегрануляция) в окружающую среду.
Процесс активации тромбоцитов сопровождается выделением ионов Са 2+ из внутриклеточных гранул, что связано с опосредуемым фосфолипазой С гидролизом фосфатидилинозитол-4,5-бисфосфата до 1,4,5-инозитолтрифосфата (ИТФ) и диацилглицерола. После этого ИТФ соединяется со специфическим рецептором, что приводит к поступлению Са 2+ внутрь кровяных пластинок, сопрягаясь с прохождением его сквозь плазматическую мембрану. Это носит название «гранулоуправляемый» кальциевый вход. Очень важна в этом процессе Са 2+ - воспринимающая молекула внутриклеточных гранул - молекула стромы взаимодействия-1 - STIM1 (stromalinteractionmolecule 1) и четыре трансмембранных белковых канала CRACM1 (Calcium-releaseactivatedcalciummodulator) или Orai1. Под воздействием STIM1 в плазмолемме происходит открытие Orai1 канала. Еще один механизм, ведущий к поступлению ионов Са 2+ в тромбоциты, непосредственно связан с рецептор-зависимым кальциевым каналом - Р2Х1, активирующим под действием диацилглицерола, возникающим в ходе распада фосфатидилинозитол-4,5-бисфосфата. При этом поступление кальция в тромбоциты сквозь плазматическую мембрану возможно благодаря TRPC (canonical transient receptor potential channel) в ходе работы натриево-кальциевого насоса [8].
Очень важным для инициации адгезии является столкновение тромбоцитов между собой и стенкой сосудов. Вместе с тем наиболее важную роль в продвижении кровяных пластинок к очагу адгезии играют сдвиговые силы, развивающиеся в ходе циркуляции крови. Под влиянием индуктора происходит активация тромбоцитов, наступающая в следующей последовательности: изменение формы кровяных пластинок, агрегация, генерация эндопероксидов, простагландинов и тромбоксана, выброс в плазму плотных гранул и α-гранул.
Выраженность агрегации в значительной степени зависит от содержания в крови молекул фибриногена и числа мономеров фибрина. Для образования устойчивой связи между двумя тромбоцитами достаточно между ними одной нити фибриногена. Процесс активации тромбоцитов, стимулированный напряжением сдвига, является одним из механизмов запуска тромбообразования под влиянием прокоагулянтов, выделяемых тромбоцитами [9].
Обычно тромбоциты способны активироваться и адгезировать к эндотелию в зонах разветвлений артерий. Р-селектин-зависимое соединение и роллинг вызывают взаимодействие кровяных пластинок синтактным эндотелием, но данный процесс никогда не бывает выраженным.
Соединение тромбоцитов с эндотелием возможно благодаря Р-селектину и PSGL-1 (P-selecting lycoproteinligand 1) на фоне активации тромбоцитов и тормозит их перемещение. В ходе роллинга отмечается также адгезия тромбоцитов с различными клетками, опосредуемая экспрессией Р-селектина. При этом, вследствие выброса оксида азота, простациклина и прочих дезагрегирующих соединений происходит распад сформировавшихся агрегатов и отвыв тромбоцитов от неповрежденного эндотелия.
На фоне повреждения сосуда развивается адгезия тромбоцитов к различным субэндотелиальным белкам. В условиях низкого напряжения сдвига, наблюдающегося при альтерации крупных артерий и вен, кровяные пластинки адгезируют прямо к оголенным коллагеновым волокнам благодаря коллагеновым рецепторам - GpVI,GpIV и GpIa/IIa. В этих условиях выраженность адгезии во многом определяется типом коллагена. В условиях контакта тромбоцитов с коллагеном V происходит примерно в 3 раза слабее, чем к коллагену I и III, и примерно в 1,5 раза слабее, чем к коллагену IV. При этом к коллагену V типа происходит адгезия в основном отдельных тромбоцитов, а к коллагену I и III наблюдается массовое прилипание с формированием крупных многослойных агрегатов. Это обеспечивает то, что только в случае глубокого повреждения сосудов с оголением коллагеновых волокон I и III типов возможно возникновение пристеночных тромбозов [1].
В условиях высокого напряжения сдвига в условиях наступления травмы мелких артерий и артериол процесс адгезии тромбоцитов обеспечивается фактором Виллебранда, находящегося в плазме и имеющего 3 активных центра - два из них соединяются с рецепторами тромбоцитов (GpIb), а один - со структурами субэндотелия.
По причине достаточно высокого содержания в субэндотелии фактора Виллебранда независимо от величины скорости сдвига, а также от уровня его в плазме и тромбоцитах в случае оголения субэндотелиальных волокон обязательно происходит адгезия тромбоцитов [9].
Кровяные пластинки адгезируют с фактором Виллебранда через рецептор GpIb/IX/V и непосредственно с коллагеном без фактора Виллебранда - через GpVI. Прочная адгезия тромбоцитов происходит через активированные интегриновые рецепторы GpIIb/IIIa (рецепторы к фибриногену) и рецептор к коллагену - α2β1, а также благодаря созданию «мостов» с участием αVβ3-интегрина, эндотелиальной ICAM-1 и GpIbα. При этом интегрины создают связь между экстрацеллюлярными мембранными протеинами и белками внутри тромбоцитов, обеспечивая эффективную двустороннюю сигнализацию.
В ходе адгезии тромбоцитов к субэндотелию они меняют свою форму, распластываются, вследствие чего развивается значительное увеличение их поверхности. Эти явления дают возможность возникнуть более обширным связям между рецепторами тромбоцитов и структурами субэндотелия с прочной фиксации на повреждённой сосудистой стенке кровяных пластинок и их агрегатов [7].
Течение агрегации помогает фактор активации тромбоцитов (РАF) и, кроме того, тромбин, всегда генерирующийся в месте повреждения сосудистой стенки. Под действием слабых индукторов (адреналин, АДФ, серотонин, фибронектинвитронектин) развивается экспрессия рецепторов на поверхности тромбоцитов к фибриногену (GpIIb/IIIa), вследствие чего при наличии в среде Са 2+ он соединяет друг с другом 2 прилегающих тромбоцита. В обеспечении данного процесса из всех адгезивных протеинов основная роль принадлежит фибриногену, являющимся главным кофактором агрегации ввиду того, что его концентрация в плазме наибольшая по сравнению с прочими белками, участвующими в адгезии и по причине достаточно большой аффинности к тромбоцитарным рецепторам (GpIb/IIa). Кроме того, симметричное строение фибриногена дает ему возможность вступать в двухсторонние связи с различными рецепторами на поверхности тромбоцитов, создавая мостики, связывающие их [2].
На начальном этапе агрегация носит обратимый характер, т.к. после нее может развиться частичное или полное разрушение агрегатов - процесс дезагрегации. Ввиду того, что связь между тромбоцитами порой непрочна, то определенное количество агрегатов способно отрываться и уноситься с кровью. Эта агрегация называется первичной, или обратимой, не обладающей возможностью полного и окончательного прекращения кровотечения даже из небольших сосудов.
Большое значение имеет вторичная (необратимая) агрегация, сопровождающаяся процессом тромбоцитарной секреции. Слабые индукторы, соединяясь со своими рецепторами, на тромбоцитах вызывают повышение цитоплазматического Са 2+ с активацией фосфолипазы А2, выщепляющей из мембран кровяных пластинок арахидоновой кислоты, которая превращается в PgG2, PgH2 и тромбоксан А2 (ТхА2), являющиеся сильными агонистами агрегации и вазоконстрикторами. Выбрасываясь из тромбоцитов PgH2PgG2 и ТхА2, повышают уровень экспрессии фибриногеновых рецепторов и усиливают сигнал, передаваемый внутрь кровяных пластинок. ТхА2 активирует фермент фосфолипазу С и стимулирует полифосфоинозитольный путь активации тромбоцитов. При этом ТхА2 способствует выделению Са 2+ в цитоплазму из плотной тубулярной системы, что активирует актом иозиновую систему и процесс фосфорилирования протеинов.
На фоне активации тромбоцитов наступает дополнительная экспрессия интегрина GpIIb/IIIa (αIIbβ3) на мембране тромбоцитов, являющегося наиболее важным для адгезии и агрегации. В этих условиях GpIb инициирует межтромбоцитарный контакт, тогда как GpIIb/IIIa сохраняет возникающие агрегаты. В этой связи главным моментом, регулирующим переход обратимой агрегации в необратимую, следует считать экспрессию GpIIb/IIIa, наступающую под действием АДФ, ТхА2 и тромбина.
Появление в крови тромбина ведет к активации протеиназоактивируемых рецепторов РАR-1 РАR-3, РАR-4, связанных с G-белками, что обеспечивает рост концентрации Са 2+ внутри кровяных пластинок и развитие их агрегации [3,7].
В результате адгезии, агрегации и ретракции из тромбоцитов выбрасываются находящиеся в гранулах биологически значимые вещества - РАF,АДФ, адреналин, фибриноген, норадреналин, ТхА2, фактор Виллебранда, фибронектин, витронектини тромбоспондин, что существенно укрепляет образовавшийся тромбоцитарный тромб. Вышедший из кровяных пластинок в ходе ретракции фактор роста способствует ускорению репарации поврежденной сосудистой стенки. Восстановлению проходимости сосуда обеспечивают выделяемые из тромбоцитарных γ-грануллизосомальные энзимы. При этом происходит синтез тромбина, стимулирующего распластывание и агрегацию тромбоцитов и вызывающий выпадение сети фибрина, в которой всегда задерживаются отдельные лейкоциты и эритроциты [10].
В ходе агрегации кровяные пластинки меняют свой состав и форму. В самом начале агрегации и возникновения первых порций тромбина поверхность тромбоцитов не испытывает значимых изменений, но в некоторых кровяных пластинках отмечаются признаки распада цитоплазмы. Спустя 40-90 сек. течения агрегации уже часть тромбоцитов становится мутной, их цитоплазма набухает, клетки плотно прилипают друг к другу, хотя повреждений мембраны найти не удаётся. Некоторые тромбоциты в этих условиях теряют гранулы, в прочих же число гранул остаётся без изменений. Спустя 2-3 мин. после появления тромбина тромбоциты набухают, их цитоплазма бледнеет, α-гранулы фрагментируются на мелкие пузырьки. В этих условиях гранулы постепенно перемещаются к центру кровяной пластинки и в ходе сокращения актомиозиновых комплексов сквозь мембрану выталкиваются в плазму. В последующем тромбоциты истончаются и несколько удлиняются. В их цитоплазме определяются только митохондрии, тогда как гранулы уже не выявляются. В этих условиях тромбоциты плотно примыкают друг к другу, а между ними находится в большом количестве фибрин. Изменения формы кровяных пластинок сопряжены с утратой мембранной асимметрии фосфолипидов. В этих условиях имеющие отрицательный заряд фосфолипиды - фосфатидилсерин, и отчасти фосфатидилэтаноламин, переходят на наружный листок мембраны тромбоцита, что обеспечивает условия, необходимые для свёртывания крови, полимеризации нитей фибрина и консолидации тромбоцитарной пробки, а в последующем ретракции тромбоцитарного конгломерата [1,9].
Таким образом, тромбоциты по праву считаются основой всего первичного гемостаза за счет их способности путем агрегации тромбировать локусы повреждения в сосудах. При формировании из них избыточного количества динамичных агрегатов могут меняться реологические свойства крови и тем самым состояние трофики тканей во всем организме.
Рецензенты:
Грушкин А.Г., д.б.н., профессор кафедры ветеринарии и физиологии животных Калужского филиала РГАУ-МСХА имени К.А.Тимирязева, г. Калуга;
Смахтин М.Ю., д.б.н., профессор кафедры биохимии Курского государственного медицинского университета, г. Курск.
Свойства тромбоцитов. Тромбоцитарная пробка
Закрытие мелких повреждений в сосудах. Основная теория свертывания крови
а) Важность тромбоцитарного механизма для закрытия мелких повреждений в сосудах. Механизм формирования тромбоцитарной пробки очень важен для закрытия мельчайших разрывов в мелких кровеносных сосудах, которые появляются много тысяч раз ежедневно. Действительно, множество мелких дырочек в самих эндотелиальных клетках часто закрываются тромбоцитами, которые буквально сливаются с эндотелием, формируя дополнительную мембрану эндотелиальной клетки. У человека с низким содержанием тромбоцитов в крови ежедневно появляются буквально тысячи точечных кровоизлияний под кожей и во всех внутренних тканях, но этого не случается у людей с нормальным содержанием тромбоцитов в крови.
б) Свертывание крови в разорванном сосуде. Третьим механизмом гемостаза является формирование кровяного сгустка. Он начинает развиваться через 15-20 сек при серьезной травме сосудистой стенки, и через 1-2 мин — при незначительной. Запускают процесс свертывания покрывающие место повреждения вещества-активаторы, выделяющиеся из стенки травмированного сосуда, кровяных пластинок и белков крови. Физические явления этого процесса показаны на рисунке ниже, а в таблице перечислены наиболее важные факторы свертывания.
Процесс свертывания в травмированном сосуде
Если отверстие в сосудистой стенке не слишком велико, в течение 3-6 мин после повреждения сосуда все отверстие или разорванный конец сосуда заполняются сгустком крови. Через 20-60 мин происходит ретракция (сжатие) сгустка; это способствует дальнейшему закрытию сосуда. В ретракции сгустка важную роль играют также тромбоциты.
в) Фиброзная организация или растворение кровяного сгустка. После формирования кровяного сгустка возможны два пути его дальнейшего развития: (1) заполнение сгустка фибробластами, которые в дальнейшем формируют соединительную ткань на всем протяжении сгустка; (2) растворение сгустка. При небольшом отверстии в сосудистой стенке сгусток обычно заполняется фибробластами через нескольких часов после его формирования (этому способствует, по крайней мере, частично, фактор роста, секретируемый тромбоцитами). Процесс продолжается в течение примерно 1-2 нед вплоть до полной организации сгустка в фиброзную ткань.
Наоборот, если в ткань вытекло много крови и образовались сгустки там, где в них нет необходимости, внутри самого сгустка обычно активируются особые вещества, функционирующие как ферменты, растворяющие сгусток. Подробнее это изложено далее.
Механизм свертывания (коагуляции) крови
Основная теория. В крови и тканях обнаружены более 50 веществ, вызывающих свертывание крови или влияющих на него. Одни из них способствуют свертыванию и их называют прокоагулянтами, другие — тормозят этот процесс и их называют антикоагулянтами. Останется ли кровь жидкой или произойдет ее коагуляция, зависит от баланса между этими группами веществ. В нормальном кровотоке преобладают антикоагулянты, поэтому кровь, циркулирующая в кровеносных сосудах, не свертывается. Но при разрыве сосуда прокоагулянты из области повреждения ткани активируются и перекрывают действие антикоагулянтов, что способствует образованию сгустка.
Основные этапы коагуляции крови. Все исследователи, занимающиеся проблемой свертывания крови, согласны с тем, что в основе свертывания лежат три основных процесса: (1) в ответ на разрыв сосуда или повреждение самой ткани в крови происходит сложный каскад химических реакций с участием более дюжины факторов свертывания крови. Итогом этого каскада является образование комплекса активированных веществ, в совокупности называемых активатором протромбина; (2) активатор протромбина катализирует превращение протромбина в тромбин; (3) тромбин действует как фермент, превращающий фибриноген в нити фибрина, формируя сгусток, внутрь которого захватываются кровяные пластинки, клетки крови и плазма.
Начнем с обсуждения механизма формирования самого сгустка крови, а именно: с превращения протромбина в тромбин; затем вернемся к начальным стадиям процесса свертывания, в результате которых образуется активатор протромбина.
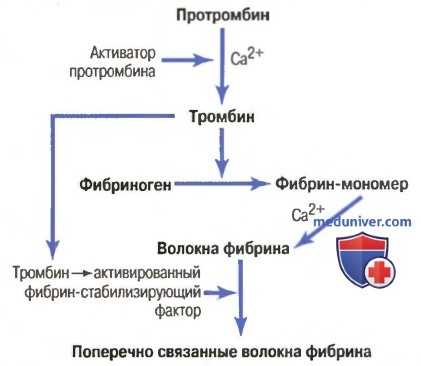
Схема превращения протромбина в тромбин и полимеризации фибрина с формированием волокон фибрина
Видео физиология остановки кровотечения (гемостаза) - профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Термин «гемостаз» означает предупреждение кровопотери. Всякий раз при повреждении или разрыве сосуда развивается гемостаз с помощью нескольких механизмов: (1) сужение сосуда; (2) образование тромбоцитарной пробки; (3) формирование кровяного сгустка в результате коагуляции крови; (4) врастание в кровяной сгусток фиброзной ткани, что закрывает место разрыва в сосуде окончательно.
а) Сужение сосуда. Сразу после перерезки или разрыва сосуда гладкая мышца его стенки сокращается; это мгновенно уменьшает вытекание крови из разорванного сосуда. Сужение сосуда возникает в результате: (1) локального мышечного спазма; (2) действия местных факторов, выделяющихся из травмированных тканей и тромбоцитов крови; (3) рефлекторных влияний. Рефлекторное сужение сосуда происходит в ответ на импульсы от болевых или других рецепторов в травмированном сосуде или рядом расположенных тканях. Однако в большей степени сужение сосуда связано с локальным сокращением его гладких мышц, возникающим в ответ на прямое повреждение сосудистой стенки. При повреждении мелких сосудов за основную часть их сужения ответственны тромбоциты в связи с высвобождением из них сосудосуживающего вещества — тромбоксана А2.
Чем сильнее травмирован сосуд, тем выше степень сосудистого спазма. Спазм может продолжаться в течение многих минут или даже часов, во время которых осуществляется процесс формирования тромбоцитарной пробки и коагуляция крови.
б) Формирование тромбоцитарной пробки. При незначительной травме кровеносного сосуда (на самом деле много очень небольших отверстий ежедневно появляется в разных сосудах системы кровообращения) повреждение часто закрывается тромбоцитарной пробкой, а не кровяным сгустком. Чтобы понять это, следует обсудить природу тромбоцитов.
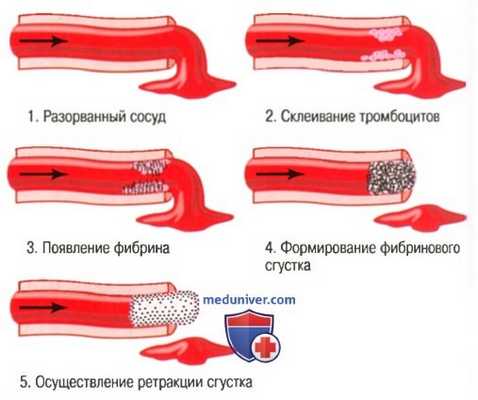
Процесс свертывания в травмированном сосуде
в) Физические и химические свойства тромбоцитов. Тромбоциты (называемые также кровяными пластинками) представляют собой мелкие диски диаметром от 1 до 4 мкм. Они образуются в костном мозге из мегакариоцитов— очень крупных клеток гемопоэтического ряда костного мозга; мегакариоциты фрагментируются на мелкие пластинки либо в костном мозге, либо вскоре после выхода мегакариоцитов в кровь, особенно во время их прохождении через капилляры. Нормальная концентрация кровяных пластинок в крови составляет 150000-300000 в 1 мкл.
Хотя кровяные пластинки не имеют ядра и не могут размножаться, они сохраняют многие функциональные характеристики целых клеток. В цитоплазме тромбоцитов находятся:
(1) молекулы актина и миозина, подобные сократительным белкам мышечных клеток, а также сократительный белок тромбостенин, способный вызывать сокращение тромбоцитов;
(2) остатки эндоплазматического ретикулума и, аппарата Гольджи, где синтезируются различные ферменты и хранится большое количество ионов кальция;
(3) митохондрии и ферментные системы, способные формировать аденозинтрифосфат и аденозиндифосфат;
(4) ферментные системы для синтеза простагландинов (локальных гормонов, вызывающих различные сосудистые и другие местные тканевые реакции);
(5) белок, называемый фибрин-стабилизирующим фактором, важную роль которого мы обсудим далее в связи со свертыванием крови;
(6) фактор роста, стимулирующий рост и размножение сосудистых эндотелиальных клеток, гладкомышечных клеток сосудов и фибробластов, что способствует окончательному заживлению поврежденных сосудистых стенок.
Существенную роль играет также клеточная мембрана пластинок. Снаружи она покрыта оболочкой из гликопротеинов, которые препятствуют прилипанию тромбоцитов к нормальному эндотелию, но способствуют их приклеиванию к поврежденным областям сосудистой стенки, особенно к поврежденным эндотелиальным клеткам и любому обнаженному коллагену, расположенному в глубине сосудистой стенки. Кроме того, мембрана пластинок содержит большое количество фосфолипидов, активирующих многие стадии процесса свертывания крови, которые будут изложены далее.
Механизм формирования тромбоцитарной пробки
Закрытие сосудистых отверстий с помощью тромбоцитов основано на нескольких важных функциях самих тромбоцитов. При контакте тромбоцитов с поверхностью поврежденного сосуда, особенно с коллагеновыми волокнами сосудистой стенки, свойства тромбоцитов немедленно резко изменяются. Они начинают увеличиваться в размере, принимают неправильную форму с множеством расходящихся псевдоподий, выступающих с их поверхности; их сократительные белки мощно сокращаются, способствуя выделению из гранул секрета, содержащего множество активных факторов. В результате тромбоциты становятся такими «липкими», что «приклеиваются» к коллагену в тканях и к белку, называемому фактором Виллебранда, который вытекает в травмированную ткань из плазмы. Пластинки секретируют большое количество АДФ, а их ферменты синтезируют тромбоксан А2. АДФ и тромбоксан, в свою очередь, действуют на прилежащие тромбоциты, активируя их, и «липкость» этих дополнительных тромбоцитов заставляет их «приклеиваться» к первоначально активированным тромбоцитам.
Следовательно, при появлении отверстия в стенке любого кровеносного сосуда поврежденная сосудистая стенка активирует последовательно нарастающее число тромбоцитов, которые сами притягивают все больше и больше дополнительных тромбоцитов, формируя тромбоцитарную пробку. Вначале это неплотная пробка, но она обычно успешно блокирует вытекание крови, если отверстие в сосуде небольшое. Затем во время последующего процесса свертывания крови формируются нити фибрина. Они прочно прикрепляются к тромбоцитам, уплотняя пробку.
Кровяные пластинки препятствуют внезапной потере крови, мгновенно закупоривая место повреждения кровеносных сосудов вначале временной, а затем постоянной тромбоцитной пробкой. Установлена также антипаразитарная активность тромбоцитов. При инфецировании организма человека шистосомами, трематодами (долгоживущие паразиты, вызывающие поражение внутренних органов человека — легких, печени и др.) тромбоциты оказывают на них цитотоксический эффект и поражают их.
Структура и функции тромбоцитов
Тромбоциты имеют дисковидную форму, диаметр от 2 до 5 мкм, объем 5— 10 мкм3 (рис. 7.6). В тромбоците выделяют несколько зон: периферическую, золя-геля, внутриклеточных органелл. На наружной поверхности периферической зоны располагается покров толщиной до 50 нм, содержащий плазматические факторы свертывания крови, энзимы, рецепторы, необходимые для активации тромбоцитов, их адгезии (приклеивания к субэндотелию) и агрегации (приклеивания друг к другу).
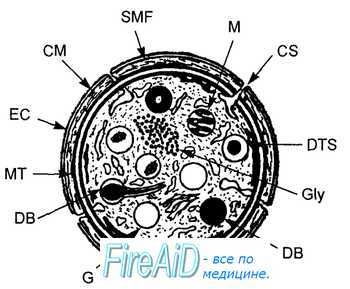
Рис. 7.6. Ультраструктурная организация тромбоцита. Сечение тромбоцита, параллельное горизонтальной плоскости. ЕС — периферическая зона тромбоцита, -СМ — трехслойная мембрана, SMF — субмембранный филамент, МТ — микротрубочки, Gly — гликоген. Зона opra- нелл: М — митохондрии, G — гранулы, DB — плотные гранулы, DTS — система плотных трубочек, CS — система открытых канальцев.
Периферическая зона. Мембрана тромбоцитов содержит «мембранный фосфолипидный фактор 3» — «фосфолипидную матрицу», формирующую активные коагуляционные комплексы с плазменными факторами свертывания крови. Мембрана богата арахидоновой кислотой, из которой фермент мембраны — фосфолипаза А2 образует свободную арахидоновую кислоту для синтеза простагландинов. Метаболиты простагландинов формируют короткоживущий агент — тромбоксан А2, вызывающий мощную агрегацию тромбоцитов. Фосфолипаза А2 активируется при контакте с адгезивным белком субэндотелия — коллагеном, обнажающемся при повреждении эндотелия, и с фактором Виллебранда, адгезирующемуся к субэндотелию после повреждении эндотелия сосудов.
В липидный бислой мембраны тромбоцита «встроены» гликопротеины I (субъединицы Ia, Ib, Ic), II (субъединицы IIа, IIIb), III (субъединицы IIIа, IIIb), ГУ, V, VI, которые обусловливают адгезивные и агрегационные функции тромбоцитов.
Функции гликопротеинов. Iа — рецептор адгезии (прилипание, приклеивание) тромбоцитов к коллагену субэндотелия. Комплекс «Ib — фактор свертывания крови IX» обеспечивает рецепцию фактора Виллебранда, что необходимо для адгезии пластинок на поврежденный субэндотелий. Iс — взаимодействуя с адгезивным белком субэндотелия фибронектином, обеспечивает адгезию пластинки к субэндотелию. IIа и IIb — необходимы для всех видов агрегации тромбоцитов. IIIа с гликопротеином IIb образуют Са2+-зависимый комплекс, связывающий на тромбоцитах фибриноген, что обеспечивает дальнейшую агрегацию тромбоцитов и ретракцию (сокращение) сгустка. V — гидролизуется тромбином, поддерживает агрегацию тромбоцитов. Недостаток в мембране тромбоцитов различных субъединиц гликопротеинов I—V вызывает повышенную кровоточивость.
Зона золя - геля гиалоплазмы прилегает к нижнему краю периферической зоны тромбоцита и, в свою очередь, отделяет зону внутриклеточных орга-нелл. В указанной зоне вдоль края клетки располагается сократительный аппарат тромбоцита — краевое кольцо микротрубочек, контактирующее с микрофиламентом. При стимуляции тромбоцита кольцо микротрубочек, сокращаясь, смещает гранулы к центру тромбоцита («централизация гранул»), сжимает их, вызывая секрецию содержимого гранул через систему открытых канальцев в плазму крови. Сокращение кольца микротрубочек позволяет тромбоциту образовывать псевдоподии (выросты цитоплазмы), что увеличивает его способность к агрегации.
Зона плотных и а-гранул I и II типа. Плотные гранулы содержат АДФ, АТФ, кальций, серотонин, норадреналин и адреналин. Кальций участвует в регуляции адгезии, сокращения, секреции тромбоцитов, активации его фосфолипаз и, следовательно, продукции в мембране тромбоцитов простагландинов, необходимых для образования тромбоксана А2. При адгезии тромбоцитов к поврежденной стенке сосуда плотные гранулы начинают секретировать в больших количествах АДФ, которая усиливает приклеивание циркулирующих тромбоцитов к адгезированным, т. е. агрегацию тромбоцитов, поддерживая тем самым и рост тромбоцитарного агрегата. Реакция «освобождения гранул» усиливает секрецию серотонина, вызывающего вазоконстрикцию в районе поврежденного участка ткани, что уменьшает кровотечение из нарушенных травмой сосудов.
а-Гранулы I типа содержат и секретируют антигепариновый фактор тромбоцитов 4, тромбоцитарный ростовой фактор, тромбоспондин (глико-протеин G). АДФ, тромбин, адреналин вызывают секрецию антигепаринового фактора тромбоцитов 4, что усиливает агрегацию тромбоцитов. Тромбоспондин, взаимодействуя с фибриногеном, образует на поверхности активированных тромбоцитов комплекс, необходимый для формирования тромбоцитарных агрегатов. Тромбоцитарный ростовой фактор — полипептид, стимулирующий рост гладких мышц сосудов и фибробластов, восстановление сосудистой стенки и соединительной ткани. Благодаря его свойствам тромбоциты поддерживают целостность сосудистой стенки. У больных тромбоцитопенией имеется сниженная устойчивость стенки капилляра, поэтому петехии (точечные кровоизлияния в коже) появляются вслед за легкими травмами или изменениями давления крови. Петехии вызываются слущиванием эндотелия капилляров. В нормальных условиях возникающий дефект в стенке капилляров устраняется тромбоцитами, секрети-рующими тромбоцитарный ростовой фактор.
а-Гранулы II типа содержат лизосомальные энзимы (кислые гидролазы). После адгезии или агрегации большая часть гранул в тромбоците исчезает. Данный феномен получил название «реакции освобождения гранул». Он имеет место после активации тромбоцитов тромбоксаном А2, АДФ, адреналином, тромбином, протеолитическими энзимами, бактериальными эндотоксинами, коллагеном.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Как тромбоциты ускоряют свёртывание крови
Если посмотреть на каплю крови в микроскоп (пусть это будет световой микроскоп, но достаточно мощный), то можно увидеть клетки трёх типов: многочисленные эритроциты, или красные кровяные тельца, немногочисленные, но довольно крупные лейкоциты и мельчайшие тромбоциты, которые удаётся разглядеть с некоторым трудом. Эритроциты, плотно набитые белком гемоглобином, переносят кислород: гемоглобин связывает его в лёгких и отдаёт в тканях и органах, которые в нём нуждаются. Лейкоциты — клетки иммунной системы, и они вместе с иммунными белками защищают нас от инфекций и от некоторых неинфекционных заболеваний, например от рака. Лейкоцитов существует несколько типов, отличающихся в том числе и по численности; возможно, из лейкоцитов нам попадутся Т-лимфоциты, которые целенаправленно распознают и сами уничтожают как чужеродные, так и наши собственные клетки, которым не повезло заболеть. Наконец, тромбоциты. Про тромбоциты мы знаем, что они нужны для свёртывания крови.
Кто не представляет, как работает система свёртывания крови? Уколовши палец, мы наблюдаем, как он сначала кровоточит, а потом перестаёт — образовавшийся тромб остановил кровь. Если бы кровь не свёртывалась, то разбитый нос мог бы оказаться смертельным ранением. Но, наверно, едва ли не более важная функция механизма свёртывания — предотвращение внутренних кровотечений, которые часто случаются при различных заболеваниях (например, при тяжёлой инфекции или при злокачественной опухоли). При этом система свёртывания должна быть очень точно сбалансирована: если она будет работать плохо, то пойдут неостанавливаемые кровотечения, внутренние и наружные; если же механизм свёртывания будет слишком активным, начнут формироваться тромбы, грозящие закупоркой сосудов и остановкой кровоснабжения. В медицине есть масса примеров, когда процессы свёртывания крови и тромбообразования идут не так, как надо, и не там, где надо. Причиной тому могут быть либо другие болезни, и тогда нарушения системы свёртывания крови — это просто сопутствующий симптом, либо же сами эти нарушения представляют собой отдельные, самостоятельные заболевания (вроде небезызвестной гемофилии или болезни Виллебранда).
Бороться с аномалиями системы свёртывания можно по-разному, и сейчас есть медицинские средства, которые позволяют эффективно регулировать её работу. Но чтобы такие средства работали ещё лучше, чтобы сделать их ещё более совершенными, нужно как можно точнее знать, как на молекулярно-клеточном уровне устроен механизм свёртывания крови. Его изучают уже более ста лет, и сейчас его схему можно найти в любом школьном учебнике; правда, схему эту большинство из нас старается забыть, как страшный сон: ещё бы, около двух десятков белков, соединённых стрелками, — кто-то кого-то активирует, кто-то кого-то ингибирует. Однако если рассматривать свёртывание по этапам, то всё становится более или менее понятно.
Стоит сразу сказать, что собственно свёртывание — лишь часть более общего процесса гемостаза (от греч. haimatos — кровь, stasis — остановка). И этот процесс начинается как раз с тромбоцитов. Они происходят от мегакариоцитов — гигантских клеток костного мозга. От зрелых мегакариоцитов «отшнуровываются» куски цитоплазмы, которые и становятся безъядерными клетками тромбоцитами (хотя, учитывая их происхождение и отсутствие ядра, более корректно называть их просто тельцами крови или кровяными пластинками). Тромбоциты циркулируют по крови, пока не «заметят» брешь в сосуде. Сигналом для них служит соединительнотканный белок коллаген. Он обычно спрятан внутри стенки сосуда, но при её повреждении оказывается лицом к лицу с тромбоцитами и другими белками крови. На мембране тромбоцитов есть специальный рецептор, который хватает коллаген и заставляет кровяные пластинки прилипнуть к месту повреждения. Тут в дело вступает один из факторов свёртывания под названием «фактор фон Виллебранда». Это гликопротеин (его молекула состоит из белковой и углеводной частей), который помогает другим рецепторам тромбоцитов зацепиться за торчащий из стенки сосуда коллаген. Благодаря фактору фон Виллебранда тромбоциты не только прочнее взаимодействуют с местом повреждения, но и дополнительно активируются — подают молекулярные сигналы другим тромбоцитам и белкам свёртывания, меняют внешнюю форму и активно слипаются друг с другом. В результате на стенке кровеносного сосуда появляется затычка из тромбоцитов.
Одновременно с формированием тромбоцитарной пробки происходит процесс собственно свёртывания крови — свёртывания в строгом смысле слова. В нём участвует множество белков плазмы крови, большинство из них — ферменты-протеазы, то есть белки, отщепляющие куски от других белков. Если до расщепления «жертва» протеазы была неактивным белком-ферментом, то после расщепления фермент активируется и, если он сам протеаза, тоже может кого-то расщепить. Суть ферментативных реакций, которые идут во время свёртывания, в том, что белки активируют друг друга, и в итоге всё заканчивается появлением активного белка фибрина, который быстро полимеризуется, превращаясь в нити — фибриллы. Из нитей фибрина формируется фибриновый сгусток, дополнительно укрепляющий тромбоцитовую «затычку», — образуется тромбоцитарно-фибриновый тромб. Когда сосуд восстанавливается, тромб рассасывается.
Оба этапа — и формирование тромбоцитарной пробки, и свёртывание крови с участием плазматических факторов-ферментов — подчиняются множеству регуляторов. Для организма важно, чтобы система гемостаза работала как можно более точно, и многостадийность как раз помогает выполнять тонкую настройку: на каждом этапе, на каждой реакции ферменты и другие молекулы, задействованные в процессе, проверяют, не ложный ли сигнал к ним пришёл и действительно ли есть необходимость в тромбе. Естественно, тромбоциты и факторы свёртывания теснейшим образом связаны друг с другом и тромбоциты нужны не только для того, чтобы первыми заткнуть брешь в сосуде. Во-первых, они также выделяют белки, которые ускоряют восстановление стенки сосуда. Во-вторых, что особенно важно, кровяные пластинки нужны ещё для того, чтобы ферменты свёртывания продолжали работать.
После запуска процесса гемостаза мембрана некоторых тромбоцитов изменяется особым образом, так что теперь на неё могут садиться ферменты реакций свёртывания: после приземления на такие тромбоциты они начинают работать намного быстрее. Что при этом происходит, удалось выяснить лишь относительно недавно. Активированные тромбоциты, то есть те, которые почувствовали повреждение сосуда, бывают двух форм: простые (агрегирующие) и сверхактивированные (прокоагулянтные). Простые агрегирующие тромбоциты отчасти похожи на амёбы: они образуют выпячивания мембраны, похожие на ножки, которые помогают им лучше сцепляться друг с другом, и становятся более плоскими, как бы растекаясь по поверхности. Такие клетки формируют основное тело тромба. Сверхактивированные тромбоциты ведут себя иначе: они приобретают сферическую форму и увеличиваются в несколько раз, становясь похожими на воздушные шарики. Они не просто укрепляют тромб, но и стимулируют реакцию свёртывания, почему их и называют прокоагулянтными.
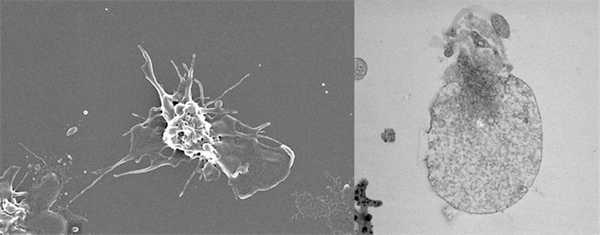
Почувствовав, что стенка кровеносного сосуда повреждена, тромбоциты активируются. Обычные активированные тромбоциты (слева; фото со сканирующего электронного микроскопа) делаются плоскими и образуют, подобно амёбам, многочисленные выросты мембраны; сверхактивированные, или прокоагулянтные, тромбоциты (справа; фото с просвечивающего электронного микроскопа) превращаются в шар и становятся площадкой для сборки и активации ферментативных комплексов аппарата свёртывания крови. Фото Михаила Пантелеева, МГУ
Как одни тромбоциты становятся простыми, а другие — сверхактивированными? Известно, что в прокоагулянтных тромбоцитах очень высок уровень кальция (ионы кальция вообще один из главных регуляторов гемостаза) и что у них выходят из строя митохондрии. Связаны ли эти изменения в клеточной физиологии со сверхактивацией тромбоцитов?
В прошлом году Фазли Атауллаханов * , директор Центра теоретических проблем физико-химической фармакологии РАН, вместе с Михаилом Пантелеевым, заведующим лабораторией молекулярных механизмов гемостаза центра и профессором кафедры медицинской физики физического факультета МГУ, опубликовали в журнале Molecular BioSystems статью с описанием модели митохондриального некроза как особой формы клеточной смерти. Мы знаем, что клетка может погибнуть в результате апоптоза, включив программу самоуничтожения (при апоптозе всё происходит по плану и с минимальным беспокойством для клеток-соседей), или в результате некроза, когда гибель случается быстро и незапланированно, например из-за разрыва наружной мембраны или из-за масштабных внутренних неприятностей, вроде вирусной или бактериальной инфекции.
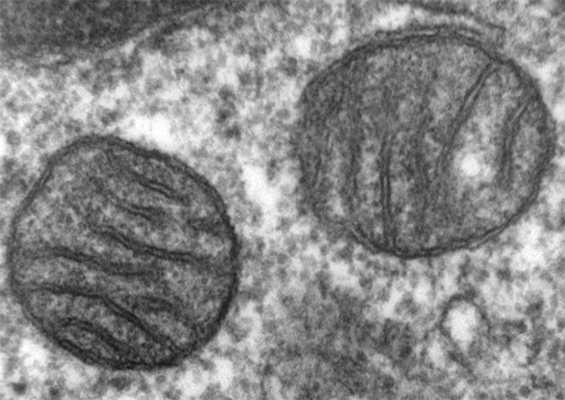
Поперечный срез через митохондрии клетки лёгкого. Митохондрии выглядят как цистерны, окружённые двойной мембраной; поперечные полосы на снимке — впячивания их внутренней мембраны, на которой сидят ферменты энергетического обмена веществ. Фото: Louisa Howard/Wikimedia Commons
В чём особенность митохондриального некроза? Митохондрии, как известно, служат источниками энергии для любой нашей клетки: в митохондриях происходит кислородное окисление «питательных» молекул, а освобождённая при этом энергия запасается в удобной для клетки форме. Побочным продуктом при работе с кислородом оказываются агрессивные кислородные радикалы, которые могут испортить любую биомолекулу. Сами митохондрии стараются уменьшать концентрацию радикалов и не выпускать их из себя в клеточную цитоплазму.
При митохондриальном некрозе происходит следующее: митохондрии вбирают в себя кальций, и в какой-то момент, когда кальция становится слишком много, они разрушаются, выплёскивая в цитоплазму и кальций, и активные формы кислорода. В результате в клетке распадается внутриклеточный белковый скелет и клетка сильно увеличивается в объёме, превращаясь в шар. (Как мы помним, шарообразная форма характерна для сверхактивированных тромбоцитов.) Кроме того, и ионы кальция, и активные формы кислорода активируют фермент скрамблазу, который перебрасывает фосфатидилсерин — один из липидов цитоплазматической мембраны — из внутреннего слоя мембраны в наружный. И вот на такую модифицированную мембрану округлившихся тромбоцитов, обогащённую фосфатидилсерином, прилипают некоторые важные факторы свёртывания: здесь они собираются в комплексы, активируются, и в результате реакция свёртывания ускоряется в 1000–10 000 раз.
В новой статье, опубликованной в июне этого года в Journal of Thrombosis and Haemostasis, Михаил Пантелеев, Фазли Атауллаханов и их коллеги описывают эксперименты, которые полностью подтверждают такую модель активации тромбоцитов: кровяные пластинки стимулировали тромбином, одним из белков системы свёртывания, после чего митохондрии наполнялись ионами кальция, а в митохондриальных мембранах появлялись поры. Проницаемость митохондрий увеличивалась, и в какой-то момент, когда изменение проницаемости делалось необратимым, весь запасённый кальций оказывался в цитоплазме и запускал процесс «переформатирования» наружной мембраны.
Получается следующая картина: тромбоциты, подчиняясь внешним активаторам, впитывают кальций. Из их цитоплазмы кальций переходит в митохондрии. В самой цитоплазме уровень ионов кальция то повышается, то понижается (осциллирует), но в митохондриях он неуклонно растёт, и наступает момент, когда они уже не могут удерживать кальциевые ионы внутри себя. Весь кальций (с кислородными окислителями) выходит в цитоплазму и включает фермент, перебрасывающий липиды в цитоплазматической мембране тромбоцита. В результате на поверхности сверхактивированного и, очевидно, доживающего свои последние минуты тромбоцита собираются ферментативные комплексы, ускоряющие реакцию свёртывания.
Почему же не все тромбоциты становятся сверхактивированными — прокоагулянтными? Вероятно, потому, что для активации требуется сумма сигналов от разных регуляторов. Мы уже сказали, что тромбоциты чувствительны к тромбину, который плавает в плазме крови, а в начале статьи говорили, что одним из первых активирующих сигналов для кровяных пластинок служит коллаген из повреждённой стенки сосуда. Коллаген и тромбин действительно сильные активаторы, но кроме них тромбоциты «прислушиваются» и к некоторым другим молекулам. Степень активации зависит от количества разных входных сигналов, и превращение в прокоагулянтную форму, очевидно, происходит тогда, когда суммарный сигнал извне оказывается для конкретного тромбоцита особенно сильным.
Практические аспекты полученных результатов понятны каждому: чем больше подробностей узнаем про свёртывание крови, тем скорее научимся управлять этим процессом, ускоряя или замедляя его в соответствии с медицинскими показаниями.
Читайте также:
