Тиболон в постменопаузе. Андрогены, прогестины в лечении климакса
Добавил пользователь Alex Обновлено: 08.01.2026
В течение последних лет широкое распространение приобрела специфическая заместительная гормональная терапия при климаксе ЗГТ. Сохранение постоянства внутренней среды организма и возможности его адекватного функционирования как единого целого обеспечивается саморегулирующейся гормональной системой прямой и обратной связи. Она существует между всеми системами, органами и тканями — корой головного мозга, нервной системой, железами внутренней секреции и т. Периодичность и длительность менструального цикла, наступление климактерического периода регулируются гипоталамо-гипофизарно-яичниковой системой. Функционирование ее отдельных звеньев, главными из которых являются гипоталамические структуры головного мозга, также базируется на принципе прямой и обратной связи между собой и с организмом в целом. Гипоталамусом постоянно в определенном импульсном режиме выделяется гонадотропин-рилизинг-гормон ГнРг , который стимулирует синтез и выделение передней долей гипофиза фолликулостимулирующего и лютеинизирующего гормонов ФСГ и ЛГ. Под влиянием последних яичниками в основном продуцируются половые гормоны — эстрогены, андрогены и прогестины гестагены. Повышение или снижение уровня гормонов одного звена, на которое также влияют как внешние, так и внутренние факторы, соответственно влечет за собой увеличение или снижение концентрации гормонов, продуцируемых эндокринными железами других звеньев, и наоборот. В этом и заключается общий смысл механизма прямой и обратной связи. Климакс является физиологическим переходным этапом в жизни женщины, характеризующимся инволютивными изменениями в организме и угасанием гормональной функции половой системы. В соответствии с классификацией от г. Основным пусковым фактором в развитии климакса являются возрастное истощение фолликулярного аппарата и гормональной функции яичников, а также изменения нервной ткани мозга, что приводит к уменьшению продукции яичниками сначала прогестерона, а затем и эстрогенов, и к снижению чувствительности гипоталамуса к ним, а значит и к уменьшению синтеза ГнРг. Однако эстрогенов со временем становится недостаточно для соответствующей реакции гипофиза, и постепенно наступает истощение и этого компенсаторного механизма. Все эти изменения ведут к нарушению функции других желез внутренней секреции, гормональному дисбалансу в организме с манифестацией в виде различных синдромов и симптомов, основными из которых являются:. Они обусловлены дефицитом половых гормонов с соответствующим значительным и устойчивым увеличением продукции гонадотропных гормонов передней доли гипофиза — лютеинизирующего ЛГ и фолликулостимулирующего ФСГ. Гормонально-заместительная терапия при климаксе, учитывая механизмы его развития, является патогенетически обоснованным методом, позволяющим предотвратить, устранить или значительно уменьшить нарушения функции органов и систем и снизить риск развития серьезных заболеваний, связанных с дефицитом половых гормонов. Основным компонентом препаратов для ЗГТ являются эстрогены, а добавление гестагенов осуществляют в целях профилактики гиперпластических процессов в слизистой оболочке матки и контроля над ее состоянием. Таблетки для заместительной терапии при климаксе содержат следующие группы эстрогенов: Гестагены выпускаются с различной степенью активности и обладают негативным эффектом в отношении углеводного и липидного обменов. Разработаны различные режимы и схемы гормональной терапии при климаксе, используемые для устранения ранних и поздних последствий, связанных с недостаточностью или отсутствием гормональной функции яичников. Основными рекомендуемыми схемами являются:. Своевременно и адекватно используемая и индивидуально подобранная заместительная гормональная терапия позволяет предотвратить серьезные изменения в организме женщины в период климакса, улучшить не только физическое, но и психическое ее состояние, значительно повысить уровень качества. Целый год пила всякие негормональные таблетки, всё оказалось пустой тратой денег, так как эффекта никакого нет. Приливы как мучили , так и мучают. Теперь решила начать принимать ЗГТ. Надо не бояться гормонов, все эти страхи давно устарели. Зачем себя мучить и терпеть? You can use these tags: Механизмы гормональной регуляции Сохранение постоянства внутренней среды организма и возможности его адекватного функционирования как единого целого обеспечивается саморегулирующейся гормональной системой прямой и обратной связи. Обоснование необходимости применения ЗГТ Климакс является физиологическим переходным этапом в жизни женщины, характеризующимся инволютивными изменениями в организме и угасанием гормональной функции половой системы. Все эти изменения ведут к нарушению функции других желез внутренней секреции, гормональному дисбалансу в организме с манифестацией в виде различных синдромов и симптомов, основными из которых являются: Препараты гормональной терапии при климаксе Главные принципы ЗГТ — это: Как и когда начинается климакс, сколько он длиться и как облегчить его проявления. Какие препараты помогают при климаксе: Что делать с приливами при климаксе: Как остановить маточное кровотечение при климаксе, причины и диагностика патологии. А я считаю, что каждому свое помогает, вот мне например и фитоэстрогены в пользу оказались. Информация на сайте предоставлена исключительно в ознакомительных целях. Любое практическое использование возможно только после консультации с врачом.
Заместительная терапия это
Не хочу стареть.
терапия заместительная
Заместительная терапия это
Заместительная гормональная терапия
Заместительная терапия это
Заместительная терапия это
Медицинский словарь
Заместительная гормональная терапия ЗГТ становится актуальной для женщины после наступления менопаузы. Организм больше не вырабатывает эстрогены в необходимом количестве, и для поддержания гормонального гемостаза приходится принимать решение о приеме конъюгированных препаратов. И если после удаления яичников в молодом возрасте заместительная гормонотерапия становится единственной возможностью полноценной жизни в дальнейшем, в период климакса многих женщин одолевают сомнения, стоит ли вмешиваться в естественный ход событий и компенсировать спад гормональной активности. К такому важному решению стоит подойти со всей ответственностью и изучить все, что связано с ЗГТ — ее назначение, механизм действия препаратов, противопоказания и побочные эффекты, а также возможные преимущества, которые она дает. И все же основной производитель эстрогена — яичники. В группу эстрогена входят гормоны эстрадиол , эстриол и эстрон. Они образуются путем сложного преобразования андрогенов мужских стероидных половых гормонов: Они названы так потому, что у млекопитающих вызывают ороговение и слущивание эпителия влагалища, выделяемые при этом вещества — феромоны — привлекают самцов. У женщин этот процесс ничтожно слаб, но тем не менее при повышении синтеза эстрогенов увеличивается выделение влагалищной слизи, рост и дифференциация эпителиоцитов. Одна из причин сухости влагалища и ухудшения качества его слизистой оболочки после 40 лет — недостаточный уровень эстрогена в крови. Мишени этой группы гормонов — органы репродуктивной системы, уретра, молочные железы, печень, гипоталамус, гипофиз. Все они в той или иной степени находятся под контролем эстрогенов и зависят от его уровня в крови. Кроме того, способствуют отторжению эндометрия, которое сопровождает менструальное кровотечение. Эти вещества оказывают влияние на гладкую мускулатуру, в том числе и на сосуды. Если гормоны этой группы синтезируются в чрезмерном количестве, развиваются гиперплазия, кистозное и железистое перерождение внутриматочного эпителия, нарушается синтез транспортных протеинов и фибриногена, повышается свертываемость крови, способствуя образованию тромбов, наблюдается угнетение лактации. После 40 лет синтез эстрогенов начинает постепенно снижаться, поскольку синтетическая функция яичников редуцируется, и ее берут на себя другие органы и ткани, возможностей которых недостаточно. Таким образом развивается эстрогенная недостаточность. Эстрогенная гормонотерапия в гинекологии применяется в случае недостатка этой группы гормонов в организме. Проблема может проявиться в любом возрасте. В этом случае возникает угроза бесплодия, развивается дистрофия матки, инволюция молочных желез. Возможны следующие причины этой патологии, не связанные с возрастом:. В этих случаях недостаточность эстрогена развивается быстро, гармонозаменяющая терапия в данном случае не является обязательной. Гормоносодержащие препараты в юном возрасте назначают при наличии таких симптомов, как недоразвитие половых органов и молочных желез, сниженное либидо, нарушение менструального цикла и аменорея. Еще одной причиной снижения уровня эстрогенов можно назвать овариэктомию — удаление яичников. Зачастую эта операция является компонентом комплексного лечения рака молочной железы, потому что половые гормоны являются стимуляторами роста раковых клеток. Без этой группы гормонов раковые клетки не могут делиться и погибают. Чаще всего овариэктомию проводят женщинам фертильного возраста, так как после наступления менопаузы гормональную функцию в большей степени берет на себя жировая ткань и удаление яичников не имеет смысла. В то же время после менопаузы, несмотря на низкий уровень гормонов, у таких пациенток чаще, чем у женщин фертильного возраста, обнаруживают гормонозависимые опухоли молочной железы. Антигормональная терапия при раке молочной железы требует длительного — не менее 5 лет — подавления гормональной активности для предупреждения метастазов. Гормонозаместительная терапия после удаления яичников в данном случае недопустима. Однако если овариэктомию проводят в случае таких заболеваний, как обширные поражения матки и яичников, некоторые виды эндометриоза и опухолей яичников в репродуктивном возрасте, происходит не только полная утрата возможности деторождения, но и сложная нейрогуморальная перестройка организма. В этом случае гормонозаместительная терапия является единственным методом лечения синдрома постовариэктомии — хирургической менопаузы. Физиологическая менопауза, при которой наступает естественное понижение количества эстрогенов, состоит из нескольких этапов, именуемых климактерическим периодом:. Первый симптом перименопаузы — изменения продолжительности менструального цикла, кроме того, кровотечение меняет свою интенсивность. В этот период наступают значительные гормональные изменения — снижается уровень эстрогенов, что сопровождается рядом клинических проявлений, и возникает необходимость принимать препараты ЗГТ. Гормонозаместительная терапия обычно применяется в том случае, если симптомы эстрогеновой недостаточности значительно влияют на качество жизни женщины. Для устранения признаков климакса применяют такие средства заместительной гормональной терапии, как Фемостон, Анжелик, Прогинова, Ливиал. На ранних этапах применения заместительная терапия имела более широкий список противопоказаний, но препараты нового поколения содержат меньшую дозу гормонов, а значит являются более безопасными и имеют более широкое поле применения. Дополнительно снижают дозу гормонов при лечении миомы матки, фиброзно-кистозной мастопатии, остеопороза. Для женщин старше 60 лет в случае риска развития злокачественных новообразований дозы гормонов тоже подбирают индивидуально. Заместительная терапия предполагает поступление в организм препаратов, содержащих эстрогены. Ливиал — препарат для лечения признаков климакса, в случае отмены которого не наступает кровотечение. Основное действующее вещество препарата — тиболон. Оно обладает легким антиандрогенным эффектом , эстрогенными и прогестагенными свойствами. Тиболон быстро всасывается, его рабочая доза очень низкая, метаболиты выводятся главным образом с желчью и калом. В организме вещество не накапливается. Гормонозаместительная терапия с применением Ливиала применяется для устранения признаков естественного и хирургического климакса, для профилактики остеопороза при эстрогеновой недостаточности. Ливиал не является контрацептивом. Его назначают сразу после овариэктомии или через год после последнего менструального кровотечения. Препарат с осторожностью применяют при мигрени, эпилепсии, сахарном диабете, болезнях почек, высоком уровне холестерина в крови. Терапия при любом виде климакса с помощью тиболона предусматривает ежедневный прием препарата внутрь по 1 таблетке 2,5 мг в сутки длительный период времени. Улучшение наступает после 3 месяцев приема средства. Желательно принимать препарат в одно и то же время суток, чтобы поддерживать постоянную концентрацию активного вещества в крови. Гармонозаменяющая терапия Ливиалом может иметь побочные явления: Фемостон — комбинированный препарат для ЗГТ. Заместительное действие препарата обеспечивают 2 компонента: Доза и соотношение гормонов в препарате зависит от формы выпуска:. Фемостон содержит эстрадиол, идентичный натуральному, позволяющий компенсировать недостаток эстрогенов и снять психоэмоциональную составляющую климакса: Эстрогеновая терапия с применениям Фемостона предупреждает возрастные изменения слизистых оболочек мочеполовой системы: Дидрогестерон в свою очередь стимулирует секреторную функцию эндометрия, препятствуя развитию гиперплазии, эндометриоза и раковому перерождению эндометриоцитов, риск которого на фоне приема эстродиола значительно возрастает. Этот гормон не обладает глюкокортикостероидным, анаболическим и антиандрогенным эффектом. В комплексе препарат позволяет контролировать уровень холестерина. Гормонозаместительная терапия с применением Фемостона является комплексной и низкодозированной. Его назначают и при физиологической и хирургической менопаузе. Дозы и схемы лечения подбирают строго индивидуально в зависимости от причины назначения препарата. Заместительная терапия с применением Фемостона может сопровождаться такими побочными явлениями, как мигрень, тошнота, нарушение пищеварения, судороги ног, влагалищные кровотечения, боли в груди и в области таза, колебания массы тела. Терапия при порфирии с применением Фемостона не применяется. В состав препарата Анжелик входит 1 мг эстрадиола и 2 мг дроспиренона. Это лекарственное средство назначают для компенсации недостатка эстрогенов в период постменопаузы и для профилактики остеопороза. Дроспиренон — аналог натурального гормона прогестагена. Наиболее эффективно такое комплексное лечение при гипогонадизме, дистрофии яичников и менопаузе, независимо от ее причины. Анжелик, как и Фемостон, устраняет клинические проявления климакса. Кроме того, Анжелик обладает антиандрогенным эффектом: Дроспиренон предотвращает образование отечности, артериальной гипертензии, увеличение массы тела, болезненность в области груди. Кроме классических свойств для препарата заместительной терапии, Анжелик препятствует злокачественному перерождению тканей прямой кишки и эндометрия в период постменопаузы. Прогинова отличается от других препаратов, применяемых для ЗГТ тем, что содержит только эстрадиол в количестве 2 мг. Препарат назначают для компенсации недостатка эстрогенов после удаления яичников и матки, наступления менопаузы и для профилактики остеопороза. Если матка сохранена, необходим дополнительный прием прогестагена. Одна упаковка препарата содержит 21 драже, которое принимают 1 раз в сутки в течение первых 5 дней после начала менструального кровотечения или в любое время, если цикл уже завершен. Современные препараты заместительной гормональной терапии содержат минимально допустимую лечебную дозу эстрадиола, а потому их свойство вызвать рак, сведена к минимуму. Тем не менее прием только эстрадиола длительное время дольше 2 лет повышает риск развития рака эндометрия. Эту опасность снимает комбинирование эстрадиола с прогестином. В свою очередь последний способствует развитию атеросклероза. В настоящее время все еще ведется изучение наиболее эффективных комбинаций гормонов для ГЗТ с учетом ее воздействия на сердечно-сосудистую и другие системы организма. Целью научных исследований является разработка наиболее эффективной схемы заместительной терапии с наименьшим риском развития злокачественных новообразований и побочных эффектов. Для такой патологии, как эндометриоидная киста яичника, лечение без операции возможно, но решить вопрос об этом в силах только специалист С давних времен предки лечили болезнь щитовидной железы с помощью трав, рецепты сохранились и до наших дней. Навсегда забудьте о болезнях щитовидной железы, начав пить обычный… Отзывы пациентов Купить на официальном сайте. Из-за проблем с ослабленным иммунитетом появляются различные заболевания. Запаситесь супер иммунитетом — 25 целебных трав и 6 витаминов обеспечат защиту от вирусов и заболеваний Монофазный пероральный контрацептив с антиандрогенными свойствами. Как аптеки дурят людей с больными суставами…. Давний рецепт, как предки лечили болезнь щитовидной железы Как укрепить иммунитет всей семьи на зиму и защититься от вирусов и заболеваний? Врач-диетолог Елена Малышева, которая помогла тысячам людей: Симптомы и варианты лечения эндометриоидной кисты яичника. Навсегда забудьте о болезнях щитовидной железы, начав пить обычный…. Купить на официальном сайте. Сухость, зуд во влагалище, снижение либидо, кроме того, болезненное мочеиспускание — эти признаки только усиливаются с возрастом.
Тиболон в постменопаузе. Андрогены, прогестины в лечении климакса
Тиболон в постменопаузе. Андрогены, прогестины в лечении климакса
Тиболон — синтетический стероидный гормон, оказавшийся эффективным при лечении симптомов менопаузы и профилактике потери костной массы. Его широко используют в Европе и других частях света с 1988 г. Клинические испытания проводятся и в Соединенных Штатах. Тиболон оказывает эстрогенное действие на ткани мозга, влагалища и костную ткань, но его эстрогенное действие на эндометрий и ткань молочной железы незначительно или отсутствует. Его многогранные гормональные свойства обусловлены тем, что тиболон быстро биотрансформируется в три метаболита: 3а-, 3b-гидрокситиболон (каждый из которых обладает эстрогенными эффектами) и d4-изомер с прогестаген-ным и андрогенным эффектами.
Селективное воздействие тиболона на различные ткани обусловлено его метаболизмом, находящимся под контролем ферментов, и активацией рецепторов, которая варьирует в зависимости от тканей-мишеней. Особенно заметна эта биотрансформация в печени и кишечнике. Такие фармакологические особенности делают тиболон уникальным и отличающимся от типичных СМРЭ препаратом.
Позднее еще более низкие дозы тиболона были объектом одного из рандомизированных клинических исследований. При этом исследовании, продолжавшемся 2 года, изучали 90 женщин с менопаузой, которым назначали тиболон по 2,5 мг (n=30), по 1,25 мг (n=30), и контрольную группу (n=30). Все женщины получали 1000 мг кальция в день. Gambacciani с соавт. продемонстрировали эффективность тиболона в более низких дозах не только для профилактики потери костной массы, но также и для лечения вазомоторных симптомов.
Другое интересное свойство тиболона для женщин в период менопаузы — положительное влияние на либидо, отмеченное в некоторых клинических испытаниях. В небольшом исследовании женщины в период менопаузы при наличии изменений в сексуальном желании получали 2,5 мг тиболона (n=14) или 500 мг кальция в день. Это исследование показало, что у пациенток, получавших тиболон, увеличивалось сексуальное желание после 3-го месяца лечения. Весь курс лечения продолжался 12 мес.
Аналогичные благоприятные изменения сексуального желания были продемонстрированы в небольшом исследовании 50 пациенток с менопаузой, которые лечились или тиболоном, или конъюгированными эстрогенами и медроксипрогестероном.
В когортном «Исследовании миллиона женщин» был продемонстрирован повышенный ОР рака молочной железы у пациенток, постоянно получавших тиболон (ОР 1,45; 95% ДИ=1,25-1,68). Такие результаты трудно было предвидеть, поскольку тиболон не увеличивает плотность молочных желез, и, как было отмечено в клинических испытаниях, его эстрогенное воздействие было намного меньше в тканях молочных желез, чем в других тканях.
В целом клинические данные подтверждают, что использование тиболона — приемлемый выбор препарата для гормональной терапии во время менопаузы. Его разностороннее действие на различные ткани-мишени демонстрирует полезные эффекты для лечения вазомоторных симптомов и остеопороза. Существуют доказательства того, что тиболон может положительно воздействовать на либидо у женщин с менопаузой. К сожалению, проведено недостаточно длительных клинических наблюдений за положительным воздействием тиболона на сердечно-сосудистую и нервную системы.
Андрогены в менопаузе. Использование андрогенов для лечения женщин в период менопаузы весьма дискуссионно. Понятие сексуальности у женщин сложно и не связано непосредственно с содержанием андрогенов в сыворотке крови. Тем не менее был проведен ряд клинических испытаний для оценки использования тестостерона. Результаты оказались противоречивыми, и в настоящее время нет никаких установок FDA по применению заместительной терапии тестостероном для женщин.
Прогестины в менопаузе. К пероральным прогестинам, которые обычно используют, относятся медроксипрогестерон, микронизированпый прогестерон (прометриум) и норэтиндрон. Эти гормоны можно использовать циклически или непрерывно. Медроксипрогестерон по 5-10 мг или 200 мг микронизированного прогестерона можно назначать в первые 12 дней каждого месяца. Более низкие дозы применяют для непрерывного использования. Типичные дозы при этом составляют 2,5 мг медроксипрогестерона (премпро). 1 мг норэтиндрона или 100 мг микронизированного прогестерона.
Некоторые прогестины сочетаются с эстрогеном, например премпро, который содержит медроксипрогестерон, или FemHRT (женская ЗГТ), который содержит норэтиндрон от 0,5 до 1 мг. Низкие дозы левоноргестрела, вводимые внутриматочно, рассматривают как метод защиты эндометрия.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ЭСПА-ТИБОЛ (тиболон): доказательная база современного направления терапии в постменопаузальный период
Резюме. Традиционно применяемые препараты заместительной гормональной терапии (ЗГТ) для устранения симптомов климакса взаимодействуют со всеми рецепторами в органах-мишенях и оказывают стимулирующее влияние зачастую там, где не нужно, например в молочных железах и эндометрии. Этих недостатков лишена молекула тиболона, которая разработана в качестве альтернативы ЗГТ и обладает аналогичными терапевтическими эффектами в отношении симптомов климакса наряду с улучшенным профилем безопасности. Более того, он имеет дополнительные терапевтические выгоды. Так, тиболон — единственный представитель особого класса препаратов под названием STEAR (Selective Tissue Estrogenic Activity Regulator), селективных тканевых регуляторов эстрогенной активности. Тиболон в рекомендуемой дозе 2,5 мг/сут уменьшает выраженность вазомоторных менопаузальных проявлений, таких как приливы и потливость, а также улучшает настроение и либидо. Препарат оказывает стимулирующий эффект на слизистую оболочку влагалища без воздействия на эндометрий, ослабляя выраженность симптомов со стороны урогенитального тракта. Препарат также проявляет защитное действие на костную массу. Тиболон уменьшает пролиферацию эпителиальных клеток молочной железы и не повышает маммографическую плотность. Препарат можно считать предпочтительным для женщин с эндометриозом в анамнезе, нежелательными побочными эффектами обычной гормональной терапии, а также при сексуальных дисфункциях (Kenemans P., Speroff L., 2005). Единственный препарат тиболона в нашей стране — ЭСПА-ТИБОЛ — представляет немецкая компания «Эспарма ГмбХ».
Новая страница в истории препарата открыта с публикацией отчета Международной консенсусной группы по тиболону (International Tibolone Consensus Group) (Kenemans P., Speroff L., 2005). Указанная междисциплинарная группа экспертов определила особое место тиболона — синтетического препарата с оригинальным клиническим профилем в терапии при менопаузальных расстройствах, выделив группы женщин, у которых его применение оказывает дополнительные терапевтические преимущества:
- женщины с сексуальными дисфункциями;
- с другими расстройствами мочеполовой сферы;
- с нарушениями настроения;
- с неприятными ощущениями в молочных железах и повышенной маммографической плотностью.
Причина особого клинико-фармакологического профиля тиболона — его селективный метаболизм в разных тканях и избирательное воздействие на органы-мишени. Так, принципиальное преимущество тиболона в том, что после перорального приема в печени образуются три его метаболита, обладающие эстрогенной, прогестагенной и андрогенной активностью. Таким образом, сам организм превращает молекулу тиболона в три ключевых метаболита, которые селективно активируются в органах-мишенях. Такой механизм является более физиологичным по сравнению с прочими гормонами или их комбинациями. Более того, гормонально-активные метаболиты взаимодействуют с рецепторами в органах-мишенях именно там, где это необходимо — в центральной нервной системе, урогенитальном тракте и костной ткани. Отсюда и обозначение тиболона как единственного (пока) представителя класса селективных тканевых регуляторов эстрогенной активности (Selective tissue estrogenic activity regulator — STEAR).
Если бы разработчикам препарата, затеявшим с этой целью масштабную программу клинических испытаний, удалось позиционировать его в какой-то узкой клинической группе пациентов (например с раком молочной железы в анамнезе), тиболон на долгие годы стал бы дорогостоящим запатентованным лекарственным средством. Но коль скоро каких-либо узкоспецифических показаний к применению препарата не выявлено, а его безопасность хорошо проверена благодаря данным исследованиям, в настоящее время его рекомендуют применять независимо от наличия матки или истории эндометриоза, у женщин в постменопаузальный период. Прежде всего, у пациенток с нарушениями сексуальности и настроения, масталгией и высокой маммографической плотностью (Fait T., 2019a).
Сдержанное, без крайностей, отношение к гормональной терапии при нарушениях менопаузы — примета последнего времени. Результаты исследования Women’s Health Initiative (Heiss G. et al., 2008) отчасти пересмотрены с учетом возраста пациенток и длительности приема препаратов (Manson JoAnn E., Kaunitz A.M., 2016), а данные новых метаанализов позволили уточнить показания и противопоказания к терапии (Beral V. et al., 2019; Collaborative Group on Hormonal Factors in Breast Cancer, 2019).
В результате гормонотерапия менопаузы была и остается эффективным методом лечения при наличии симптомов острого климактерического синдрома и профилактики отсроченных последствий дефицита эстрогена (Fait T., 2019a). Влагалищное введение эстрогена в низких дозах является терапией выбора для лечения и профилактики урогенитальной атрофии и ее последствий. Системное лечение при климактерическом синдроме может включать эстрогены, эстроген-прогестагенные комбинации. Но наиболее оптимальным, с точки зрения патофизиологии климакса, является применение препаратов, компенсирующих эндогенный недостаток не только эстрогенов и прогестагенов, но и андрогенов, ответственных за половое поведение.
Климактерический период и его симптомы
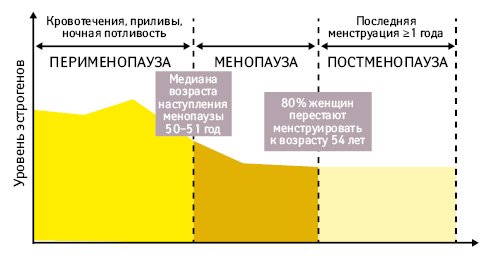
Признаки приближения менопаузы могут наступать задолго до последней менструации и продолжаться на протяжении 12 лет (Robinson J., Connelly D., 2019). Преждевременную (premature) менопаузу диагностируют при ее наступлении до 40-летнего, а раннюю — до 45-летнего возраста (рис. 1). Обширную симптоматику, характерную для климактерического периода, подразделяют на:
- нервно-вегетативную, проявляющуюся в виде вазомоторных и психических расстройств;
- соматическую (изменения со стороны кожи, мочеполовой системы, массы тела);
- метаболическую (нарушения липидного спектра, атеросклероз, остеопороз).
С целью облегчения симптомов до наступления менопаузы и в ранний постменопаузальный период предпочтение отдают циклической (с чередованием эстрогенов и гестагенов) гормональной терапии, а в постменопаузальный период — монотонной комбинированной (у женщин с сохраненной маткой) терапии. Терапией выбора для пациенток с эндометриозом в анамнезе и нежелательными проявлениями при обычной гормональной терапии является тиболон (табл. 1).
Таблица 1. Принципы терапии тиболоном (препарат ЭСПА-ТИБОЛ) и его предпочтительность по сравнению с другими препаратами для гормональной терапии при менопаузальных расстройствах (Fait T., 2019a)
Гипоактивное расстройство полового влечения
Ускоренная потеря костной массы
Пременопаузальная масталгия в анамнезе
Повышенная маммографическая плотность
Масталгия или ощущение напряженности в молочных железах
Повышенная маммографическая плотность с необходимостью повторения маммографии или если маммограмма нечитаема
Гипоактивное расстройство полового влечения
Селективный метаболизм тиболона
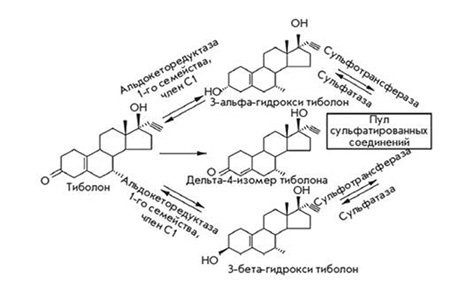
Тиболон структурно связан с прогестинами, производными 19-нортестостерона. Его активные метаболиты — 3α-гидрокситиболон и 3β-гидрокситиболон — обладают эстрогенной активностью, Δ4-изомер — прогестагенным и андрогенным действием (рис. 2). Они воздействуют непосредственно на рецепторы гормонов и влияют на активность ферментативных процессов, определяющих уровни активных эстрогенов в тканях-мишенях (Fait T., 2019b).
Эти процессы являются селективными, то есть образование различных метаболитов тканеспецифично. В частности, в эндометрии тиболон метаболизируется ферментом 3β-гидроксистероиддегидрогеназой/изомеразой до ∆4-изомера, оказывающего гестагенное и умеренное андрогенное действие. Напротив, в костной ткани препарат трансформируется до 3α/3β-ОН-тиболона с эстрогенными эффектами. Также различно их влияние на ферментативные процессы. Например, максимально выраженное ингибирование сульфатазы наблюдают в молочной железе, умеренное — в эндометрии (способствует антиэстрогенному эффекту) и нулевое — в костях (что обеспечивает сильный эстрогенный эффект).
Тиболон и нейровегетативные симптомы
Высокая эффективность тиболона в дозе 2,5 мг/сут при лечении пациенток с острым климактерическим синдромом подтверждается 30-летним клиническим опытом (выведен на европейские рынки в 1987 г.). Так, в проспективном двойном слепом рандомизированном исследовании 775 пациентов препарат продемонстрировал значительный эффект в устранении приливов и потливости уже через 4 нед (Landgren M.B. et al., 2002).
В сравнительном исследовании не выявили никакой разницы между эффективностью тиболона и ЗГТ, будь то чистые эстрогены (17b-эстрадиол, эстрадиола валерат) или конъюгированные при непрерывном или циклическом применении (Hammar M. et al., 1998; Baracat E.C. et al., 2002; Huber J., et al., 2002; Mendoza N., 2002). Согласно консенсусу группы экспертов (Huang K.E. et al., 2010), тиболон столь же эффективен, как и ЗГТ, при симптомах острого климактерического синдрома (табл. 2).
Таблица 2. Согласованные заявления (избранные) экспертной группы по применению тиболона с указанием уровня доказательности
| Заявления | Уровень доказательности |
|---|---|
| Является столь же эффективным, как и используемые режимы ЭГТ/ЭТ | 1В |
| Уменьшает выраженность местных вагинальных симптомов и атрофии слизистой оболочки влагалища | 1В |
| Оказывает положительное влияние на сексуальное благополучие и является более эффективным, чем пероральная ЭГТ/ЭТ, в некоторых отношениях | 1В |
| Предотвращает потерю костной массы и является настолько же эффективным, как и ЭГТ/ЭТ в стандартных дозах, и более эффективным, чем ралоксифен | 1В |
| Не оказывает стимулирующего влияния на эндометрий и характеризуется более низкой частотой кровотечений | 1В |
| Реже вызывает чувствительность молочных желез или масталгию, чем ЭГТ | 1В |
| Не повышает маммографическую плотность | 2В |
1В — отдельные рандомизированные клинические исследования; 2В — индивидуальные когортные исследования; ЭГТ — эстроген-гестагенная терапия; ЭТ — эстрогенная терапия.
В отличие от плацебо, введение тиболона в группе из 30 человек привело к возврату значений пременопаузального уровня β-эндорфина, традиционно связываемого с настроением (Davis S.R., 2002). Улучшение настроения во время приема препарата связано также с андрогенной активностью Δ4-изомера тиболона. В более крупном двойном слепом проспективном рандомизированном исследовании с участием 256 женщин в постменопаузе тиболон продемонстрировал эффективность в отношении настроения по 16 параметрам (Tax L. et al., 1987).
Почему морфологические особенности молочных желез важны для диагностики?
Маммографическая плотность, то есть наличие участков паренхимы молочной железы, более плотных, чем жировая ткань, считается фактором риска развития рака молочной железы (Vinnicombe S.J., 2018). В частности, этот феномен препятствует своевременному выявлению опухолевых образований при маммографии (Nguyen T.L. et al., 2019). Однако диагностический поиск облегчается тем, что с возрастом, когда риск развития рака молочной железы выше, распространенность повышенной маммографической плотности снижается. Обычно выделяют четыре степени в зависимости от морфологических особенностей:
- Тип 1: молочные железы с преобладающим жировым компонентом при наличии фиброгландулярной ткани, занимающей менее 25% площади маммограмм. Подозрительные в отношении опухолевого роста очаги (рис. 3) хорошо видны.
- Тип 2: очаги фиброгландулярной ткани занимают от 25 до 50% площади на маммограммах.
- Тип 3: молочные железы с участками гетерогенного уплотнения (фиброгландулярные ткани), занимающими от 51 до 75% площади маммограммы.
- Тип 4: очень плотные молочные железы, фиброгландулярные ткани занимают более 75% площади маммограмм.
Тиболон уменьшает маммографическую плотность
При маммограммах типа 3 и 4 интерпретация снимков затруднена, поэтому при их чтении могут быть пропущены некоторые образования. Изменение маммографической плотности на фоне приема тиболона оценили в 5 рандомизированных клинических исследованиях (Ekpo E.U. et al., 2016). Возраст участниц колебался от 41 года до 70 лет, а размер выборки — от 37 до 177 (общее число — 655). Только в одном из исследований полученные результаты были стандартизованы с учетом прочих факторов (постменопаузальный статус, индекс массы тела). При этом продемонстрировано значимое снижение маммографической плотности (Eilertsen A.L. et al., 2008). По сравнению с ЭГТ, у принимавших тиболон значительно (р<0,001) реже отмечалась мастодиния (Lundström E. et al., 2002).
Обширная доказательная база
В 2005–2010 гг. проведен целый ряд рандомизированных клинических исследований тиболона (табл. 3). Согласно их результатам, тиболон не уступает ЭГТ по эффективности купированию менопаузальных расстройств, в том числе по предотвращению развития остеопороза. Среди неоспоримых преимуществ тиболона — существенно меньшая частота кровотечений (главная причина прекращения терапии) и мастодинии.
Таблица 3. Характеристики основных рандомизированных клинических исследований тиболона
Заключение
Тиболон открывает новые горизонты возможностей врачам-гинекологам в лечении пациенток с менопаузальными расстройствами по сравнению с классическими схемами гормональной терапии. В отношении влияния на настроение женщин в постменопаузальный период применение препарата позволяет достичь лучших результатов, а в отношении влияния на сексуальность — это препарат выбора. Также тиболон оказывает положительное влияние на маммографическую плотность.
Таким образом, тиболон — альтернатива терапии ЭГТ/ЭТ с благоприятным профилем безопасности, прежде всего у женщин в постменопаузальный период с нарушениями сексуальности, настроения, масталгией и повышенной маммографической плотностью.
От редакции
В настоящее время единственным препаратом тиболона, представленным на рынке Украины, является препарат ЭСПА-ТИБОЛ компании «Эспарма ГмбХ», Германия, сочетающий традиционно высокое немецкое качество и доступную цену.
Рекомендованная доза препарата ЭСПА-ТИБОЛ составляет 1 таблетку в сутки. Улучшение обычно достигается в течение нескольких недель, но лучшие результаты получают при лечении на протяжении минимум 3 мес. Применение препарата ЭСПА-ТИБОЛ в рекомендованной дозе можно продолжать и дольше.
Выбор между гормональной и альтернативной терапией в периоде менопаузального перехода и постменопаузе
Менопауза – ключевой момент старения женской репродуктивной системы. Прекращение менструальной функции связано с изменением ряда биологических и физиологических процессов в организме и сопровождается появлением симптомов, которые могут нарушать качество жизни пациенток и иметь негативные отдаленные последствия. Наиболее характерными из них являются вазомоторные симптомы – приливы жара и ночная потливость, часто служащие поводом для обращения к врачу. «Золотым стандартом» терапии вазомоторных симптомов считается менопаузальная гормональная терапия (МГТ), которая подбирается индивидуально в зависимости от характеристик исходного статуса женщины. Но к МГТ нередко выявляются противопоказания, кроме того, некоторые женщины по разным причинам отказываются от применения гормонов. В подобных ситуациях рекомендуется назначать негормональные средства, ассортимент которых в настоящее время достаточно большой. В обзоре особое внимание уделено принципам выбора между гормональной и негормональной коррекцией вазомоторных симптомов климактерического синдрома, представлены варианты МГТ (тиболон) и альтернативной терапии (высокоочищенный экстракт цветочной пыльцы) в перименопаузе и постменопаузе с учетом доказанной эффективности и безопасности данных средств в различных клинических ситуациях.
Ключевые слова: менопауза, приливы жара, менопаузальная гормональная терапия, альтернативная терапия, тиболон.
Для цитирования: Кузнецова И.В. Выбор между гормональной и альтернативной терапией в периоде менопаузального перехода и постменопаузе. РМЖ. Мать и дитя. 2018;26(2(I)):43-47.
The choice of hormonal and alternative therapy in menopausal and post-menopausal period
Kuznetsova I.V.
First Moscow State Medical University named after I.M.Sechenov (Sechenov University), Moscow
Menopause is a key moment in the aging of a female reproductive system. Termination of menstrual function is associated with a change in a number of biological and physiological processes and is accompanied by the appearance of the symptoms that can affect the quality of life of patients and have negative long-term consequences. The most frequent symptoms are vasomotor symptoms - hot flashes and night sweats, which often make a woman to apply to a doctor. Menopausal hormone therapy (MHT) is the gold standard for the treatment of vasomotor symptoms, it is selected individually depending on the woman’s initial status. But there are contraindications to MHT, in addition, some women refuse to use hormones for various reasons. In such situations it is recommended to use non-hormonal methods of correction of menopausal symptoms, the choice of which is currently quite large. In the review, special attention is paid to the principles of choosing the hormonal or non-hormonal correction of the vasomotor symptoms of menopausal syndrome, the variants of the appointment of MHT (tibolone) and alternative therapy (highly purified pollen extract) in perimenopause and postmenopause, taking into account the proven efficacy and safety of these drugs in various clinical situations.
Key words: menopause, hot flushes, menopausal hormone therapy, alternative therapy, tibolone.
For citation: Kuznetsova I.V. The choice of hormonal and alternative therapy in menopausal and post-menopausal period //
RMJ. 2018. № 2(I). P.43 –47.
Обзор посвящен принципам выбора между гормональной и негормональной коррекцией вазомоторных симптомов климактерического синдрома, представлены варианты менопаузальной гормональной терапияи (Тиболон) и альтернативной терапии (высокоочищенный экстракт цветочной пыльцы) в перименопаузе и постменопаузе.
Гетерогенный и многоликий процесс старения имеет уникальные гендерные черты, у женщин особенно ярко проявляясь потерей менструальной функции, связанной с утратой циклической активности яичников. Прекращение менструаций – не одномоментное событие, а длительный процесс, занимающий значительный период жизни женщины и связанный не только с завершением фертильной функции, но и с непростой адаптацией к принципиально новому состоянию гомеостаза [1]. На протяжении этого периода женщину часто сопровождает климактерический синдром – симптомокомплекс, характеризующийся сочетанием нейропсихических, вегетативно-сосудистых, нейроэндокринных изменений, которые, в свою очередь, являются предикторами множества более поздних сердечно-сосудистых, обменно-метаболических и неврологических нарушений [2, 3]. Наиболее типичным симптомом климактерического синдрома признаются приливы жара, на которые жалуются около 80% женщин в периодах менопаузального перехода и ранней постменопаузы.
Приливы возникают в результате внезапного расширения мелких сосудов и проявляются чувством жара, гиперемией, сердцебиением, потоотделением. Они длятся до 5 мин и повторяются от 1 до 20 раз и более в сутки. Ночным аналогом приливов считаются пароксизмы потливости. Приливы жара и ночная потливость объединяются понятием «вазомоторные симптомы». Патологический климакс обычно диагностируется при приливах жара и приступах ночной потливости, превышающих 50 эпизодов в неделю. Кроме частоты учитывается тяжесть этих состояний, а также другие жалобы, включая нарушение дыхания, мышечные и суставные боли, аффективные расстройства и др. В совокупности патологический климакс существенно нарушает качество жизни женщины и может продолжаться длительное время. Климактерический синдром в некоторых случаях спонтанно разрешается, но, в противоположность ранее существовавшей точке зрения, продолжительность нарушений чаще не ограничивается 2–3 годами. В настоящее время установлено, что женщина может испытывать приливы жара до 15 лет и более, иногда до конца жизни [4].
Снижение качества жизни далеко не единственное негативное следствие приливов. Современные методы нейровизулизации позволили установить, что в момент прилива резко уменьшается кровоток в отдельных областях головного мозга, в т. ч. отвечающем за механизмы памяти гиппокампе. Частые, хотя и кратковременные эпизоды ишемии могут стать основой развития дегенеративных процессов в головном мозге с исходом в сосудистую деменцию и болезнь Альцгеймера. Приливы также считаются индикатором латентно протекающих сердечно-сосудистых заболеваний (ССЗ) [5] и прямо коррелируют с субклиническими их признаками – нарушением функции сосудистого эндотелия (потокоопосредованное расширение плечевой артерии), кальцификацией аорты, увеличением толщины интимы медиа сонной артерии, повышением уровня прокоагулянтных факторов (факторы VII и tPA), развитием дислипопротеинемии [6–9]. Женщины с приливами жара имеют более высокий уровень систолического артериального давления, что, как известно, является независимым фактором риска развития ССЗ и их осложнений [10].
Патогенез
Основу физиологической и патологической перестройки гомеостаза в климактерии составляет постепенное снижение овариальной функции, последовательно приводящее к гипопрогестеронемии, гипоэстрогенемии, повышению содержания гонадотропинов, что вносит свой вклад в процесс старения, изменяя метаболизм, деятельность центральной нервной системы (ЦНС) и прямо либо опосредованно влияет на все функциональные системы организма. Уменьшение секреции эстрогенов признается ключевым звеном в механизме развития климактерического синдрома [11], однако связь между этими двумя событиями не столь прямолинейна, как считалось прежде. Бесспорно, изменение привычного гормонального гомеостаза ведет к дисфункции нейрональных систем головного мозга, испытывающих своеобразную депривацию в результате утраты эстрогенных влияний [12]. Контраргументами этого утверждения выступают отсутствие корреляции между уровнем эстрогенов и наличием приливов и вазомоторные нарушения, наблюдающиеся в некоторых случаях при нормальной секреции эстрогенов даже на фоне овуляторного менструального цикла [13]. Показательно, что верным предиктором менопаузальных вазомоторных симптомов в периоде менопаузального перехода являются не гормональные маркеры, а предшествующая история приливов жара и ночной потливости в репродуктивном периоде. Таким образом, одного снижения эстрогенов для развития вазомоторных симптомов недостаточно, и необходимо иначе взглянуть на их происхождение, в котором становится очевидной роль гипоталамуса и/или других отделов ЦНС, постепенно утрачивающих чувствительность к эстрогенам в результате физиологического старения или пережитых стрессов, в т. ч. дисфункции серотонинергической и норадренергической систем [14–16].
Лечение
Заключение
Таким образом, сегодня мы обладаем достаточно широким спектром лекарственных и нелекарственных средств для терапии климактерических расстройств. Залогом удачного выбора метода лечения, как всегда, остается внимательное отношение, позволяющее найти индивидуальное средство коррекции менопаузальных симптомов.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Для кого тиболон?
Тиболон — синтетический стероид, тканеселективный регулятор эстрогенной активности. В организме человека он метаболизируется в три изомера: 3 альфа-гидрокситиболон, 3 бета-гидрокситиболон и 4 дельта-метаболит, обладаюшие тканеселективным сродством к эстро
Tibolon is synthetic steroid, tissue-selective regulator of estrogenic activity. In the human organism, it is metabolized into three isomers: 3alfa-gidroksitibolon, 3beta-gidroksitibolon and 4 delta-metabolite, which have tissue-selective affinity for the estrogenic receptors.
Изменение демографической структуры общества в последние десятилетия привело к увеличению в популяции доли женщин старшей возрастной группы. В настоящее время развитые страны мира стоят перед серьезной социальной и медицинской проблемой — инверсией возрастной «пирамиды», что связано с увеличением продолжительности жизни. Более трети своей жизни современная женщина проводит в состоянии дефицита женских половых гормонов. По данным ВОЗ с каждым годом возрастает число женщин, вступающих в период постменопаузы (к 2030 г. их количество достигнет 1,2 млрд человек). Менопауза, не являясь заболеванием, приводит к нарушению эндокринного равновесия в организме женщины, вызывая приливы, раздражительность, бессонницу, а в последующем — возможные урогенитальные расстройства, повышение риска развития остеопороза и сердечно-сосудистых заболеваний. Все эти данные свидетельствуют о необходимости разработки целого ряда медицинских и социальных мер по защите здоровья, сохранению работоспособности и достойного качества жизни женщин пери- и постменопаузального периода.
Новым этапом в развитии менопаузальной гормональной терапии (МГТ) стали данные о возможности эффективного использования особых групп препаратов как альтернативы традиционной эстрадиолсодержащей заместительной гормональной терапии (ЗГТ) [1]. Одним из таких препаратов является тиболон, относящийся к категории G3H — другие половые гормоны и препараты, применяющиеся для лечения менопаузальных нарушений. Тиболон — синтетический стероид, тканеселективный регулятор эстрогенной активности. В организме человека он метаболизируется в три изомера: 3 альфа-гидрокситиболон, 3 бета-гидрокситиболон и 4 дельта-метаболит, обладающие тканеселективным сродством к эстрогенным рецепторам. Гидроксиметаболиты циркулируют в плазме крови в связанном неактивном состоянии в виде сульфатированных форм. Попадая в ткани-мишени (кости, центральная нервная система, мочеполовые органы, сердечно-сосудистая система), метаболиты тиболона реактивируются под воздействием сульфатазы, что обеспечивает их эстрогеноподобный эффект. В молочной железе и эндометрии 4 дельта-изомер блокирует сульфатазу, препятствуя формированию активных метаболитов, способных взаимодействовать с эстрогенными рецепторами. Этот изомер обладает также гестагенными и слабыми андрогенными свойствами. В результате достигаются благоприятные эстрогенные эффекты в центральной нервной системе, костях и мочеполовом тракте при отсутствии нежелательных влияний в эндометрии и молочных железах.
В рандомизированных плацебо-контролируемых исследованиях было показано, что тиболон позволяет контролировать приливы жара, потливость и другие типичные симптомы, такие как бессонница, головная боль и утомляемость. В плане облегчения климактерических симптомов он оказался настолько же эффективным, как и многочисленные схемы эстроген-прогестагенной комбинированной и только эстрогенной терапии (ЭПТ/ЭТ) [8–10], хотя, возможно, он и характеризуется несколько более медленным началом действия, но может также использоваться в качестве «терапии прикрытия» для облегчения симптомов дефицита эстрогенов у женщин, получающих лечение агонистами гонадотропин-рилизинг-гормона (аГнРГ) по поводу миомы матки и эндометриоза [11, 12].
Показано, что тиболон способствует обратному развитию атрофии влагалища (увеличивает кариопикнотический индекс и индекс созревания клеток) и улучшает качество цервикальной слизи [13]. Женщины, получающие лечение тиболоном, отмечают значительное уменьшение сухости во влагалище, выраженности диспареунии и мочевых симптомов.
Эффекты тиболона в отношении циркулирующих андрогенов отличаются от действия стандартных пероральных схем МГТ (ЭПТ/ЭТ). При использовании тиболона уровень глобулина, связывающего половые стероиды (ГСПС), снижается, а не увеличивается, в связи с этим концентрация свободного тестостерона повышается, в то время как при стандартной МГТ (ЭПТ/ЭТ) наблюдается ее снижение. Показано, что увеличивается также концентрация дегидроэпиандростеронсульфата (ДЭАС) [14]. Кроме этого, 4 дельта-изомер тиболона также оказывает некоторое андрогенное действие. Эти свойства тиболона способствуют его благоприятному влиянию на сексуальное благополучие, которое заключается в повышении сексуального влечения, возбуждения, стимуляции сексуальных фантазий и повышении увлажненности влагалища [15–17]. В сравнении со стандартными схемами ЭПТ, тиболон в значительно большей степени способствует увеличению частоты коитусов, повышает степень наслаждения и удовлетворенности половым актом [18]. Что касается частоты оргазма и сексуальной чувствительности, то при применении тиболона или комбинации эстрогенов и андрогенов наблюдается более выраженный эффект, нежели при использовании ЭТ или в контрольной группе [19].
Предполагается, что существенное благоприятное воздействие тиболона на уровень настроения обусловлен нормализацией уровня эндорфинов и его андрогенными свойствами [15, 20]. В сравнительном исследовании с использованием ЭПТ тиболон оказался более эффективным в плане уменьшения выраженности расстройств настроения [21]. Кроме того, его эффект может осуществляться синергистически с эффектами психоактивных препаратов, что сопровождается более быстрым достижением улучшения у женщин, страдающих депрессией и психозами. Поскольку применение антидепрессантов часто ассоциируется с сексуальной дисфункцией, влияние тиболона на сексуальность у таких женщин сопровождается дополнительными преимуществами.
В рандомизированных контролируемых исследованиях показано, что тиболон вызывает увеличение минеральной плотности костной ткани (МПК) и предотвращает потерю костного вещества [23, 24]. Благоприятные эффекты тиболона наблюдались как в шейке бедра, так и в позвоночнике. Эти благоприятные эффекты отмечались при длительном (10-летнем) лечении [25] как в ранней, так и в поздней постменопаузе у женщин с установленным диагнозом остеопороза и у женщин, получавших лечение агонистами ГнРГ [11, 12, 26–28].
Терапия тиболоном значительно реже вызывает болезненность молочных желез и масталгию, нежели ЭПТ; эта причина гораздо реже, чем в случае ЭПТ, приводит к прекращению лечения тиболоном [8, 9, 23, 29]. Женщины с болезненностью молочных желез или масталгией на фоне ЭПТ, по-видимому, могут воспользоваться благоприятным эффектом при переходе на тиболон [30].
Тиболон не вызывает увеличения плотности ткани на маммограмме [29, 31]. Самопроизвольно возникшая повышенная рентгенографическая плотность молочных желез рассматривается как независимый фактор риска рака молочной железы. В настоящее время неясно, является ли индуцированная ЭПТ плотность молочных желез суррогатным маркером повышенного риска рака молочной железы, однако повышенная маммографическая плотность может маскировать опухоли молочных желез при скрининговой маммографии, что приводит к поздней диагностике [32]. Кроме того, повышенная маммографическая плотность приводит к увеличению частоты повторных вызовов пациенток, что вызывает страх женщин [33, 34]. Действие тиболона на молочные железы отличается от эффектов ЭПТ. В отличие от ЭПТ, тиболон не повышает риск пролиферации ткани молочной железы, но стимулирует апоптоз [31, 35]. Согласно объединенным данным всех исследований тиболона III/IV фазы, тиболон не вызывал увеличения риска рака молочной железы, в сравнении с плацебо (относительный риск (ОР) 0,50; 95% доверительный интервал 0,11–2,54) [36]. Исследование «Миллион женщин» (MWS) сообщает о повышении ОР рака молочной железы на фоне лечения тиболоном (ОР 1,45; 95% доверительный интервал 1,25–1,67), хотя это увеличение и достоверно (p < 0,0001) меньше, чем на фоне ЭПТ [5]. В другом эпидемиологическом исследовании, где использовалась база данных исследований общей практики Великобритании (GPRD), не обнаружено повышения риска при использовании тиболона (ОР 1,02; 95% доверительный интервал 0,78–1,33) [37]. Однако данные этого исследования были опубликованы только в виде тезисов, а не в виде полнотекстовой статьи.
Хотя лучшие доказательства влияния тиболона на развитие рака молочной железы, имеющиеся в настоящее время, получены от MWS, риски, описанные в этом обсервационном исследовании, вероятно, переоценены [3, 4]. Данные проведенных проспективных исследований [2, 33] свидетельствуют о том, что абсолютное увеличение риска рака молочной железы ниже, чем описано в исследовании MWS, и что риск применения тиболона и ЭТ, вероятно, ниже, чем риск использования ЭПТ.
В итоге: для кого Ледибон?
Пациентки в постменопаузе, имеющие вазомоторные симптомы, у которых Ледибон может иметь особое значение:
- женщины с низким уровнем сексуального влечения или так называемой женской сексуальной дисфункцией;
- женщины с расстройствами настроения и женщины, получающие психоактивные препараты;
- женщины с риском ускоренной потери костной ткани;
- женщины с менопаузальной масталгией;
- женщины с повышенной рентгенологической плотностью молочных желез;
- женщины с миомой матки;
- женщины с урогенитальными жалобами.
Пациентки, у которых может оказаться благоприятным переход с ЭПТ/ЭТ на Ледибон:
- женщины, у которых имеет место усиление боли в молочных железах;
- женщины, у которых наблюдается увеличение плотности молочных желез, что приводит к частым ложным вызовам на осмотр или получению нечитаемых маммограмм;
- женщины с низким сексуальным влечением;
- женщины с колебаниями настроения;
- женщины с кровотечениями (при условии отсутствия гистопатологических причин для кровотечения).
Пациентки без климактерических симптомов, которых следует иметь в виду (некоторые постменопаузальные женщины без климактерических симптомов или со слабо выраженной симптоматикой могут получить преимущество от лечения Ледибоном):
- женщины с низким сексуальным влечением;
- женщины с колебаниями настроения;
- женщины с остеопенией.
Литература
- Smith C. L., O’Malley B. W. Coregulator function: a key to understanding tissue specificity of selective receptor modulators // Endocr Rev. 2004; 25: 45–71.
- Anderson G. L., Limacher M., Assaf A. R. et al. Effects of conjugated equine estrogen in postmenopausalwomen with hysterectomy: the Women’s Health Initiative randomized controlled trial // J Am Med Assoc. 2004; 291: 1701–1712.
- Shapiro S. The Million Women Study: potential biases do not allowuncritical acceptance of the data // Climacteric. 2004; 7: 3–7.1
- Whitehead M., Farmer R. The MillionWomen Study: a critique // Endocrine. 2004; 24: 187–194.
- Million Women Study Collaborators. Breast cancer and hormone replacement therapy in the MillionWomen Study // Lancet. 2003; 362: 419–427.
- EMAS Revised Statement // Maturitas. 2005; 51: 8–14.
- IMS Revised Position Paper // Climacteric. 2004; 7: 333–337.
- Hammar M., Christau S., Nathorst-B¨o¨os J., Rud T., Garre K. A double-blind randomised trial comparing the effects of tibolone and continuous combined hormone replacement therapy in postmenopausal women with menopausal symptoms // Br J Obstet Gynaecol. 1998; 105: 904–911.
- Huber J., Palacios S., Berglund L. et al. The effect of tibolone compared with conjugated equine oestrogens continuously combined with medroxyprogesterone acetate on bleeding rates, quality of life and tolerability in postmenopausal women // Br J Obstet Gynaecol. 2002; 109: 886–893.
- Baracat E. C., Barbosa I. C., Giordano M. G. et al. A randomized, open-label study of conjugated equine estrogens plus medroxyprogesterone acetate versus tibolone: effects on symptom control, bleeding pattern, lipid profile and tolerability // Climacteric. 2002; 5: 60–69.
- Lindsay P. C., Shaw R. W., Coelingh Bennink H. J., Kovic P. The effect of add back treatment with tibolone (Livial®) on patients treated with the gonadotrophin-releasing hormone agonist triptorelin (Decapeptyl) // Fertil Steril. 1996; 65: 342–348.
- Palomba S., Affinito P., Di Carlo C., Bifulco G., Nappi C. Longterm administration of tibolone plus gonadotrophin-releasing hormone agonist for the treatment of uterine leiomyomas: effectiveness and effects on vasomotor symptoms, bone mass and lipid profile // Fertil Steril. 1999; 72: 889–895.
- Morris E. P., Wilson P. O. G., Robinson J., Rymer J. M. Long-term effects of tibolone on the genital tract in postmenopausal women // Br J Obstet Gynaecol. 1999; 106: 954–959.
- Doren M., Rubig A., Coelingh Bennink H. J., Holzgreve W. Differential effects on the androgen status of postmenopausal women treated with tibolone and continuous combined estradiol and norethindrone acetate replacement therapy // Fertil Steril. 2001; 75: 554–559.
- Davis S. R. The effects of tibolone on mood and libido // Menopause. 2002; 9: 162–170.
- Palacios S., Menendez C., Jurado R., Castano J. C., Vargas J. C. Changes in sex behaviour after menopause: effects of tibolone // Maturitas. 1995; 22: 155–161.
- Laan E., van Lunsen R. H. W., Everaerd W. The effects of tibolone on vaginal blood flow, sexual desire and arousability in postmenopausal women // Climacteric. 2001; 4: 28–41.
- Nathorst-Boos J., Hammar M. Effect on sexual life–a comparison between tibolone and a continuous estradiol-norethisterone acetate regimen // Maturitas. 1997; 26: 15–20.
- Castelo-Branco C., Vicente J., Figueras F. et al. Comparative effects of estrogens plus androgens and tibolone on bone, lipid pattern and sexuality in postmenopausal women // Maturitas. 2000; 34: 161–168.
- Genazzani A. R., Petraglia F., Facchinetti F. et al. Effects of Org OD 14 on pituitary and peripheral-endorphin in castrated rats and in postmenopausalwomen // Maturitas. 1987; 1: 35–48.
- Egarter Ch., Huber J., Leikermoser R. et al. Tibolone versus conjugated estrogens and sequential progestogen in the treatment of climacteric complaints // Maturitas. 1996; 23: 55–62.
- Meeuwsen I. B., Samson M. M., Duursma S. A., Verhaar H. J. The influence of tibolone on quality of life in postmenopausal women // Maturitas. 2002; 41: 35–43.
- Roux C., Pelissier C., Fechtenbaum J., Loiseau-Peres S., Benhamou C. L. Randomized, double-blind, 2-year comparison of tibolone with 17-estradiol and norethindrone acetate in preventing postmenopausal bone loss // Osteoporosis Int. 2002; 13: 241–248.
- Lippuner K., Haenggi W., Birkhauser M. H., Casez J.-P., Jaeger P. Prevention of postmenopausal bone loss using tibolone or conventional peroral or transdermal hormone replacement therapy with 17-oestradiol and dydrogesterone // J Bone Min Res. 1997; 12: 806–812.
- Rymer J., Robinson J., Fogelman I. Ten years of treatment with tibolone 2.5 mg daily: effects on bone loss in postmenopausal women // Climacteric. 2002; 5: 390–398.
- Berning B., Kuijk C. V., Kuiper J. W., Coelingh Bennink H. J. T., Kicovic P. M., Fauser B. C. J. M. Effects of two doses of tibolone on trabecular and cortical bone loss in early postmenopausal women: a two-year randomized, placebo-controlled study // Bone. 1996; 19: 395–399.
- Bjarnason N. H., Bjarnason K., Haarbo J., Rosenquist C., Christiansen C. Tibolone: prevention of bone loss in late postmenopausal women // J Clin Endocrinol Metab. 1996; 81: 2419–2422.
- Pavlov P. W., Ginsburg J., Kicovic P. M., van der Schaaf D. B., Prelevic G., Coelingh Bennink H. J. T. Double-blind, placebo controlled study of the effects of tibolone on bone mineral density in postmenopausal osteoporotic women with and without previous fractures // Gynecol Endocrinol. 1999; 13: 230–237.
- Lundstrom E., Christow A., Svane G. et al. Effects of tibolone and a continuous combined HRT regimen on mammographic breast density // Am J Obstet Gynecol. 2002; 186: 717–722.
- Palomba S., Di Carlo C., Morelli M. et al. Effect of tibolone on breast symptoms resulting from postmenopausal hormone replacement therapy // Maturitas. 2003; 45: 267–273.
- Valdivia I., Campodonico I., Tapia A. et al. Effects of tibolone and continuous combined hormone therapy on mammographic breast density and breast histochemical markers in postmenopausal women // Fertil Steril. 2004; 81: 617–623.
- Thurfjell E. Breast density and the risk of breast cancer // N Engl J Med. 2002; 347: 866.
- Chlebowski R. T., Hendrix S. L., Langer R. D. et al. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: theWomen’s Health Initiative Randomized Trial // J Am Med Assoc. 2003; 289: 3243–3253.
- Banks E., Reeves G., Beral V. et al. Impact of use of hormone replacement therapy on false positive recall in the NHS breast screening programme: results from the Million Women Study // Br Med J. 2004; 328: 1291–1292.
- Conner P., ChristowA., Kersemaekerc W. Acomparative study of breast cell proliferation during hormone replacement therapy: effect of tibolone and continuous combined estrogen progestogen therapy // Climacteric. 2004; 7: 50–58.
- Helmond F. A., Kloosterboer H. J. Safety and tolerability profile of Livial. In: Genazzani AR, editor. Hormone replacement therapy and cancer. The current status of research and practice. Boca Raton: The Parthenon Publishing Group; 2002. P. 252–256.
- Allen D. S., de Vries C. S., Farmer R. D. T. Pharmaceutical content and regimen of hormone replacement therapy and risk of breast cancer // Pharmacoepidemiol Drug Saf. 2002; 11 (Suppl 1): 296.
А. Л. Тихомиров 1 , доктор медицинских наук, профессор
И. Б. Манухин, доктор медицинских наук, профессор
Е. И. Манухина, доктор медицинских наук, профессор
В. В. Казенашев, кандидат медицинских наук
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Читайте также:
