Токсичность бензола. Токсичность пестицидов и инсектицидов
Добавил пользователь Morpheus Обновлено: 27.01.2026
Как правило, инсектициды подразделяются на группы по способу их действия на насекомых. Если инсектицид проявляет токсическое действие лишь при попадании в кишечник вредителя, он относится к группе кишечных инсектицидов. Инсектициды, убивающие насекомых при попадании на наружные покровы, относятся к самой многочисленной группе контакт ных инсектицидов. В связи с тем что существует ряд вредителей с ротовым аппаратом сосущего типа, имеющих непроницаемые внешние оболочки, были предприняты поиски инсектицидов, проникающих в растение через листья или корни и делающих растение токсичным для насекомых, — эта группа инсектицидов получила название системных инсектицидов.
Контактные инсектициды. В группе синтетических контактных инсектицидов по значимости и широте применения до 70-х годов XX столетия выделялись полигалогснопро- изводные, из которых 4,4-дихлордифенилтрихлорэтан (ДДТ) и гексахлорциклогексан (ГХЦГ, гексахлоран) были наиболее широко применяемыми препаратами:
За открытие действия ДДТ на насекомых П. Мюллер в 1948 г. получил Нобелевскую премию. Оба препарата были доступны и дешевы. ДДТ получали конденсацией хлорбензола с хлоралем под действием концентрированной серной кислоты, а гексахлоран — при фотохимическом хлорировании бензола.
Однако большинство полихлоропроизводных — очень устойчивые соединения, крайне медленно разлагающиеся в природных условиях и накапливающиеся в живых организмах. В связи с этим применение ДДТ запрещено в России и в большинстве развитых стран. По-видимому, и другие еще используемые пол и галогенопроизводные также будут запрещены к применению в ближайшие годы.
Серьезной проблемой при применении инсектицидов стало привыкание (резистентность) насекомых к действию препарата. Так, за прошедшие с начала применения ДДТ 40 лет появились популяции полностью устойчивых к нему насекомых. Частичное решение проблемы дает комплексное применение препаратов, но все равно после использования большинства пестицидов в течение десятка лет их действие очень сильно ослабевает (часто более чем в 100 раз). Эта проблема еще более остро, чем в сельском хозяйстве, стоит и в медицине, где чрезвычайно быстрая смена поколений у бактерий приводит уже через несколько лет к появлению рас, устойчивых к действию тех или иных препаратов.
Среди группы контактных инсектицидов особый интерес представляют пиретрины — действующее начало пиретрума — природного инсектицида, добываемого из некоторых видов ромашки. Пиретрины — единственная группа инсектицидов, в которой не замечено никакой резистентности, несмотря на фактическое применение их с 1830 г. Кроме того, пиретрины практически не токсичны для теплокровных животных. К сожалению, они мало устойчивы при хранении. Химия пиретри- нов была детально исследована Ружичкой и Штаудингером. Наиболее токсичным для насекомых оказался эфир циклического кетоспирта — пиретролона и кислоты циклопропанового ряда (хризантемовой):
Большинство пиретроидов являются эфирами 3-замещен- ной-2,2-диметилциклопропанкарбоновой кислоты или изосте- рической кислоты. Синтетические пиретроиды представляют собой липофильные вещества, мало растворимые в воде. Это обусловливает их высокую токсичность в отношении насекомых и отсутствие системного действия. В настоящее время разрешены к применению на территории РФ следующие синтетические пиретроиды-инсектициды:
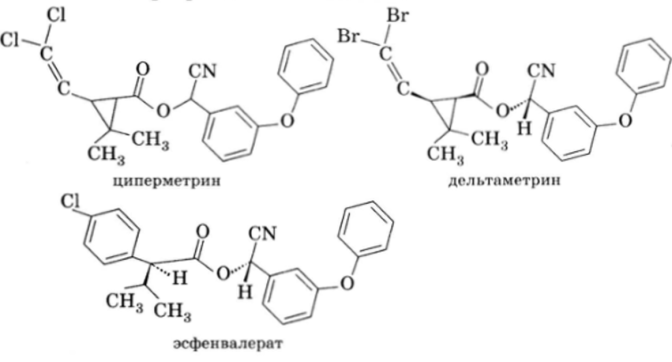
Метаболизм всех пиретроидов начинается со стадии гидролиза сложноэфирной связи. Продукты гидролиза пестицидной активностью не обладают.
Ряд природных алкалоидов, в частности никотин и анабазин, несмотря на высокую контактную инсектицидную активность, не находят широкого применения из-за очень высокой токсичности для теплокровных:
Соединения, содержащие никотиновый и анабазиновые фрагменты, относятся к неоникотиноидам. Наиболее распространенные из них следующие:
К важнейшим контактным инсектицидам относятся и многочисленные органические производные фосфора: производные фосфорной, тио- и дитиофосфорной, фосфоновой кислот. Все соединения этого класса являются фосфорилирующи- ми агентами и фосфорилируют ферменты вредителя (ацетил- холинэстеразу), нарушая его жизненные функции. Их общий недостаток — токсичность для теплокровных, хотя для отдельных представителей она и не очень высока. Замена в группировке фосфорной кислоты атомов кислорода на серу, как правило, несколько снижает токсичность, не уменьшая инсектицидную активность. Все многочисленные производные этого класса довольно быстро дезактивируются в природе вследствие гидролитических процессов и процессов окисления. Процессы метаболизма также идут довольно быстро. Ниже приведены некоторые фосфорорганические инсектициды — эфиры тио-, дитиофосфорной кислот:
Системные инсектициды. Широкое применение системных инсектицидов несколько сдерживается их токсичностью для теплокровных и не всегда достаточно быстро протекающим метаболизмом до нетоксичных продуктов. Наиболее часто используются эфиры и амиды дитиофосфорной кислоты, например:
Длительность процесса метаболизма фосфамида в растениях обычно не превышает трех недель и заключается в последовательном гидролизе эфирных и тиоэфирных групп.
Весьма интересные работы выполнены Карлсоном, которому удалось из растительного сырья выделить так называемые инсектицидные гормоны стероидной природы, например экдизон.
Первичные испытания показали их малую токсичность для теплокровных животных и отсутствие резистентности к ним у насекомых:
Токсичность бензола. Токсичность пестицидов и инсектицидов
Токсичность бензола. Токсичность пестицидов и инсектицидов
Бензол — это прекрасный растворитель, но он высокотоксичен и канцерогенен. Токсические эффекты острого недлительного воздействия бензола включают помутнение зрения, тремор, нарушение дыхания, сердечные аритмии, паралич и потерю сознания. Хроническая интоксикация может привести к апластической анемии и лейкемии.
Толуол угнетает ЦНС и в низких концентрациях вызывает слабость и утомляемость, но, видимо, не приводит к апластической анемии и лейкемии. Пары толуола высвобождаются из клея при его вдыхании.
В США ежегодно используют более 0,5 млрд тонн пестицидов, а в мире — около 2 млрд. Чаще всего используют гербициды, реже — инсектициды и фунгициды.
Остатки инсектицидов, попадающие в пищу, обусловливают воздействие этих токсичных веществ на население, хотя и на низком уровне. Острое отравление обычно возникает при употреблении сильно загрязненной пищи, при сельхозработах или в результате преднамеренного отравления.
Хлорорганические инсектициды. Эти инсектициды содержат несколько атомов хлора на углеводороде и различаются по своей токсичности. Их молекулярный вес варьирует от 300 до 500. Они все жирорастворимы, поэтому легко проникают в ЦНС и активируют печеночные CYP-ферменты. Хлорированные производные этана, такие как дихлордифенилтрихлорэтан (ДДТ), широко использовали как инсектициды. ДДТ обладает высокой жирорастворимостью и потому медленно экскретируется из тканей. Он безопасен для человека (нет описанных случаев смерти), но кумуляция его в пищевой цепи вызывает побочные эффекты у хищных видов, чаще птиц, стоящих высоко в пищевой цепи. Эти и другие потенциальные экологические проблемы привели к запрету ДДТ во многих странах.

К сожалению, ДДТ был и остается одним из лучших средств в борьбе с малярийными комарами. Метоксихлор, заменитель ДДТ, стимулирует ЦНС путем антагонизма с ионными рецепторами гамма-аминомасляной кислоты, вызывая снижение тока Сl- и снижение торможения. Метоксихлор и схожие соединения могут вызвать судороги еще до появления других видимых признаков отравления.
Хлорированные циклодиены, в отличие от ДДТ, хорошо всасываются через неповрежденную кожу. Среди инсектицидов, запрещенных в США, наибольшим канцерогенным потенциалом обладают алдрин и диэлдрин, а хлордан и гептахлор запрещены для использования в сельхозкультурах.
Углеводороды, используемые в качестве инсектицидов, включают у-изомер бензолгексахлорида и линдан. Отравление линданом вызывает слабость, тремор, атаксию и судороги. Установлено, что и линдан, и бензолгексахлорид вызывают апластическую анемию. Углеводород токсафен вызывает опухоли у мышей. Другие хлорированные углеводородные инсектициды тысячекратно концентрируются в пищевой цепи.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Токсичность
Токсичность веществ из группы пестицидов зависит от их химического состава, количества, воздействующего на организм, пути поступления, механизмов и продолжительности действия, условий внешней среды, чувствительности, исходного состояния организма и ряда других факторов. [1]
Виды токсичности
Разделяют острую и хроническую токсичность веществ, определяя, таким образом, их действие на организм и опасность для человека. В защите растений в основном используются пестициды, обладающие острой токсичностью, которая обеспечивает быстрый эффект в отношении вредных организмов. В специальных случаях, когда применение больших количеств пестицидов представляет опасность для полезных организмов и человека, используют их хроническую токсичность, вводя в состав приманок малые доли отравляющих веществ и обновляя эти приманки каждый день в течение недели (например, применение антикоагулянтов крови – родентицидов). [3]
Факторы, влияющие на токсичность
Для различных организмов мерой токсичности пестицидов является доза – количество отравляющего вещества на единицу измерения объекта, вызывающее определенный эффект. Ее выражают в единицах массы пестицида по отношению к единице массы обрабатываемого объекта (мкг/г, мг/кг), объема (концентрация в мкг/мл, мг/л) или на объект (мкг/особь). При оценке токсичности того или иного вещества всегда учитывается общий биологический закон развития живых существ: жизнеспособность вида определяется степенью гетерогенности его популяции. Исходя из этого, оценка проводится с использованием определенного числа организмов и по некому усредненному показателю. Наиболее часто применяется доза, вызывающая 50%-ный эффект (угнетение какого-то жизненно важного процесса) или 50%-ную гибель подопытных организмов. В первом случае такую дозу обозначают, как эффективная доза ЕД50, во втором это называется смертельной, или летальной дозой СД50 или ЛД50. Данные показатели также используются для определения степени устойчивости популяции к пестициду и избирательности действия пестицида на определенные виды организмов. [3]
В соответствии с современными представлениями о механизме действия ядов, любой химический агент после поступления в организм должен войти во взаимодействие с определенным химическим рецептором, который ответствен за прохождение жизненно важной биохимической реакции. Такой рецептор называют «местом действия». Токсичность вещества для организма будет зависеть от того, какое количество яда достигло места действия, насколько сильно и на какое время блокируется биохимическая реакция, а также каково значение этой реакции для жизнедеятельности организма. По этой причине любой фактор, который влияет на процессы поступления вещества в организм, его «поведения» в нем и взаимодействие с рецептором, вызывает изменение токсичности.
Также токсичность вещества для живого организма зависит от дозы токсиканта и продолжительности экспозиции. В определенном диапазоне с увеличением дозы и экспозиции пропорционально возрастает эффект. [3]
В целом, токсичность пестицида зависит от нескольких факторов, без оглядки на которые невозможно правильное использование препаратов. Все эти факторы можно распределить по трем группам:
- действующие на длительность контакта пестицида с вредоносным организмом (экспозицию);
- влияющие на поступление яда в организм вредителя;
- связанные с «поведением» отравляющего вещества в организме вредителя и взаимодействие яда с рецептором (местом действия). [3]
Экспозиция (продолжительность контакта токсического вещества с вредным организмом) – это одно из основных условий проявления токсичности. Известно, что с ростом экспозиции токсическое действие яда возрастает, поскольку в организм поступает его большее количество. При обработке почвы и растений экспозиция зависит от продолжительности сохранности пестицида в почве и на растениях. Большое значение при этом имеют условия внешней среды и физико-химические свойства пестицида. [3]
Длительность экспозиции в наибольшей степени зависит от химической, термической стойкости и фотостабильности, а также от летучести вещества. Химически стойкие и малолетучие вещества долго сохраняются на растениях и в почве. Эффективность и продолжительность действия синтетических пиретроидов во многом определяется их фотостабильностью. [3]
Из условий внешней среды наибольшее влияние на токсичность пестицидов оказывает температура. Под ее воздействием возможно изменение активности как самого вещества, так и реакции организма. С увеличением температуры повышаются потери пестицида с обработанной поверхности, но токсичность его может одновременно возрастать, например, при образовании более токсичных веществ (переход тионовых изомеров в тиоловые). При этом, в условиях оптимальной температуры организм становится более чувствительным к токсическому веществу из-за усиления процессов обмена веществ. [3]
Все почвенные факторы, которые влияют на сохранность пестицидов в почве, будут иметь влияние на токсичность препаратов. С увеличением содержания органического вещества и илистых частиц в почве резко возрастает сорбция пестицидов почвенным комплексом. В результате уменьшается количество вещества в почвенном растворе, снижается его эффективность и, как следствие, норму расхода пестицидов приходится увеличивать. [3]
На токсичность пестицида заметное влияние оказывают также процессы, которые протекают внутри организма. Поступление яда в организм вызывает ответные защитные реакции, ограничивающие его токсическое действие. К таким реакциям относятся: выведение вещества во внешнюю среду в неизменном виде, отложение (депонирование) его в тканях и разрушение яда до более простых веществ с включением их в общие процессы метаболизма или последующей экскрецией. [3]
Токсичность яда также зависит от скорости активной или пассивной диффузии веществ через различные ткани. Чем выше скорость проникновения, тем больше ядовитость соединения, поскольку уменьшаются возможности для его детоксикации и депонирования. Во многих организмах также есть внутренние структурные барьеры, препятствующие проникновению токсических веществ к жизненно важным центрам. [3]
Токсичность яда, проникшего к месту действия, зависит от степени сходства молекулы токсина с молекулой рецептора. Необходимость подобного сходства молекул подтверждается тем, что токсичность многих веществ зависит от структуры молекулы и пространственного расположения атомов. Инсектицидная активность синтетических пиретроидов зависит от количества активных стереоизомеров в препарате. Такая зависимость отмечена у фунгицидов из группы триазолов (металаксил), у гербицидов – производных арилоксифеноксипропионовой кислоты и др. [3]
Показатели токсичности
Как уже говорилось, универсальной мерой токсичности пестицидов для вредных организмов является доза отравляющего вещества – количество препарата, вызывающего определенный эффект. Она обычно выражается в единицах массы пестицида в отношении к единице массы вредоносного организма (в миллиграммах на килограмм).
Показатели токсичности обозначают буквенными символами с указанием величины эффекта:
- СД (смертельная доза) = ЛД (летальная доза),
- СК (смертельная концентрация) = ЛК (летальная концентрация),
- ЕД (эффективная доза)
Например, ЛД50 – это доза пестицида, вызывающая смерть 50% организмов, на которые она воздействует.
Эффект токсических веществ для вредных организмов определяют по проценту их гибели или по характерным признакам отравления ядом (уменьшение массы, задержка роста, изменение активности отдельных систем организма, его реакции и т.п.).
Количественные показатели токсичности определяют эмпирически, действуя на группы опытных объектов разными (логарифмически возрастающими) дозами препаратов. [1]
ГХЦГ (Гексахлоран)
ГХЦГ [γ-изомер гексахлорциклогексана] – химическое действующее вещество пестицидов (хлорорганическое соединение), ранее использовалось (в том числе в смесях с другими активными компонентами) в сельском хозяйстве для борьбы вредными насекомыми и вредителями запасов. Ныне отсутствует в списках пестицидов, разрешенных для применени.
ГХЦГ (Гексахлоран) - Трехмерная модель молекулы ГХЦГ (Гексахлоран) - Структурная формула
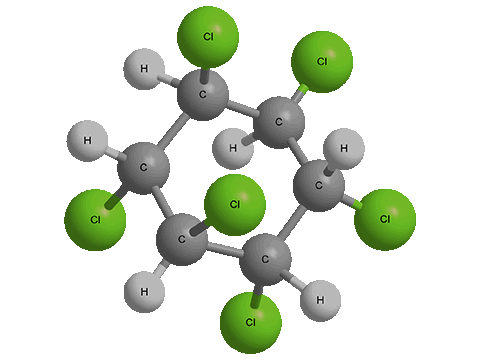
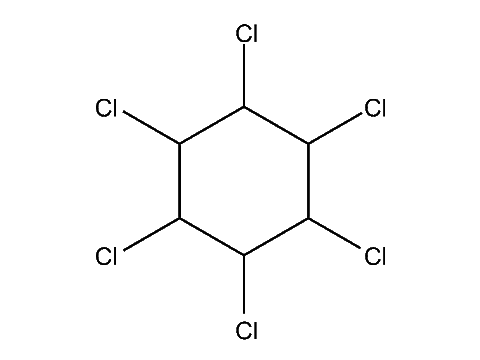
Действующие вещества
ГХЦГ (Гексахлоран) , Гексахлорциклогексана γ-изомер , ГХЦГ (гексахлоран) , ГХЦГ гамма-изомер , Гексахлоран , Линдатокс , Агризерт , Линдарам , Гаматокс , Линдан , ВНС
В настоящее время данное действующее вещество не применяется. Аналоги можно подобрать в Списке действующих веществ инсектицидов.
Физико-химические свойства
ГЦХГ представляет собой белый кристаллический порошок.
γ-изомер плохо растворяется в воде, хорошо – в ацетоне, эфире, бензоле, метиловом и этиловом спиртах, а также жирах и жирных маслах. Растворимость изомеров ГХЦГ в органических растворителях различна, что используется в процессе их разделения. Вещество является кислотоустойчивым. Под действием спиртовой щелочи и при нагревании водных растворов разлагается с образованием трихлорбензолов. Термически устойчиво, но при высоких температурах возгоняется с образованием белого густого дыма, что дает возможность применять его в форме аэрозоля. Слабо разрушается под действием ультрафиолетовых лучей, но благодаря относительно высокой летучести возгоняется с парами воды или испаряется с обработанных поверхностей, поэтому сохранность его в основном зависит от температуры.
ГХЦГ достаточно устойчив к действию концентрированных кислот: азотной, серной, соляной (даже при их температуре кипения), и различных окислителей. Это свойство применяется при анализе растений на остатки инсектицида: растительную пробу обрабатывают серной кислотой, после чего возгоняют ГХЦГ с парами воды.
Примеси пентахлорциклогексена и тетрахлорциклогексадиена придают веществу неприятный запах. Очень чистые препараты не пахнут, и лишь на свету и в присутствии влаги или оснований приобретают неприятный запах.
Содержание гамма-изомера ГХЦГ в техническом продукте составляет более 90%.
Физические характеристики
- Молекулярная масса 290,8;
- Температура плавления 112,8 °С;
- Давление паров (при 20 °С) ~ 1,25•10 -3 Па (9,4•10 -6мм .рт.ст.);
- Растворимость в воде (при 20°С) 10 мг/л.
Взаимодействие ГХЦГ с различными веществами
По химическим свойствам гексахлорциклогексан сравнительно мало отличается от других галогенпроизводных углеводородов с атомами галогена при соседних атомах углерода.
Гексахлорциклогексан при комнатной температуре реагирует с водой медленно, и лишь при нагревании до 100°С выделяется заметное количество хлористого водорода. Так, при действии на гексахлорциклогексан паров воды при температуре около 102°С в течение одного часа от α-изомера отщепляется около 0,13% хлористого водорода. При нагревании α-гексахлорциклогексана с водой при 200°С взапаянных трубках получается 1,2,4 – трихлорбензол и продукты его гидролиза. Скорость реакции увеличивается при освещении в присутствии оснований (изображение).
При взаимодействии с едкими щелочами в спиртовом растворе и при нагревании водных растворов гексахлорциклогексан превращается в трихлорбензолы. (изображение).
Главный продукт реакции – 1,2,4-трихлорбензол (выход 75-95%). Наряду с ним, образуются 1,2,3-трихлорбензол (3-20%) и 1,3,5-трихлорбензол (0-17,6%). На различной скорости реакции едких щелочей с изомерамигексахлорциклогексана основан кинетический метод количественного определения γ-изомера в смеси.
Отщепление HCl происходит и при взаимодействии с известью, аммиаком и органическими аминами. Разложение гексахлорциклогексана с образованием трихлорбензола и хлористого водорода протекает при повышенной температуре (250-350°С) в присутствии веществ, способных инициировать такое разложение (алюминий, железо, хлор, их соли и др.).
Токсикологические данные
Действие на вредные организмы
γ-изомер гексахлорциклогексана – высокоактивный инсектицид контактного и кишечного действия. При небольшой дозе контактное действие может проявиться вскоре (уже через несколько минут) после попадания на насекомое. Из-за высокого давления паров действующее вещество обладает свойствами фумиганта. При внесении в почву инсектицид проникает в растение, проявляя системное действие и защищая растения от вредных организмов в течение 5-15 дней. На отдельных насекомых инсектицид действует как отпугивающее средство.
ГХЦГ – яд, действующий на нервную систему. Вещество быстро проникает через кутикулу насекомых, достигая с током гемолимфы непосредственно нервной системы, концентрируется в периферийных областях ганглиев брюшного и головного отделов. Все начинается с возбуждения и расстройства координации движений. Вскоре наступает паралич конечностей и общий паралич. Последняя стадия может продолжаться от нескольких часов до нескольких дней.
Механизм действия ГХЦГ не изучен. Вероятно, молекулы вещества проникают в структуру липопротеиновых мембран нервных клеток, нарушая перенос ионов в момент передачи нервного импульса. Важное значение при этом имеет пространственная структура молекулы. По-видимому, гексахлорциклогексан может нарушить обмен липидов у насекомых. Действие ГХЦГ также проявляется в накоплении очень больших количеств холестерина в тканях пораженного насекомого, вследствие чего можно предположить, что инсектицид воздействует на липопротеино-стериновые комплексы клеточных структур.
Токсичность γ-изомера гексахлорциклогексана изменяется в зависимости от температуры внешней среды. При ее понижении усиливается его контактное и кишечное действие, а при повышении – фумигационное действие, но при этом сокращается продолжительность эффекта.
В организме насекомого гексахлорциклогексан подвергается различным превращениям. Продукты этих превращений, а иногда и не измененный инсектицид выделяются через мальпигиевы трубы.
Резистентность. Систематическое применение ГХЦГ приводит к появлению групповой приобретенной устойчивости насекомых. Насекомые, резистентные к гексахлорциклогексану, очень устойчивы и к другим хлорорганическим соединениям. Выявлены устойчивые к ГХЦГ расы тараканов, комнатных мух, колорадского жука, некоторых видов долгоносиков (свекловичный, люцерновый) и других вредных насекомых.
Применение
Ранее ГХЦГ служил одним из основных средств борьбы с гусеницами подгрызающих совок и почвообитающими насекомыми, широко использовался для фумигации складских помещений до их загрузки.
Для большинства вредных насекомых ГХЦГ обладал высокой токсичностью. Высокочувствительны к нему прямокрылые, в том числе и чешуекрылые, саранчовые, мухи, жуки и личинки этих видов, особенно младших возрастов. В то же время, кокциды и растительноядные клещи весьма устойчивы, поэтому после долгого применения ГХЦГ популяция этих вредителей на обрабатываемых участках возрастала вследствие уменьшения численности естественных врагов.
Фитотоксичность. Препараты на основе ГХЦГ в рекомендуемых дозах не вызывают ожогов растения или угнетения их роста. По окончании обработки наблюдаются изменения в метаболизме растений: временное (7-10 дней) усиление гидролитических процессов, рост содержания аминокислот и простых сахаров без существенного подавления процессов синтеза. Позже рост растений приходит в норму или даже стимулируется. После обработки семян наблюдается четкая стимуляция растений, но увеличение нормы расхода ГХЦГ вызывает деформацию и искривление проростков, остановку роста первичных корешков и разрастание боковых корней.
Баковые смеси. Под действием щелочей гексахлорциклогексан разлагается с отщеплением хлористого водорода и образованием трихлорбензола (в основном 1,2,4-трихлорбензола), который нетоксичен для насекомых. Поэтому препараты не рекомендуется использовать совместно с пестицидами щелочной реакции или известью.
В настоящее время препараты на основе ГХЦГ запрещены к применению, ранее их использование было строго регламентировано. Посадка клубнеплодов пищевого назначения в почву обработанную препаратом разрешалась не ранее, чем через четыре года. В течение месяца после обработки был запрещен выпас скота на обработанных участках. Время ожидания на люцерне составляло 30 дней, на горохе и в садах 60 дней, на хлопчатнике, картофеле и сахарной свекле 75 дней.
Проведение работ на участках, обработанных инсектицидом, допускалось через 4 сут. Рыхление почвы, а также работа в жаркую погоду и на плохо проветриваемых посевах разрешалась только через 2 недели после обработки.
Токсическое действие
Остаточные количества в растениях и продукции растениеводства. Содержание ГХЦГ зависит от вида растения, применяемой дозы, типа почвы, пути поступления и метеорологических условий.
По окончании обработки надземных органов количество γ-изомера в растениях быстро понижается и спустя 20-40 дней уменьшается, в зависимости от дозы, в 10-30 раз (до 0-0,4 мг/кг). Еще быстрее и в больших количествах вещество поступает в растения через корни. При этом, вследствие длительной сохранности препарата в почве, его поступление в растения происходит дольше. На супесчаных и легких песчаных почвах поступление γ-изомера ГХЦГ в растения значительно выше, чем на тяжелых и торфяных. Этот процесс также усиливается при увеличении влажности почвы. При попадании на плоды и овощи, особенно внутрь, ГХЦГ придает им неприятный вкус и запах. Это происходит даже при очень малом содержании в них технического ГХЦГ (0,1 мг/кг). При внесении препаратов в почву особенно сильный привкус приобретают ягоды, клубни картофеля и корнеплоды.
Действие на энтомофагов. γ-изомер гексахлорциклогексана – очень сильный инсектицид, поэтому при обработке им лесных и сельскохозяйственных угодий отмечается значительная гибель полезных насекомых. К нему довольно чувствительны жужелицы, трихограммы и хищные клещи. Очень токсичен он для пчел и шмелей, а также для рыб и организмов, которые являются для них пищей. Помимо этого, он значительно изменяет органолептические свойства воды.
Влияние на теплокровных. Гексахлорциклогексан – яд политропного действия, он поражает, в первую очередь, центральную и вегетативную нервную систему теплокровных животных и человека. Сильно страдают почки и печень. Наиболее токсичен ГХЦГ (ЛД50 для крыс 125 мг/кг живой массы), в то время, как технический ГХЦГ, представляющий смесь изомеров, среднетоксичен (ЛД50 для крыс 600 мг/кг).
Все изомеры гексахлорциклогексана обладают выраженными кумулятивными свойствами. При поступлении их в организм животного наблюдается материальная и функциональная кумуляция, что служит причиной хронических отравлений.
Следует отметить, что α- и β-изомеры обладают большей хронической токсичностью, чем γ-изомер.
ЛД50 для различных лабораторных животных составляет 25-200 мг/кг. Действующее вещество характеризуется кожно-резорбтивным, а также раздражающим действием. Кумулятивные свойства слабые.
Таблица Токсикологические данные составлена в соответствии с ГН 1.2.3111-13.
История
ГХЦГ был синтезирован Фарадеем еще в 1825 году, но его промышленное производство было начато в Японии только в 1949 году после установления инсектицидной активности одного из его изомеров – линдана (γ-ГХЦГ).
Получение
Гексахлорциклогексан получают хлорированием бензола (промышленный способ), а также хлорированием циклогексана и циклогексена (изображение).
В промышленности наибольшее распространение получило фотохимическое хлорирование бензола. Хлорирование ведут в избытке бензола или в растворе других органических растворителей, чаще всего хлористого метилена. Хорошие результаты дает хлорирование в алифатических нитрилах.
При хлорировании бензола получается смесь следующего состава (в %):
- α-изомер 53-70
- β-изомер 3-14
- γ-изомер 11-18
- δ-изомер 6-10
- другие изомеры 3-5
- гептахлорциклогексан 3-4
- октахлорциклогексан 0,5-1
- маслянистые вещества (неустановленного состава) 0,5-3.
Оптимальными условиями получения гексахлорциклогексана с возможно большим содержанием γ-изомера являются следующие:
- Низкая температура хлорирования (-20 – -30°С). Процесс рекомендуется проводить в органических растворителях, так как бензол кристаллизуется при температуре ниже +6°С. При проведении хлорирования в избытке бензола рекомендуется поддерживать температуру не выше 24°С. Хлорирование при более низкой температуре значительно уменьшает скорость реакции и, следовательно, снижает производительность аппаратуры. Зависимость выхода γ-изомера от температуры хлорирования приведена на гафике. Высокая концентрация хлора в реакционной среде.
- Низкая концентрация продуктов хлорирования в конечном реакционном растворе (12-15%).
Большое значение имеют чистота исходных продуктов: такие примеси, как кислород воздуха, соединения железа и некоторые другие вещества, отрицательно влияют на процесс. Примеси железа не только замедляют основной процесс, но и способствуют образованию побочных продуктов реакции – продуктов замещения водорода в молекуле бензола на хлор.
Принципиальная технологическая схема производства технического гексахлорциклогексана по описанному способу приведена на схеме.
Из технического продукта γ-гексахлорциклогексан может быть выделен экстракцией соответствующим растворителем.
(c) Справочник AgroXXI
Агрохимия, 2019, № 11, стр. 17-26
Ключевые слова: пестициды, водные организмы, токсичность, опасность, биоаккумуляция, индикатор агрегированного риска.
ВВЕДЕНИЕ
Одним из возможных негативных последствий применения пестицидов является загрязнение ими поверхностных вод и вредное воздействие на водные организмы (рыб, беспозвоночных, водоросли и высшие водные растения). В водоемы пестициды могут попадать за счет сноса потоками воздуха при обработке полей и садов, смыва с поверхности почвы с жидким и твердым стоком, миграции с дренажными водами. По сравнению с наземными и почвенными организмами, гидробионты более чувствительны к пестицидам в силу физиологических особенностей и из-за того, что вода является их постоянной средой обитания и менее буферна по отношению к загрязнителям, чем почва.
Еще одним ограничением, принятым в 2013 г. “Водным кодексом Российской Федерации” [3] и призванным уменьшить воздействие пестицидов на водные организмы, является запрещение применения всех пестицидов в водоохранных зонах водных объектов. На наш взгляд, оно является чрезмерным из-за недифференцированного подхода к способности разных пестицидов оказывать негативное воздействие на гидробионты и ограничивает возможности защиты растений с использованием пестицидов, обладающих низким риском для этих нецелевых видов организмов.
Очевидно, что для формирования списка приоритетных пестицидов, подлежащих первоочередному регулированию и ограничениям применения, необходим объективный и научно обоснованный подход сравнительной оценки негативного воздействия пестицидов на гидробионты. Он должен базироваться не только на показателях токсичности пестицидов для гидробионтов, характеризующих их опасность для данной группы организмов, но и учитывать концентрации пестицидов в воде и их способность к биоаккумуляции. Чтобы объединить разнородные данные в один удобный показатель – индикатор риска, применяют разнообразные методы их агрегирования. В последние годы интерес к агрегированным показателям, как относительно простым и доступным инструментам планирования риска и принятия решений, значительно вырос как со стороны органов, регулирующих регистрацию и применение пестицидов, так и со стороны их потребителей. Неудивительно, что уже предложены десятки таких индикаторов, предприняты попытки их систематизации и выбора наиболее приемлемых (например, проект Европейского Союза “CAPER” [4]). Первые попытки разработки экологических индикаторов пестицидов связаны с оценкой их вреда для окружающей среды в целом, включая различные нецелевые виды организмов [5–7]. Но они оказались не совсем удачными, прежде всего из-за того, что ни один вид организмов не является одинаково чувствительным ко всем пестицидам. Большее развитие получили экологические индикаторы риска пестицидов для отдельных природных сред (воды, почвы, воздуха) и различных групп нецелевых организмов. В частности, стоит отметить проект Организации экономического сотрудничества и развития (ОЭСР), в рамках которого специально для гидробионтов разработаны 3 индикатора риска пестицидов: REXTOX, ADSCOR и SYSCOR [8], применимые в масштабах государства, региона и фермерского хозяйства для отдельных культур, пестицидов и их комбинаций. Общими недостатками этих 3-х индикаторов являются их сложность и использование скоринга (программы, которая в реальном времени оценивает все возможные риски, используя имеющиеся данные об объекте) для оценки уровня воздействия вместо более реалистичных моделей прогноза концентраций пестицидов в воде.
Цель работы – предложить простой и понятный метод ранжирования пестицидов по их рискам для водных организмов с использованием: 1 – имеющихся данных по токсичности пестицидов для гидробионтов и их биоаккумуляции, 2 – спрогнозированных концентраций пестицидов в поверхностных водах, 3 – обобщения данных для расчета агрегированного индикатора риска. Предполагается, что рассчитанные рейтинги риска пестицидов для гидробионтов могут быть использованы для научно обоснованных управленческих решений по регулированию обращения пестицидов и при выборе приоритетных пестицидов для национального мониторинга в поверхностных водоемах.
МЕТОДИКА ИССЛЕДОВАНИЯ
Методология оценки опасности и риска пестицидов для водных организмов. Поэтапная схема процедур оценки опасности, рисков и определения рейтингов агрегированного риска пестицидов для гидробионтов приведена на рис. 1. Под опасностью пестицида для гидробионтов понимали его способность оказывать негативное воздействие на эти нецелевые организмы. Одним из основных видов опасностей пестицида является его токсичность для водных организмов. Риск пестицида – это возможность реализации его опасности (прежде всего токсичности) в конкретных условиях окружающей среды и регламента применения пестицида. Количественно риски пестицида для гидробионтов характеризовали отношением показателей токсичности пестицида к его прогнозируемой концентрации в воде. Для обобщения нормализованных показателей риска острой и хронической токсичности, коэффициентов биоаккумуляции пестицидов использовали один из самых простых и общепринятых методов агрегирования данных – сложение баллов, который позволил составить рейтинги агрегированного риска пестицидов для водных организмов.
Рис. 1.
Схема поэтапной оценки опасности и риска пестицидов для гидробионтов.
Классификации опасности пестицидов для гидробионтов. Для классификации и описания характеристик опасности пестицидов для водных организмов использовали 2 государственных стандарта [16, 17]. Оба ГОСТа подготовлены на основе международного документа – “Согласованной на глобальном уровне системе классификации опасности и маркировки химической продукции (СГС)” [18]. В обобщенном и адаптированном для пестицидов виде классификации острой и хронической токсичности пестицидов для гидробионтов представлены в табл. 1 и 2.
Читайте также:
