Токсичность хрома
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Токсичность хрома VI неодинакова для разных видов животных и зависит также от конституции. Летальная доза колеблется в пределах от 0,5 до 30 г ( 1.143). При острых отравлениях хромом наблюдаются боли в желудке и кишечнике и коллапс со рвотой, повреждениями ночек, гематурией, анурией и уремией, которая и служит непосредственной причиной смерти в большинстве случаев отравления. Возможно также повреждение первной системы.
В питьевой воде для человека содержание Сг не должно превышать 0,5 мг/кг. Присутствие в питьевой воде 10 мг/кг бихромата калия вызывает через 15 дней явления дурноты у человека, доза 3,5 мг/кг за такой промежуток времени еще не сказывается на общем состоянии. Крысы переносят дозу 25 мг/кг в питьевой воде в течение года; содержание Сг 134 мг/кг вызывает через 2—3 месяца некротические изменения в печени и почках.
1.3.9.5.2. Токсичность хрома III
Соли хрома III значительно менее ядовиты, чем соли хрома VI. Летальная доза составляет 5—30 мг хромата или 500—3000 мг окиси хрома па 1 кг ЖИВОЙ массы у теплокровных. Питьевая вода с содержанием хрома 0,1 мг/кг для человека безвредна, дозу до 1 мк/кг оп переносит.
Летальная доза для мышей при внутривенном введении от 0,25 до 2,3 г/кг. Очень четко выражено различие в ядовитости трех- и шестива- лентпого Сг при сравнении действия на цыплят доз в 900 мг/кг в течепие 6 недель ( 1.144).
1.3.9.6. Потребность в хроме
В настоящее время известна только потребность в Сг для человека и крысы. У крысы описанные выше явления недостаточности наступают при содержании Сг в рационе менее 100 мкг/кг. Содержание выше 100 мкг/кг может вызвать нарушение усвоения глюкозы. Для млекопитающих и птицы жизненно необходимой дозой считают 300— 500 мкг/кг, но у обезьяп отмечепы явления недостаточности при 3 мг Сг в расчете на 1 кг корма (!).
Очевидно, решающее значение имеет форма хрома в корме. Соли хрома-П, а также кислый Cr-II-ацетат оказались неэффективными нри лечении недостаточности у обезьяп, в то время как нейтральным Сг-Ш- ацетатпым комплексом удалось устранить симптомы заболевания. У мышей, крыс, а также человека применение Сг-Н-ацетата повышало толерантность к глюкозе.
Содержание хрома в кормах, за исключением картофеля и зерна, составляет более 200 мкг/кг, хотя исследования недостаточно полны. Если потребность в Сг крыс экстраполировать на кур и свиней, то такой уровень содержания элемента в кормах этих животных недостаточен.
Суточная потребность в хроме у человека колеблется от 5 до 200 мкг. Среднее потребление Сг по разным районам составляет 18, 52, 56, 78, 120 и 140 мкг Сг в сутки. Различия в количестве потребляемого Сг связаны главным образом с источником белка. Рыба очень бедна хромом, в то время как мясо млекопитающих и птицы содержит относительно много этого элемента.
Смотрите также:
Факторами окружающей среды, влияющими на токсичность
Канцерогенными веществами являются никель, кобальт, хром, мышьяк, бериллий, кадмий.
Элюенты от регенерации анионитов содержат до 40— 50 г/л 6-валентного хрома.
сточных вод, отличающихся высокой токсичностью, является ионный обмен.
Токсичность хрома обусловлена температурой воды, значением рН, временем контакта и валентностью.
Токсичность хрома

Хром широко используется во многих промышленных процессах, включая производство хромсодержащих пигментов, хромирование, производство нержавеющей стали и дубление кожи. Многочисленные исследования свидетельствуют о высокой распространенности рака легких среди работников, подвергшихся профессиональному воздействию Cr(VI) при вдыхании. Международное агентство по изучению рака (МАИР) классифицировало Cr(VI) как канцероген.
Хром является очень распространенным загрязнителем в питьевой воде. В прошлом имели место обширные выбросы в окружающую среду воды, содержащей хроматы В прошлом имели место обширные выбросы в окружающую воды, содержащей хроматы. Люди, имеющие колодцы, рядом с источниками таких утечек подвергаются отравлению хроматами.
Исследование, проведенное в Китае, сообщило о росте смертности от рака желудка в районе с повышенными концентрациями Cr(VI) в питьевой воде.
Если на Вашем предприятии осуществляются работы с хромсодержащими веществами Вам необходимо измерение оксидов хрома и других веществ.
Хром в окружающей среде
Хром является одним из наиболее распространенных элементов в земной коре со средней концентрацией 125 мг/кг. Хром имеет многочисленные степени окисления, варьирующиеся от Cr(0) (элементарный хром) до Cr(VI) (шестивалентный хром). Наиболее распространенной, а также стабильной формой хрома является трехвалентная, Cr(III). Хром(III) встречается естественным образом в хромитовой руде и обычно используется для производства металла хрома и моно- или ди-хроматов.
Следующей наиболее стабильной формой является шестивалентный хром. Эта форма встречается редко в природе и в основном производится в результате промышленной деятельности. Cr(VI) и Cr(III) отличаются не только степенями окисления, но и химическими свойствами и токсичностью. В то время как Cr(III) служит пищевой добавкой и может играть роль в метаболизме глюкозы и липидов, Cr(VI) очень токсичен, вызывая широкий спектр повреждений в клетках, например: повреждение ДНК, хромосомные аберрации, изменения в эпигеноме.
Еще одним отличием Cr(VI) от Cr(III) является их способность проникать в клетки, что является основой почти тысячекратной разницы в их токсичности. Cr(VI) структурно сходен с сульфатными и фосфатными анионами, поэтому клетки легко захватывают его с помощью неспецифических переносчиков анионов. Попадая внутрь клетки, Cr(VI) в конечном итоге преобразуется в Cr(III). Напротив, соединения Cr(III) не могут попасть в клетки ни по какому механизму переноса.
Вред и токсичность хрома
Основными факторами, определяющими токсичность соединений хрома, являются степень окисления и растворимость. Соединения Cr (VI), которые являются мощными окислителями и, следовательно, имеют тенденцию вызывать раздражение и коррозию, оказываются системно гораздо более токсичными, чем соединения Cr (III), при аналогичных количествах и растворимости. Хотя механизмы биологического воздействия не определены, это изменение токсичности может быть связано с легкостью, с которой Cr (VI) может проходить через клеточные мембраны, и его последующим внутриклеточным восстановлением. Последствия попадания хрома в организм включают следующее:
Отравление хромом – вред и токсичность хрома
Хром является относительно лёгким по своему атомному весу элементом, и непосредственно примыкает к железомарганцевой группе. До него в ряду элементов идёт ванадий, а после него – марганец. Такое соседство и обеспечивает чисто металлические свойства этого элемента, и наиболее популярными являются его коррозионная устойчивость, твердость и жаропрочность.

Металл хром и его соединения
Хром относят к чёрным, и неблагородным металлам, но само его название в переводе с греческого обозначает «цвет», и практически повторяет наименование популярного интернет – браузера Google Chrome. Вот диаграмма Пурбе, на которой – некоторые цвета соединений этого металла, а рядом – элементный, простой металл.
В чистом, элементном виде, хром является одним из самых прочных металлических элементов. Хром и его соединения в своих химических реакциях проявляют множество положительных валентностей, или способности присоединять определенное количество электронов: от 2 и до 6. Растворимые соединения практически все имеют красивую окраску: голубую, лиловую, жёлтую и оранжевую. На рисунке ниже слева один из сильнейших ядов: дихромат калия, он же хромпик. Его применяют для определения чистоты (пробы) серебряных изделий, и его можно купить по цене 170 рублей за целый килограмм. При этом его средняя смертельная доза всего около 5 г. Справа – относительно малотоксичный оксид элемента (III), используемый в пасте ГОИ.
Паста ГОИ для полировки
Соединения, причем растворимые, и обуславливают самый сильный вред хрома для человека, но в некоторых случаях их сам металлический хром может вызывать развитие неблагоприятной симптоматики.
Применение хрома
Самая главная область применения элемента – это плавление различных легированных сталей. В современном автомобилестроении, авиационной промышленности, в сталелитейных производствах оборонного комплекса и аэрокосмической отрасли этот элемент и стали на его основе как легирующей добавки прочно вошли в употребление.
Кроме этого, стали на основе хрома значительно повышают твердость готовой продукции, стали и сплавы становятся более устойчивыми к окислению, которое проходит при значительно более высоких температурах, а также механически более инертны и стойки к действию трения. Нашел свое применение хром и для изготовления особо жаропрочных деталей, таких, как лопатки газовых турбин в виде соединения этого металла с бором.

Слова «хром» и «трение» очень связаны, и на его основе получают различные шлифовальные пасты, а также твердые вещества для шлифовки и полировки различных астрономических стёкол, изделий из металла. Всем, кто служил в армии, хорошо известна паста ГОИ на основе зеленой окиси этого металла (ГОИ – государственный оптический институт), которой полировали с бляхи солдатских ремней.
Соединения широко применяются для производства различных красок и пигментов (это хроматы аммония и щелочных металлов). Такие токсичные соединения, как бихромат натрия и калия широко применяются в качестве дубильных веществ в кожевенной промышленности. Соединениями этого металла протравливают семена, их применяют в качестве реактивов в аналитической химии, фотографическом деле.
Среди обилия соединений рома существуют и токсичные, и их весьма много. Из вышеописанного уже ясно, что польза и вред хрома для человека велики, и если о пользе мы уже поговорили, теперь осталось объяснить, каков вред хрома для человека, и как сделать его меньше?
Токсичность соединений хрома
Конечно, чем выше растворимость соединений, тем более и высока токсичность хрома. Наиболее ядовитыми являются дихроматы, или соединение различных элементов с дихромовой (двухромовой) кислотой.
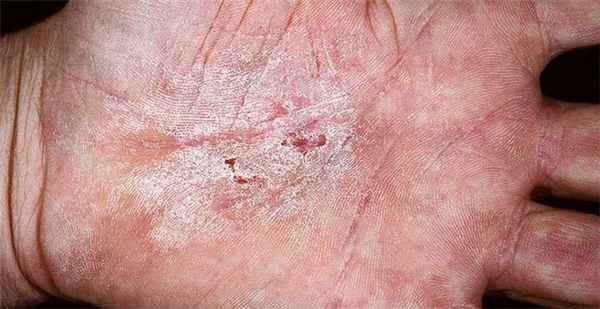
Они начинают вредить человеку ещё снаружи. При нанесении их растворов на кожу они раздражают, прижигают ее, вызывают денатурацию белков кожи и слизистых оболочек. Длительный контакт с кожей приводит к образованию язв, например, при длительном контакте с некоторыми видами бетона.

В некоторых марках бетона содержится вредный дихромат
При попадании этих соединений внутрь и всасывании их в кровь возникает гемолиз, или массивный распад эритроцитов в просвете сосудов, в результате этого гемолиза образуется соединение гемоглобина, неспособное к переносу кислорода, или метгемоглобин.
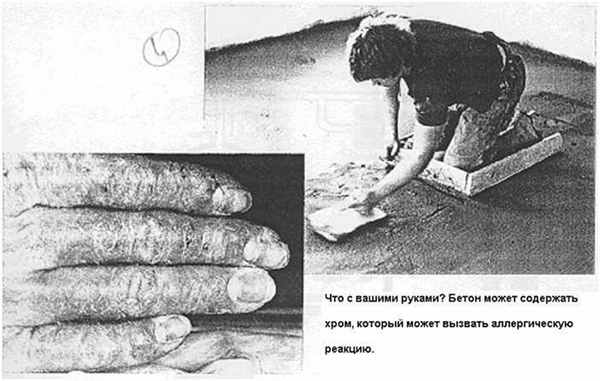
Внутреннее употребление соединений (например, в качестве суицида, или детьми, поскольку все соединения хрома имеют яркий цвет, и спутать их с солью и сахаром невозможно даже дальтоникам) приводит к различным ожогам желудочно-кишечного тракта, возникает острый понос и кровавая рвота.

Так выглядит дихромат калия
Длительное воздействие соединений приводит к накоплению этого элемента в основном в почках, тканях печени и в железах внутренней секреции. Поскольку хром и его соединения в подавляющем количестве выводятся почками, то их поражение может быть достаточно серьезным и привести к хронической почечной недостаточности.
Вред хрома для организма при длительном местном и аэрогенном (вдыхании) контакте заключается в возникновении раковых опухолей, и речь идёт о элементе, который является шестивалентным. Рабочие, контактировавшие на производстве с пигментами этого соединения, часто попадали в поле зрения хирургов в связи с различными злокачественными опухолями носа еще на рубеже XIX – XX века. Рак легких тоже значительно чаще возникает в зоне незащищенных производств соединений хрома, а также при вдыхании его пыли.

Процесс хромирования в домашних условиях – очень опасная и вредная процедура
Природный хром, круговорот которого в природе обуславливает проникновение в человеческий организм, находится или в виде электронейтрального, элементного металла, или в виде трехвалентного хрома. Он попадает в естественную среду вследствие процесса переработки руды. Что касается наиболее вредного хрома, то он имеет валентность 6 +, используется для производства растворимых солей, о которых было сказано выше.
В организм человека этот элемент в низких концентрациях также может поступать с пищей и водой, выделяться из протезов, как зубных, так и суставных, и входить в состав ядовитых соединений табачного дыма. На внутренние органы влияет, в основном, шестивалентный хром. Трехвалентное соединение на внутренние органы не влияет, поскольку он плохо всасывается в организм. Шестивалентные же соединения являются всегда сильными окислителями, вред от 6 валентного хрома несопоставим про силе токсического воздействия с другими соединениями этого металла. Они разъедают и раздражают ткани, и в этом смысле похожи на родственное соединение марганца – перманганат калия, или всем известная «марганцовка».
Сравнительно часто применяется популярная пищевая добавка, а именно пиколинат хрома. Вред пиколината хрома не доказан, также как не существует данных рандомизированных исследований. Пиколинат – это органическое соединение 3-валентного хрома, которое обладает низкой активностью в организме человека, в отличие от 6 валентных соединений. Поэтому польза и вред пиколината хрома до сих пор не определены. Как особой пользы, так и сильного вреда от его приема не выявлено.
Также следует сказать о 5 – и четырехвалентном металле, которые исключительно редко проникают в организм человека самостоятельно. Чаще всего они являются результатом многоступенчатых реакций, когда в организме восстанавливается шестивалентный токсичный хром. Поэтому вред шестивалентного хрома заключается в каскадности его реакций: как окислитель, он постепенно восстанавливается в организме, приводя к появлению промежуточных соединений, валентностью выше 3, но меньше 6.
Вредные факторы производства – главная причина отравлений
Конечно, острое отравление растворимыми солями, принятыми внутрь, в настоящее время случается очень редко, в качестве случаях клинической казуистики. Наибольшее число случаев отравления хромом и его соединениями происходит по причине его нахождение в воздухе плавильных цехов и на производстве подготовки руды. Речь идёт о загрязнении рабочей зоны колосниковых площадок, на пульте управления термическими печами, в зоне дробления породы, на узле дозировки и в других местах производства стали и сплавов.

К наличию превышения предельных допустимых концентраций этого металла и соединений, а также пыли,приводят различные нарушения герметизации технологических зон, разливка расплавленного металла, конечный этап – а именно загрузка хромовых сплавов в вагоны и их транспортировка.
Кроме пыли, профессиональные болезни на производстве вызваны не только отравлением хромом – обычно в пыли содержатся кремний, высока концентрация оксида марганца. Особо опасным фактором является аэрозоль соединений шестивалентного металла, который постоянно выделяется с расплавленной поверхности свежеотлитого металла и высокотемпературных шлаков.
Безусловно, к появлению профессиональных интоксикаций хромом и марганцем можно отнести и трудовую деятельность на дробильно-обогатительных фабриках, а также различные открытые способ добычи руды, содержащих этот металл.
Симптомы острого и хронического отравления
Как и при любой другой интоксикации, симптомы отравления хромом будут зависеть от пути попадания внутрь или на кожу, от времени контакта, и от валентности. Чем она выше у атома в соединении, тем признаки отравления хромом тяжелее. Существует острая и хроническая интоксикация.
При остром отравлении в организм чаще всего попадают большие дозы шестивалентного хрома. Если средство принято внутрь (например, раствор дихромата калия), то одним из характерных симптомов является сильнейшие боли в эпигастрии и в животе, симптомы желудочно-кишечного кровотечения, которое в тяжелых случаях осложняется перфорацией кишечника.
Через некоторое время в поджелудочной железе и печени развиваются участки омертвения, у пациента развивается гемолиз крови и синдром диссеминированного внутрисосудистого свертывания (ДВС).
Возникает олигурия, а затем анурия, появляется острая токсическая почечная недостаточность, вследствие некроза паренхимы почек.
Такие случаи тяжелейших отравлений требуют неотложных реанимационных мероприятий и часто, несмотря на все усилия врачей, приводят к смерти.
Если соединения воздействуют на кожу, то они приводят к тяжелым токсическим дерматитам с образованием язв, но вследствие высокой окислительной способности соединения через кожу не всасываются, если нанесены на небольшой площади, поскольку контактируют с белками и коагулируют их, обладая подсушивающим и вяжущим, дубящим действием. Это спасает подкожную клетчатку и внутренние органы от трансдермального пути передачи. Однако, в том случае, если 10% всей поверхности кожи поражено (чуть больше площади одной ладони, или более 9%), то могут развиться и общие признаки интоксикации.
При длительном контакте соединений с кожей развивается аллергия на хром. Дерматит протекает в виде длительно текущего контактного и аллергического поражения кожи, с экссудацией, корками, мокнутием и образованием хронических, незаживающих язв. В клинике известны так называемые «хромовые ожоги», так называют язвы, которые рубцуются и после которых возникают шрамы, они появляются при контактном дерматите у рабочих в красильной промышленности. Аллергия на хром и кобальт может возникать в ортодонтии, при ношении зубных коронок без предварительной аллергической пробы.
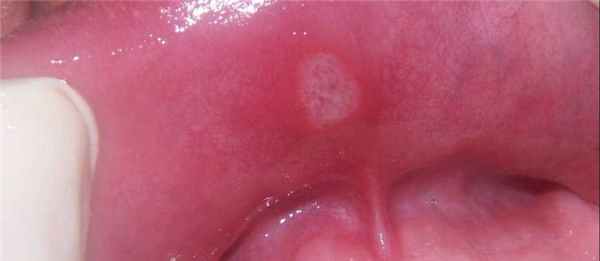
Симптомы аллергии проявляются в виде возникновения стоматитов, иногда с изъязвлением. При подтверждении диагноза протезы обязательно следует снимать.
Соединения шестивалентного хрома могут вызывать тяжелую интоксикацию при вдыхании. Он раздражает носоглотку и бронхи, в перегородке носа появляются язвы и перфорация. Уже через несколько часов возникает кашель и одышка, а при длительном контакте шестивалентный хром вызывает рак легких, по некоторым данным – уже через два года после работы с нарушением правил техники безопасности.
Основные принципы неотложной терапии
Оказание первичной помощи при отравлении хромом зависит от пути попадания токсичных соединений в организме человека. Так, при вдыхании пыли металла и поражении слизистой носовой полости, необходимо защитное промывание носа мыльной водой, смазывание ноздрей метилурациловой и вазелиновой мазью. При развитии приступов удушья необходимо инъекционное применение эуфиллина, атропина или платифиллина. Специфический антидот при отравлении парами хрома отсутствует, но некоторые справочники советуют применять ингаляции облепихового масла.
Чаще всего в быту возникает попадание соли хрома на кожу. В данном случае, необходимо длительное промывание теплой водой, не менее 15 минут, а затем следует наложить повязку с мазью, которая будет препятствовать прижигающему действию. Это может быть Пантенол или Бепантен, метилурациловая мазь. Также эффективна мазь тиосульфата натрия, ланолина и аскорбиновой кислоты. При попадании раствора в глаза также обязательно длительное промывание водой, не менее 15 минут с последующим закапыванием в глаза раствор альбуцида, для предупреждения микробного вторичного процесса.
Очень важно выяснить, какой хром послужил причиной отравления при приеме внутрь. Если это зеленое соединение трехвалентного хрома, то можно не браться за удаление этих солей даже в случае попадания в желудочно-кишечный тракт, поскольку трехвалентный хром не токсичен, именно он и входят в состав пиколината. Но таким пациентам обязательно назначают сорбенты, активированный уголь, поскольку кроме хрома, в составе соединений может быть и другие вредные и токсичные вещества.
Если же отравление произошло бихроматом калия, то в качестве антидота внутривенно вводится унитиол, в дозировке по 10 мл 5% раствора, через каждые 8 часов, до стабилизации состояния. Средняя смертельная доза для человека растворимых соединений шестивалентного хрома – всего 5 граммов.
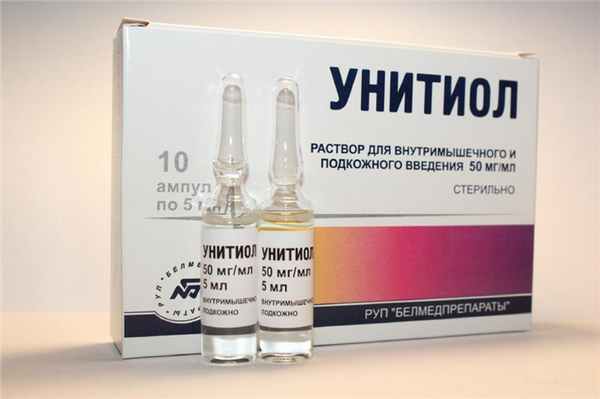
При употреблении шестивалентного хрома обязательно нужно вызвать рвоту и выполнить промывание желудка. Желудок промывают многократно до чистой воды, несмотря на рвоту, а затем проводится ФГДС на предмет наличия перфорации.
Коварство интоксикации в том, что этот металл не выводится из организма при назначении аппарата «искусственная почка», при гемосорбции и перитонеальном диализе. Поэтому лечение интоксикации хромом является сложным и длительным делом.
В некоторых случаях назначаются высокие дозы аскорбиновой кислоты, поскольку «в пробирке» она способна перевести шестивалентный хром в трехвалентный, но эффективность при острых отравлениях этого метода лечения не доказана.
О профилактике
Главным средством профилактики отравлений в быту является грамотное обращение с высокотоксичными препаратами, особенно растворимыми, и хранение их в местах, недоступных для детей.

На производстве – гальваническое хромирование
На производстве наилучший эффект дают технологические меры. Это герметизация аппаратуры, автоматизация на производстве, соблюдение норм принудительной вентиляции, отдельный цех для работы с соединениями хрома, обязательные условия для обезвреживания рабочих одежд после смен, ее стирка, сушки и обеспыливание. Там, где такие меры по технологическим соображениям применяться не могут, необходимо использовать респираторы, перчатки, изолирующие противогазы. Одним из главных способов медицинской профилактики является периодический медицинский осмотр согласно приказу номер 302Н, поскольку хром для человека приносит не только пользу, но и вред: он является аллергеном, канцерогеном, и элементом, соединения которого могут вызывать тяжелые отравления вплоть до летальных.
Найден новый способ снижения токсичности хрома в сточных водах
Специалисты ЮФУ совместно с коллегами из Токийского университета науки обнаружили новый фотокатализатор, которой может помочь в эффективном снижении вредного воздействия на живые организмы соединений хрома в загрязненных почвах и сточных водах.

Найден новый способ снижения токсичности хрома в сточных водах / ©Getty images
Несмотря на широкое использование хрома, этот элемент имеет плохую репутацию – долгосрочное воздействие его соединений приводит к высокому риску развития злокачественных новообразований и других вредных для здоровья человека процессов. К тому же, хром присутствует в промышленных отходах и потому является одним из основных источником загрязнения воды.
По словам исследователей, токсичность соединений хрома напрямую зависит от степени окисления металла. Из двух наиболее стабильных состояний, которые проявляет этот эелемент, – шестивалентный хром (Cr(VI)) и трехвалентный хром (Cr(III)), – первое является более токсичным и растворимым. Таким образом, загрязнение хромом может быть смягчено простым преобразованием хрома шестивалентного в менее растворимую форму Cr(III) с помощью реакции восстановления, которую можно легко извлечь в виде осадка. Однако большинство методов, которые позволяют это сделать, либо дорогостоящие и опасные, либо имеют высокие энергетические требования.
Так, ученые сосредоточились на поиске соединений (фотокатализаторов), которые при световом воздействии способны переводить соединения Cr(VI) в Cr(III), снижая при этом вредное воздействие на окружающую среду. Используя воду в качестве растворителя (в то время, как раньше отдавалось предпочтение органическим растворителям) специалисты Южного федерального университета совместно с иностранными коллегами нашли соединение, которое проявляет фотокаталитическую активность в реакции восстановления соединений Cr(VI) до Cr(III) и, следовательно, может использоваться при очистке сточных вод.
Команда исследователей, возглавляемая профессором Такаширо Акицу из Токийского университета науки (г. Токио, Япония), успешно провела исследование, опубликованное в New Journal of Chemistry. В состав команды также вошли Ёшито Миягава, Томоюки Харагучи (Токийский университет науки, Япония), Аршак Цатурян (Туринский университет, Италия, и Южный федеральный университет, Россия) и Игорь Щербаков (Южный федеральный университет, Россия).
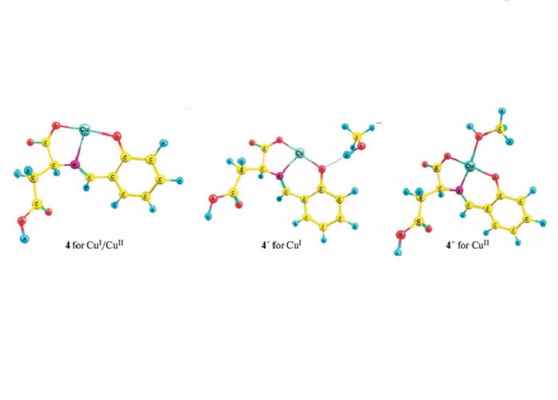
В своем исследовании команда синтезировала комплексы меди (Cu(II)) из целого ряда органических соединений. В ходе дальнейших анализов они подтвердили, что эти комплексы вместе с фотокатализатором, оксидом титана (TiO2), участвуют в фотохимической реакции, приводящей к восстановлению шестивалентного хрома Cr(VI) как в метаноле, так и в воде.
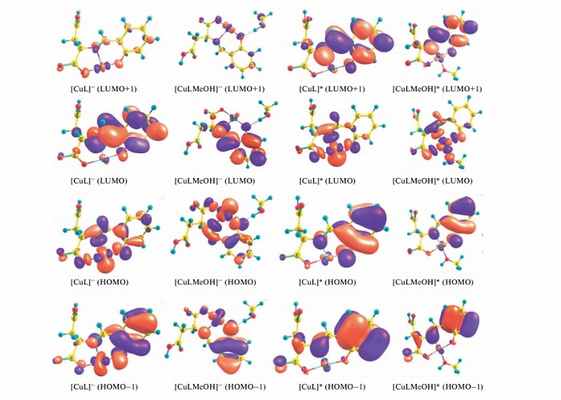
«Мы изучили зависимость фотокаталитической активности комплексов меди Cu(II) от длины волны облучения, кислотности среды в различных средах (метанол и вода). Экспериментальная работа была дополнена квантово-химическим моделированием пространственного строения и физических свойств фотокатализаторов. Полученные результаты доказали высокую эффективность координационных соединений меди(II) с основаниями Шиффа в снижении содержаний растворимых форм соединений хрома.
Эта активность проявляется при облучении в диапазоне 460-495 нм длин волн, что соответствует диапазону видимого спектра. В дополнении было показано, что фотокаталитическая активность диоксида титана при облучении ультрафиолетовым светом повышается при совместном использовании с комплексами меди.
Дальнейшие электрохимические эксперименты показали, что фотокатализаторы являются многоразовыми, а это указывает на их потенциальную применимость в улучшении экологической обстановки», – рассказал кандидат химических наук, старший научный сотрудник Лаборатории фотохимии Отдела строения реакционной способности органических соединений НИИ ФОХ ЮФУ Аршак Цатурян. Работа ученых открывает перспективы для разработки новой экономически эффективной и действенной процедуры очистки сточных вод.
Новый проект двух испанских компаний Aqualia и SEAT направлен на разработку биотоплива, получаемого из сточных вод.
Токсичность хрома

Специалисты ЮФУ Аршак Цатурян и Игорь Щербаков совместно с коллегами из Токийского университета науки Ешито Миягава, Томоюки Харагучи и Такаширо Акитцу обнаружили новый фотокатализатор, которой может помочь в эффективном снижении вредного воздействия на живые организмы соединений хрома в загрязненных почвах и сточных водах.
Несмотря на широкое использование хрома, этот элемент имеет плохую репутацию, – долгосрочное воздействие его соединений приводит к высокому риску развития злокачественных новообразований и других вредных для здоровья человека процессов. К тому же, хром присутствует в промышленных отходах и потому является одним из основных источником загрязнения воды.
По словам исследователей, токсичность соединений хрома напрямую зависит от степени окисления металла. Из двух наиболее стабильных состояний, которые проявляет хром, – шестивалентный хром (Cr(VI)) и трехвалентный хром (Cr(III)), – первое является более токсичным и растворимым. Таким образом, загрязнение хромом может быть смягчено простым преобразованием хрома шестивалентного в менее растворившую форму Cr ( III ) с помощью реакции восстановления, которую можно легко извлечь в виде осадка. Однако большинство методов, которые позволяют это сделать, либо дорогостоящи и опасны, либо имеют высокие энергетические требования.
Так, ученые сосредоточились на поиске соединений (фотокатализаторов), которые при световом воздействии способны переводить соединения Cr ( VI ) в Cr ( III ), снижая при этом вредное воздействие на окружающую среду. Используя воду в качестве растворителя, в то время как раньше отдавалось предпочтение органическим растворителям, специалисты Южного федерального университета совместно с иностранными коллегами нашли соединение, которое проявляет фотокаталитическую активность в реакции восстановления соединений Cr ( VI ) до Cr ( III ) и, следовательно, может использоваться при очистке сточных вод.
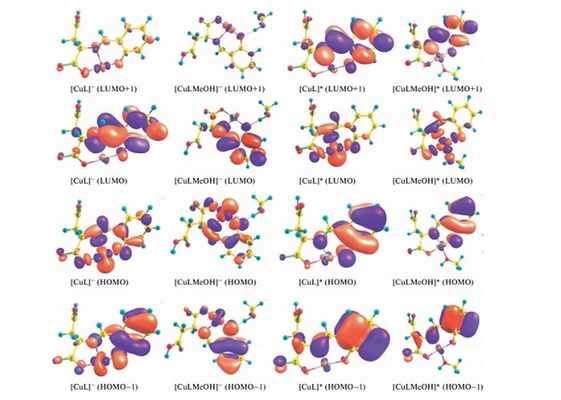
Форма граничных молекулярных орбиталей перспективных фотокатализаторов восстановления Cr(VI)
Команда исследователей, возглавляемая профессором Такаширо Акицу из Токийского университета науки (г. Токио, Япония), успешно провела исследование, опубликованное в New Journal of Chemistry . В состав команды также вошли Ёшито Миягава, Томоюки Харагучи (Токийский университет науки, Япония), Аршак Цатурян (Туринский университет, Италия, и Южный федеральный университет, Россия) и Игорь Щербаков (Южный федеральный университет, Россия).
В своем исследовании команда синтезировала комплексы меди (Cu(II)) из целого ряда органических соединений. В ходе дальнейших анализов они подтвердили, что эти комплексы вместе с фотокатализатором, оксидом титана (TiO2), участвуют в фотохимической реакции, приводящей к восстановлению шестивалентного хрома Cr(VI) как в метаноле, так и в воде.
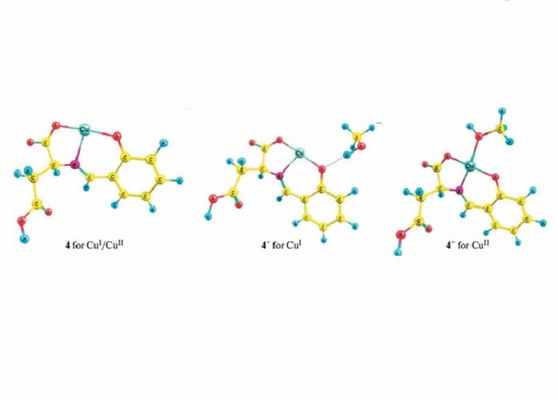
Строение комплексов меди, проявивших фотокаталитическую активность
«Мы изучили зависимость фотокаталитической активности комплексов меди Cu(II) от длины волны облучения, кислотности среды в различных средах (метанол и вода). Экспериментальная работа была дополнена квантово-химическим моделированием пространственного строения и физических свойств фотокатализаторов. Полученные результаты доказали высокую эффективность координационных соединений меди( II ) с основаниями Шиффа в снижении содержаний растворимых форм соединений хрома. Эта активность проявляется при облучении в диапазоне 460-495 нм длин волн, что соответствует диапазону видимого спектра. В дополнении было показано, что фотокаталитичекая активность диоксида титана при облучении ультрафиолетовым светом повышается при совместном использовании с комплексами меди. Дальнейшие электрохимические эксперименты показали, что фотокатализаторы являются многоразовыми, а это указывает на их потенциальную применимость в улучшении экологической обстановки» , – рассказал кандидат химических наук, старший научный сотрудник Лаборатории фотохимии Отдела строения реакционной способности органических соединений НИИ ФОХ ЮФУ Аршак Цатурян.
Работа ученых открывает перспективы для разработки новой экономически эффективной и действенной процедуры очистки сточных вод.
«Это продолжение плодотворного сотрудничества в области разработки фотокатализаторов между учеными из Южного федерального университета и Токийского университета науки. Благодаря проведенным исследованиям, отраженным в публикациях Russian Chemical Bulletin , Journal of Molecular Structures , Inorganica Chimica Acta , появилась возможность создать технологию, которая поможет обратить вспять негативное воздействие промышленных отходов на водные объекты», – заключил доктор химических наук, профессор, заведующий кафедрой физической и коллоидной химии имени профессора В.А. Когана Игорь Щербаков.
Читайте также:
