Трансъюгулярные внутрипеченочные портосистемные шунты. Особенности внутрипеченочных шунтов.
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Как образуется портосистемный шунт. Врождённые и приобретённые шунты
Кровообращение плода (рис.2) отличается от кровообращения взрослого животного. Артериальная кровь от плаценты к плоду идёт по пупочной вене. В воротах печени пупочная вена разделяется на две ветви: первая ветвь впадает в воротную вену, а вторая ветвь (венозный проток)— в одну из печеночных вен или в каудальную полую вену. Таким образом, артериальная кровь, которая оттекает по пупочной вене от плаценты, частично поступает непосредственно в нижнюю полую вену, а частично — в печень, являющуюся у плода органом кроветворения. То есть, существование у эмбриона сосудов, по которым кровь из воротной вены сбрасывается в каудальную полую или непарную вену, является нормой.
Считается, что дополнительные сосуды, шунтирующие у плода воротную кровь в обход печени, могут располагаться и вне печени.
В норме в первые дни после рождения животного сосуды, шунтирующие печень, должны закрыться и воротная вена должна стать самостоятельным сосудом, не связанным с системными венами. Если эмбриональные сосуды, шунтирующие печень не закрылись, то с началом полноценной работы желудочно-кишечного тракта и повышением давления в воротной вене они становятся врождёнными портосистемными шунтами (рис. 3, 4).
У взрослого животного с патологией печени, вызывающей повышение давления в воротной вене, закрывшиеся и полностью запустевшие эмбриональные сосуды, могут постепенно восстановить свою функцию и стать приобретёнными (вторичными, по отношению к первичной печёночной патологии) шунтами. Приобретённые шунты часто могут быть множественными.
У кого встречается эта патология
Чаще всего врождённые шунты встречаются у собак декоративных пород. Реже – у остальных собак. В одном из масштабных ретроспективных исследований, проведённых в США, было показано, что около 3% йоркширских терьеров имеют врождённый портосистемный шунт.
У кошек врождённые шунты встречаются на порядок реже, чем у собак.
Приобретенные шунты встречаются (а может быть диагностируются) реже врождённых. Для развития вторичного шунта нужно, чтобы патология печени и вызываемая ею портальная гипертензия развивались постепенно на протяжении длительного времени.
Клинические проявления
В случае врожденного шунта клинические признаки обычно проявляются у животных в возрасте от 3–4 месяцев до 3 лет (к этому времени обычно диагноз уже ставят, но встречались случаи, когда наличие врожденного шунта предположили и подтвердили у пациентов в возрасте 8 лет). Животные отстают в росте, мало едят, не набирают вес, у них могут наблюдаться гиперсаливация и рвота, извращённый аппетит. Иногда выявляют полидипсию и полиурию, наличие камней (уратных) в почках и мочевом пузыре (около 20-30% случаев). Возможно развитие печёночной энцефалопатии, проявляющейся расстройствами центральной нервной системы: заторможенностью, манежными движениями, сменами настроения. Симптомы могут проявляться периодически, например, после еды.
Проявление вторичных шунтов чаще маскируется за проявлениями первичной печеночной патологии.
Лабораторная диагностика
- Гипоальбуминемия и пониженное содержание в крови общего белка.
- Низкий уровень мочевины.
- Низкие уровни холестерина и глюкозы.
- Повышенная концентрация печёночных ферментов.
- Увеличение уровня аммиака в крови в периоды между приёмами корма.
- Резкое повышение в сыворотке желчных кислот (тест проводится до и после кормления).
- У 72% собак выявляют микроцитоз с сопутствующей анемией или без неё.
- Может наблюдаться лейкоцитоз.
- Снижается плотность мочи
- Могут быть признаки цистита.
- Наличие уратов в моче у молодого животного является показанием для проведения дальнейших исследований.
- Желчные кислоты. Считается, что при наличии шунта, уровень желчных кислот в моче повышается незначительно, в отличие от уровня желчных кислот в сыворотке.
Визуальная диагностика
Задача методов визуальной диагностики – подтвердить наличие шунта и описать его расположение.
Ультразвуковое исследование (УЗИ) позволяет оценить размеры и структуру печени. При наличии шунта печень, как правило, уменьшена, вены печени уменьшены или неразличимы. В желчном пузыре, почках и мочевом пузыре могут быть обнаружены конкременты (кристаллы урата аммония).
Успех визуализации шунта с помощью УЗИ во многом определяется уровнем подготовки и опытом специалиста, проводящего исследование. Внутрипеченочные шунты визуализируются проще, внепеченочные – сложнее. Допплерография позволяет обнаружить турбулентные потоки в полой и воротной венах, которые обычно возникают в области шунта.
Рентгенография
На обзорных рентгенограммах брюшной полости ищут последствия наличия шунта: уменьшение размеров тени печени, тени рентгеноконтрастных камней в почках и мочевом пузыре. Кристаллы урата аммония не рентгеноконтрастны, но нередко при портосистемных шунтах образуются камни более сложного состава, являющиеся рентгеноконтрастными (рис. 5, 6) .
Для визуализации воротной вены и шунта применяют селективную ангиографию воротной вены– портографию.
- введение рентгеноконтрастного вещества в брыжеечную вену;
- введение рентгеноконтрастного вещества в сосуды селезёнки;
- введение рентгеноконтрастного препарата в краниальную брыжеечную артерию.
КТ-ангиография (КТА) – метод получения изображения сосудов при помощи компьютерной томографии. Преимуществом КТА является возможность визуализировать сосуды брюшной полости, в том числе и воротную вену, не прибегая к селективному контрастированию. Контрастный препарат вводится в периферическую вену грудной конечности, откуда попадает в сердце, проходит малый круг кровообращения, возвращается в сердце и попадает в аорту. Из нисходящей аорты кровь с контрастным веществом попадает в сосуды селезёнки и кишечника, а оттуда - в воротную вену. Время начала сканирования подбирается таким образом, чтобы воротная вена была хорошо контрастирована.
Топология портосистемных шунтов
В печени воротная вена делится на правую и левую главные ветви, которые в свою очередь делятся на долевые ветви. Помимо анатомической нормы (рис. 7), нередко встречаются и анатомические варианты (какая-либо из ветвей может впадать не в тот сосуд, который описан в учебнике), не имеющие клинического значения.
Портосистемные шунты очень многообразны, но их можно поделить на несколько типов. Однако это не исключает необходимости тщательного описания каждого конкретного случая.
Внутрипечёночный шунт может быть незакрытым венозным протоком. Венозный проток у плода начинается от левой основной ветви воротной вены, напротив пупочной вены, проходит между левой латеральной долей печени и папиллярным отростком хвостатой доли и заканчивается на дорсальной стороне левой печеночной вены.
Внутрипечёночный шунт может быть анастомозом между долевой печёночной ветвью воротной вены и долевой печеночной веной. Тогда он может располагаться в любой доле печени (рис. 8).
Внепечёночный шунт может быть частично расположен в печени (как в доле, так и между долями), проходить по краниальному краю печени и впадать в диафрагмальную вену. Такой шунт анатомически является внепечёночным (рис.9).
Внепечёночный шунт может полностью располагаться за пределами печени, начинаясь от одного из притоков воротной вены (обычно от селезёночной вены или левой желудочной) и впадая в каудальную полую, диафрагмальную или непарную вену (рис. 10).
Приобретённый шунт чаще начинается от селезёночной вены и впадает в левую почечную вену или в левую яичниковую (семенниковую), которая в свою очередь впадает в левую почечную вену (рис. 11).
Шунт может быть множественным (несколько шунтов), может иметь дополнительные петли.
Сосудистое русло животного может отличаться от стандартного, описанного в учебниках. Это не патология, а вариант нормы. При наличии шунта крайне важно описать анатомические варианты хода основных сосудов (рис. 12).
КТ-ангиография позволяет не только обнаружить шунт, но и всесторонне описать его топологию: исследовать между какими сосудами происходит сброс крови, описать локализацию шунта, оценить его размеры, выявить наличие множественных шунтов, описать другие особенности сосудистого русла исследуемого пациента.
Трансъюгулярный внутрипеченочный портосистемный шунт - Transjugular intrahepatic portosystemic shunt
Выполняется рентгеноскопическое изображение TIPS. Катетер введен в печеночная вена а после пункции иглой проводник вводили в ветвь воротной вены. Путь был расширен баллоном и введен контраст. А саморасширяющийся металлический стент еще не был помещен на провод.
Трансъюгулярный внутрипеченочный портосистемный шунт (ЧАЕВЫЕ или же СОВЕТЫ) - искусственный канал в печень который устанавливает связь между притоком воротная вена и отток печеночная вена. Используется для лечения портальная гипертензия (что часто связано с цирроз печени ), что часто приводит к кишечному кровотечению, опасному для жизни пищеводному кровотечению (варикоз пищевода ) и скопление жидкости в брюшной полости (асцит ).
An интервенционный радиолог создает шунт, используя управляемый изображением эндоваскулярный (через кровеносный сосуд ) подход, с яремная вена как обычный сайт входа.
Впервые процедура была описана Йозеф Рёш в 1969 г. Орегонский университет здоровья и науки. Впервые он был использован у пациента доктором Рональдом Колапинто из Университет Торонто, в 1982 году, но не добился воспроизводимого успеха до разработки эндоваскулярных стентов в 1985 году. В 1988 году первые успешные TIPS были реализованы M. Rössle, G.M. Рихтер, Г. Нёльдге и Й. Пальмаз на Фрайбургский университет. [1] С тех пор эта процедура получила широкое признание в качестве предпочтительного метода лечения портальной гипертензии, которая не поддается лечению, заменив в этой роли хирургический портокавальный шунт.
Содержание
Медицинское использование
TIPS - это процедура, которая спасает жизнь при кровотечении из варикозного расширения вен пищевода или желудка. Рандомизированное исследование показало, что выживаемость лучше, если процедура проводится в течение 72 часов после кровотечение. [2] TIPS показали некоторые перспективы для людей с гепаторенальный синдром. [3] Это также может помочь с асцит. [4]
Осложнения
Менее распространенным, но более серьезным осложнением является ишемия печени, вызывающая острую печеночную недостаточность. В то время как здоровая печень преимущественно насыщается кислородом за счет портального кровоснабжения, длительная портальная гипертензия приводит к компенсаторной гипертрофии и повышенной зависимости от печеночной артерии для оксигенации. Таким образом, у людей с запущенным заболеванием печени отвод портальной крови от гепатоцитов обычно хорошо переносится. Однако в некоторых случаях внезапное шунтирование портального кровотока от печени может привести к острой печеночной недостаточности, вторичной по отношению к ишемии печени. [6] Острая печеночная дисфункция после TIPS может потребовать экстренного закрытия шунта.
Редкое, но серьезное осложнение - стойкая инфекция TIPS, также известная как эндотипсит. [7]
Наконец, TIPS могут быть заблокированы сгустком крови или разрастанием эндотелиальных клеток и больше не функционируют. Это было значительно уменьшено за счет использования политетрафторэтилен (PTFE) - стенты с покрытием. [8]
Механизм действия
Портальная гипертензия, важное последствие заболевания печени, приводит к развитию значительного коллатеральное кровообращение между портальной системой и системным венозным дренажом (порто-кавальное кровообращение). Застой в воротной вене приводит к тому, что венозная кровь, покидающая желудок и кишечник, отводится вспомогательными путями с меньшим сопротивлением, чтобы стекать в системный кровоток. Со временем мелкие сосуды, составляющие коллатеральный путь для порто-кавального кровообращения, наполняются кровью и расширяются. Эти сосуды хрупкие и часто кровоизлияния в желудочно-кишечный тракт. (Видеть пищеводный, желудочный, ректальный варикоз ).
Процедура TIPS снижает эффективную сосудистое сопротивление печени путем создания альтернативного пути циркуляции воротной вены. Создавая шунт из воротной вены в печеночную вену, это вмешательство позволяет портальной крови стать альтернативным каналом для дренажа в системный кровоток. В обход устойчивой к потоку печени конечным результатом является снижение падение давления через печень и пониженное давление в воротной вене. Снижение давления в воротной вене, в свою очередь, снижает застойное давление вдоль вен кишечника, что снижает вероятность кровотечения в будущем. Пониженное давление также приводит к уменьшению выработки жидкости, хотя это может занять недели или месяцы.
Имплантация
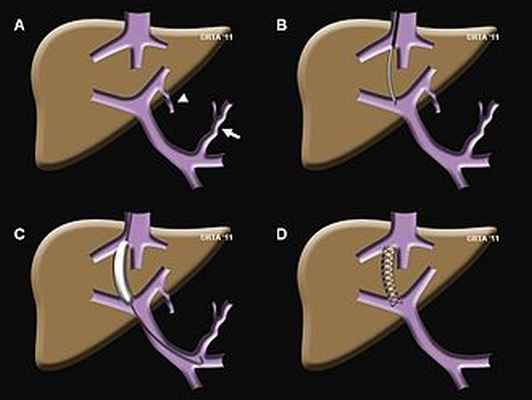
Этапы процедуры TIPS: A) портальная гипертензия вызвала коронарная вена (стрелка) и пупочная вена (стрелка), чтобы расшириться и течь в обратном направлении. Это приводит к варикозному расширению вен пищевода и желудка, которое может кровоточить; Б) игла введена (через яремную вену) и проходит из печеночной вены в воротную вену; в) тракт расширен баллоном; D) после установки стента портальное давление нормализуется, и коронарные и пупочные вены больше не заполняются.
Трансъюгулярные внутрипеченочные портосистемные шунты обычно устанавливаются интервенционным радиологом под рентгеноскопический руководство. [9] Доступ к печени обеспечивается, как следует из названия «трансъюгулярная», через внутренняя яремная вена в шея. После подтверждения доступа к яремной вене обычно помещают проводник и интродьюсер, чтобы облегчить шунт размещение. Это позволяет интервенционному радиологу получить доступ к пациенту. печеночная вена перемещаясь из верхней полой вены в нижнюю полую вену и, наконец, в печеночную вену. Как только катетер находится в печеночной вене, получается давление клина для расчета градиента давления в печени. После этого вводится углекислый газ, чтобы определить местонахождение воротной вены. Затем специальная игла, известная как Colapinto, продвигается через паренхиму печени, чтобы соединить печеночную вену с большой веной. воротная вена, около центра печени. Затем создается канал для шунта путем надувания баллона для ангиопластики в печени вдоль пути, созданного иглой. Шунт завершается помещением специальной сетчатой трубки, известной как стент или эндотрансплантат для поддержания пути между воротной веной с более высоким давлением и печеночной веной с более низким давлением. После процедуры делают рентгеноскопические изображения, чтобы показать расположение. Часто измеряется давление в воротной вене и нижней полой вене.
Трансъюгулярное внутрипеченочное портосистемное шунтирование (TIPS)
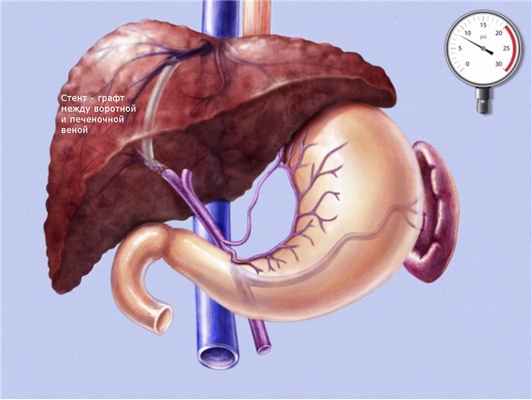
Трансюгулярное внутрипеченочное портосистемное стентирование (TIPS) представляет собой эндоваскулярную операцию по созданию искусственного канала в печени, который обеспечивает отток крови из воротной вены в нижнюю полую вену, минуя пораженную печеночную ткань.
Операция эффективно останавливает кровотечения из варикозных вен пищевода и уменьшает асцит, за счет снижения давления в воротной вене, которое всегда повышено при циррозе печени.
Операция проводится в рентгеноперационной под контролем ангиографии. Во время вмшетельства используются контрастные вещества и ультразвуковое сканирование печени. Средняя продолжительность вмешательства около 2 часов.
Подготовка и обследование для TIPS
Для определения вида портальной гипертензии необходимо выполнить визуализацию структуры печени, проходимость вен воротной системы и определить степень портальной гипертензии и ее риски.
Необходимые методы диагностики:
- УЗИ внутренних органов живота (печени, селезенки, поджелудочной железы) - дают возможность оценить степень поражения печени, выявить опухоли печени и поджелудочной железы, увеличение селезенки.
- УЗИ воротной вены позволяет получить общую информацию о размере и проходимости воротной вены.
- МРТ внутренних органов и вен брюшной полости - в сосудистом режиме позволяет оценить проходимость воротной вены
- Компьютерная томография с ангиографией аорты и венозной фазы - позволяет получить общую оценку воротной системы и варикозных вен в брюшной полости
- Прямая портография (чрезпеченочное введение катетера и контрастирование воротной системы) - заключительный метод диагностики перед вмешательством.
Анестезиологическая поддержка
- За неделю до операции мы переводим пациентов на диету с ограничением белковых продуктов. Это делается для того, чтобы избежать развития энцефалопатии в раннем послеоперационном периоде.
- Накануне вмешательства даются слабительные препараты и ставится очистительная клизма, дается легкий ужин.
- Операция проводится под местной анестезией мест проколов. Анестезиолог присутствует в операционной, для контроля за жизненно-важными функциями организма.
- Пациенту устанавливается мочевой катетер и монитор для измерения артериального давления и снятия ЭКГ.
Как проходит операция
Трансюгулярное внутрипеченочное портосистемное шунтирование проводится под рентгеноскопическим контролем с использованием ультразвукового сканирования для контроля доступов к сосудам.
Доступ к печеночной вене осуществляется через внутреннюю яремную вену на шее. Для облегчения доступа используется ультразвуковой контроль. После пункции устанавливается проводник и интродьюсер. Проводник с катетером проводятся в нижнюю полую и печеночную вену. После установки катетера в печеночной вене измеряется давление прямым методом, чтобы рассчитать в последующем градиент.
Для поиска ветви воротной вены может использоваться УЗИ навигация, либо проводится пункция печени под УЗИ контролем и проводится контрастное исследование портальной системы с использованием функции roadmap.
После определения целевой воротной вены через катетер в печеночной вене проводится пункция специальной иглой. Проведя последнюю в воротную вену через нее устанавливают проводник и проводят катетер. Проводится контрастирование воротной системы через яремный катетер и замеряется давление в воротной системе.
Через паренхиму печени по проводнику проводится баллон, который затем раздувается создавая канал в печеночной ткани. После извлечения баллона по проводнику проводится специальный стент-графт, представляющий собой трубчатую металлическую сетку покрытую внутри специальным герметичным пластиком.
Таким образом, мы соединяем прямым шунтом воротную и печеночную вену, что способствует снижению давления в воротной системе и предупреждает рецидивы кровотечения.
После измерения давления в воротной системе все инструменты удаляются, а пациент помещается в палату наблюдения.
Возможные осложнения
В руках опытного хирурга частота опасных осложнений составляет менее 1%. Очень редко может развиться внутрибрюшное кровотечение или абсцесс печени.
Чаще встречаются осложнения, связанные с успехом процедуры. Прямой поток крови из кишечника может привести к увеличению поступления в системный кровоток азотистых шлаков и развитие энцефалопатии. Проявления энцефалопатии (тремор, бессоница, спутанность сознания) наблюдаются у 25% прооперированных пациентов, однако у большинства пациентов эти симптомы проходят в течение недели после операции. Для предупреждения энцефалопатии необходимо уменьшить потребление белковой пищи.
Недостаточность кровоснабжения печени - ишемический гепатит является более редким осложнением, так как при портальной гипертензии основное кровообращение печень получает за счет печеночной артерии. Однако в некоторых случаях, создание шунта может вызвать ишемическое повреждение печени с острой печеночной недостаточностью, что может потребовать срочного закрытия шунта.
Редким, но серьезным осложнением является развитие инфекционного процесса в зоне вмешательства, то есть нагноения стент-графта. Для предупреждения подобного осложнения в послеоперационном периоде применяются сильные антибиотики.
Прогноз после TIPS
Важно понимать, что портокавальные анастомозы не лечат цирроз печени, но устраняют опасные для жизни осложнения. Пациенты с функционирующим шунтом имеют меньший риск умереть от желудочно-кишечного кровотечения, однако сохраняется риски связанные с печеночной недостаточности.
В целом TIPS позволяет избежать преждевременного неблагоприятного исхода связанного с кровотечениеми и часто применяется как предварительное вмешательство перед пересадкой печени.
Наблюдение после операции
Контроль за функцией шунта осуществляется как с помощью прямых методов визуализации, так и косвенных.
Из косвенных признаков важным является уменьшение диаметра вен в подслизистом слое перехода из пищевода в желудок. Это позволяет иметь уверенность, что рецидива кровотечения не будет. ЭГДС мы рекомендуем выполнять через неделю и через месяц после вмешательства, а затем раз в 6 месяцев.
При ультразвуковом сканировании отмечается кровоток по шунту и определяется его скорость. Оценивается диаметр воротной вены и размеры селезенки. Так же можно отметить уменьшение асцита. УЗИ рекомендуем выполнять каждые 3 месяца у нашего специалиста.
Через год после вмешательства мы рекомендуем выполнить МСКТ ангиографию брюшной полости с оценкой венозной фазы. При этом хорошо выявляется функционирующий стент.
Метод TIPS в Инновационном сосудистом центре
Сосудистые хирурги Инновационного сосудистого центра с 2004 года занимались проблемой лечения осложнений портальной гипертензии, выполняя открытые портокавальные вмешательства. С 2011 года в нашей клинике появилась возможность выполнять эндоваскулярные операции взамен более опасных открытых вмешательств.
Для операций TIPS мы берем пациентов с печеночной формой портальной гипертензии и осложненной тяжелым варикозным расширением вен пищевода, либо уже после состоявшегося пищеводного кровотечения. После обследования мы принимаем решение о виде оперативного вмешательства.
Трансъюгулярные внутрипеченочные портосистемные шунты. Особенности внутрипеченочных шунтов.
Проанализированы результаты лечения 70 больных с кровотечением из варикозно расширенных вен пищевода и желудка, обусловленным портальной гипертензией цирротического генеза. I группу составили 35 пациентов, которым в комплексе лечебных мероприятий, включающем медикаментозные способы гемостаза и эндоскопическое лигирование, была выполнена операция трансъюгулярного внутрипеченочного портосистемного шунтирования (TIPS/ТИПС). Во II группу включено такое же количество больных. Данное портосистемное шунтирующее пособие у них было дополнено селективной эмболизацией левой желудочной вены. Изучены анатомические особенности этого сосуда, сформулированы показания для эмболизации. Сравнительный анализ эффективности этих двух вариантов портосистемной шунтирующей операции по количеству рецидивов геморрагий, показателям летальности и выживаемости, прослеженным за период длительностью 36 мес., позволил установить достоверные преимущества сочетанной методики, примененной во II группе, предложенный алгоритм лечения варикозных кровотечений портального генеза считаем оптимальным у этой тяжелой категории больных.
1. Маев И.В. Допплерсонографическое изменение кровотока в системе воротной вены при портальной гипертензии / И.В. Маев, Л.П. Воробьев // Клинич. медицина. – 1992. – № 1. – С. 41–13.
2. Рыжков В.К., Карев А.В., Борисов А.Е., Петрова С.Н. Внутрипеченочный портокавальный шунт в лечении портальной гипертензии при циррозе печени // Вест. хир. – 2007. – Т. 166. – № 4. – С. 11–15.
3. Хоронько Ю.В., Черкасов М.Ф., Поляк М.И., Косовцев Е.В., Хоронько Е.Ю., Дмитриев А.В. Трансъюгулярное внутрипеченочное портосистемное шунтирование: роль и место в комплексе мероприятий при лечении пищеводно-желудочных кровотечений цирротического генеза // Вестник хирургической гастроэнтерологии. – 2011. – № 3. – С. 33–38.
4. Шерцингер А.Г., Жигалова С.Б., Мелкумов А.Б., Манукьян В.Г., Варикозное расширение вен желудка у больных с портальной гипертензией: диагностика и лечение // Анналы хирургической гепатологии. – 2010 – Т. 15, № 3. – С. 84–94.
5. Шиповский В.Н., Цициашвили М.Ш., Саакян А.М., Монахов Д.В., Хуан Ч., Нечаев А.И. Повторные эндоваскулярные вмешательства после трансъюгулярного внутрипеченочного порто-системного шунтирования (TIPS) // Ангиология и сосудистая хирургия. – 2010. – Т. 16. – № 2. – С. 37–40.
6. Bassеne M.L., Diouf M.L., Dia D., Mbengue M., Halim A., Diallo S., Thioubou M.A., Cissе M.M. / Esophageal variceal band ligation in Dakar, Senegal // Med. Sante Trop. – 2012. – Vol. 22, № 2. – P. 166–169.
7. Boyer T.D., Haskal Z.J. The Role of Transjugular Intrahepatic Portosystemic Shunt in the Management of Portal Hypertension. // Hepatology. – 2005. – Vol. 41, № 2. – P. 1–15.
8. Cooper G., Bellamy P., Dawson N. A prognostic model for patients with end-stage liver disease // Gastroenterology. – 1997. – № 113. – Р. 1278–1288.
9. Darcy M. Evaluation and management of transjugular intrahepatic portosystemic shunts // J. Roentgenol. – 2012. – Vol. 199, № 4. – P. 730–736.
10. Kravetz D. Prevention of recurrent esophageal variceal hemorrhage: review and current recommendations // J Clin Gastroenterol. – 2007 Nov-Dec. – Vol. 41, № 10, Suppl 3. – P. 5318–5322.
11. Weil A.B. Anesthesia for patients with renal/hepatic disease // Top Companion Anim Med. – 2010 May. – № 25(2). – Р. 87–91.
12. Yoshida H., Mamada Y., Taniai N., Tajiri T. New methods for the management of gastric varices // World J Gastroenterol. – 2006 October 7. – № 12(37). – Р. 5926–5931.
Портальная гипертензия (ПГ) – один из ведущих синдромов, характерных для цирроза печени (ЦП) [1]. При ПГ в круг патологических расстройств вовлекается сосудистое русло всех органов брюшной полости. Для данного осложнения характерны следующие проявления: пищеводно-желудочное кровотечение из варикозно расширенных вен (ВРВ) пищевода и желудка, асцит, гепато-ренальный синдром, энцефалопатия, спонтанный бактериальный перитонит [3, 6, 8]. Наиболее опасное и нередко фатальное для больного осложнение – варикозное кровотечение [4, 10].
Основные сосудистые коллекторы, в области которых чаще всего происходят такие геморрагии, располагаются в кардио-эзофагеальной зоне, а именно в нижней трети пищевода и кардиального отдела желудка. Именно здесь при ПГ формируется один из самых клинически значимых порто-кавальных анастомозов между левой желудочной веной (ЛЖВ), являющейся ветвью воротной вены (ВВ) и непарной и полунепарной венами, несущими кровь в верхнюю полую вену [2, 12].
Существует множество медикаментозных, эндоскопических и хирургических методов гемостаза при варикозных кровотечениях. Однако, несмотря на это, результаты лечения подобных пациентов в большинстве случаев остаются неудовлетворительными [9, 11]. Операция трансъюгулярного внутрипеченочного портосистемного шунтирования (TIPS/ТИПС) нашла широкое применение в клинической практике в лечении ПГ с целью остановки и профилактики рецидивов кровотечений из ВРВ пищевода и желудка ввиду миниинвазивности, отсутствия широкого хирургического доступа и многочасового анестезиологического пособия, которые могут усугубить течение фонового заболевания и смерти пациента [5, 7]. Известна разновидность выполнения TIPS/ТИПС с последующей эмболизацией ЛЖВ и пищеводных вен. После установки внутрипеченочного стента через созданный портосистемный шунт в ЛЖВ проводят ангиографический катетер и устанавливают эмболизационные спирали, тем самым редуцируя кровоток в пищеводных вариксах. Данная манипуляция приводит к снижению риска рецидива пищеводного кровотечения в случае дисфункции внутрипеченочного шунта [9].
Проведя анализ литературных данных, следует сказать, что эндоваскулярная эмболизация ЛЖВ является эффективной дополнительной манипуляцией к портосистемному шунтирующему вмешательству в лечении и профилактике варикозных пищеводно-желудочных кровотечений. Успех выполнения данного оперативного пособия зависит от особенностей анатомического строения системы ВВ и в частности ЛЖВ.
Цель исследования – оценить эффективность выполнения операции TIPS/ТИПС в сочетании с селективной эмболизацией ЛЖВ в лечении и профилактике варикозных пищеводно-желудочных кровотечений при ПГ путем клинико-анатомического обоснования данной манипуляции.
Материалы и методы исследования
Материалом для исследования послужили данные, полученные при анализе клинических, ультразвуковых, томографических и ангиографических данных. В хирургической клинике РостГМУ в период с 2007 по 2014 гг. операции TIPS/ТИПС подверглись 144 пациента с ПГ цирротического генеза. Отметим, что 102 пациентам основным показанием к оперативному вмешательству стали продолжающиеся или состоявшиеся в недавнем анамнезе пищеводно-желудочные кровотечения. В 52 случаях данное вмешательство дополнено селективной эмболизацией ЛЖВ. С целью оценки эффективности выполнения эмболизации ЛЖВ и обоснованности ее применения в профилактике варикозных кровотечений проведен ретроспективный анализ клинических случаев. Сформированы 2 сопоставимые клинические группы путем случайной выборки из общего количества больных. В каждую группу вошли по 35 больных. Больным I группы выполняли операцию TIPS/ТИПС, во II – основной этап оперативного пособия дополняли селективной эмболизацией ЛЖВ. Возраст больных – от 27 до 74 лет (в среднем 47,9 ± 6,8). Распределение больных в выборке по степени тяжести печеночной недостаточности в соответствии с критериями Чайлд-Пью было следующим: 3 человека относились к классу А, 35 – к классу В, 32 – к классу С. Отметим, что группы были сопоставимы по полу и возрасту, а также по количеству больных в зависимости от класса хронической печеночной недостаточности. Как видно, большинство больных обеих групп находились в суб- и декомпенсированных стадиях заболевания. В предоперационном периоде наряду с рутинными методами обследования всем больным выполнялось дуплексное сканирование системы ВВ и селезеночной вены для определения их диаметра, линейной, объемной скоростей кровотока, его характера. С целью оптимизации прогноза проведения TIPS/ТИПС в контексте предстоящего вмешательства и оценки внутрипаренхиматозного топографоанатомического расположения браншей ВВ, визуализации внепеченочных ветвей спленопортального ствола у больных с ЦП выполнялась компьютерная спленопортография. Также оценивались анатомические особенности ЛЖВ. Основными показаниями для выполнения эмболизации явились наличие пищеводных кровотечений в анамнезе, рентген-ангиографическое подтверждение варикозно расширенных вен (ВРВ) пищевода. Обязательным завершающим этапом хирургического пособия являлась контрольная прямая портография. Критерием адекватного выполненного вмешательства было контрастирование ВВ, внутрипеченочного стента без дефектов наполнения, а также отсутствие кровотока по ранее выявленным ВРВ пищевода.
Результаты исследования и их обсуждение
Правильная оценка рентген-анатомических особенностей ВВ и ее внутрипеченочных ветвлений в контексте предстоящей операции TIPS/ТИПС является залогом успешного создания внутрипеченочного канала с целью эффективной декомпрессии портальной системы. Весьма информативную картину представления о состоянии сплено-портального русла и особенностей анатомии ЛЖВ на дооперационном этапе дает компьютерная сплено-портография (рис. 1).
Во всех случаях было выявлено, что при ПГ в первую очередь расширяются сосуды, расположенные ближе к воротам печени. Такими сосудами являются ЛЖВ, селезеночная и мезентериальные вены. Объясняется это тем, что развивающийся гепатофугальный кровоток всегда идет по пути наименьшего сопротивления. Кроме этого, визуализировались расширенные порто-кавальные анастомозы области ворот печени и селезенки. У больных обеих групп отмечено расширение ЛЖВ (1) и извитые пищеводные вены (5) (рис. 1). В нескольких случаях контрастировались расширенные и варикозно-трансформированные венозные стволы выше диафрагмы, впадающие в систему непарной и полунепарной вен (пути оттока в систему верхней полой вены) (рис. 2). В ряде случаев для более детальной оценки анатомического строения системы ВВ и в частности ЛЖВ нами использовалась 3D-реконструкция изображения (рис. 3). Отметим, что ВРВ пищевода у пациентов визуализировались при выполнении эзофагогастродуоденоскопии (ЭГДС).
Рис. 1. Пациентка Л., 45 лет. СКТ-ангиография: 1 – варикозно трансформированная ЛЖВ; 2 – селезеночная вена; 3 – ВВ; 4 – устье впадения ЛЖВ в ВВ; 5 – нижние пищеводные вены
Рис. 2. Пациентка К., 54 лет. СКТ-ангиография. 1 – ЛЖВ
Рис. 3. Пациентка К., 54 лет. СКТ-ангиография, 3D-реконструкция. 1 – ЛЖВ
Во всех случаях II группы наблюдения этап эмболизации стал дополнением основному эндоваскулярному хирургическому мероприятию. Основными показаниями к данной манипуляции служили пищеводно-желудочные кровотечения в анамнезе и возможность технического исполнения. Непосредственно перед оперативным пособием для визуализации анатомических особенностей порто-печеночного русла применялась селективная ангиография данных венозных сосудов. После установки внутрипеченочного стента выполнялась контрольная прямая портография. Помимо оценки функционирования внутрипеченочного шунта, мы обращали внимание на наличие ВРВ пищевода и варикозно трансформированной ЛЖВ (рис. 4).
Рис. 4. Пациентка Д., 35 лет: 1 – стент; 2 – левая желудочная вена; 3, 4 – варикозно расширенные вены
Рис. 5. Пациентка Д., 35 лет: 1 – ВВ; 2 – TIPS/ТИПС; 3 – спираль Gianturco
На представленных ангиограммах (прямая портограмма) визуализируются ВРВ пищевода. Селективно катетеризирован ствол ЛЖВ. Эмболизация производилась спиралями Gianturco, которых требовалось от одной до четырех, в зависимости от диаметра данных сосудов. Критерием ее эффективности было отсутствие ретроградного кровотока по эмболизированным сосудам и контрастирования вариксов при контрольной ангиографии (рис. 5).
У двух больных ЛЖВ была представлена несколькими стволами. В подобных случаях мы раздельно катетеризировали каждый из варикозных стволов с последующей эмболизацией.
Как видно, процедуру эмболизации ЛЖВ, дополняющую шунтирование системы ВВ, мы выполнили в 36,1 % случаев от общего количества больных. У пациентов I группы селективная эмболизация ЛЖВ в ряде случаев не выполнялась. Техническая невозможность исполнения данной манипуляции даже при рентгенологически подтвержденной картине наличия ВРВ пищевода объяснялась зависимостью от анатомических особенностей ЛЖВ и угла отхождения ее ствола ВВ. Наличие острого угла α (угол между ВВ и ЛЖВ) в 30° и менее представляло технические трудности в селективной катетеризации ЛЖВ либо вен пищевода с помощью катетера диаметром 5–6 F типа Cobra. Наличие выраженных ВРВ пищевода более 15 мм в диаметре также не являлось показанием к селективной эмболизации ЛЖВ. Объясняется это тем, что сброс портальной крови в нижнюю пищеводную вену происходил не только через ЛЖВ, но и через селезеночную вену, далее в левую желудочно-сальниковую, короткие желудочные вены, вены подслизистого слоя тела и дна желудка и далее в пищеводные. В подобных случаях пищеводные вены имели несколько венозных притоков. Кроме этого, наличие большего диаметра расширенных вен является предрасполагающим фактором к миграции эмболизационных спиралей.
Проанализировав полученные данные, мы установили следующие показания к селективной эмболизации ЛЖВ, дополняющей операцию портосистемного шунтирования:
- острое или состоявшееся в анамнезе кровотечение из ВРВ пищевода или кардиального отдела желудка;
- высокий риск кровотечения из ВРВ пищевода и/или кардиального желудка, подтвержденный при эндоскопическом исследовании;
- установленную при прямой портографии расширенную и извитую ЛЖВ и варикозно трансформированных пищеводных вен;
- массивный сброс крови из ВВ в венозную систему гастроэзофагеального бассейна и далее в непарную и полунепарную вены.
На основании проведенного ретроспективного анализа отмечено следующее. Селективная эмболизация ЛЖВ, выполняемая через созданный портосистемный канал, является эндоваскулярной процедурой, имеющей целью устранить ретроградный кровоток по венозной магистрали, соединяющей ВВ с сосудами, располагающимися в подслизистом слое нижней трети пищевода и кардиального отдела желудка. Сочетание двух этапов оперативного пособия, а именно TIPS/ТИПС и селективной эмболизации ЛЖВ, позволяет редуцировать ретроградный гепатофугальный кровоток в ВВ и сброс крови в гастроэзофагеальный бассейн, что в значительной мере снижает риск рецидива пищеводно-желудочного кровотечения даже в условиях тромбоза стента.
Тем не менее, по данным некоторых авторов, эндоваскулярная эмболизация ЛЖВ усложняет оперативное вмешательство и увеличивает время его продолжительности, что негативно может сказываться на течении основного заболевания в послеоперационном периоде [9]. Более того, с течением времени существует вероятность снижения эффективности данной манипуляции вследствие вариабельности коллатерального портального кровообращения при рецидиве ПГ [1].
В заключение необходимо отметить следующее. Соблюдение сформулированных показаний, техническую возможность исполнения селективной эмболизации ЛЖВ позволяет надежно профилактировать пищеводно-желудочные кровотечения даже в условиях тромбированного внутрипеченочного шунта. Это позволяет не только снизить рецидив варикозных кровотечений портального генеза в отдаленном послеоперационном периоде и летальность, но и повысить выживаемость данной категории больных.
Выводы
- Операция TIPS/ТИПС – эффективный эндоваскулярный способ лечения ПГ цирротического генеза, позволяющий минимизировать развитие варикозных пищеводно-желудочных кровотечений в послеоперационном периоде.
- Наличие у пациентов в анамнезе варикозных пищеводно-желудочных кровотечений является показанием к выполнению селективной эмболизации ЛЖВ при возможности технического исполнения данной манипуляции.
- Этапное выполнение операции TIPS/ТИПС и эмболизации ЛЖВ является эффективным методом лечения и профилактики пищеводно-желудочных кровотечений портального генеза.
Рецензенты:
Черкасов М.Ф., д.м.н., профессор, главный хирург ЮФО, заведующий кафедрой хирургических болезней ФПК и ППС ГБОУ ВПО РостГМУ Минздрава России, г. Ростов-на-Дону;
Шапошников А.В., д.м.н., профессор, ФГБУ «РНИОИ» Минздрава России, главный научный сотрудник центра подготовки и переподготовки специалистов, г. Ростов-на-Дону.
Портосистемные шунты у собак
Кровообращение печени имеет свои особенности и закономерности. Поступает кровь в печень по артериальному и венозному сосудистому руслу. Воротная (портальная) вена обеспечивает 75-80% общего притока крови в печень. Кровь из кишечника, желудка, селезёнки и поджелудочной железы поступает в общий венозный коллектор – портальную вену. В этой крови содержится не только большое количество веществ жизненно необходимых для организма, но различного вида токсины. Все эти вещества по воротной вене попадают в печень, где происходят процессы синтеза и детоксикации.
Существуют врожденные или приобретённые аномалии кровообращения печени, при которых часть или вся кровь минуя печень, попадает в большой круг кровообращения по портосистемным шунтам. В этом случае в печени не происходит физиологической детоксикации крови. Различного вида нейротоксины, псевдо нейромедиаторы, мочевая кислота, жирные кислоты, фенолы, меркаптан и другие неизвестные вещества — продукты жизнедеятельности микрофлоры кишечника вызываю печёночную энцефалопатию.
Портосистемный шунт у собак симптомы
Портосистемные врождённые шунты могут быть внутрипечёночными и внепечёночными. При врождённых портосистемных шунтах патология проявляется в возрасте от 4 — х месяцев до 3 — х лет. Симптомами является:
- отставанием в росте
- нарушением обменных процессов
- беспричинным отказом от корма
- мочекаменной болезнью
- печёночной энцефалопатией
Печёночная энцефалопатия у собак проявляется различными видами расстройств центральной нервной системы: беспокойство, заторможенность, манежные движения, внезапные смены настроения, рвота.
Типы портосистемных шунтов
Болеют все породы собак и кошки, однако чаще патология встречается у декоративных и карликовых пород (йоркширский терьер, той — терьер, вест — хайленд терьер и д.р.).
- Врождённые портосистемные шунты могут иметь портокавальные, портоазигональные (портальная и непарная вена) анастомозы по которым кровь поступает в большой круг кровообращения.
- Приобретённые портосистемные шунты – это заместительная реакция организма с формированием коллатералей сосудистого русла на резкое повышение портального давления вследствие нарушения возврата крови по воротной вене в печень. Основной причиной в формировании портосистемных шунтов играют морфологические изменения в паренхиме печени при циррозах, фиброзах и других заболеваниях приводящих к изменению сосудистого русла паренхимы печени.
Основными клиническими признаками приобретённых портосистемных шунтов являются признаки печёночной недостаточности, асцит.
Диагностика портосистемных шунтов
Для диагностики портосистемных шунтов мы в своей практике используем комплексный подход с проведением клинических, лабораторных и инструментальных методов исследования.
При проведении исследований клинического анализа крови выраженные изменения, как правило, отсутствуют.
Биохимическое исследование крови: повышение щелочной фосфатазы, АЛТ, снижение мочевины, резкое повышение в сыворотке желчных кислот (тест проводится до и после кормления).
Исследование мочи указывают, как правило, на мочекаменную болезнь с формированием конкрементов из мочекислого аммония.
Инструментальные методы в нашей практике являются основными и включают в себя: УЗИ с использованием цветного допплера, рентгенографию, портографию с измерением портального давления. При выраженных энцефалопатиях проводим компьютерную томографию головы для исключения заболеваний вызывающих схожие клинические признаки. К таким заболеваниям относятся гидроцефалия, менингоэнцефалит.
УЗИ методы исследования печени при портосистемных шунтах обычно позволяют выявлять изменения характерные для данной патологии: уменьшение размеров печени (может быть не свойственно декоративным и карликовым породам), эхогенные изменения паренхимы печени с расширением полости желчного пузыря и резкое обеднение сосудистого рисунка при допплеровском сканировании. Особую проблему представляет собой визуализация шунта при цветном допплеровском сканировании, что является самым объективным и точным при использовании УЗИ.
Наш клинический опыт и высококлассное ультразвуковое оборудование в 98,8% случаев позволяет нам выявлять внутрипеченочный портокавальный шунт и в 70% внепеченочный (видео).
На простой рентгенограмме выполненной в боковой проекции определяется уменьшение контуров тени печени (фото 1).
Портография представляет собой инвазивный метод объективной диагностики, который проводится в условиях кратковременного наркоза. Суть метода заключается в ведении рентгеноконтрастного вещества в портальную вену через брыжеечную вену.
На рентгенограмме в норме определяется распространение контрастного вещества по долям печени, при портосистемных шунтах контрастное вещество по портальной вене частично попадает в печень, или полностью шунтируется по шунтам, не попадая печень (фото 2а, б, в, г, д, е).
Одновременно проводится инвазивное измерение давления в портальной вене. В норме давление составляет от 6 до 8 мм.рт.ст. При наличии шунта давление обычно снижается.
Портосистемный шунт у собак лечение
Существует консервативная терапия и операция по лигированию шунта с цель восстановления портального кровотока.
Консервативная терапия не отвечает требованиям данной патологии и предполагает использование адсорбентов, антибиотиков и низкобелковой диеты.
Основным и адекватным методом лечения является хирургический. Наш опыт показывает, что проведение операции по лигированию портосистемного шунта имеют свои особенности. Наложение стягивающей лигатуры на сосуд – метод, который традиционно используется при лечении портосистемных шунтов, требует при проведении манипуляций обязательный контроль со стороны изменения портального давления. Одномоментное полное закрытие шунта приводит к резкому повышению портального давления и гибели животного. Давление можно измерять с помощью «водяного столба» или с использованием электронных датчиков кардиомонитора (фото 3а, б, в).
В нашей практике мы используем кардиомонитор с датчиками для инвазивного давления. На сегодняшний день широко вошли в клиническую практику сосудистые констрикторы, при наложении которых на сосуд происходит медленное его закрытие, что профилактирует портальную гипертензию (фото 4а, б, в, г, д, е, ж). Однако существуют множественные шунты, при лигировании которых требуется сочетание методик под контролем инвазивного давления.
Основным опасным периодом после операции считаются первые трое суток, которые требуют наблюдение специалиста за животным. Адекватное хирургическое лечение портосистемного шунта приводит к полному восстановлению функции печени и животного.
Читайте также:
