Влияние бактерий кишечника на ее воспалительную реакцию
Добавил пользователь Alex Обновлено: 23.01.2026
Взаимодействие кишечника с микрофлорой и их взаимное влияние
Существуют доказательства того, что микроорганизмы могут оказывать различное влияние на функции кишечника. Вероятно, синергизм множества микроорганизмов, составляющих микробиоту кишечника, важен для его нормальной работы и соответствующего контроля за патогенными микроорганизмами.
Микрофлора зависит не только от микроорганизмов, заселяющих кишечник, но и от механизмов собственной защиты кишечника организма хозяина. Кишечник имеет несколько физиологических барьеров против бактерий: перистальтику, желудочный сок, протеолитические ферменты, кишечную слизь, поверхностные гликоконъюгаты клеток и плотное примыкание клеток кишечного эпителия друг к другу.
Все эти барьеры ограничивают количество бактерий в полости кишечника и предотвращают фиксацию и проникновение их сквозь эпителий кишечника. Кишечник также имеет сложную систему иммунной защиты хозяина. Кроме того, существуют биохимические факторы, роль которых заключается в ограничении роста микроорганизмов, проникших за физиологический барьер.
Имеются в виду Т- и В-лимфоциты, секреторный иммуноглобулин А, дефенсины, секретируемые клетками Панета, и трилистный фактор, секретируемый непосредственно эпителием кишечника.
В кишечнике существует система взаимодействия его с микрофлорой. Благодаря этой системе возможно распознавание бактерий-комменсалов, к которым иммунные факторы толерантны, и патогенных микроорганизмов, запускающих воспалительные и иммунные реакции. В распознавании микробной среды принимают участие три типа клеток: М-клетки, поверхностные энтероциты и дендритные клетки.
М-клетки обнаруживаются на всем протяжении пищеварительного тракта в составе особого эпителия в лимфоидных фолликулах слизистой оболочки или пейеровых бляшках. М-клетки могут переносить антигены и бактерии через эпителий к субэпителиальным дендритным клеткам посредством активного везикулярного транспорта, используя клатрин-зависимый эндоцитоз, пиноцитоз или фагоцитоз.
Считается, что этот процесс осуществляет регуляцию комменсальной микрофлоры и обеспечивает реакцию с участием антител класса иммуноглобулинов (Ig) А. Данный механизм активирует иммунный ответ, но при этом имеется возможность проникновения патогенных микроорганизмов через слизистую оболочку.
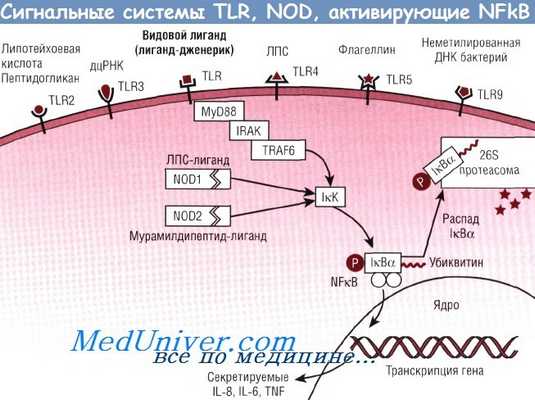
Несмотря на то что различные TLR- и NOD-рецепторы имеют специфические лиганды, пострецепторные сигнальные пути, приводящие к активации NFkB, одинаковы. Сигнальный каскад начинается с привлечения молекул адаптерных белков MyD88, IRAK и TRAF6, что ведет к активации IкК, который, в свою очередь, фосфорилирует IкВа, нацеливая его на убиквитинацию и распад под действием 26S протеасомы. Высвобожденный таким образом NFkB переносится в ядро и присоединяется к ДНК, что ведет к транскрипции гена.
IкВ — ингибитор каппа В;
IкК — IкВ-киназа;
IL — интерлейкин; IRAK — киназа, ассоциированная с рецептором IL-1;
NFkB — нуклеарный фактор каппа В;
NOD — нуклеотидсвязывающий олигомерный домен;
Р — фосфорилирование;
TLR — Toll-подобные рецепторы;
TNF — фактор некроза опухоли;
TRAF6 — ассоциированный с TNF фактор 6;
дцРНК — двухцепочечная РНК;
ЛПС — липополисахариды.
Поверхностные энтероциты распознают бактерии с помощью ряда рецепторов, распознающих молекулярные структуры микроорганизмов (патоген-ассоциированные молекулярные паттерны). Эти рецепторы носят название Toll-подобных рецепторов, каждый из которых распознает особые структуры бактерий.
Например, TLR2 распознает такие структуры грамположительных микроорганизмов, как пептидогликан и липотейхоевая кислота, TLR4 — липополисахариды грамотрицательных микроорганизмов, TLR5 распознает флагеллин — провоспалительный элемент флагеллы (жгутика) бактерий, a TLR9 — неметилированную ДНК бактерий. Связывание с любым из этих рецепторов приводит к активации NFkB. Кроме того, внутриклеточные рецепторы NOD1 и NOD2 также распознают бактериальные фрагменты, такие как ЛПС, и активируют NFkB.
NFkB представляет собой группу структурно связанных белков, которые активируют транскрипцию целого ряда генов, участвующих в воспалительном и иммунном ответах. В неактивном состоянии димеры NFkB соединены в цитоплазме с IкВ (IкВ-белками). Клеточная стимуляция может запускать механизм сигнальной трансдукции, приводящей к активации IкК, который затем фосфорилирует IкВ, что ведет к разрушению внутри протеасом.
Высвобожденный таким образом NFkB перемещается в ядро, где активирует транскрипцию генов, повышая синтез цитокинов (IL-6, TNF-a), хемокинов (IL-8), молекул адгезии и регуляторов апоптоза.
Дендритные клетки являются антигенпрезентирующими клетками кишечника. Они могут располагаться между поверхностными энтероцитами, не разрывая плотных контактов, и передавать живые бактерии или их антигены в мезентериальные лимфатические узлы для осуществления иммунного ответа. Дендритные клетки, экспрессируя молекулы ГКГС класса II, представляют собой антигены пищи или бактерий, которые вступают в контакт с эпителием кишечника и наивным Т-лимфоцитом пейеровых бляшек.
Иммунный ответ кишечника на эти бактериальные сигналы в целом может быть представлен двумя классами CD4+ Т-клеток, отличающихся спектром продуцируемых цитокинов. Т-хелперы (Th) типа 1 продуцируют интерферон (IFN) у и TNF-b. Эти цитокины необходимы для развития клеточного иммунитета. Неадекватный ответ с доминированием Th1 связан с возникновением аутоиммунных заболеваний. Th2 продуцируют IL-4, IL-5, IL-10 и IL-13. Эти цитокины ассоциируются с развитием IgE-ответа.
Неадекватный ответ с доминированием Th2 приводит к возникновению аллергии и атопии. Активация и дифференцировка CD4+ Т-лимфоцитов зависят как от вида и количества антигена, так и от баланса цитокинов. Присутствие IL-12 приводит к активации Th1-ответа, в то время как присутствие IL-4 — к Th2-ответу.
При проникновении бактерий через слизистый барьер начинается процесс инициации распознавания структур микроорганизмов Toll-подобными рецепторами и запускается Th1-ответ, а Th2-ответ подавляется, что ведет к активации соответствующей воспалительной реакции, препятствующей бактериальной инвазии. Если потребность в иммунном ответе отсутствует, Th2-клетки продуцируют IL-4 и IL-10, что ведет к супрессии Th1-клеток, которые продуцируют IFN-y и IL-12, и баланс возвращается в первоначальное состояние. Дисрегуляция может привести к развитию неадекватного иммунного ответа на бактерии (воспалительному заболеванию кишечника) или на пищевые антигены (пищевой аллергии или целиакии).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Влияние изменений кишечной микробиоты на течение воспалительных заболеваний кишечника
Важная роль в развитии и прогрессировании воспалительных заболеваний кишечника принадлежит факторам окружающей среды, в частности, микробиоте кишечника. Успехи в технологии геномного секвенирования позволили установить, что именно изменение состава микроб
The influence of changes in intestinal microbiota on the course of inflammatory intestinal diseases O. V. Gaus, V. A. Akhmedov
An important role in the development and progression of inflammatory bowel diseases belongs to environmental factors, in particular, the intestinal microbiota. Advances in the technology of genomic sequencing made it possible to establish that it is the change in the composition of the intestinal microbiota that triggers the inflammation in the intestine, and not vice versa, as it was previously thought.
В структуре патологии желудочно-кишечного тракта (ЖКТ) воспалительные заболевания кишечника (ВЗК), такие как болезнь Крона (БК) и язвенный колит (ЯК), уступают другим нозологическим единицам по уровню распространенности, однако во много раз превосходят их по таким показателям, как частота развития осложнений, летальности и тяжести течения [1, 2]. Кроме того, ВЗК является существенным бременем как для самого больного, значительно снижая качество его жизни, так и для системы здравоохранения, требуя больших затрат на лечение, оплату листов нетрудоспособности [3].
Согласно зарубежным данным, заболеваемость ЯК колеблется от 0,6 до 24,3 случая на 100 тыс. человек, БК — от 0,3 до 20,2 случая на 100 тыс. человек; распространенность ЯК достигает 505 случаев на 100 тыс. человек, БК — 322 случая на 100 тыс. человек [4]. Наиболее часто ВЗК обнаруживаются в Северной Америке и Европе. Эпидемиология ВЗК в Российской Федерации точно не установлена, отдельные эпидемиологические исследования проводились на малочисленных выборках, и их довольно сложно интерпретировать на всю популяцию [2]. В настоящее время во всем мире наблюдается неуклонный рост заболеваемости ВЗК, примерно в 6 раз за последние 10 лет [3].
Несмотря на то, что точные причины возникновения ВЗК до сих пор остаются неустановленными, недавно проведенные исследования подтверждают гипотезу о том, что воспаление при БК и ЯК является следствием сложного взаимодействия генетических факторов, местного иммунитета, диеты и факторов окружающей среды, которые могут оказывать влияние на развитие данных заболеваний напрямую или опосредованно через изменение состава микробиоты кишечника [5].
Микробиом кишечника является самостоятельным «органом», динамично развивающимся и изменяющимся с возрастом. Видовой состав кишечного микробиома у младенца напрямую зависит от тактики ведения родов: при рождении через естественные родовые пути в кишечнике новорожденного наблюдается доминирование типичной фекальной и вагинальной микрофлоры, в то время как при проведении родоразрешения путем кесарева сечения — типичной микрофлоры кожи [6]. В проведенном в Дании когортном исследовании младенцев, родившихся в период с 1973 по 2008 годы, было отмечено, что ведение родов посредством кесарева сечения повышает риск развития ВЗК в последующем [7]. На состав бактерий кишечника младенцев также немаловажное воздействие оказывает характер питания, при этом отмечено снижение риска развития ВЗК у детей, находящихся на грудном вскармливании [8].
В детстве и в зрелом возрасте значимое влияние на микробный состав кишечника оказывают диета, курение, причем как активное, так и пассивное, экология, прием антибиотиков и других лекарственных препаратов [9].
В настоящее время выявлено около 1150 видов микроорганизмов, которые могут заселять ЖКТ человека, однако культивировать удается не более 20–30% из них [10]. Огромный «прорыв» в изучении видового состава кишечной микробиоты здорового человека, а также у лиц с различными патологическими состояниями был получен после разработки методики геномного секвенирования ДНК [10].
Впервые связь между возникновением воспалительного процесса в кишечнике и изменением состава кишечного микробиома была наглядно показана в проведенных экспериментальных исследованиях на животных, когда введение гомогенатов кишечника от больных БК приводило к развитию гранулематозного колита у экспериментальных животных [11]. На основании этого был вполне справедливо выдвинут тезис: «Нет бактерий — нет колита», который впоследствии стал основой теории о том, что именно обычная комменсальная, а не патогенная микрофлора кишечника, при условии потери иммунологической толерантности к ней организма, может способствовать развитию ВЗК [12]. Проведенные последующие клинические исследования подтвердили присутствие значительных изменений кишечной микробиоты как при БК, так и при ЯК, каким бы методом (микробиологическим или молекулярно-генетическим) ни проводилась оценка. Интересная особенность в том, что эти изменения наблюдаются на всем протяжении кишечника и не зависят от активности воспалительного процесса в изучаемом сегменте [13]. Принимая во внимание полученные данные, логично предположить, что нарушение качественного или количественного состава микробиоты кишечника, скорее всего, имеет первичный характер, а не является следствием воспалительного процесса.
Важным патогенетическим звеном ВЗК является транслокация бактерий в стенку кишки вследствие повышения проницаемости эпителиального барьера слизистой оболочки, что основывается на выявлении повышения концентрации ДНК бактерий в биоптатах слизистой оболочки кишки у пациентов с ВЗК и еще большего его увеличения по мере нарастания активности процесса [14].
Более 90% микробиоты кишечника человека представлены 4 типами бактерий: Firmicutes (49–76%), Bacteroidetes (16–23%), в меньшей степени — Proteobacteria и Actinobacteria [15].
Изменения количественного или качественного состава кишечной микробиоты при ВЗК достаточно разнообразны, при этом до сих пор ни для одного микроорганизма не была доказана прямая причинно-следственная связь в развитии ЯК или БК. В большинстве исследований описано снижение видового разнообразия бактерий кишечника у больных ВЗК, в частности, снижение Firmicutes, Bacteroidetes и увеличение Proteobacteria [15]. Однако следует отметить, что это нарушение видового разнообразия может быть весьма вариабельным в зависимости от конкретного варианта ВЗК: например, у пациентов с ЯК на фоне уменьшения Bacteroidetes и Firmicutes чрезмерно возрастает количество грамотрицательных энтеробактерий (Klebsiella pneumoniae, Escherichia coli, Clostridium difficile), в то время как при БК сокращается представительство Clostridium spp., а повышение Escherichia coli выражено в большей степени, чем при ЯК [14]. В особенности значимы среди энтеробактерий адгезивно-инвазивные штаммы Escherichia coli, способные внедряться в эпителиальные клетки слизистой оболочки кишки и проникать в макрофаги, где стимулируют синтез ключевой молекулы воспаления — фактора некроза опухоли альфа (ФНО-α) [15].
При исследовании биоптатов, полученных при эндоскопическом исследовании кишечника больного ВЗК в активной фазе была обнаружена довольно интересная особенность — характерное изменение и в соотношении так называемых «сахаролитических бактерий» — Lactobacillus (тип Firmicutes) и Bifidobacterium (тип Actinobacteria): при ЯК оно смещается в сторону Bifidobacterium, при БК — в сторону Lactobacillus [16]. Кроме того, при БК отмечается снижение содержания нормальных клостридий — Clostridium coccoides и Clostridium leptum (тип Firmicutes), а при ЯК только незначительное уменьшение количества Clostridium leptum [16].
В настоящее время считается, что снижение количества облигатных анаэробов Faecalibacterium prausnitzii (тип Firmicutes, группа Clostridium leptum) в составе кишечной микробиоты может служить одним из ключевых моментов патогенеза ВЗК [17]. Faecalibacterium prausnitzii преобладает в кишечнике здорового человека и оказывает существенное влияние на защитную функцию кишечного барьера, приводя к стимуляции выработки противовоспалительного цитокина ИЛ-10, а также дифференцировки регуляторных Т-клеток (Treg), оказывающих мощное противовоспалительное действие [17]. Отмечено также, что при значительном сокращении численности Faecalibacterium prausnitzii у пациентов с БК повышается риск осложнений после проведения илеоцекальной резекции [9].
Предполагается участие в развитии воспалительных заболеваний кишечника и микроорганизма Campylobacter concisus (тип Proteobacteria), который обычно обнаруживается в полости рта у здоровых людей [18]. Некоторые штаммы Campylobacter concisus могут приобретать от профага дополнительный генетический материал и начинают вырабатывать так называемый Zot-токсин (англ., zonula occludens toxin), который является аналогом токсина холерного вибриона и приводит к расширению межклеточных контактов и повышению проницаемости эпителия слизистой оболочки кишечника. По результатам ПЦР-диагностики образцов биоптатов слизистой оболочки кишечника Campylobacter concisus обнаруживался у 33–69% пациентов с воспалительными заболеваниями кишечника. Известно, что естественным аналогом Zot-токсина в организме человека является зонулин — белок группы гаптоглобина, вырабатывающийся в печени [18].
Среди больных с воспалительными заболеваниями кишечника активно распространена инфекция Clostridium difficile (ИКД), с которой связывают приблизительно 40% всех обострений ЯК и БК [9]. Отношение шансов развития ИКД в группе пациентов с ВЗК составляет 2,9 (95% доверительный интервал — ДИ 2,1–4,1) по сравнению с лицами без ВЗК, и наиболее высок риск данной инфекции при ЯК [19]. Следствием этого явилось появление участившихся случаев госпитализации и повышения летальности при ВЗК [20]. Довольно интересным является тот факт, что распространенные факторы риска ИКД, такие как недавнее применение антибиотиков и посещение лечебных учреждений, по-видимому, реже встречаются среди больных ВЗК [18]. Клиническое течение ИКД может быть довольно вариабельным и протекать как в виде бессимптомного носительства, так и вплоть до формирования фульминантного колита, осложняющегося развитием токсического мегаколона [19]. Типичным проявлением ИКД является появление диареи с примесью крови или слизи, что затрудняет ее дифференциальную диагностику с обычным обострением воспалительного заболевания кишечника, поэтому исследование кала на токсины Clostridium difficile следует выполнять всем пациентам при любом обострении язвенного колита и болезни Крона [21]. В лечении ИКД, в том числе при ВЗК, с успехом применяется пробиотик Saccharomyces boulardii (Энтерол), который проходит через пищеварительный тракт в неизмененном виде без колонизации и полностью выводится из организма в течение 2–5 дней после прекращения приема. Saccharomyces boulardii обладает антагонистическим действием в отношении широкого спектра патогенных и условно-патогенных микроорганизмов: Klebsiella pneumoniae, Staphylococcus aureus, Pseudomonas aeruginosa, Candida kruesei, Candida albicans, Candida pseudotropicalis, Salmonella typhimurium, Escherichia coli, Shigella dysenteriae, Yersinia enterocolitica [22]. Saccharomyces boulardii блокируют активацию белков сигнальной трансдукции, стимулирующих транскрипцию провоспалительных генов, а также увеличивают секрецию иммуноглобулина А в кишечнике [22]. Кроме того, в отношении Clostridium difficile активен антибиотик рифаксимин, рекомендованный Российской гастроэнтерологической ассоциацией (РГА) и Ассоциацией колопроктологов России (АКР) для индукции ремиссии при среднетяжелых и тяжелых атаках болезни Крона [2]. Немаловажным преимуществом рифаксимина перед другими антибактериальными средствами является то, что он плохо всасывается в желудочно-кишечном тракте и не обладает системными побочными эффектами.
Возможным патогенетическим звеном в развитии ВЗК является также и снижение выработки микробных метаболитов — ацетата и бутирата, играющих важное значение в обеспечении функционального состояния кишечного эпителия [11, 12]. Данные короткоцепочечные жирные кислоты (КЦЖК) обладают активным противовоспалительным и регенераторным эффектом, поскольку стимулируют дифференциацию Treg и увеличивают способность Treg подавлять пролиферацию эффекторных CD4+ Т-клеток [12]. Кроме того, усиливая ацетилирование гистонов ДНК хозяина и закрепляя данный эффект на долгие годы, КЦЖК осуществляют эпигенетическое действие [11]. Учитывая то, что ацетат и бутират образуются в ходе жизнедеятельности анаэробной резидентной флоры (Firmicutes, Bacteroidetes), уменьшение представителей этих типов бактерий сопровождается ослаблением противовоспалительного и антипролиферативного потенциала кишечника [23]. В настоящее время исследованиям терапевтического применения КЦЖК при ВЗК посвящено большое количество клинических работ. Еще в 2003 г. были опубликованы результаты двойного слепого плацебо-контролируемого мультицентрового испытания, показавшие эффективность применения бутирата у пациентов с дистальной формой ЯК в составе комплексной терапии с местными формами 5-аминосалицилатов (5-АСК)/гидрокортизона на протяжении 6 недель [24]. Добавление препаратов КЦЖК к стандартной противовоспалительной терапии в течение 6 месяцев позволяет достичь полной клинико-эндоскопической ремиссии у 86% больных с ЯК и у 53% — с БК [25, 26]. К тому же, с целью увеличения выработки бутирата в толстой кишке, логично было бы предположить возможность дополнительного назначения анаэробных бактерий, которые обладают свойством гидролизировать нерастворимые дисахариды до КЦЖК. Сегодня на фармацевтическом рынке имеется большое количество пробиотиков, содержащих бутиратпродуцирующие Lactobacillus и Bifidobacterium, однако эффективность их при ВЗК, особенно в период обострения, в крупных рандомизированных клинических исследованиях не доказана, поэтому в национальных и международных рекомендациях упоминания о них отсутствуют [9].
Следует отметить, что изменения микробиоты кишечника, аналогичные таковым при ВЗК, могут встречаться и при ряде других хронических иммунопатологических заболеваний (пищевой аллергии, целиакии), а также при ожирении [12]. Скорее всего, ключевую роль в патогенезе воспалительных заболеваний кишечника играет не только нарушение качественного и количественного состава бактерий кишечника, но и генетика организма хозяина. Установлено, что наличие родственника первой линии с ЯК и БК повышает риск развития ВЗК в 2–10 раз [9]. Генетические исследования позволили установить взаимосвязь между генными аберрациями и изменениями состава микробиоты у больных ВЗК. Недавно проведенное международное полногеномное исследование генетических ассоциаций GWAS (от англ. Genome — Wide Association Studies) выявило 163 различных однонуклеотидных полиморфизма, связанные с ВЗК, 110 из которых общие для ЯК и БК, 30 — специфичны для БК, 23 — для ЯК [27]. Данные гены распределены на группы в зависимости от их роли в патогенезе ВЗК: формирование приобретенного иммунитета — ИЛ-23R (от англ. interleukin 23 receptor), ИЛ-12B (от англ. interleukin 12 В receptor), JAK2 (от англ. janus kinase 2), STAT3 (от англ. signal transducer and activator of transcription 3); бактериальное распознавание и процессинг — NOD2/CARD15 (от англ. nucleotide-binding oligomerization domain containing 2/caspase activation and recruitment domains 15); аутофагия — ATG16L (от англ. autophagy-related protein 16–1), IRGM (от англ. immunity-related GTPase family M protein), ATG5 (от англ. autophagy-related protein 5); проницаемость слизистого барьера — ECM1 (от англ. extracellular matrix protein 1), CDH1 (от англ. cadherin 1), LAMB1 (от англ. laminin subunit beta 1) [28].
Наиболее изученным однонуклеотидным полиморфизмом стал расположенный на хромосоме 6 ген NOD2/CARD15, с которого началась эпоха генетического исследования БК в 2001 г. Данный ген кодирует воспалительный ответ на бактериальные пептидогликаны, отвечает за распознавание кишечной микробиоты путем регуляции экспрессии в эпителиоцитах, моноцитах и макрофагах внутриклеточного рецептора к мурамилдипептиду — структурному компоненту клеточной стенки всех грамположительных и грамотрицательных бактерий [29]. При активации данных рецепторов запускаются процессы аутофагии и антигенной презентации, что способствует формированию врожденного и приобретенного иммунитета [29]. Все мутации этого гена приводят к нарушению процесса нормального торможения передачи сигнала по пути ключевого ядерного транскрипционного фактора NF-kB (от англ. nuclear factor κB) и, как следствие, усилению воспалительного ответа на бактериальные продукты [12]. Кроме того, у больных ВЗК с мутациями гена NOD2 была выявлена сниженная продукция антимикробных пептидов AMPs (от англ. antimicrobial peptides) в клетках Панета и уменьшенная продукция противовоспалительного цитокина ИЛ-10 в периферических мононуклеарах [29].
Заключение
На основании представленных результатов многочисленных исследований последних лет складывается представление о том, что в основе этиологии и патогенеза ВЗК лежит нарушение взаимодействия иммунной системы желудочно-кишечного тракта с факторами внешней среды, в том числе кишечной микробиотой, что делает ее объектом пристального изучения исследователей и клиницистов. С этих позиций, безусловно, перспективными представляются разработки новых методов терапии ВЗК, направленные на коррекцию качественного и количественного состава кишечной микробиоты. Несмотря на отсутствие четких рекомендаций по применению пробиотиков при воспалительных заболеваниях кишечника, имеется достаточное количество данных, подтверждающих целесообразность назначения некоторых из них.
Литература
О. В. Гаус, кандидат медицинских наук
В. А. Ахмедов 1 , доктор медицинских наук, профессор
ФГБОУ ВО ОмГМУ МЗ РФ, Омск
Влияние изменений кишечной микробиоты на течение воспалительных заболеваний кишечника/ О. В. Гаус, В. А. Ахмедов
Для цитирования: Лечащий врач № 8/2018; Номера страниц в выпуске: 24-27
Теги: желудочно-кишечный тракт, воспаление, иммунопатологические заболевания
Влияние бактерий кишечника на ее воспалительную реакцию
Влияние на воспалительный ответ кишечника у грудных детей
Как уже было отмечено, комменсальная микрофлора способна подавлять формирование воспалительной реакции и, возможно, играть определенную роль в поддержании гомеостаза. Опыты in vitro с культурой клеток молочнокислых бактерий показывают уменьшение воспалительного сигнала: лактобактерии способны предотвратить возникновение колита в естественной модели у мышей, a Bacteroides thetaiotaomicron могут ингибировать NFkB путем усиления его экспорта из ядра.
Ранее было показано, что непатогенные бактерии способны ингибировать провоспалительные пути NFkB посредством блокады убиквитинации IкВ. Кроме того, было продемонстрировано, что большое количество бактерий-комменсалов могут ингибировать NFkB посредством этого механизма, особенно путем блокады модификации Nedd8, необходимой для ферментативной активации комплекса IкВ/убиквитин-лигаза. Предпологают, что чрезмерно активное воспаление у недоношенных детей может развиваться из-за неадекватной колонизации кишечника и последующей утраты регулируемого бактериями торможения воспалительных путей. Это отличается от процесса, происходящего при заселении кишечника нормальной микрофлорой.
С учетом той роли, которую играет бактериальная колонизация при многих кишечных заболеваниях, применение пробиотиков представляется довольно перспективным направлением. Пробиотиками называют «живые микроорганизмы, которые в условиях нормального пищеварения способны приносить дополнительный эффект оздоровления». К наиболее часто используемым в качестве пробиотиков относят лактобактерии, бифидобактерии и грибы рода Saccharomyces.
Как было установлено, они способствуют снижению тяжести ротавирусной диареи и диареи, вызванной применением антибиотиков, а также улучшают исходы таких аллергических заболеваний, как аллергия на белок коровьего молока и атопический дерматит. Недавно проведенное небольшое рандомизированное контролируемое исследование показало значительное снижение частоты возникновения ЯНЭК у детей с ОНМТ, получавших грудное молоко вместе с пробиотиками (лактобактериями, бифидобактериями), по сравнению с младенцами, вскармливаемыми только грудным молоком.
Каким же образом пробиотики оказывают свое терапевтическое действие? У новорожденных детей пробиотики могут способствовать заселению нормальной микрофлоры. К настоящему времени известны многочисленные механизмы, посредством которых пробиотики осуществляют свой положительный эффект: улучшение барьерной функции эпителия, конкурентное вытеснение патогенных микроорганизмов, прямое противовоспалительное действие на эпителиальные сигнальные пути. Некоторые из эффектов пробиотиков могут быть обусловлены действием живых микроорганизмов, которые, возможно, являются источниками эффекторных протеинов и малых молекул.
Однако некоторые из последних исследований показали, что очищенные TLR-лиганды сами по себе способны оказывать положительное действие в отсутствие живых микроорганизмов.
Еще один потенциальный терапевтический подход, имеющий меньший инфекционный риск, заключается в использовании пребиотиков. Пребиотики — это неперевариваемые компоненты пищи, чаще всего представляющие собой длинноцепочечные углеводы или муцины, которые улучшают состояние кишечника, способствуя размножению комменсальной микрофлоры и тем самым восстанавливая экологическое равновесие в кишечнике. Пребиотики также улучшают процесс непосредственного удаления токсинов, тем самым оказывая влияние на иммунный ответ и обеспечивая колонизацию комменсальной флорой.
Эти бактерии, в свою очередь, расщепляют пребиотики и вырабатывают КЦЖК, которые (1) могут подавлять рост патогенных микроорганизмов в кишечнике, (2) обеспечивают питание энте-роцитов, являясь источником бутирата, (3) способствуют абсорбции минералов и предупреждают запоры. Предварительные исследования выявили повышенную колонизацию кишечника бифидобактериями и пониженную колонизацию патогенными микроорганизмами у тех недоношенных детей, которые получали в качестве питания специальные смеси, содержащие пребиотики (90% короткоцепочечных галактоолигосахаридов и 10% длинноцепочечных фруктоолигосахаридов), по сравнению с младенцами, вскармливаемыми обычной смесью.
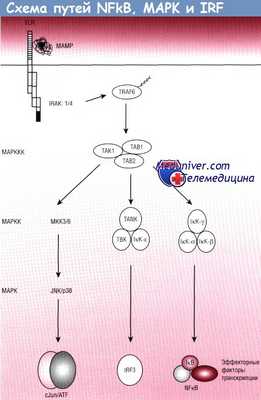
Пути взаимодействующих протеинов обозначены стрелками. Слева указаны функциональные классы ферментов.
ATF — трансмембранный фактортранскрипции;
IкВ — ингибитор каппа В;
IкК — IкВ-киназа;
IRAK — киназа, ассоциированная с рецептором IL-1;
IRF — фактор транскрипции, индуцирующий интерфероновый ответ;
МАМР — ассоциированные с микроорганизмами молекулярные паттерны;
МАРК — митоген-активируемая протеинкиназа;
МАРКК — киназа МАРК;
МАРККК — киназа киназы МАРК;
NFkB — нуклеарный фактор каппа В;
TLR — Toll-подобные рецепторы;
TRAF6 — ассоциированный с TNF фактор 6.
У доношенных детей, получающих смесь с пребиотиками, по сравнению с теми, кто находится на грудном вскармливании, в стуле определяется снижение рН и повышение содержания КЦЖК. Кроме того, можно говорить о вероятном положительном влиянии пребиотиков на иммунитет организма в целом.
Однако назначение пребиотиков может сопровождаться рядом осложнений, наиболее частыми из них являются метеоризм, диарея, которые удается разрешить отменой пребиотика.
Одно из последних направлений терапии заключается в использовании метаболитов бактерий, для которых оправданным будет название «постбиотики». Многие представители нормальной микрофлоры вырабатывают масляную кислоту — четырехуглеродную КЦЖК, являющуюся продуктом анаэробного катаболизма сложных углеводов, которые доходят до нисходящей кишки, практически не подвергаясь расщеплению. Бутират — основной источник энергии для энтероцитов, но его роль в росте и дифференцировке кишечника, подавлении воспаления и апоптозе in vitro и/или в экспериментальной модели на животных изучена плохо.
Был получен ограниченный эффект при использовании бутирата в случае воспалительных заболеваний кишечника у человека. Возможно, это и другие низкомолекулярные производные нормальной микрофлоры в конце концов и определяют ее (и экзогенных про- и пребиотиков) положительный эффект и могут быть использованы в качестве наиболее контролируемых терапевтических агентов.
Недавно проведенные исследования позволили получить интересную информацию о том, что производные комменсальной микрофлоры могут индуцировать TLR-опосредованные защитные ответы, имеющие решающее значение для поддержания нормального состояния кишечника. Было показано, что мыши, лишенные нормальной микрофлоры кишечника и, соответственно, МАМР, были значительно более чувствительны к повреждению кишечника химическим соединением декстраном сульфата натрия. Повреждение слизистой в результате воздействия этого соединения может быть восстановлено путем перорального введения МАМР (например, липотейхоевой кислоты или ЛПС).
Это исследование также показало, что описанное защитное действие не наблюдается у мышей, лишенных TLR2 и TLR4, что доказывает значимость TLR-сигнала для механизма защиты организма хозяина. Положительное воздействие бактерий-пробиотиков можно объяснить эффектом отдельных МАМР. Например, было показано, что неметилированный пробиотик CpG-ДНК способен купировать у мышей колит, обусловленный воздействием декстрана сульфата натрия. Кроме того, отмеченные защитные свойства были утрачены у мышей, лишенных TLR9, что свидетельствует о непосредственном вовлечении TLR-сигнала в защитную систему клеток кишечника. Было выявлено, что TLR-сигнал МАМР напрямую ингибируют процесс апоптоза в нейтрофилах.
Другие индуцируемые МАМР гены, такие как стромальные факторы роста и ангиогенные факторы, обладают функцией репарации, поэтому из-за причастности к более быстрому восстановлению клеток их также можно считать защитными.
Обобщая результаты нескольких исследований, можно предположить, что слизистая оболочка (эпителиальные клетки, иммунокомпетентные резидентные клетки в собственной пластинке слизистой или и те и другие) может воспринимать многочисленные МАМР в содержимом просвета кишки и индуцировать транскрипционный ответ, усиливающий защиту клеток. Возможно, пероральный прием биодоступных TLR-лигандов может стимулировать экспрессию еще не окончательно распознанных генов выживаемости или цитопротективных факторов (например, белков теплового шока, трилистных факторов, антиапоптозных эффекторов) и таким образом оказывать защитное по отношению к эпителию действие.
В этом отношении МАМР могут индуцировать внутренний иммунный эффект трофического питания. Безусловно, нет абсолютной уверенности в том, что эпителий новорожденного реагирует на МАМР нормальной микрофлоры таким же образом и с той же интенсивностью, как и зрелый эпителий.
Использование пробиотиков у недоношенных младенцев может подвергнуть их потенциально гиперчувствительный эпителий с незрелой иммунной системой изменению микрофлоры очень быстро, что спровоцирует осложнения воспалительного характера (вплоть до сепсиса). Возможно, использование нежизнеспособных TLR-лигандов или производных метаболизма бактерий будет менее опасным. Необходимы дальнейшие исследования для того, чтобы получить полное представление о развитии врожденной иммунной системы, в т.ч. ее внутреннего и индуцируемого компонентов. Когда возникает провоспалительныи ответ с его антиапоптозным компонентом в режиме online: внутриутробно или в неонатальном периоде?
Какие именно процессы контролируются в рамках онтогенеза, а какие индуцируются диетой, бактериями или продуктами их жизнедеятельности? Когда происходят экспрессия и функционирование каскадов каспазы и PRR? Ответы на все эти вопросы необходимо получить до того, как будет принято решение о внедрении в клиническую практику пробиотиков или фармакологических модуляторов воспалительных путей.
Кроме участия в созревании иммунного ответа бактериальная микрофлора играет важную роль в процессе контроля воспалительных процессов, происходящих в ЖКТ. Непатогенные микроорганизмы могут подавлять воспалительные сигналы, действуя через NFkB посредством уменьшения распада его ингибитора IкВ при участии убиквитина.
К тому же, как было показано, Bacteroides thetaiotaomicron задерживает NFkB-сигнал, вызывая связывание субъединицы Re1A фактора транскрипции NFkB и рецептора у, активирующего пролиферацию пероксисом (PPAR-y). В дальнейшем это ведет к усилению экспорта из ядра NFkB PPAR-y-зависимым путем, что ограничивает провоспалительную продукцию цитокинов.
Недавно проведенные исследования показали, что комменсальные бактерии имеют молекулярные структуры, распознаваемые TLR. Это ведет к критической для гомеостаза кишечника активации TLR. Если комменсальные микроорганизмы не способны передавать сигнал посредством TLR, как в случае животных без MyD88 или мышей с дефицитом TLR2 или TLR4, отмечается восприимчивость к заболеваниям с последующим воспалением в кишечнике, возможно из-за потери способности к индукции цитопротективных цитокинов, таких как IL-6 и CXCL1, а также белков теплового шока (hsp).
К другим способам предупреждения иммунного ответа с помощью бактериальной флоры относится подавление ответа Toll-подобных рецепторов. Для TLR2 и TLR4 было показано, что после многократного или длительного воздействия лиганда отмечается снижение TLR-сигнала из-за уменьшения экспрессии поверхностного рецептора и увеличения экспрессии Toll-интерактивного протеина.
Проведенные в последние годы исследования продемонстрировали, что бактерии могут контролировать регуляцию цитопротективных путей. Белки теплового шока являются высококонсервативными белками, которые могут быть существенно экспрессированы и задействованы в удержании белков в зрелых третичных структурах, или белки теплового шока могут быть мобилизованы для восстановления частично разрушенных белков в условиях стресса.
Действие тепла — лишь один из примеров стресса, другими являются бактериальная инфекция или ишемия/реперфузия. Hsp названы в соответствии с их молекулярной массой. Две из индуцированных форм hsp — это hsp25, который стабилизирует актин, сохраняя таким образом плотные контакты цитоскелета, и hsp72, который связывает и стабилизирует критические клеточные белки, предотвращая денатурацию. В норме hsp экспрессируются колоноцитами, а не клетками тонкой кишки.
Было высказано предположение, что это может быть обусловлено постоянным воздействием бактерий на колоноциты. С этим предположением согласуются результаты исследований, в которых изучали самозаполняющиеся петли тонкой кишки с последующей хронической колонизацией или самоосвобождающиеся петли, при которых присутствует низкий уровень бактерий. Данные исследования показали, что продолжающееся воздействие бактерий приводит к увеличению экспрессии hsp25 и hsp72 в тонкой кишке.
В целом здоровый организм взрослого человека колонизируется большим количеством кишечных бактерий, которые играют значительную роль в осуществлении нормальной функции кишечника, созревании клеток, иммунной регуляции и контроле за воспалительными процессами.
Псевдомембранозный колит - симптомы и лечение
Что такое псевдомембранозный колит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Аверина Александра Анатольевича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Аверина Александра Анатольевича работали литературный редактор Вера Васина , научный редактор Роман Васильев и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Псевдомембранозный колит (Pseudomembranous colitis) — это острое воспалительное заболевание толстого кишечника, вызываемое токсигенными штаммами бактерии Clostridium difficile [1] . Микроб вырабатывает токсины А и В, повреждающие кишечную стенку, и белок, угнетающий перистальтику кишечника. В результате возникает диарея, боль в животе, появляется слизь и иногда примесь крови в кале.
Характерным признаком заболевания являются фиброзные наложения на слизистой оболочке толстой кишки [27] [28] .
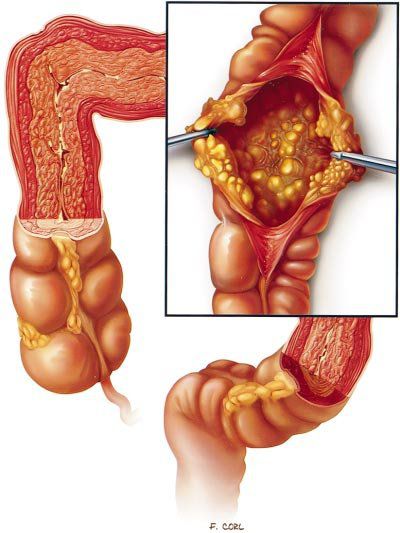
Псевдомембранозный колит (ПМК) чаще всего развивается после лечения антибиотиками. Его ещё называют Clostridium difficile-ассоциированным псевдомембранозным колитом, антибиотик-ассоциированным псевдомембранозным и клостридиозным колитом.
Эпидемиология
Заболеваемость ПМК лучше всего отслеживается в США и странах западной Европы [2] . В России статистический учёт заражения C. diff не ведётся. Согласно систематическому обзору за 2011 год, каждый 5-й случай из всех антибиотик-ассоциированных диарей (ААД) и каждый 2–3 случай внутрибольничной ААД в странах Европы и Северной Америки вызваны C. diff [3] .
В стационарах США среди внутрибольничных инфекций C. diff занимает первое место (12,1 % от общего количества), опережая K. pneumoniae (9, 7 %) и E. coli (9,3 %) [4] . В 2011 г. было зафиксировано более 450 тыс. случаев C. difficile-ассоциированной болезни и более 29 тыс. смертей от неё [29] .
В европейских странах заболеваемость C. diff составляет около 7 случаев на 10000 койко-дней, т. е. при средней госпитализации 10 дней, 7 случаев из 1000 госпитализаций заканчиваются ПМК. В 20 европейских странах это значение колеблется от 0,7 до 28,7 на 10000 койко-дней [5] .
В России в 2011 году было продано 295 млн упаковок антибиотиков, в 2019 — 379 млн [8] [26] . Антибактериальных препаратов потребляется всё больше, их продажа из аптек не контролируется, поэтому проблемы ААД и ПМК актуальны и в нашей стране.
В клиниках Санкт-Петербурга у пациентов с ААД тест на токсины C. diff был положительным в 47,7 % случаев [6] .
Смертность от ПМК колеблется от 9,3 до 22 % и зависит от возраста пациента, смерть чаще наступает при тяжёлом течении заболевания [7] [26] .
В настоящее время увеличилась внутри- и внебольничная заболеваемость C. difficile-ассоциированной болезнью, расширились группы риска, стали чаще встречаться рецидивы и тяжёлые формы, в том числе вызванные более патогенным штаммом BI/NAP1/027, возросла смертность [27] .
Причины псевдомембранозного колита
Основная причина болезни — это приём антибиотиков. ПМК могут вызывать любые антибактериальные препараты, но наиболее часто к нему приводит применение Клиндамицина, хинолонов, цефалоспоринов 2-го и 3-го поколения, карбапенемов. Реже ПМК развивается после приёма макролидов, пенициллина, Тетрациклина, Тигециклина.
К факторам риска, помимо приёма антибиотиков, относятся:
- возраст старше 65 лет;
- терапия ингибиторами протонной помпы и Н2-гистаминоблокаторами — препаратами, снижающими секрецию соляной кислоты в желудке;
- лечение в стационаре, особенно в отделениях реанимации, — каждые 7 дней госпитализации увеличивают риск ПМК на 8 % [1][9][10] ;
- наличие дополнительной патологии, в том числе воспалительных заболеваний кишечника, ВИЧ, сахарного диабета[31][32][33] ;
- хирургические вмешательства на органах ЖКТ;
- энтеральное питание, в том числе через назогастральный зонд;
- приём иммуносупрессивных препаратов (глюкокортикостероидов, Такролимуса) и противоопухолевых средств [31] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы псевдомембранозного колита
Наиболее частые симптомы лёгкого или умеренного псевдомембранозного колита:
- водянистая диарея (жидкие испражнения, похожие на кашицу) от трёх раз в сутки на протяжении двух и более дней в сочетании с болью в животе;
- лёгкие спазмы в животе, часто сопровождающиеся с позывами на стул, но не всегда приводящие к дефекации;
- примеси слизи, крови или гноя в испражнениях;
- температура тела 38,5 °С и более;
- тошнота или потеря аппетита.
При тяжёлом течении псевдомембранозного колита возникает водянистая диарея с кровью, уровень альбумина снижается менее 30 г/л, что сочетается с одним из следующих симптомов: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10 9 /л) и/или болезненностью при ощупывании живота. На фоне длительной диареи организм теряет много жидкости, что приводит к обезвоживанию и проявляется тёмно-жёлтой мочой, чувством жажды, усталости, головокружением, спутанностью сознания и заторможенностью [1] [9] .
При рецидиве болезни симптомы появляются повторно менее чем через 8 недель после окончания терапии.
Проявления псевдомембранозного колита схожи с симптомами других инфекций, поражающих толстый кишечник. Но в отличие от них признаки ПМК могут быть слабо выражены и, как правило, наблюдаются долго: от одной недели до нескольких месяцев. Также встречаются случаи, когда человек является носителем возбудителя ПМК — C. diff, но симптомы полностью отсутствуют.
Патогенез псевдомембранозного колита
В основе патогенеза ПМК лежит чрезмерное размножение бактерий C. diff на фоне уменьшения или гибели нормальной микробиоты толстого кишечника. C. diff вырабатывает токсины А и В, которые вызывают воспаление в кишечной стенке. На течение заболевания влияет состояние иммунной системы пациента и патогенные свойства бактерий, такие как вирулентность, наличие токсинов А и В.
Основной путь передачи инфекции — фекально-оральный. Бактерии попадают в организм с загрязнённых поверхностей, например с дверных ручек, смесителей, ручек смыва сливного бачка, мебели или медицинского инвентаря. Также переносить инфекцию может персонал больницы и заражённые пациенты.
Бактерии C.diff образуют споры, которые устойчивы к действию антибиотиков и могут длительно сохраняться в желудочно-кишечном тракте человека, заражая окружающих и вызывая рецидивы заболевания у самого пациента [12] .
Для некоторых людей C.diff — это часть нормальной микрофлоры ЖКТ, но в таком случае численность бактерий контролируется за счёт других микроорганизмов и работы иммунной системы.
Основные поражающие факторы C.diff — это выделяемые ею токсины [1] . Токсин А (энтеротоксин, белковая молекула с массой 308 кДа) влияет на секрецию жидкости, приводит к повреждению слизистой оболочки кишечника (мембран клеток) и вызывает воспалительный ответ со стороны иммунной системы.
Токсин В (цитотоксин, белковая молекула с массой от 250 до 270 кДа) в 1000 раз более цитотоксичен по сравнению с токсином А. Он вызывает распад филаментного актина — белка, поддерживающего целостность клеток. В результате клетки слизистой разрушаются и гибнут. Токсин В опасен для человека, но не приводит к воспалению и повреждению слизистой оболочки кишечника у животных.
Под действием токсинов в кишечной стенке развивается специфическое воспаление с характерными изменениями на поверхности слизистой. Она становится отёчной, разрыхляется, приобретает ярко-красный цвет, на ней исчезает сосудистый рисунок. При контакте эндоскопа со слизистой капельки крови не появляются. Наблюдается множество желтовато-белых бляшек диаметром 3–5 мм, которые плотно фиксированы к слизистой оболочке. При взятии биопсии они отрываются с трудом, торцом эндоскопа не снимаются. Преобладает два типа воспалительных реакций: диффузно-катаральное воспаление слизистой и очаги фибриноидного некроза — бело-жёлтые бляшки, или псевдомембраны, поэтому такой тип колита называется псевдомембранозным.
![Бляшки при ПМК [35]](/pimg3/vliyanie-bakteriy-kishechnika-BCD3D.jpeg)
В биоптатах, полученных из воспалительно-изменённых участков слизистой, выявляют скопление иммунных клеток крови и слизистой, расширение капилляров и некроз клеток покровного эпителия [1] .
В биоптатах, взятых из бляшек, присутствует фибрин, обрывки некротизированного покровного эпителия, слизь, лейкоциты, плазматические клетки и колонии бактерий.
Чтобы определить патогенность клостридий, нужно выявить их токсины. Посев биоптатов на питательные среды удовлетворительных результатов не даёт. Метод в данном случае затратен и неинформативен, поэтому токсины C. diff определяют в кале.
Воспалительный процесс, как правило, захватывает несколько отделов толстого кишечника, но чаще поражена его прямая и сигмовидная часть, реже вовлекается вся толстая кишка. Протяжённость её поражения связана с тяжестью течения заболевания: чем больше толстого кишечника вовлечено в воспалительный процесс, тем тяжелее протекает колит и ярче симптомы.
Продолжительное воспаление в кишечной стенке приводит к следующим нарушениям:
- не всасывается жидкость, из-за чего развивается обезвоживание;
- потери крови из образующихся эрозий и язв приводят к анемии;
- кишечная стенка становится проницаемой для токсинов возбудителя и продуктов его жизнедеятельности, находящихся в просвете кишки, из-за чего нарастает общая интоксикация.
При тяжёлом течении прекращается перистальтика толстого кишечника, развивается токсический мегаколон и возникает полиорганная недостаточность, из-за чего пациент может погибнуть.
Классификация и стадии развития псевдомембранозного колита
ПМК входит в группу антибиотик-ассоциированных диарей. В Международной классификации болезней (МКБ-10) псевдомембранозный колит кодируется как АО 4.7 — Энтероколит, вызванный Clostridium difficile.
В зависимости от тяжести течения болезни и клинической картины выделяют следующие формы:
- ПМК лёгкой или умеренной тяжести. Проявляется диареей — неоформленным жидким, кашицеобразным стулом три или более раз в сутки и болью в животе.
- ПМК тяжёлого течения. Сопровождается водянистой диареей с кровью и изменениями в анализах. В биохимическом анализе крови отмечается низкий уровень альбумина (меньше 30 г/л), который сочетается с одним из следующих признаков: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10 9 /л) в клиническом анализе крови и/или болезненностью при ощупывании живота.
- Осложнённые формы ПМК. Протекают с водянистой диареей с кровью и одним из следующих симптомов: снижение артериального давления, температура тела ≥ 38,5 °C, отсутствие перистальтики тонкого кишечника, помрачение или угнетение сознания. В клиническом анализе крови лейкоциты повышены > 25×10 9 /л или снижены < 2×10 9 /л, возникает органная и почечная недостаточность, требуется искусственная вентиляция лёгких.
- Рецидивирующее течение ПМК. Заболевание развивается повторно менее чем через 8 недель после окончания терапии [1][14] .
Данная классификация используется для выбора схемы лечения.
Осложнения псевдомембранозного колита
Наиболее частые осложнения псевдомембранозного колита:
- Обезвоживание и электролитные нарушения — из-за сильной и длительной диареи нарушается ритм сердца, снижается артериальное давление и мышечный тонус. Чаще эти осложнения развиваются при недостаточном восполнении потерянной жидкости и солей.
- Почечная недостаточность — при стремительном обезвоживании нарушается работа почек, из-за чего снижается частота мочеиспусканий, появляются отёки, по анализам крови видно, что растёт содержание азотистых шлаков.
- Токсический мегаколон — расширение толстой кишки, редкое осложнение с плохим прогнозом. На фоне диареи частота стула резко урежается до одного раза в сутки, в дальнейшем дефекация прекращается полностью. Это происходит из-за замедления и полного прекращения перистальтики толстого кишечника. Из-за распирания толстого кишечника газами и содержимым нарастает вздутие живота, усиливается боль в нём. Интоксикация и электролитные нарушения приводят к резкому ухудшению самочувствия и выраженной слабости. В дальнейшем стенка кишки разрывается, содержимое изливается в брюшную полость (перфорация кишечника) и начинается перитонит. Как правило, это осложнение наблюдается у ослабленных пациентов, находящихся в отделении реанимации и хирургии.
- Перфорация кишечной стенки — образуется сквозное отверстие в кишечной стенке с излитием содержимого кишечника в брюшную полость и развитием перитонита.
- Полиорганная недостаточность — может привести к гибели пациента [1][15] .
Диагностика псевдомембранозного колита
Тесты на C. diff показаны при длительной диарее с болью в животе и/или примесью крови в стуле, возникшей спустя 3–60 суток после выписки из стационара и/или после приёма антибиотиков [1] .
Чтобы выявить токсигенные штаммы C. diff, токсины A и B определяют в кале [16] .
Для этого используют следующие методы:
- Цитотоксиновый копрологический тест. Чувствительность — 95 %, специфичность — 99 %, результат — в течение 2–3 дней.
- ELISA (Enzyme Linked Immuno Sorbent Assay) — фермент-связанный иммуносорбентный тест для определения токсинов. Чувствительность — 70–90 %, специфичность — 99 %, результат — через 4–6 часов.
- ПЦР (полимеразная цепная реакция) на токсин В. Чувствительность — 96 %, специфичность — 100 %, результат — в течение нескольких часов.
Чувствительность теста — это доля положительных результатов среди больных людей, т. е. вероятность правильно определить инфекцию у заболевших, отсутствие ложноотрицательных результатов. Специфичность — доля отрицательных результатов среди здоровых людей, т. е. отсутствие ложноположительных результатов.
Посев кала на C.diff не проводится, так как этим методом не удаётся определить токсигенные штаммы.
С помощью дополнительных методов можно оценить тяжесть состояния пациента и своевременно выявить осложнения.
К дополнительным обследованиям относятся:
- ректороманоскопия или сигмоидоскопия — позволяют обнаружить типичные изменения стенки кишки (множественные желтоватые бляшки 2–10 мм в диаметре, плотно фиксированные на поверхности слизистой оболочки);
- колоноскопия — помимо типичных изменений кишечной стенки, определяется распространённость процесса и поражение толстого кишечника выше сигмовидной кишки [17] ;
- обзорная рентгенография органов брюшной полости — используется, чтобы выявить признаки пареза кишечника и токсического расширения кишки;
- анализ крови — показывает уровень лейкоцитов (при ПМК повышен до 10–50 × 10 9 ), уровень креатинина (выше нормы) и альбумина (ниже нормы).
Гистологическое исследование биоптатов не является необходимым при C. difficile-ассоциированной болезни, но может быть крайне важным для дифференциальной диагностики.
Лечение псевдомембранозного колита
Методы лечения псевдомембранозного колита в российских и зарубежных клинических рекомендациях совпадают [1] [18] . При лёгком и среднетяжёлом течении его проводят в амбулаторных условиях (дома), при тяжёлом и/или осложнённом — в стационаре.
Для лечения ПМК назначаются антибиотики:
Антибиотики подавляют развитие C. diff. Бактерия чувствительна только к трём перечисленным антибактериальным препаратам.
При развитии осложнений ПМК могут применяться следующие методы:
- При токсическом мегаколоне показана колэктомия — удаление толстой кишки.
- Для лечения рецидивирующего ПМК в качестве экспериментального метода рассматривается трансплантация кишечной микробиоты (fecal microbiota transplantation, FMT) [23][24][25] . Кишечную микробиоту берут от здорового донора и при помощи назоинтестинального зонда, клизмы или колоноскопии переносят пациенту в кишечник. В России такое лечение считается экспериментальным. Проводится в научных клинических учреждениях, например в Федеральном научно-клиническом центре ФМБА России.
В качестве вспомогательных и симптоматических препаратов используются:
- Сорбенты (Диоктаэдрический смектит) — эффективно удаляет токсины C. diff, снижая их действие на кишечную стенку, улучшает качество стула.
- Пробиотики (Lactobacillus rhamnosus, Bifidobacterium longum, Bifidobacterium bifidum, Bifidobacterium infantis не менее 1×10 9 КОЕ/г) — подавляют активность C. diff. Данные об их эффективности пока противоречивы [22] .
- Препараты на основе дрожжей Saccharomyces cerevisiae (boulardii) — эффективны как вспомогательные и профилактические средства.
Прогноз. Профилактика
При лёгком или среднетяжёлом течении ПМК и хорошей реакции на стандартную терапию прогноз благоприятный, при тяжёлом и осложнённом — неблагоприятный. При рецидивирующем течении прогноз сомнительный, так как не разработаны эффективные схемы лечения.
Профилактика псевдомембранозного колита
Для профилактики развития ПМК следует:
- чаще мыть руки и соблюдать правила личной гигиены;
- рационально принимать антибиотики — строго по назначению врача с соблюдением всех указаний;
- изолировать пациентов с инфекцией C. diff в отдельные палаты, соблюдать меры санитарного режима;
- тщательно обрабатывать все поверхности хлорсодержащими или другими дезинфицирующими средствами, активными против спор C. diff;
- сокращать сроки госпитализации пациентов старше 65 лет [16] .
Чтобы предотвратить рецидив C. difficile-ассоциированной болезни, после завершения лечения Метронидазолом или Ванкомицином назначаются пробиотики курсом не менее трёх месяцев. Серьёзных побочных эффектов от них не выявлено [34] .
Читайте также:
