Влияние иммунофенотипа на прогноз миелодиспластического синдрома (МДС)
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
Когда ставят диагноз "миелодиспластический синдром", то всегда помнят о том, что существует множество других болезней, способных ухудшить кровь и изменить костный мозг: это хронические инфекции (туберкулез, токсоплазмоз…), аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит…), разнообразные опухоли. Вот почему пациента нужно всесторонне обследовать, а МДС является, скорее, диагнозом исключения, то есть его ставят тогда, когда все другие причины изменения крови исключены. МДС – болезнь пожилых, средний возраст пациентов составляет 70 лет.
Всем клеткам крови человека дает начало стволовая клетка. По мере взросления ее потомков выделяются 3 основных ветви, или ростка: красный росток (эритроидный), белый росток (лейкоцитарный) и тромбоцитный (тромбоцитарный). И хотя ростков всего три, весь процесс кроветворения очень сложен и многогранен. Воспроизводство крови подобно «оркестру», который в течение всей жизни человека, подстраиваясь под нужды организма, играет, тем не менее, по очень точным и сложным нотам.
Термин «миелодиспластический» состоит из трех частей: «миело-» – греческая приставка, обозначающая связь с костным мозгом, «дис-» – приставка, обозначающая «нарушение», и «-плазия» – конечная часть сложных слов, обозначающая «развитие». Термином «синдром» называют совокупность связанных между собой признаков. Таким образом, из самого названия следует, что в организме произошла какая-то поломка, которая привела к тому, что нарушено созревание (развитие) клеток костного мозга. Причины ученым еще предстоит выяснить, но из-за нарушения на тех или иных этапах взросления клеток кровь начинает меняться. Вначале страдает один росток крови, чаще всего эритроидный. У человека постепенно в крови снижается гемоглобин, больной начинает чувствовать слабость, нарастающее недомогание, привычная работа оказывается не по силам, а отдых не приносит облегчения. Это происходит потому, что, когда в крови уменьшается количество гемоглобина (основного переносчика кислорода) и вдыхаемый из воздуха кислород не попадает в органы и ткани, у них начинается кислородное голодание. Пациент чувствует слабость.
Диагноз «миелодиспластический синдром» (МДС) поставить довольно сложно. Здесь лечащий врач, как никогда, нуждается в помощи врачей-лаборантов: цитолога и цитогенетика с хорошей лабораторией. Врач-цитолог, глядя в микроскоп, тщательно анализирует костный мозг, капелька которого нанесена на специальное маленькое стекло и делает заключение о том, есть ли внешние признаки нарушения работы костного мозга. Этот метод относится к одному из самых технически простых, однако специалистов-цитологов, способных выявить и оценить «неправильные» клетки, в городе очень мало. Врач-цитогенетик с помощью сложной аппаратуры анализирует делящиеся клетки костного мозга и ищет типичные изменения в генах, которые очень важны для диагноза, прогноза, выбора лечения и контроля за ним.
Когда ставят диагноз МДС, то всегда помнят о том, что существует множество других болезней, способных ухудшить кровь и изменить костный мозг: это хронические инфекции (туберкулез, токсоплазмоз…), аутоиммунные заболевания (системная красная волчанка, ревматоидный артрит…), разнообразные опухоли. Вот почему пациента нужно всесторонне обследовать, а МДС является, скорее, диагнозом исключения, то есть его ставят тогда, когда все другие причины изменения крови исключены. МДС – болезнь пожилых, средний возраст пациентов составляет 70 лет.
Чем же опасен миелодиспластический синдром, кроме низкого гемоглобина? Одним из самых неприятных и опасных следствий является постепенное накапливание поломок в кроветворении, поскольку первая поломка в зрелых клетках «тянет» за собой другие поломки и уже в более молодых клетках. Со временем заболевают все более и более активные клетки, и возникает болезнь «острый лейкоз». Наблюдая за пациентами, а также анализируя картину их болезни, врачи научились примерно предсказывать его появление. Риск перехода МДС в острый лейкоз записывают специальными прогностическими индексами (IPSS, WPSS и другими), которые обычно указывают в диагнозе.
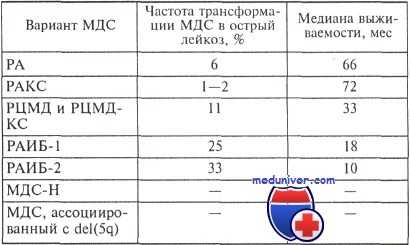
Миелодисплатический синдром существует в нескольких видах:
Мировая статистика показывает, что в зависимости от разных факторов пациенты с МДС живут от одного-двух месяцев до нескольких лет.
Влияние иммунофенотипа на прогноз миелодиспластического синдрома (МДС)
Иммунофенотипирование при миелодиспластических синдромах - маркеры МДС
Как показали многочисленные исследования, при миелодиспластических синдромах нарушается иммунофенотип клеток гранулоцитарного и моноцитарного ростков. Изменяется нормальный антигенный статус гранулоцитов: появляется аномальная экспрессия и исчезают специфичные антигены, однако до настоящего времени не обнаружено каких-либо специфических маркеров миелодиспластических синдромов.
При миелодиспластических синдромах выявлено увеличение числа гранулоцитов со сниженной экспрессией мембранного рецептора CD11b/CD18 по сравнению со здоровыми лицами; большое число случаев отсутствия экспрессии гранулоцитами CD64 (до 66 %), экспрессия гранулоцитами антигенов лимфоидных клеток (до 38 %), низкая экспрессия CD71 гликофорин-А-позитивными эритроидными предшественниками. У больных миелодиспластическими синдромами было обнаружено снижение экспрессии нейтрофилами антигена CD43, участвующего в регуляции их адгезии и пролиферации.
Экспрессия этого антигена характеризовалась прямой связью с экспрессией CD53 и CD 44 и обратной связью с CD11b, CD18, CD35, CD67 и CD69.
Иммунофенотипирование бластных клеток часто вызывает трудности в связи с их небольшим числом. Исследование с использованием специального Метода накопления бластных клеток показало, что почти у всех больных МДС (116 пациентов, включая все ФАБ-варианты МДС и 21 случай развития ОМЛ из МДС) бластные клетки костного мозга характеризовались иммунофенотипом коммитированных миелоидных предшественников (CD34+, CD38+, HLA-DR+, CD13+, CD33+). В этих случаях миелопероксидаза не обнаруживалась у 58 % больных.

Бластные клетки также экспрессировали антигены более зрелых форм нейтрофилов (CD15 и CD11b в 64 и 48 % случаев соответственно). Случаи экспрессии Т-клеточных антигенов CD2 и CD5 были единичными, в то время как CD4 и CD7 экспрессировались значительно чаще (у 47 и 34 % больных). Экспрессия бластными клетками CD19 и CD20 (В-клеточные антигены) отсутствовала, a CD10 определялась у 19 % больных. В 27 % случаев бластные клетки экспрессировали CD56 (ЕК-ассоциированный антиген).
Данная работа представляет несомненный интерес, поскольку, во-первых, ставит под сомнение прогностическую значимость экспрессии антигенов CD34 и HLA-DR, которые, по данным авторов, определялись в 97 и 100 % случаев соответственно.
Во-вторых, проведенный анализ указывает на то, что бластные клетки при миелодиспластических синдромах (МДС) зачастую относятся к более ранним этапам дифференцировки, чем при ОМЛ (за исключением варианта М0).
Следует отметить, что в настоящее время иммунофенотипирование клеток крови и костного мозга при миелодиспластических синдромах (МДС) может использоваться только в качестве дополнительного дифференциально-диагностического метода.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Неоднозначные данные получены при оценке прогноза миелодиспластического синдрома (МДС) в зависимости от результатов иммунофенотипирования, изучения клеточных культур, апоптоза, ангиогенеза и молекулярно-биологических изменений. Исследования выживаемости на большом клиническом материале нередко отсутствуют, а утверждения о прогностической роли основываются на частоте обнаружения или выраженности исследуемого признака в разных прогностических группах (в основном при «ранних» или «продвинутых» вариантах болезни).
Прогностически неблагоприятным признаком, предвещающим короткую продолжительность заболевания и высокую частоту трансформации в острый лейкоз, является высокая экспрессия антигена CD34. По данным D. Guyotat и соавт., при однофакторном анализе прогностическое значение имела экспрессия антигенов CD34 и CD33, однако при многофакторном анализе независимым неблагоприятным фактором была только экспрессия CD34. При иммуногистохимическом исследовании трепанобиоптатов достоверно большее число CD34+-клеток обнаружено при РАИБ по сравнению с РА, при РАИБ-Т по сравнению с РАИБ и при ОМЛ, развившемся из МДС, по сравнению с РАИБ-Т.
Существуют и другие ангигены, имеющие прогностическое значение. Показано, что при увеличенном числе клеток, экспрессирующих антиген HLA-DR, вероятный срок трансформации МДС в ОЛ у 50 % больных составляет 16 нед, а у HLA-DR-негативных больных —88 (р = 0,004). При низкой экспрессии CD11b (менее 53 % клеток костного мозга) этот показатель составляет 29 нед, а при высокой — 160. У 50 % больных с двумя указанными неблагоприятными факторами вероятный срок лейке-мической трансформации составляет 13 нед, а при их отсутствии — 88 (р = 0,017).
Прогностическое значение ФАБ-вариантов миелодиспластических синдромов (МДС)
Имеются данные о неблагоприятном прогностическом значении в отношении трансформации в острый лейкоз экспрессии антигенов CD56, CD25 или CD16. Отмечено, что популяция клеток с аберрантным иммунофенотипом CD34+, CD15+, HLA-DR- достоверно чаще обнаруживается при «продвинутых» ФАБ-вариантах. Многофакторный анализ, проведенный К. Ogata и соавт., показал негативное значение экспрессии бластными клетками CD7 в отношении выживаемости и вероятности трансформации в ОЛ, а также фенотипа бластных клеток CD7+ и CD15- в отношении выживаемости.
По данным многочисленных исследований, выраженность апоптоза при миелодиспластических синдромах (МДС) особенно при «ранних» вариантах, выше, чем при ОМЛ. Кроме того, имеются указания об обратной корреляции числа CD34+-клеток, находящихся в процессе апоптоза, и прогностическими группами IPSS. Повышенная экспрессия CD34+-клетками проапоптотических белков (ВАК, BAD, BCL-XS) связана с длительной продолжительностью жизни и низкой степенью риска лей-кемической трансформации, в то время как повышенная экспрессия антиапоптотических белков (BCL-2, BCL-XL) ассоциирована с низкой выживаемостью.
Прогностическое значение ВОЗ-вариантов миелодиспластических синдромов (МДС)
При изучении костного мозга больных миелодиспластическими синдромами (МДС) в динамике отмечено увеличение экспрессии BCL-2 ранними миелоидными предшественниками при лейкемической трансформации. У больных РА выявлен достоверно более высокий уровень TNF-a, чем у пациентов с РАИБ и РАИБ-Т. Влияние экспрессии антигена CD95 (Fas/APO-1) на прогноз остается малоизученным. По данным D. Bouscary и соавт., у больных МДС выявлена более высокая экспрессия CD95 ядросодержащими клетками костного мозга по сравнению с контрольной группой здоровых лиц.
Корреляция между экспрессией CD95 и ФАБ-вариантами отсутствовала, однако была обнаружена достоверная обратная связь с числом бластных клеток костного мозга, что позволило предположить утрату бластными клетками CD95 во время прогрессирования миелодиспластического синдрома (МДС). По нашим наблюдениям, основанным на результатах анализа небольшой группы больных, при отсутствии экспрессии антигена CD95 (Fas/APO-1) на клетках костного мозга имеется тенденция к короткой продолжительности жизни и быстрому развитию острого лейкоза. Таким образом, гипотетическим прогностически неблагоприятным фактором в отношении трансформации миелодиспластического синдрома (МДС) в ОМЛ может являться уменьшение апоптоза лейкемических клеток.
Миелодиспластический синдром
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Общие сведения
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов. В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% - нейтропения и лейкопения. У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Прогноз миелодиспластических синдромов (МДС) - значение кариотипа
Миелодиспластические синдромы гетерогенны по продолжительности жизни и вероятности трансформации в острый лейкоз. Прогноз течения миелодиспластического синдрома (МДС) определяется как особенностями биологии заболевания, возрастом больного, его общим состоянием, наличием сопутствующих заболеваний, так и выбором терапии.
Вполне понятно, что при использовании разных препаратов или схем лечения миелодиспластического синдрома (МДС) выявлены различные прогностические факторы, влияющие на успех терапии. В связи с этим в работах, направленных на поиск прогностической роли клинико-лабораторных симптомов миелодиспластического синдрома (МДС), используются выборки больных, получавших либо только симптоматическую терапию, либо лечение, которое не влияет на продолжительность жизни и вероятность трансформации заболевания в ОМЛ.
Среди клинических признаков прогностическое значение имеют пол и возраст. Продолжительность жизни больше у больных моложе 60 лет и у женщин. На вероятность трансформации в острый лейкоз пол и возраст влияния не оказывают. Отрицательную прогностическую роль играет наличие симптомов интоксикации. Особенно короткая выживаемость отмечена при вторичных миелодиспластических синдромов (МДС) (5— 7 мес).
Среди показателей крови к неблагоприятным прогностическим факторам относятся: анемия, нейтропения и тромбоцитопения. Негативное влияние на течение миелодиспластического синдрома (МДС) оказывает не только наличие цитопении разной степени выраженности, но и ее характер (одно-, двух- или трехростковый). Трехростковая цитопения рассматривается как несомненно неблагоприятный признак. К неблагоприятным прогностическим признакам относится наличие в крови 5 % и более бластных клеток, нормоцитов и молодых форм нейтрофилов, а также повышенный уровень ЛДГ.
Среди показателей костного мозга наиболее прогностически значимым считается число бластных клеток. Показано, что при числе бластных клеток более 10 % прогноз хуже, чем при их количестве 5— 10 %. Негативное прогностическое значение имеет большое число пельгероидных форм гранулоцитов и микроформ мегакариоцитов, наличие в трепанобиоптате скоплений бластных клеток, фиброза костного мозга, АЛМП.
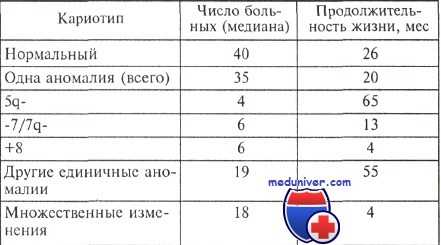
Продолжительность жизни больных миелодиспластическим синдромом с различными изменениями кариотипа
По данным G. Tricot и соавт., в группе больных с числом бластных клеток в миелограмме менее 5 % с выявленной АЛМП медиана выживаемости составила 14 мес, в то время как при отсутствии АЛМП — 49 мес. Некоторые авторы считают, что при низкой клеточности трансформация в острый лейкоз наступает реже и выживаемость больных выше. В исследовании A. Georgii и соавт. при гипопластическом варианте миелодиспластического синдрома (МДС) медиана выживаемости составила 18,6 мес., при других вариантах — 15,4 мес.
Существенное значение для прогноза имеют изменения кариотипа. К прогностически благоприятным факторам относятся нормальный кариотип, а также изолированные аберрации 5q-, 20q- и -Y. Пациенты с таким кариотипом составляют 70 % среди больных миелодиспластическими синдромами (МДС). Неблагоприятными хромосомными изменениями являются аномалии хромосомы 7 или ее утрата и комплексные хромосомные изменения. Подобные изменения, по данным Международной системы числовой оценки прогноза при миелодиспластическом синдроме (IPSS), встречаются у 16 % больных.
Другие изменения кариотипа имеют промежуточное прогностическое значение (14 %).
Читайте также:
