Возрастной фактор атеросклероза. Влияние тиреоидных гормонов на сосуды
Добавил пользователь Валентин П. Обновлено: 20.01.2026
Гипотиреоз - симптомокомплекс изменений со стороны различных органов и систем, обусловленный снижением уровня тиреоидных гормонов.
Качество же жизни пациентов с гипотиреозом, постоянно получающих заместительную терапию левотироксином, незначительно отличается о такового для лиц без гипотиреоза. Сам гипотиреоз становится для пациента образом жизни, а не заболеванием.
Однако при отсутствии своевременного адекватного лечения гипотиреоза возрастает опасность развития осложнений. Гипотиреоидная кома (ГК) - это редкое, угрожающее жизни осложнение гипотиреоза. В первую очередь развивается у пожилых пациентов долгое время не- или плохо леченных. Пациенты с ГК умирают преимущественно от дыхательной и сердечной недостаточности, в некоторых случаях - от тампонады сердца. Даже при своевременно начатой энергичной терапии 40% больных погибают.
Клинические симптомы гипотиреоза
Клинические симптомы гипотиреоза развиваются у больного с постепенным нарастанием. Наиболее часто гипотиреоз характерен для пациентов, оперированных на щитовидной железе (первичный послеоперационный гипотиреоз).
Врач должен заподозрить наличие у пожилого больного синдром гипотиреоза и провести определение уровня тиреотропного гормона (ТТГ) в сыворотке крови в том случае, если пациент имел какое-либо заболевание щитовидной железы в анамнезе или получал лекарства, которые могут провоцировать развитие гипотиреоза. Кроме того, наличие запоров, резистентных к обычному лечению, кардиомиопатии, анемии неясного генеза, деменции, должно быть причиной исключения гипотиреоза у пожилого больного.
Лабораторная диагностика
Лабораторными параметрами для диагностики гипотиреоза являются определение базального (не стимулированного) ТТГ и показателей свободных Т4 и Т3. Нормальный базальный уровень ТТГ исключает гипотиреоз. При повышенном базальном ТТГ диагноз подтверждают обнаружением пониженных концентраций свободных Т4 и Т3.
Ошибки диагностики гипотиреоза
Диагноз гипотиреоза зачастую бывает несвоевременным, так как в начальной его стадии выявляемые симптомы крайне неспецифичны. Кроме того, синдром гипотиреоза может имитировать различные нетиреоидные заболевания, что связано с полиорганностью поражений, обнаруживаемых в условиях дефицита гормонов щитовидной железы. Очень часто проявления гипотиреоза у пожилых людей рассматриваются врачом и пациентом как признаки нормального старения. Действительно, такие симптомы, как сухость кожи, алопеция, снижение аппетита, слабость, деменция и др., аналогичны проявлениям процесса старения. Типичные симптомы гипотиреоза выявляются только у 25-50% пожилых людей, остальные же имеют либо крайне стертую симптоматику, либо гипотиреоз клинически реализован в виде какого-либо моносимптома.
Клиническая диагностика
| Клинические симптомы гипотиреоза | |
| Общие симптомы Усталость, утомляемость, слабость Увеличение массы тела, зябкость Сердечно-сосудистые симптомы Синусовая брадикардия Сердечная недостаточность Кардиомегалия Перикардит Артериальная гипотония или парадоксальная гипертония Органы дыхания Дыхательная недостаточность, гиперкапния Кожа и ее производные Сухость кожи, выпадение волос Утолщение ногтей Выпадение латеральных частей бровей Окраска кожи бледная с желтоватым оттенком Нервная система Апатия, сонливость, нарушение концентрации внимания Ухудшение памяти Депрессивные психозы Ступор и кома Гипорефлексия | Костно-мышечная система Мышечная слабость Мышечная атрофия Нарушение скелетообразования у детей Желудочно-кишечный тракт Отсутствие аппетита Запоры, мегаколон, илеус Половые органы У женщин: нарушение цикла по типу аменореи или меноррагии Бесплодие У мужчин: отсутствие либидо, снижение потенции, гинекомастия Обмен веществ Снижение основного обмена Увеличение массы тела, ожирение Высокий холестерин, гипогликемия Задержка жидкости с увеличением объема языка, отеки лица, особенно век Лабораторные данные Гипонатриемия Анемия Повышение уровня креатинкиназы Щитовидная железа Зоб или его отсутствие |
Гипотиреоидная кома
Разрешающими факторами являются тяжелые сопутствующие заболевания, операции, травмы, прием седативных препаратов и наркотиков, а также переохлаждение.
Основу патогенеза ГК составляет альвеолярная гиповентиляция с последующей гипоксией жизненно важных органов, следствием чего является снижение температуры тела, брадикардия и гипогликемия. При несвоевременном оказании помощи возможен летальный исход. Летальность при ГК составляет от 60 до 90%.
У пациента усиливаются все симптомы гипотиреоза. Выражены сонливость, дезориентация, коматозное состояние. Температура тела снижена до 34-35 ° С, возникает брадикардия. Кожные покровы холодные, пастозные.
Основным симптомом ГК является снижение температуры тела. Кома сопровождается прогрессирующими изменениями со стороны ЦНС, угнетением всех типов рефлексов. Изменения со стороны ЦНС ведут к нарастанию брадикардии, снижению артериального давления и гипогликемии.
Нарушения со стороны сердечно-сосудистой системы, развивающиеся у больного с ГК, нередко являются причиной летального исхода. Показатели периферической гемодинамики одними из первых реагируют на изменения концентрации гормонов щитовидной железы. Гипотиреоз сопровождается уменьшением частоты сердечных сокращений (ЧСС). Брадикардия, возникающая при гипотиреозе, обратима при достижении эутиреоза.
Другим эффектом при гипотиреозе является изменение общего периферического сопротивления сосудов (ОПСС). Гипотиреоз вызывает повышение ОПСС, с чем в определенной мере связано развитие диастолической артериальной гипертензии (АГ). Диастолическая гипертензия при гипотиреозе является распространенным явлением. У больных с гипотиреозом и наличием АГ содержание альдостерона и ренина в плазме крови снижено, т.е. диастолическая гипертензия при гипотиреозе носит гипорениновый характер.
Предполагаемыми причинами нарушения вазодилатирующей функции при гипотиреозе являются: снижение генерации вазодилатирующих субстанций и/или резистентность к ним сосудистых гладкомышечных клеток; снижение концентрации предсердного Na-уретического пептида.
Состояние гипотиреоза характеризуется уменьшением числа β-адренорецепторов, с чем связывают более низкую вероятность развития аритмий. Однако установлено, что у лиц с гипотиреозом секреция норадреналина и содержание его в плазме крови повышено. Норадреналин, являясь в основном стимулятором адренорецепторов, может способствовать спазму коронарных артерий.
Гипотиреоз характеризуется снижением сократительной способности миокарда, уменьшением фракции выброса, развитием сердечной недостаточности. Состояние гипотиреоза также сопровождается пролонгацией диастолы, увеличением времени изоволюметрической релаксации левого желудочка.
Лечение гипотиреоза
Поскольку ГК является результатом либо отсутствия лечения гипотиреоза, либо проведения неадекватной терапии данного синдрома и представляет собой крайне тяжелое состояние с высокой летальностью, врач любой специальности должен иметь представление об алгоритмах терапии гипотиреоза и используемых для этого препаратах.
Очень важно вовремя распознать гипотиреоз, который возможно диагностировать всего лишь по одному показателю гормонального анализа - ТТГ, и назначить заместительную терапию Эутироксом. Его отличием от других препаратов тиреоидных гормонов является возможность с легкостью подобрать нужную дозировку - 25,50,75,100, 125 или 150 мкг, что существенно облегчает проведение заместительной терапии гипотиреоза.
Режим дозирования лекарственного препарата
ЭУТИРОКС (левотироксин натрий)
Устанавливают индивидуально в зависимости от показаний, эффекта лечения и лабораторных данных. Всю суточную дозу принимают 1 раз/сут утром, не менее чем за 30 мин до завтрака и запивают жидкостью.
При гипотиреозе в начале лечения назначают в дозе 50 мкг/сут. Дозу увеличивают на 25-50 мкг каждые 2-4 недели до достижения признаков эутиреоидного состояния.
У больных с длительно существующим гипотиреозом, микседемой и, особенно, в случаях, когда имеются заболевания сердечно-сосудистой системы, начальная доза препарата должна составлять не более 25 мкг/сут. У большинства пациентов эффективная доза не превышает 200 мкг/сут. Отсутствие адекватного эффекта при назначении 300 мкг/сут свидетельствует о мальабсорбции либо о том, что пациент не принимает назначенную дозу Эутирокса. Адекватная терапия обычно приводит к нормализации уровня тиреотропного гормона и тироксина (Т4) в плазме через 2-3 недели лечения.
Представлена краткая информация производителя по дозированию лекарственных средств у взрослых. Перед назначением препарата внимательно читайте инструкцию.
Лечение ГК
Основная задача лечения ГК - восстановление нормальных физиологических функций всех органов и систем, нарушенных вследствие гипотиреоза. Критерием адекватности лечения служит исчезновение клинических и лабораторных проявлений гипотиреоза.
Тяжесть и длительность гипотиреоза являются основными критериями, определяющими тактику врача в момент начала лечения.
Чем тяжелее гипотиреоз и чем дольше он не был компенсирован, тем выше будет общая восприимчивость организма к тиреоидным гормонам, особенно это относится к кардиомиоцитам.
Основные лечебные мероприятия при ГК:
- 1. Заместительная терапия препаратами тиреоидных гормонов (левотироксин).
2. Применение глюкокортикоидов.
3. Борьба с гиповентиляцией и гиперкапнией, оксигенотерапия.
4. Устранение гипогликемии.
5. Нормализация деятельности сердечно-сосудистой системы.
6. Устранение выраженной анемии.
7. Устранение гипотермии.
8. Лечение сопутствующих инфекционно-воспалительных заболеваний и устранение других причин, которые привели к развитию комы.
Лечение ГК проводится в специализированном реанимационном отделении и направлено на повышение уровня тиреоидных гормонов, борьбу с гипотермией, устранение сердечно-сосудистых и нервно-вегетативных нарушений.
В основу лечения ГК положен принцип максимального введения тиреоидных гормонов, в первую очередь левотироксина, через зонд либо капельно, либо внутримышечными инъекциями.
Потребность в левотироксине увеличивается во время беременности. Оценка функции щитовидной железы у беременных женщин, подразумевающая исследование уровня ТТГ и свободного Т4, целесообразна в каждом триместре беременности. Доза препарата должна обеспечивать поддержание низконормального уровня ТТГ.
У женщин с гипотиреозом в постменопаузе, которым назначается заместительная терапия эстрогенами, для поддержания нормального уровня ТТГ может понадобиться увеличение дозы левотироксина.
Возрастной фактор атеросклероза. Влияние тиреоидных гормонов на сосуды
Объясняя влияние возрастного фактора на развитие атеросклероза, Danowski и Cambell (1962) пытаются связать это с состоянием функции щитовидной железы, приводя интересные фактические данные о постепенном снижении функции щитовидной железы в более пожилых возрастных группах. Параллельно со снижением функционального состояния щитовидной железы происходит повышение уровня холестерина и бета-липопротеидов.
Было установлено, что поглощение J131 и уровень PBJ у пожилых людей ниже, чем у молодых. У стариков вес щитовидной железы значительно ниже и нередко в железе наблюдается фиброз.
У больных микседемой наблюдаются нарушения липидного обмена, характерные для атеросклероза. Помимо повышения уровня холестерина и снижения фосфолипидов, многие авторы указывают также на повышение уровня липонротеидов и триглицеридов (Malmros и Swahn, 1953; Danowski, 1963).
Аналогичные результаты были получены И. Е. Ганелиной с сотрудниками (1964). По их данным, уровень холестерина у больных гипотиреозом в большинстве случаев превышал 260 мг%, доходя до 400 мг%. Также значительно оказались повышенными бета-липопротеиды и триглицериды.
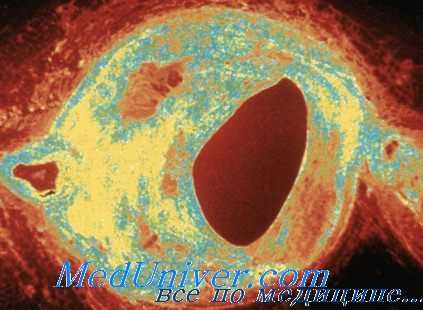
Наряду с этим в литературе имеется описание ряда случаев тяжелого гипотиреоза, протекавшего с нормальным уровнем холестерина. Совершенно очевидно, что вопрос о выраженности атеросклероза нельзя решать на основании изменений показателей липидного обмена. Более достоверными являются данные патологоанатомов, большинство из которых описывают тяжелые проявления атеросклероза у больных, погибших от гипотиреоза (Douglass и Jacobson, 1957; Bansi, 1955; Kountz, 1950).
Большое значение в развитии атеросклероза у больных гипотиреозом имеют дегенеративные изменения сосудистой стенки, ведущие к повышенной ее проницаемости.
Известную роль в повреждающем действии на сосудистую стенку играет тиреотроппый гормон, который повышенно секретируется при гипотиреозе. Как показали наблюдения Asboe-Hansen и Iversen (1951), Uotila с соавт. (1961), тиреотропный гормон повреждает соединительную ткань сосудистой стенки путем активации действия гиалуронидазы, что может способствовать более быстрому развитию атеросклероза.
На основании литературных данных можно прийти к заключению, что если в отношении влияния гормонов щитовидной железы на обмен липидов данные довольно определенны и однородны, то в отношении роли щитовидной железы в качестве фактора, препятствующего развитию атеросклероза, имеется еще много противоречий и неясностей.
Несмотря на благоприятное влияние тиреоидных гормонов на обмен липидов, повышенная продукция этих гормонов или усиленное введение их могут оказать повреждающее воздействие на сосудистую стенку. Необходимо иметь в виду, что влияние тиреоидных гормонов на сердечно-сосудистую систему осуществляется через посредство катехоламинов, содержание которых в сердечной мышце увеличивается под влиянием раздражения симпатикуса. Сердечная мышца обладает способностью накапливать катехоламины, в частности норадреналин. Катехоламины оказывают также влияние и на обменные процессы и на состояние сосудистой стенки.
За последнее время установлено, что парентеральное введение адреналина влечет за собой повышение содержания свободных жирных кислот и фосфолипидов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Гормональные причины атеросклероза. Теория А. Л. Мясникова коронарного атеросклероза
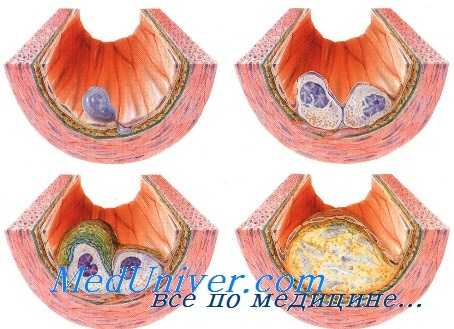
Несмотря на интенсивное изучение вопросов патогенеза атеросклероза, эту проблему до сих пор еще нельзя считать окончательно разрешенной. Из многочисленных факторов, принимающих участие в развитии атеросклеротического процесса, основными надо считать нарушения обменных процессов и изменения состояния сосудистой стенки — ее проницаемости.
Выдвинутая Л. Л. Мясниковым (1965) нервно-метаболическая теория патогенеза атеросклероза рассматривает это заболевание как следствие нарушения регуляции как липидного обмена, так и состояния сосудистой стенки, объединяя единой причиной оба патогенетических фактора.
Нарушения обменных процессов, несомненно, имеют очень большое значение, однако они не ограничиваются только изменениями холестеринового и всего жирового метаболизма, но почти, как правило, сопровождаются выраженными нарушениями белкового и углеводного обменов.
Роль нарушений липидного обмена в развитии атеросклероза не вызывает сомнений, но механизм проникания холестерина в сосудистую стенку еще далеко не ясен. По-видимому, немаловажное значение в этом процессе имеет состояние самой стенки сосуда, в частности ее эндотелия.
С помощью меченого холестерина было доказано, что эндотелий сосудов обладает способностью захватывать холестерин из эмульсии (Smith, 1965). Имеется также указание, что сосудистая стенка самостоятельно синтезирует холестерин.
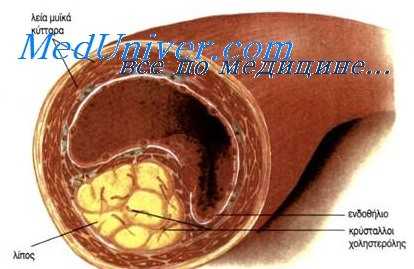
Watts с соавторами (1963) впервые указал на участие митохондрий клеток сосудистой стенки в процессе отложения холестерина при экспериментальном атеросклерозе. Smith с соавторами (1966) подтверждает эти данные и высказывает предположение о нарушении ферментативной активности митохондрий, в связи с чем нарушается внутриклеточный метаболизм холестерина и митохондрии превращаются в мешочки, наполненные жиром. Предполагается, что в этих случаях нарушается преимущественно активность липо-литических ферментов.
Большой интерес представляют экспериментальные наблюдения А. Л. Мясникова и его сотрудников (1965), установивших повреждающее сосудистую стенку действие гиперхолестеринемической сыворотки. Добавляя гнпсрхолестеринемическую сыворотку к культурам тканей (стенка аорты), авторы установили выраженные дегенеративные изменения и пролиферацию клеток интимы, тогда как добавление к культурам чистого холестерина вызывает только дегенерацию и гибель клеток.
А. Л. Мясников высказывает предположение о возможном стимулирующем пролиферацию клеток действии глобулиновых фракций гиперхолестеринемической сыворотки.
Имбибиция сосудистой стенки холестерином возможна только при повышении ее проницаемости. Весьма существенное значение в изменении проницаемости сосудистой стенки имеет содержание в ней кислых мукополисахаридов, которых особенно много в интиме сосудов. Считается, что кислые мукополисахариды предохраняют эластические элементы сосудистой стенки от лизиса при действии ферментов (эластазы). Laszt (1964) указывает, что изменения в содержании кислых мукополисахаридов в сосудистой стенке играют определенную роль в развитии некоторых видов сосудистой патологии.
За последние годы установлено, что сосуды обладают собственным активным метаболизмом, изменения которого, в особенности нарушение кислородного обмена, могут влиять на проницаемость сосудов. Оба фактора, как процессы метаболизма, так и состояние сосудистой стенки, находятся под постоянным контролем и регулирующим воздействием нервной и эндокринной системы.
Известно, что нервно-эмоциональные напряжения способствуют развитию атеросклероза коронарных артерий. Расстройства нервной регуляции липидного обмена влекут за собой также и эндокринные нарушения, в связи с чем меняется нормальная ассимиляция пищевых жиров. Некоторые гормоны оказывают непосредственное воздействие и на общие процессы метаболизма и на обмен веществ в самой сосудистой стенке, благодаря чему может нарушиться ее проницаемость в отношении ряда веществ, инфильтрирующих ее.
Декстро-трийодтиронин при атеросклерозе. Влияние половых гормонов на обмен холестерина
Из препаратов, подвергшихся клиническому испытанию, необходимо упомянуть о декстро-трийодтиронине. Изучая его действие у больных коронарным атеросклерозом с высоким уровнем холестерина в крови (выше 300 мг%) в течение длительного периода его применения (40 недель), Brown с соавторами (1962) наблюдал значительное снижение всех липидных компонентов (холестерина, фосфолипидов, триглицеридов), однако в ряде случаев этот препарат вызывал приступы стенокардии в связи с повышением потребления кислорода сердечной мышцей.
Все авторы, применявшие тиреоидные препараты, указывают на необходимость очень длительного (в течение многих месяцев) их применения. Несмотря на значительно менее выраженное побочное действие d-изомера, все же и этот препарат в ряде случаев провоцирует приступы стенокардии и тахикардии. Oliver и Boyd считают, что из всех имеющихся тиреоидных препаратов только d-тироксин может быть рекомендован к практическому применению.
В 1960—1962 гг. наблюдалось некоторое увлечение в применении тиреоидных гормонов для лечения атеросклероза. Danowsky и Cambell (1962) считают вполне показанным применение этих гормонов даже с профилактической целью, так как, по их мнению, такая терапия «омолаживает» липидный состав крови. Однако вопрос этот еще нельзя считать окончательно разрешенным, так как действие всех до сих пор предложенных тиреоидных препаратов направлено в основном на снижение уровня холестерина в крови, хотя этот фактор не является единственным и ведущим в патогенезе атеросклероза.
На другой, не менее важный, патогенетический механизм — на состояние сосудистой стенки — тиреоидные гормоны могут оказать даже отрицательное влияние, поэтому вполне понятны и обоснованы поиски других путей гормональных воздействий.
В некотором кажущемся теоретическом противоречии стоят попытки подавления функции щитовидной железы при лечении больных коронарной недостаточностью на почве атеросклероза. Теоретическим обоснованием этого воздействия является подавление активности катехоламинов, усиливающих потребление кислорода сердечной мышцей. Естественным возражением против такой терапии является возможность повышения уровня холестерина в крови. Однако эти возражения не имеют под собой фактической базы.
Рядом авторов (И. М. Гянджа, Б. Э Тартаковский и Н. И. Ковалева, 1965) был использован J131 для угнетения функции щитовидной железы у больных коронарным атеросклерозом. Авторы наблюдали значительное улучшение общего состояния и ЭКГ-показателей через 2—3 месяца после начала терапии. Уровень холестерина у этих больных не только не повышался, но даже имел тенденцию к снижению.
Много работ за последнее время было посвящено изучению влияния половых гормонов, в особенности эстрогенов, на обмен холестерина. Механизм их влияния пока еще окончательно не установлен, но имеются указания, что женские половые гормоны угнетают синтез холестерина. Большинство авторов указывает, что эстрогены оказывают нормализующее действие на холестериново-лецитиновый индекс.
Boas с соавт. (1954) установил, что при кастрации самок кроликов развивается эндогенная гиперхолестеринемия. Те же данные были получены в экспериментальной работе X. X. Мансурова (1953). Экспериментальные данные получили полное подтверждение и при клинических наблюдениях. Так, Я. Д. Рафальский установил, что у женщин после операции удаления яичников значительно повышается уровень холестерина и бета-липопротеидов в крови, повышение уровня липидов отмечает также Ваrr (1953) у женщин в климактерическом периоде. Введение эстрогенов в этих случаях приводит к снижению липемии.
Кардиоваскулярные аспекты действия половых гормонов и их клиническое значение в постменопаузе
Постменопауза у женщин ассоциирована с повышением частоты сердечно-сосудистых заболеваний (ССЗ). Эстрогены оказывают многофакторное протективное влияние на разные компоненты сердечно-сосудистой системы, при возрастном снижении уровня эстрогенов процессы формирования ССЗ ускоряются. Этот обзор посвящен современным представлениям о механизмах влияния эндогенных и экзогенных эстрогенов на сердечно-сосудистую систему, а также участию прогестагенного компонента в формировании кардиоваску-лярных рисков.
Ключевые слова: сердечно-сосудистые заболевания, постменопауза, заместительная гормональная терапия.
Cardiovascular aspects of sexual hormones action and their clinical value In a postmenopause
IAJlovayskaya
Summary
The postmenopause at women is associated with of increasedfrequency of cardiovascular diseases (CVD). Estrogens make multifactorial protective impact on various components of cardiovascular system, and age-dependent estrogen levels depression accelerate the pathogenesis of CVD. This review is devoted to modern ideas of mechanisms of endogenous and exogenous estrogens influence on cardiovascular system, and also to participation of a pro-gestagene component in formation of cardiovascular risks.
Key words: cardiovascular diseases,postmenopause, hormonal replacement therapy.
Внастоящее время широко известно, что изменения уровней половых гормонов, которые происходят в течение жизни женщины, модулируют разные заболевания в том или ином возрастном периоде. Это касается в первую очередь уровня эстрогенов и их влияния на сердечно-сосудистую, центральную нервную и костную системы. В репродуктивном возрасте у женщин отмечается невысокий риск сердечно-сосудистых заболеваний (ССЗ), однако во многих исследованиях было показано, что после прекращения овари-альной функции частота ССЗ значительно повышается, и именно эти заболевания становятся ведущей причиной смертности у женщин после 50-55 лет. Framingham Study -20-летнее когортное исследование продемонстрировало в рамках одной возрастной группы 2-кратное повышение относительного риска (ОР) ССЗ у женщин в постменопаузе по сравнению с пременопаузой [1]. Менопауза в возрасте до 45 лет (в том числе хирургическая) ассоциирована с еще большим риском развития ССЗ по сравнению с естественной менопаузой [2, 3]. В шведском исследовании у испытуемых одного и того же возраста ОР инфаркта миокарда был выше в постменопаузе по сравнению с пременопаузой и составлял 2,2 для женщин 4 5 лет и менее и 1,4 для женщин 50 лет и менее [4]. В проспективном исследовании Framingham Heart Study у женщин с менопаузой в возрасте до 42 лет, не получавших гормональную терапию, риск инфаркта миокарда был в 2 раза выше по сравнению с женщинами с менопаузой в возрасте после 51 года, при этом повышение риска отмечалось и для естественной, и хирургической менопаузы [5].
В чем же заключается протективное действие эстрогенов на сердечно-сосудистую систему (ССС) и каковы механизмы, определяющие кардиоваскулярные риски? Одной из мишеней эстрогенов является эндотелий сосудов, на который они оказывают прямое влияние [6, 7]. Основным эффектом эстрогенов является выработка эндотелиальными клетками оксида азота, который обладает выраженным ва-зодилатирующим эффектом на периферические сосуды, в том числе и коронарные артерии [8].
Эстрогены контролируют массу жировой ткани в организме и ее распределение, влияют на адипоциты, предотвращая ожирение, стимулируют метаболизм свободных жирных кислот в печени. Известно, что даже в рамках одной возрастной группы содержание общей жировой ткани и висцерального жира больше в постменопаузе по сравнению с пременопаузальным периодом [9]. В ходе 5-летнего наблюдения за 102 женщинами в пременопаузе (средний возраст при включении в исследование 49,9±1,9 года; индекс массы тела - ИМТ - 23,3±2,2 кг/м 2 ) было отмечено статистически значимое увеличение массы жировой ткани и ее процентного содержания, относительного содержания висцерального жира, гликемии натощак [10]. Увеличение ИМТ в ранней постменопаузе рассматривается как один из первых этапов формирования «метаболического синдрома», развитие которого приводит к повышению кардио-васкулярных рисков [11].
Снижение содержания эстрогенов в постменопаузе ассоциировано также с нарушениями липидного спектра: повышением концентрации холестерина, триглицеридов, ли-попротеинов низкой плотности, снижением концентрации липопротеинов высокой плотности 14. Даже в рамках одной возрастной группы у женщин в постменопаузе показатели концентрации липидов значимо выше, чем в перименопаузе [13].
Эстрогены также оказывают влияние на обмен глюкозы и инсулина. Оба вида эстрогеновых рецепторов (ЭР) присутствуют на р-клетках поджелудочной железы, активация ЭРа регулирует биосинтез инсулина, его секрецию и пролифе-ративные процессы клеток островков Лангерганса. Роль ЭРр до сих пор не ясна [15]. Эстрогены подавляют печеночный глюконеогенез, а также оказывают протективное действие на панкреатические р-клетки в условиях оксидатив-ного стресса [16], а в условиях гипоэстрогении снижается чувствительность к инсулину [17], повышается гликемия натощак, запускаются механизмы формирования сахарного диабета типа 2 [18].
Эстрогены оказывают влияние на систему гемостаза. У овариоэктомированных животных в 1,5 раза усиливается адгезивная активность тромбоцитов, и введение эстрогенов снижает агрегацию тромбоцитов [19]. Положительное влияние эстрогенов на сосудисто-тромбоцитарный гемостаз заключается в усилении эндотелиальной продукции простациклина и оксида азота, ингибирующих агрегацию тромбоцитов [20].
Таким образом, эстрогены оказывают непосредственное и опосредованное влияние на разные компоненты ССС через геномные и негеномные эффекты. Снижение уровня эстрогенов в постменопаузе сопровождается липидными нарушениями и эндотелиальной дисфункцией, ускорением процессов атеросклероза, что клинически проявляется увеличением частоты ССЗ. Логично предположить, что восполнение уровня эстрогенов может снижать частоту ССЗ.
Действительно, применение заместительной гормональной терапии (ЗГТ) в пери- и постменопаузе положительно влияет на многие звенья патогенеза ССЗ. В разных исследованиях применение эстрогенов сопровождалось снижением концентраций атерогенных липидов в сыворотке крови [12, 13, 22], а также приводило к увеличению концентрации липопротеинов высокой плотности в сыворотке крови [22] и уменьшению количества абдоминального жира [13]. Метаанализ 107 исследований, посвященных метаболическим изменениями на фоне ЗГТ, показал, что в ходе ЗГТ отмечаются положительные изменения в виде снижения содержания холестерина и атерогенных фракций ли-пидов (в среднем на 16%), а также снижения содержания липопротеина А (в среднем на 25%) [21]. Применение ЗГТ в постменопаузе статистически значимо снижает риск развития сахарного диабета типа 2 [21].
Неужели данные исследований так противоречивы?
При сравнении характеристик пациенток, участвовавших в разных исследованиях (см. таблицу), можно заметить различия в возрасте и вазомоторных проявлениях. Пациентки, у которых отмечено снижение риска ССЗ, были моложе и имели вазомоторные проявления. Женщины, включенные в исследования HERS и WHI, были гораздо старше, и наличие вазомоторных проявлений стало критерием исключения из исследования. Кроме того, в испытание WHI, посвященное первичной профилактике ССЗ, включили 66% женщин старше 60 лет, 56% курили, только у 20% ИМТ был 25 кг/м 2 и менее (34% имели ИМТ>30 кг/м 2 ), 36% получали антигипертензивную терапию, у 13% обнаружен повышенный уровень холестерина, требующий медикаментозной коррекции, и 19% принимали аспирин, т.е. трудно говорить об отсутствии ССЗ в такой когорте пациенток. Данные WHI подвергли более тщательному пересмотру.
Сравнительная характеристика женщин, участвовавших в исследованиях, целью изучения которых стали риски ССЗ на фоне применения ЗГТ
Рандомизированные плацебо-контролируемые исследования
Средний возраст, лет
Время после менопаузы, лет
Есть (HERS)/нет* (WHI)
*См. пояснения в тексте.
При более внимательном анализе результатов WHI оказалось, что частота ССЗ на фоне ЗГТ зависит от возраста женщин и времени, прошедшего после менопаузы: при начале терапии в 50-59 лет в период до 10 лет после менопаузы отмечается уменьшение случаев ССЗ (из расчета на 10 тыс. женщин в год на фоне комбинированной эстроген-гестагенной терапии на 4 события и монотерапии эстрогенами на 14 случаев), но число случаев возрастает при назначении ЗГТ через 10 лет и более после менопаузы [27, 28]. В отношении венозных тромбозов также отмечено минимальное повышение риска в этой группе пациенток, помимо возраста и времени после менопаузы на частоту венозных тромбозов негативно влияли избыточная масса тела и наличие Лейденовской мутации [29]. Таким образом, даже в исследовании WHI был подтвержден кардиопротективный эффект ЗГТ у женщин в возрасте 50-59 лет с длительностью менопаузы не более 10 лет, который ранее отмечался в когортных исследованиях с менее высоким уровнем доказательности.
Косвенным подтверждением защитного действия эстрогенов на ССС могут служить данные недавно опубликованного когортного исследования, проведенного в Дании с участием 3322 женщин в возрасте старше 40 лет, принимавших ЗГТ и перенесших инфаркт миокарда. У женщин, прекративших прием ЗГТ после инфаркта, по сравнению с женщинами, продолжавшими прием, не изменялась частота повторных инфарктов, однако отмечалась тенденция к повышению кардиоваскулярной и общей смертности (коэффициент риска 1,21; 95% ДИ 0,90-1,62 и 1,22; 95% ДИ 0,97-1,53 соответственно, разница статистически не значима) [30].
Интересным аспектом оценки частоты ССЗ оказалась их связь с вазомоторными нарушениями. В ретроспективном перекрестном исследовании с участием 951 женщины с хирургической или естественной менопаузой было показано, что 10-летний риск ССЗ, подсчитанный по Фремингейм-ской формуле, прямо коррелирует с ИМТ и количеством баллов по шкале Грина, которую используют для оценки тяжести климактерических нарушений [31]. Данные последних исследований показали, что легкие и преходящие вазомоторные нарушения, отмечающиеся в ранний перимено-паузальный период, не ассоциированы с повышением риска ССЗ, в то время как вазомоторные симптомы, возникающие и персистирующие в постменопаузе, могут являться предиктором повышения риска ССЗ, инсульта, инфаркта и общей смертности [32, 33].
В настоящее время на базе результатов WHI и других современных исследований было сделано несколько заключений. Первый вывод говорит о том, что применение эстрогенов сопровождается антиатерогенным и ангио-протективным действием в случаях, когда еще нет распространенного атеросклероза, однако ассоциировано с повышением риска осложнений ССЗ, если атеросклеротиче-ское поражение уже существует [34]. Поэтому раннее начало терапии (не более 5-10 лет после менопаузы) считается одним из ключевых факторов защитного действия ЗГТ на ССС [35].
Второй вывод: все риски, отмеченные в исследовании WHI, имеют отношение в первую очередь к тем препаратам, которые применялись в ходе исследования, т.е. перо-ральному приему конъюгированных конских эстрогенов или их комбинации с медроксипрогестерона ацетатом. По данным метаанализа результатов применения ЗГТ за период около 40 лет, на фоне приема пероральных форм эстрогенов отмечено некоторое повышение концентрации С-реактивного белка [21], что может быть независимым фактором риска ССЗ. Интересно, что этот эффект частично нивелируется при комбинированной эстроген-ге-стагенной терапии [14, 36]. При трансдермальном введении эстрогенов изменения концентраций С-реактивного белка, гомоцистеина или интерлейкина-6 отмечено не было [14], применение трансдермальных эстрогенов не ассоциировано с повышением риска венозных тромбозов [37]. Поэтому при высоком индивидуальном риске нужно не отказываться от ЗГТ, а назначать трансдермальные эстрогены.
Кроме того, эффект эстрогенов во многом обусловлен дополнительным воздействием прогестагенного компонента. Было показано, что некоторые виды прогестинов, особенно с андрогенной активностью, могут нивелировать положительные влияния эстрогенов на показатели липид-ного спектра 37. Некоторые прогестагены могут уменьшать антиагрегаторный эффект эндотелиальных клеток, снижая активность синтеза оксида азота через активацию глюкокортикоидных рецепторов [37, 42]. В исследовании, посвященном оценке риска венозных тромбозов, также были отмечены роль прогестинов и повышение риска тромбозов на фоне применения непрегнановых производных [37]. Поэтому для длительной терапии особенно важно выбирать гестаген без дополнительных негативных воздействий на липидный профиль, систему гемостаза, жировой и углеводный обмены. Таким гестагеном является, например, дидрогестерон [43]. Исследования показателей липидного спектра и углеводного обмена продемонстрировали, что добавление дидрогестерона к 17р-эстрадиолу скорее усиливает, чем ослабляет положительные эффекты эстрогенов [44]. Благоприятное действие ЗГТ на показатели липидного спектра отмечается при циклическом применении дидрогестерона как с 2 мг, так и 1 мг 17р-эстрадиола (Фемостон® 2/10, Фемостон® 1/10), что свидетельствует о возможности минимизации дозы эстрогенов даже в пременопаузе [22].
Влияние половых стероидов на организм крайне важно и многофакторно и не ограничивается ССС. Поэтому вопросы применения половых стероидов с целью регресса и/или профилактики неблагоприятных проявлений, ассоциированных с менопаузой, являются крайне актуальными. Особенно остро эта проблема встает в связи с общим увеличением числа женщин постменопаузального возраста. Однако необходимо принимать во внимание тот факт, что эффекты ЗГТ во многом зависят от типа препарата, дозы, пути введения, времени начала лечения и особенностей ге-стагенного компонента [46]. Условиями успеха ЗГТ являются выбор препарата с учетом особенностей данной конкретной пациентки и начало терапии в перименопаузе или не позднее 5 лет после физиологической менопаузы. В случае преждевременного или раннего наступления менопаузы существуют клинические рекомендации, указывающие на необходимость назначения эстроген-гестаген-ной терапии в циклическом режиме до физиологического возраста прекращения менструального функции (т.е. до 50-51 года) с последующим решением вопроса о продолжении ЗГТ в монофазном режиме [47]. Широкие возможности выбора безопасного режима приема половых стероидов, доступность лекарственных средств с доказанными положительными эффектами у женщин в пре- и постменопаузе, возможности индивидуализации терапии составляют яркий контраст крайне низкой частоте приема ЗГТ в России. Это свидетельствует о том, что до сих пор клиницисты не используют возможности ЗГТ, в том числе и для профилактики ССЗ в постменопаузе.
Читайте также:
- Лечение молекулярных рецидивов острого промиелоцитарного лейкоза (ОПЛ)
- Настойчивый поклонник. Как себя вести при назойливом ухаживании?
- Глоточно-барабанная труба. Строение и топография евстахиевой трубы
- Профилактика дефицита железа - железодефицитной анемии
- Как закрасить седину? Борьба с седыми волосами
