Лечение молекулярных рецидивов острого промиелоцитарного лейкоза (ОПЛ)
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Острый промиелоцитарный лейкоз - ОПЛ (МЗ по FAB-классификации) - довольно редкий вариант острого лейкоза, на его долю приходится не более 10% среди всех острых нелимфобластных лейкозов. Яркая клиническая картина и морфологические особенности заболевания позволили Hillestad еще в 1957 г., задолго до создания FAB-классификации, выделить его в качестве отдельной формы острого лейкоза.
Что провоцирует / Причины Острого промиелоцитарного лейкоза:
Причиной острого промиелоцитарного лейкоза, является хромосомная транслокация t (15;17) ведущая к соединению гена рецептора ретиноевой кислоты (RAR-aльфа) c геном опухолевого супрессора PML [Rabbits, ea 1994, Sanchez-Garcia, ea 1997, Tenen, ea 1997], продукт которого образует в ядре специфические матрикс-ассоциированные ядерные тельца PML. Цитогенетический анализ выявляет в клетках больных APL транслокации, захватывающие хромосомы 15 и 17. Это специфические транслокации q(15;17) (q22;q11.2) не были вывлены ни в одном другом типе лейкемии миелоцитов или другом злокачественном заболевании. Транслокация (15;17) прерывает RARальфа ген и часть его сливается с локусом PML хромосомы 15, образуя химерный слитый белок PML-RARa. Ген PML кодирует белок, содержащий "цинковые пальцы", и может являться важным транс- действующим транскрипционным фактором в процессе дифференцировки гранулоцитов.
Предполагается, что химерный белок PML/RAR-a инактивирует по доминантно-негативному механизму апоптогенную функцию нормального белка PML, образуя с ним гетеродимеры. Механизмы индукции апоптоза при гиперэкспрессии PML пока не совсем ясны. Экспрессия химерного белка PML/RAR-a, вызывающая инактивацию нормальной функции белка PML, как и перестройка BCR/ABL, ведет одновременно и к изменениям регуляции клеточного цикла, и к частичному блокированию индукции апоптоза (следует заметить, что в отличие от BCR/ABL перестройка PML/RAR-a вызывает также и блок дифференцировки). В результате многонаправленного характера действия гибридных молекул появляются клетки с повышенным пролиферативным потенциалом и одновременно с устойчивостью к негативным регуляторным сигналам и/или неблагоприятным условиям окружающей среды. Предполагается, что такие изменения могут быть уже достаточными для развития по крайней мере некоторых форм гемобластозов. И, действительно, перестройки BCR/ABL или PML/RAR-a часто являются единственными генетическими изменениями, обнаруживаемыми соответственно при хроническом миелоидном и остром промиелоцитарном лейкозах .
Было идентифицировано множество лейкемия-специфических генов, но в результате слияния генов рецептора ретиноидной кислоты (RAR альфа) и гена лейкемии промиелоцитов (PML) возник новый интересный пример таких генов, приводящих к возникновению острой лейкемии миелоцитов (APL).
Три разных химерных гена PML-RARa, длинный (L), средний (M) и короткий (S) являются результатом различного типа сплайсинга экзонов гена PML при сплайсинге транслоцированного гена RARa. Транс-ретиноидная кислота (ATRA) приводит к выздоровлению больных APL, позволяя предполагать, что в процессе транслокации образуется гормон-связывающий белок. Химерный белок PML-RARa, по- видимому, блокирует дифференцировку миелоидных клеток, а обработка ATRA снимает этот эффект.
Гены, вовлеченные в патологический процесс при APM, по-видимому, приводят к структурным изменениям нормального гена (протоонкогена), и его белковый продукт, действуя на клетку-хозяина, вызывает злокачественное перерождение. Этот белок в норме вовлечен в процессы пролиферации и дифференцировки.
Молекулярные и клинические исследования APL больных выявляют, что клетки больных могут начать дифференцировку под воздействием ATRA. Обнаружение транслокации 15;17 дает хороший прогноз. При терапии ATRA перестройка гена RARa существует 2-3 недели, а затем исчезает; после выздоровления восстанавливается нормальная структура гена RARа. Использование ATRA для восстановления созревания клеток и их дифференцировку в гранулоциты приводит к выздоровлению 85-90% пациентов. Это является первым примером лечения рака человека.
В некоторых случаях больных APL, ген RARa может быть вовлечен в другие транслокации и перестройки. Были выявлены два пациента, один с перестройкой 11;17 , а другой с транслокацией 15;17, но без перестройки гена PML. На обоих пациентов терапия ATRA не подействовала. Наблюдения о необходимости сайтов перед геном PML для взаимодействия с ATRA повышает необходимость молекулярной диагностики APL перед назначением или продолжением ATRA терапии. Химерный белок PML-RARa клинически удобен для диагностики и наблюдения при лечении APL.
Патогенез (что происходит?) во время Острого промиелоцитарного лейкоза:
Симптомы Острого промиелоцитарного лейкоза:
Острый промиелоцитарный лейкоз отмечает очень быстрое течение. Ему присущи выраженная интоксикация, кровоточивость и гипофибриногенемия (понижение свертываемости крови), обусловленные ДВС-синдромом (синдром диссеминированного внутрисосудистого свертывания). Лимфатические узлы, печень и селезенка чаще всего не увеличены. В анализе крови: анемия, выраженная тромбоцитопения, в костном мозге, а обычно и в периферической крови выявляется большой процент нетипичных бластов. Ядра этих лейкозных клеток в крови нередко имеют двудольчатую форму, еще чаще их форму бывает трудно различить из-за обилия зернистости в цитоплазме. Непосредственной причиной смерти больного чаще всего бывает кровоизлияние в мозг.
Острый промиелоцитарный лейкоз характеризуется чрезвычайной злокачественностью процесса, быстрым нарастанием тяжелой интоксикации, выраженным геморрагическим синдромом, приводящим к кровоизлиянию в мозг и к гибели больного.
Острый миелобластный лейкоз характеризуется прогрессирующим течением, выраженной интоксикацией и лихорадкой, тяжелой анемией, умеренной интенсивностью геморрагических проявлений (склонностью к кровоточивости), частных язвенно-некротических поражений слизистых и кожи.
Диагностика Острого промиелоцитарного лейкоза:
Лечение Острого промиелоцитарного лейкоза:
Лечение острого промиелоцитарного лейкоза может осложниться двумя угрожающими жизни состояниями - ДВС-синдромом и ретиноидным синдромом .
ДВС-синдром обусловлен гибелью под действием цитостатиков лейкозных клеток и массивным поступлением из них в кровь прокоагулянтов. Во многих случаях эффективно лечение гепарином. Дефицит факторов свертывания возмещают криопреципитатом и свежезамороженной плазмой.
Третиноин в отличие от цитостатиков способствует дифференцировке лейкозных клеток. Лечение им острого промиелоцитарного лейкоза позволяет избежать кровотечений, но вызывает лейкоцитоз.
Проявления ретиноидного синдрома включают лихорадку, одышку, плевральный выпот и перикардиальный выпот, артериальную гипотонию. И сам лейкоцитоз, и его последствия можно предупредить назначением цитостатиков.
Летальность ДВС-синдрома и ретиноидного синдрома при изолированном назначении цитостатиков и третиноина достигает 15-20%. Одновременное назначение цитостатиков и третиноина снижает летальность, предотвращая развитие обоих синдромов.
К каким докторам следует обращаться если у Вас Острый промиелоцитарный лейкоз:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Острого промиелоцитарного лейкоза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Лечение молекулярных рецидивов острого промиелоцитарного лейкоза (ОПЛ)
Подходы к лечению молекулярных рецидивов при острого промиелоцитарного лейкоза разработаны мало. Итальянские ученые, например, предлагают использовать химиотерапию в сочетании с ATRA при повторном выявлении в течение короткого периода транскрипта RML-RARa.
Так, из 14 больных, у которых был определен молекулярный рецидив, у 12 достигнута повторная молекулярная ремиссия, причем у 7 на фоне применения ATRA в течение 30 дней. Всем больным после курса ATRA проводили химиотерапию: четыре однодневных курса цитарабина в высоких дозах (1 г/м2) в сочетании с митоксантроном (6 мг/м2).
Безрецидивная выживаемость в течение 2 лет этих 14 больных составила 92 % по сравнению с 44 % у 37 больных, которым осуществляли аналогичную терапию в гематологическом рецидиве. Эффективность ATRA, принимаемой в течение 30 дней, у больных с молекулярным рецидивом острого промиелоцитарного лейкоза отметили и английские исследователи. Они сообщили о достижении повторной молекулярной ремиссии у 2 больных с молекулярным рецидивом после аутологичной ТКМ.
Достижение ремиссии у больных с острым промиелоцитарным лейкозом и выживаемость
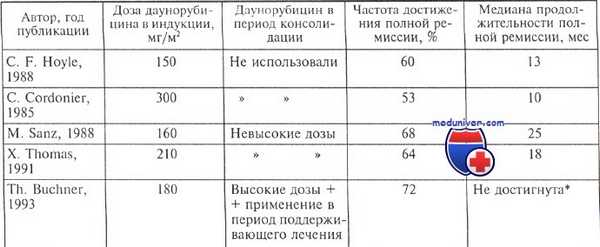
Вероятность сохранения полной ремиссии в течение 5 лет составила 53 %
Других способов лечения молекулярных рецидивов острого промиелоцитарного лейкоза в доступной нам литературе мы не нашли. Отечественными специалистами предложен новый биологический способ воздействия на минимальную остаточную болезнь при остром промиелоцитарном лейкозе: применение ИФН-а в сочетании с ATRA (ATRA 45 мг/м2 1-5-й день, ИФН-а 3 000 000 ME в 1, 2, 3-й день).
В ходе исследования эффективности нового метода лечения сформированы следующие группы: больные с молекулярным рецидивом (4); больные с персистенцией остаточной опухолевой популяции клеток после проведенного лечения (2); больные в период поддержания молекулярной ремиссии после химиотерапии малого объема (2). Полученные данные свидетельствуют о том, что лечение ИФН-a в сочетании с ATRA оказывает отчетливый эффект, т. е. позволяет без применения цитостатических воздействий индуцировать молекулярные ремиссии при остром промиелоцитарном лейкозе и длительно их поддерживать.
Число наблюдений очень невелико (8 больных), поэтому требуется четкий повторный контроль молекулярного эффекта исследуемых препаратов. Возможно, указанный подход следует использовать только у больных без факторов риска. В тех случаях, когда они присутствуют и невозможно выполнить трансплантацию аутологичных или аллогенных гемопоэтических клеток, следует чередовать курсы химиотерапии и лечение ИФН-a в сочетании с ATRA.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Критерии молекулярной ремиссии при остром промиелоцитарном лейкозе (ОПЛ)
Принципиальная значимость достижения молекулярной ремиссии при остром промиелоцитарном лейкозе (ОПЛ) давно стала очевидной, поскольку вероятность развития рецидивов у больных, у которых молекулярная ремиссия не достигнута или маркеры после нескольких отрицательных результатов вновь определяются, исключительно высока. Найдена четкая взаимосвязь между негативными результатами ПЦР и вероятностью сохранения полной ремиссии.
Например, у 27 из 36 больных, у которых после 4 мес индукционной терапии продолжал определяться транскрипт PML-RA-Ra, развился рецидив болезни. В то же время только у 5 из 86 больных, у которых результаты ПЦР были негативными, диагностировали рецидив (срок наблюдения до 5 лет).
Важно, что в случае двукратного определения транскрипта PML-RARа, если до этого получали негативные результаты, всегда возникал рецидив.
Транскрипт PML-RARa определяют у всех больных, у которых полная ремиссия достигнута только с использованием ATRA, а также у 60 % пациентов, у которых ремиссия получена после первого стандартного курса (7+3) индукционного лечения с помощью только цитостатических препаратов. После первого курса индукции, включающего ATRA и цитостатические препараты, молекулярные ремиссии, определяемые как отсутствие транскрипта PML-RARa (при чувствительности метода 1 клетка на 10 000), констатируют у 37—48 % больных.
Необходимо отметить, что в указанных исследованиях (Великобритания и Испания) индукционный протокол не был очень агрессивным (программа DAT+ATRA и AIDA). Немецкие исследователи после проведения агрессивной двойной индукции TAD/HAM с ATRA зарегистрировали очень высокий процент молекулярных ремиссий — 92. Конечно, программа двойной индукции может рассматриваться как индукция и консолидация, вместе взятые. В проведенных испанском и английском исследованиях после курса консолидации процент молекулярных ремиссий также составил 93 и 90 соответственно.
Варианты поддерживающего лечения и его эффективность при остром промиелоцитарном лейкозе (ОПЛ)
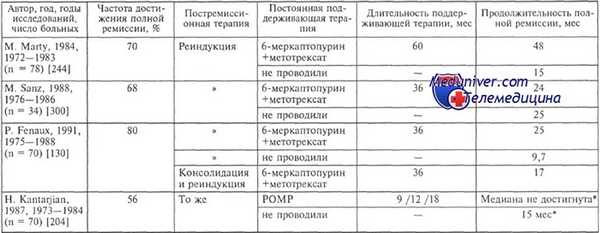
* Вероятность сохранения полной ремиссии в течение 3 лет при использовании POMP во время поддерживания ремиссии составляет 56 %, без его применения — 30 %.
Примечание. Консолидация — курсы даунорубицина, цитарабина, реиндукция — курсы цитарабина, даунорубицина, циклофосфана, винкристина, митогуазона, преднизолона.
По результатам исследования МРБ у 25 больных острым промиелоцитарным лейкозом, терапия которым осуществлялась в РАМН, молекулярная ремиссия была достигнута после первого курса индукции у 68 % больных, после второго — у 95%, после третьего — у 100%. У 13 из 25 больных исходно выявлялся bcr1-вариант транскрипта PML-RARa, а у 12 —bcr3. Имеет ли вариант транскрипта PML-RARa прогностическое значение, не вполне ясно. Данные литературы по этому вопросу противоречивы.
Так, согласно результатам английского исследования MRC, риск развития рецидивов в течение 4 лет составляет для больных с bcr1- и bcr3-вариантами транскрипта PML-RARa соответственно 19 и 42 % (статистически значимые различия). Безрецидивная выживаемость больных с различными вариантами транскрипта при этом не различается (67 и 65 % соответственно). Американские исследователи из Нью-Йоркского MSKCR центра сообщают, что риск развития рецидива у больных с транскриптом bcrl равен 8 %, а с транскриптом bcr3 — 29 %. Безрецидивная выживаемость в течение 5 лет у больных с транскриптом BCR1 составила 86 %, с транскриптом bcr3 — 65 %, причем эти показатели статистически значимо отличались.
По данным этих исследований очевидно, что результаты терапии больных в зависимости от варианта транскрипта отличаются, и складывается впечатление, что наличие транскрипта bcr3 связано с менее благоприятным течением острого промиелоцитарного лейкоза.
В исследовании РАМН после первого индукционного курса из 13 больных с транскриптом bcr1 молекулярная ремиссия отмечена у 8 (62 %), а из 12 больных с транскриптом bcr3 — у 9 (75 %). После второго курса у всех больных с транскриптом bcr3 достигнута молекулярная ремиссия, а у одной больной с транскриптом bcrl молекулярная ремиссия была получена лишь после третьего курса. У нее развился ранний (на 9-м месяце от достижения полной ремиссии) рецидив заболевания, причем молекулярный рецидив был выявлен за 2 мес до гематологического. Это был единственный гематологический рецидив у больных из группы с транскриптом bcr1.
Приведенными фактами жестко аргументируется еще один очень важный принцип современной терапии острого промиелоцитарного лейкоза (ОПЛ): необходимость проведения регулярных молекулярно-биологических и/или молекулярно-генетических исследований для определения дальнейшей тактики терапии при диагностике молекулярного рецидива.
3.8.4. Лечение рецидива ОПЛ
В лечении рецидива ОПЛ АТО в качестве монотерапии позволяет достичь становления второй молекулярной ремиссии в 70 - 90% случаев по данным разных исследований. Роль добавления ATRA пока изучена недостаточно. В то же время, использование трансплантационных подходов у пациентов, которым достигнута 2-я ремиссия ОПЛ, показывает их преимущество перед только использованием АТО-содержащих программ. Так, например, исследование европейской группы LeukemiaNet показало 3-летнюю ОВ 80% после применения аутоТКМ во второй молекулярной ремиссии по сравнению с 59% у больных без ТКМ. Хотя АллоТКМ характеризуется, по данным некоторых исследований, меньшей вероятностью развития повторных рецидивов после ТКМ по сравнению с АутоТКМ, летальность, связанная с лечением, делает этот подход у больных во второй ремиссии ОПЛ менее предпочтительным по сравнению с АутоТКМ. Ожидать высокую эффективность АутоТКМ, в то же время, следует только у больных с достигнутой 2-й молекулярной ремиссией. В небольшом одноцентровом исследовании показана высокая эффективность сочетания бортезомиба** и АТО у больных с рефрактерностью к монотерапии АТО в рецидиве ОПЛ.
В лечении рецидива ОПЛ Рабочая группа рекомендует:
- Рекомендуется у пациентов с подтвержденным молекулярным рецидивом (определенным как 2 последовательных ПЦР-положительных анализа, со стабильным нарастанием уровня PML-RARA транскрипта) начать терапию незамедлительно с целью предотвращения развернутого рецидива. [1 - 6]
Уровень убедительности рекомендации B (уровень достоверности доказательств 2).
- Рекомендуется у пациентов с подтвержденным молекулярным рецидивом (определенным как 2 последовательных ПЦР-положительных анализа, со стабильным нарастанием уровня PML-RARA транскрипта) начать терапию незамедлительно с целью предотвращения развернутого рецидива. [1 - 6].
Уровень убедительности рекомендации B (уровень достоверности доказательств 2)
- Рекомендуется у пациентов с рецидивом ОПЛ использовать схемы на основе АТО. [1 - 6].
Комментарии: хотя ATRA в сочетании с химиотерапией может быть использована в качестве терапии спасения, схемы на основе АТО в настоящее время считаются первой линией лечения рецидива ОПЛ.
- Рекомендуется пациентам, у которых получена вторая полная ремиссия, рассмотреть возможность выполнения ТКМ. [1 - 6]
- Рекомендуется пациентам, у которых не достигнута вторая молекулярная ремиссия, рассмотреть возможность выполнения трансплантация аллогенного костного мозга. [1 - 6].
- Рекомендуется пациентам во второй молекулярной ремиссии выполнение трансплантация аутологичного костного мозга, при этом в заготовленном аутотрансплантате должен отсутствовать молекулярный маркер. [1 - 6].
- Рекомендуется для пациентов, которым не может быть выполнена ТКМ, применение повторных курсов АТО с ATRA (третиноин**) или без нее. [1 - 6].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4)
- Рекомендуется для пациентов с рецидивом ОПЛ, протекающим только с поражением ЦНС, индукционная терапии из минимум еженедельного (оптимально - 2 раза в неделю) интратекального введения трех препаратов (метотрексата**, дексаметазона** и цитарабина**) до полной элиминации опухолевых клеток из спинномозговой жидкости; затем выполняется от 6 до 10 интратекальных введений в качестве консолидации. Параллельно должно проводится системное лечение как при костномозговом рецидиве. [1 - 6].
Уровень убедительности рекомендации B (уровень достоверности доказательств 3)
XII Международная студенческая научная конференция Студенческий научный форум - 2020

Современные принципы диагностики и лечения острого промиелоцитарного лейкоза
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Острый промиелоцитарный лейкоз – ОПЛ (по классификации ВОЗ 2008 – острый миелолейкоз с t(15;17)(q22;q12); (PML-RARα) и вариантами; по FAB -классификации – М3, M3v – нетипичный ОПЛ) относят к редкой, особой форме острого миелоидного лейкоза (5-15% всех случаев ОМЛ.). Он характеризуется аномальным накоплением (≥20%) в костном мозге одного из видов миелоидных клеток – промиелоцитов в сочетании с хромосомными транслокациями, затрагивающими ген альфа рецептора ретиноевой кислоты (RARα), расположенного на 17 хромосоме. В свою очередь, промиелоциты – это клетки-предшественники гранулоцитов, возникающие на одной из стадий их созревания (миелобласты – промиелоциты – миелоциты – гранулоциты) [1].
Основной хромосомной аномалией ОПЛ (95%) является реципрокная транслокация (t) (15;17)(q22;q21) - PML/RARα в опухолевых промиелоцитах, вследствие чего ген промиелоцитарного лейкоза (PML-ген), расположенный на 15 хромосоме, переносится на длинное плечо 17 хромосомы в область, где находится ген альфа-рецептора ретиноевой кислоты (RARα). В результате t (15;17) появляется пара сливных аномальных гена: PML/RARα на деривате (der) 15 хромосомы и RAR/PML на деривате 17 хромосомы.
Остальные стабильно выявляемые транслокации при ОПЛ:
t(11;17)(q23;q21) - PLZF/RARα, ( 3 % случаев ОПЛ);
t(11;17)(q13;q21) - NuMA/RARα, ( 1 % случаев ОПЛ);
t(5;17)(q35;q21) - NPM/RARα, ( 1 % случаев ОПЛ);
t (17;17) или dup 17( q 11; q 21) - Stat 5 b / RAR α, ( 0,5 % случаев ОПЛ) [2].
Факторы, способные вызвать мутацию клеток кроветворной ткани, приводящие к ОПЛ: наследственная предрасположенность к онкологическим заболеваниям, иммунодефицитные состояния, некоторые виды вирусов, медикаменты, ионизирующая радиация, химические канцерогенные вещества, механические повреждения тканей, ожирение и пр.
ОПЛ встречается в абсолютно любом возрасте, даже в детском. Однако большинство пациентов в момент диагноза заболевания имеют возраст около 40 лет, что является отличительной чертой ОПЛ от других видов острого миелолейкоза, где в основном больные – люди пожилого возраста.
Обычно ОПЛ, как и другие виды острого лейкоза, характеризуется такими проявлениями, как анемия (одышка, утомляемость, слабость), тромбоцитопения (кровоточивость, появление синяков и кровоподтеков), а так же лейкопения (снижение защитных сил организма, инфекционные болезни). Кроме этого, при ОПЛ наблюдается кровоточивость, связанная с ДВС (синдром диссеминированного внутрисосудистого свертывания).
Диагностику и лечение ОПЛ в России и за рубежом осуществляют согласно национальным клиническим рекомендациям по программам-протоколам [3, 4, 5].
Цель исследования
Провести обзор литературы по проблеме диагностики и лечения острого промиелоцитарного лейкоза. Сравнить эффективность протоколов лечения и возможную токсичность применяемых химиотерапевтических препаратов.
Материал и методы исследования
Для сравнения мировых практик лечения ОПЛ было изучено и проанализировано более 30 научно-практических статей, посвященных данной проблеме и опубликованных в различных медицинских журналах в период 1997 – 2019 годов.
Современные протоколы лечения ОПЛ как российских, так и зарубежных онкологов в основном схожи и включают в себя схемы сочетанного применения препаратов ATRA и/или ATO и антрациклиновых антибиотиков с цитарабином или же без него.
Были проанализированы следующие протоколы:
«7+3+ATRA» – Россия; AIDA, PETHEMA – Испания, Россия; Европейский режим APL.
Результаты исследования и их обсуждение
ОПЛ диагностируется на основании морфологического, цитохимического, цитогенетического, молекулярно-генетического, иммунофенотипирования анализа образца костного мозга[1].
По инициальным анализам периферической крови, всех пациентов стратифицируют по шкале M. Sanz:
1. Группа низкого риска: лейкоциты ≤ 10х10 9 /л, тромбоциты ≥ 40х10 9 /л;
2. Группа промежуточного риска: лейкоциты ≤ 10х10 9 /л, тромбоциты 40х10 9 /л;
3. Группа высокого риска: лейкоциты > 10х10 9 /л [3].
По обобщенным данным научно-практических монографий пациенты группы низкого риска составляют 26 %, среднего – 52% и высокого – 22 % от общего числа больных ОПЛ.
Ранее ОПЛ относился к категории лейкозов с очень неблагоприятным прогнозом. Но современные методы программного лечения ОПЛ – применение специфических препаратов – полностью трансретиноевой кислоты ( ATRA ) и триоксида мышьяка ( ATO ) в сочетании с полихимиотерапией, позволяют достичь высоких показателей выживаемости пациентов без применения цитостатических препаратов в 80-95 % случаев.
Во время приема препарата ATRA происходит «перепрограммирование» лейкемических промиелоцитов на дальнейшее превращение их в зрелые гранулоциты. Однако стоит отметить, что на фоне приема ATRA, даже если вводятся цитостатические препараты, всегда есть вероятность развития ретиноидного синдрома (РС), или же синдрома дифференцировки опухолевых клеток (фебрильная лихорадка, одышка, признаки острой почечной и/или печеночной недостаточности, задержка жидкости).
При малейших признаках, даже при малейшем подозрении на развитие РС больному назначают дексаметазон 10 мг/м 2 2 раза в день. Обычно признаки ретиноидного синдрома очень быстро купируются, поэтому длительная терапия дексаметазоном не показана. Отмены ATRA обычно не требуется, однако в случае развития тяжелого РС, препарат может быть отменен до купирования РС. Его прием может быть возобновлен в половинных дозах [4,7].
В случаях недостаточной эффективности или непереносимости препарата ATRA, рецидива болезни и как самостоятельный препарат для лечения ОПЛ применяется АТО (триоксид мышьяка), который характеризуется высокой эффективностью при умеренной токсичности. По данным научных источников частота достижения полной ремиссии при лечении триоксидом мышьяка составляет 86%.
Среди возможных побочных действий АТО нужно отметить дифференцировочный синдром, аналогичный упомянутому выше синдрому ретиноевой кислоты; реже встречается нарушение сердечного ритма. Следует отметить, что из-за высокой эмбриотоксичности триоксида мышьяка, применение его для лечения ОПЛ у беременных женщин категорически запрещено на любом сроке беременности.
Частота осложнений при полихимиотерапии гемобластозов составляет от 80 % и более случаев, а летальные исходы доходят до 10% [2,8].
ОПЛ – смертельно опасное заболевание и если не проводить лечение, то больные погибают в течение нескольких недель, иногда даже считанных дней.
Во всех случаях подозрения на ОПЛ (наличие у пациента характерной морфологической картины бластных клеток, лейкопении, тяжелой коагулопатии, геморрагического синдрома) следует немедленно начинать терапию ATRA и продолжать ее до момента подтверждения диагноза или его опровержения на основе молекулярно-генетического исследования.
При лечении ОПЛ выделяют четыре основных этапа лечения.
1 этап – индукционный (достижение ремиссии). Пациенту проводится интенсивная терапия химиопрепаратами для наибольшего снижения количества злокачественных клеток (5-8 недель). Этап индукционной терапии является сложным и требует адекватной массивной сопроводительной терапии (антимикробной, гемотрансфузионной, антипротозойной, противовирусной, противогрибковой и т.п.), а также правоведения профилактики и лечения ретиноидного синдрома. В период индукции выполняется контрольно-диагностическая пункция для гематологического контроля ремиссии.
2 этап – консолидирующий (закрепление ремиссии). Консолидирующая терапия основана на потенциальном риске рецидива у пациентов, которые прошли индукционную терапию. Его первостепенная цель – преобразование морфологической и цитогенетической ремиссии в длительную молекулярную ремиссию, путем уничтожения оставшихся после индукции ремиссии лейкозных клеток новой комбинацией химиопрепаратов, в течение 2-4 месяцев.
3 этап – поддерживающий. Продолжение воздействия химиопрепаратов на сохранившийся опухолевый клон. Прием поддерживающей терапии назначается, согласно разным протоколам лечения ОПЛ, с 150 по 180 дни лечения и длится 2-3 года. При грубых нарушениях режима поддерживающей терапии очень велика вероятность развития рецидива.
4 этап – профилактика нейролейкемии. Этот этап распределяется на все периоды лечения ОПЛ [4].
Индукционное лечение ОПЛ требует массивной трансфузионной терапии тромбоконцентратами (необходимо поддерживать тромбоциты на показателях – 50х10 9 /л и выше) и свежезамороженной плазмой либо криопреципитатом (уровень фибриногена более 2 г/л, протромбинового индекса – более 80%). Использование ATRA не отменило агрессивной заместительной терапии компонентами крови, а лишь несколько уменьшило объемы используемых трансфузионных средств. Так же следует избегать проведения инвазивных процедур, таких как установка центрального венозного катетера (ЦВК) или люмбальная пункция, чтобы избежать тромбогеморрагических осложнений [5].
При гиперлейкоцитозе (особенно более 50х10 9 /л) на фоне проведения программы химиотерапии целесообразно выполнение плазмаферезов (плазмаобменов) до 1,5 – 2 л. Выполнение плазмаферезов показано не только в качестве процедуры, направленной на профилактику и лечение синдрома распада опухоли, но также и на коррекцию коагуляционных осложнений (ДВС-синдром) [4, 5].
Таким образом, при анализе программ протоколов лечения, которые используются в России и за рубежом, врачи придерживаются этапного принципа терапии (таблица№1).
Программы–протоколы: «7+3+ATRA» – Россия; « AIDA », «PETHEMA» – Испания, Россия; «Европейский режим APL»
1 курс – цитарабин по 200 мг/м 2 – 1-7 дни, даунорубицин по 60 мг/м 2 – 1-3 дни, на фоне приема ATRA по 45 мг/м 2 – 1-30 дни.
1 курс – идарубицин по 12 мг/м 2 или даунорубицин по 60 мг/м 2 в 2, 4, 6, 8 дни (пациент старше 60 лет только во 2, 4, 6 дни) ATRA по 45 мг/м 2 с 1 дня до достижения ремиссии. Дексаметазон по 2,5 мг/м 2 каждые 12 часов – 1-15 дни (при лейкоцитах более 5х10 9 /л).
1 курс – аналогично протоколу « AIDA ».
Европейский режим APL
1 курс – аналогично протоколу « AIDA ». Для пациентов моложе 20 лет ATRA по 25 мг/м 2 2 раза/сутки, с 1 дня до достижения ремиссии. Для пациентов группы высокого риска включен цитарабин по 200 мг/м 2 – 1-7 дни.
Консолидация ремиссии начинается после ее констатации. При наличии осложнений начало консолидации может быть отложено, но не более чем 7 дней. Интервал между курсами 30 дней, максимально до 45 дней.
1 курс – цитарабин по 200 мг/м 2 – 1-7 дни, даунорубицин по 60 мг/м 2 – 1-3 дни, 2 курс консолидации – идентично 1 курсу. ATRA назначают одновременно с курсами выше – по 45 мг/м 2 – 1-15 дни.
1 курс – идарубицин по 5 мг/м 2 – 1-4 дни, 2 курс митоксантрон по 12 мг/м 2 – 1-5 дни, 3 курс – идарубицин по 12 мг/м 2 – 1 день. ATRA назначают одновременно с курсами выше – по 45 мг/м 2 – 1-15 дни.
1 курс – идарубицин по 5 мг/м 2 внутривенно, болюсно – 1-4 дни, 2 курс – митоксантрон по 10 мг/м 2 внутривенно, болюсно – 1-3 дни, 3 курс – идарубицин по 12 мг/м 2 внутривенно, болюсно 1 день. ATRA назначают одновременно с курсами выше – по 45 мг/м 2 , для пациентов моложе 20 лет – по 25 мг/м 2 2 раза/сутки.
1 курс – даунорубицин по 60 мг/м 2 – 1-3 дни, цитарабин по 200 мг/м 2 – 1-7 дни, 2 курс – даунорубицин по 45 мг/м 2 внутривенно в виде инфузии 15-30 мин в 1-3 дни, цитарабин по 1 г/м 2 каждые 12 ч в 1-4 дни, ATRA назначают одновременно с курсами выше – по 45 мг/м 2 , для пациентов моложе 20 лет – по 25 мг/м 2 2 раза/сутки.
В течение 2 лет – 6-меркаптопурин по 50 мг/м 2 – 1 раз/день, метотрексат по 15 мг/м 2 – 1 раз/неделя, ATRA по 45 мг/м 2 – 15 дней 1 раз/3 мес.
Аналогично протоколу «7+3+ATRA».
В течение 2,5 лет – 6-меркаптопурин по 50 мг/м 2 – 1 раз/день, метотрексат по 15 мг/м 2 – 1 раз/неделя, ATRA по 45 мг/м 2 – 15 дней 1 раз/3 мес.
В течение 2 лет – 6-меркаптопурин по 60 мг/м 2 – 1 раз/день, метотрексат по 20 мг/м 2 – 1 раз/неделя, ATRA по 45 мг/м 2 – 15 дней 1 раз/3 мес.
Все выше представленные протоколы имеют очень высокий лечебный эффект, с незначительными различиями в процентном соотношении выживаемости, сохранении полной ремиссии, летальности (таблица №2).
Читайте также:
