Врожденная нейробластома плода - лечение, прогноз
Добавил пользователь Алексей Ф. Обновлено: 16.01.2026
Нейробластома у детей: клиника, диагностика, прогноз
Нейробластома и пограничные (смежные) опухоли по происхождению представляют собой ткани нервного гребня в мозговом веществе надпочечника (хромаффинная ткань) и симпатической нервной системе. Это необычная опухоль, способная иногда к спонтанному регрессу у младенцев.
Существуют различные варианты болезни — от доброкачественного (ганглионеврома) до злокачественного (нейробластома).
Нейробластому наиболее часто обнаруживают в возрасте до 5 лет. У большинства детей выявляют абдоминальное объёмное образование, но первичная опухоль может находиться где-либо по ходу симпатического ствола от шеи до таза. Классически абдоминальные поражения имеют надпо-чечниковое происхождение, но при манифестации заболевания объёмное образование часто бывает большим, пересекает срединную линию и окружает магистральные кровеносные сосуды и лимфатические узлы.
Паравертебральные опухоли могут проникать через межпозвонковое отверстие и вызывать сдавление спинного мозга. После 2-летнего возраста клинические симптомы главным образом, бывают результатом метастатической болезни: болевой синдром в костях, миелодепрессия, потеря массы тела и недомогание.
Диагноз часто можно выставить на основании характерных клинических и радиологических признаков и повышения содержания катехоламинов в моче (VMA, гомованилиновая кислота). Диагноз обычно подтверждают биопсией, метастазы выявляют при исследовании образцов костного мозга, сканировании костей и MIBG (метайодобензилгуа-нидин) сцинтиграфией.
MIBG — меченный радиоактивным изотопом специфичный для опухоли агент — обеспечивает чувствительную визуализацию, позволяющую оценить стадию болезни и проводить мониторинг ответа на лечение. Роль его терапевтического использования не установлена.
Самые важные прогностические клинические особенности — возраст и стадия болезни на момент постановки диагноза. К сожалению, большинство детей старше 1 года манифестируют при уже запущенной стадии болезни и имеют плохой прогноз. Всё шире используют информацию о биологических особенностях нейробластомы для терапии и прогноза.
Сверхэкспрессия онкогена «N-myc» свидетельствует о делении материала в хромосоме 1 (del 1р) и об увеличении генетического материала в хромосоме 17q в клетках опухоли; это свидетельствует о более плохом прогнозе.
Немногих детей с локализованными первичными поражениями без метастазов можно излечить с использованием только хирургического метода. Для большинства больных в запущенных случаях главенствующую роль играет химиотерапия. Детям, дающим хороший начальный ответ, может быть показана консолидация с химиотерапией высокой дозы с предварительным сохранением стволовых клеток, взятых из периферической крови.
К сожалению, риск рецидива высок и перспектива лечения для детей с метастазами всё ещё остаётся немного выше 30%.
Скрининг повышенного содержания катехоламинов в моче для идентификации бессимптомных форм болезни у маленьких детей в принципе выполним, но нет никаких свидетельств того, что это уменьшает смертность, данную процедуру не осуществляют в Великобритании.
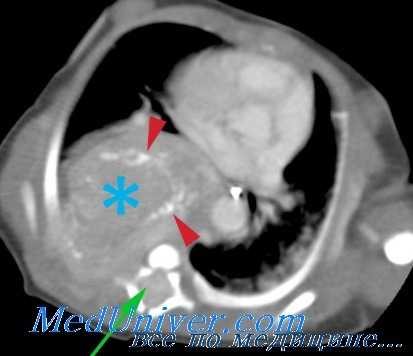
Пример нейробластомы у ребенка. Джека, 2-летнего мальчика, мать привела к врачу общей практики вследствие общего плохого самочувствия и отсутствия аппетита. Незадолго до этого ребёнок неохотно стал гулять и иногда кричал, когда его брали на руки. Раньше он нормально спал, однако теперь его сон нарушился, а бабушка Джека заметила, что мальчик стал бледным и потерял в весе.
При осмотре врач общей практики подтвердил неважное самочувствие ребёнка и забеспокоился, обнаружив возможную опухоль в верхней части брюшной полости. Мальчика срочно госпитализировали в местную клинику, где ему провели УЗИ, подтвердившее наличие абдоминальной опухоли, кроме того, была выявлена гипертензия. МРТ-исследование подтвердило наличие очень большой опухоли в верхней части брюшной полости, которая находилась в сложном взаимоотношении с левой почкой и крупными сосудами, предположительно нейробластомы.
Последующие исследования подтвердили инфильтрацию костного мозга опухолевыми клетками, а положительный результат MIBG-сканирования, показывающего захват в первичном и отдалённых очагах, согласовывался с наличием метастазов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Задержка развития плода
Задержка развития плода — отставание роста, массы и других фетометрических показателей от средних нормативных для конкретного срока гестации. Зачастую протекает бессимптомно, может проявляться малым приростом веса беременной, небольшой окружностью живота, слишком активным или редким шевелением ребенка. Для постановки диагноза выполняют УЗИ плаценты, фетометрию, КТГ, допплерографию плацентарного кровотока. Лечение комплексное медикаментозное с назначением ангиопротекторных, реологических препаратов, токолитиков, антигипоксантов, мембраностабилизаторов. При неэффективности терапии и усугублении расстройств рекомендованы досрочные роды или кесарево сечение.
Общие сведения
О задержке внутриутробного развития (гипотрофии) плода говорят в ситуациях, когда его масса на 10 и более процентилей ниже нормативной. Согласно данным медицинской статистики, ЗВУРП осложняет течение каждой десятой беременности, является причиной различных заболеваний плода и новорожденного. В 70-90% случаев задержка развивается в третьем триместре при наличии болезней матери, патологии плаценты и многоплодия. 30% детей с гипотрофией рождаются преждевременно, лишь 5% новорожденных имеют признаки доношенности. Чаще задержку роста плода диагностируют у пациенток младше 18 лет и старше 30 лет. Вероятность возникновения этой патологии особенно высока у возрастных первородящих.
Причины задержки развития плода
Любое отставание ребенка во внутриутробном росте и созревании связано с недостаточным поступлением либо усвоением питательных веществ и кислорода. Непосредственными причинами подобных нарушений могут быть патологические изменения в фетоплацентарной системе, организмах матери и плода, плодных оболочках. Обычно задержка развития возникает под воздействием таких факторов, как:
- Болезни матери. Ограниченное поступление кислорода и питательных веществ наблюдается при анемии и других заболеваниях крови, патологических состояниях, сопровождающихся спазмом сосудов и сердечной недостаточностью (гипертонии, симптоматических артериальных гипертензиях, гестозах, печеночных и почечных заболеваниях). Риск задержки повышен у пациенток с гинекологической патологией, эндокринопатиями (сахарным диабетом, гипотиреозом), перенесших острые инфекции.
- Поражение плода. Поступающие питательные вещества хуже усваиваются при наличии у ребенка генетических дефектов (синдрома Патау, синдрома Дауна), пороков развития центральной нервной системы, сердца, почек. Риск возникновения аномалий и задержки развития повышается при внутриутробном заражении плода инфекционными агентами — внутриклеточными паразитами (токсоплазмами, микоплазмами), вирусами герпеса, краснухи, ВИЧ, Коксаки, гепатитов В и С.
- Поражение плаценты и оболочек плода. Повреждение более 10-15% плацентарной ткани сопровождается формированием фетоплацентарной недостаточности — ключевой причины задержки внутриутробного созревания ребенка. Плод испытывает кислородное голодание при инфарктах плаценты, ее преждевременной отслойке или инволюции. Рост плода может нарушаться при хориоамнионите, патологии пуповины (наличии истинных узлов, воспалении), маловодии, образовании амниотических перетяжек и др.
- Конфликт в системе «мать-ребенок». Изоиммунная несовместимость плода и женщины с разными группами крови или Rh-фактором проявляется гемолизом эритроцитов плода и образованием токсичного непрямого билирубина. Гемолитическая анемия и патологические процессы, происходящие в детском организме, препятствуют достаточной оксигенации и усвоению питательных веществ, поступающих от беременной. Как следствие, нормальное развитие замедляется.
- Недостаточное питаниеженщины. У пациенток, которые питаются низкокалорийными продуктами, имеют однообразный несбалансированный рацион с дефицитом белков, сложных углеводов, микро- и макроэлементов снижается уровень питательных веществ в крови. Из-за этого пластические процессы в тканях и органах плода замедляются, что сопровождается задержкой развития. Зачастую подобная причина является ведущей у больных из социально неблагополучных семей.
- Неблагоприятные внешние воздействия. Риск ухудшения здоровья и возникновения расстройств в фетоплацентарном комплексе повышен у женщин, которые работают на производствах с вибрационными, химическими, лучевыми, термическими нагрузками или проживают в экологически неблагоприятных условиях. Прямой токсический эффект оказывают никотин, алкоголь, наркотические вещества, некоторые медикаменты (противосудорожные средства, ингибиторы АПФ).
Дополнительным фактором, провоцирующим задержку нормального развития плода, является отягощенный акушерско-гинекологический анамнез. Расстройство чаще возникает у беременных с нарушенной менструальной функцией, привычными выкидышами или преждевременными родами, бесплодием в анамнезе. Недостаток в питательных веществах также может наблюдаться при многоплодной беременности из-за относительной фетоплацентарной недостаточности.
Патогенез
Предпосылки для развития синдрома задержки роста ребенка с генетическими аномалиями, при наличии инфекционных агентов, воспалительных процессах в эндометрии закладываются еще в I триместре гестации вследствие нарушений врастания трофобласта в оболочки спиральных артерий. Расстройство гемодинамики в маточно-плацентарной системе проявляется замедленным током крови в артериальном русле и межворсинчатом пространстве. Интенсивность газообмена между женщиной и плодом снижается, что в сочетании с нарушением механизмов саморегуляции гиперпластической фазы клеточного роста приводит к симметричному варианту задержки развития.
После 20-22 недели беременности ключевым моментом в возникновении гипотрофии плода становится относительная либо абсолютная фетоплацентарная недостаточность. Именно в этот период начинается интенсивная прибавка массы за счет активных пластических процессов. При многоплодии, недостаточном питании и на фоне заболеваний, сопровождающихся гипоксемией крови матери, поражением плацентарной ткани или сосудистого русла, развивается хроническое кислородное голодание плода. Его ток крови перераспределяется для обеспечения полноценного созревания ЦНС. Возникающий brain-sparin-effect обычно становится основой асимметричного варианта задержки развития.
Классификация
Систематизация клинических форм задержки развития плода основана на оценке выраженности отставания фетометрических показателей в сравнении с нормой и пропорциональности отдельных параметров роста. О первой степени нарушений свидетельствует задержка развития на 2 недели, о второй — на 3-4 недели, о третьей — более 4 недель. Важным критерием для оценки прогноза и выбора врачебной тактики является классификация с учетом соотношения отдельных показателей развития между собой. По этому признаку специалисты в сфере акушерства и гинекологии выделяют такие формы гипотрофии плода, как:
- Симметричная. Окружность головы, рост и вес плода уменьшены пропорционально в сравнении со средними нормативными показателями для определенного срока беременности. Чаще выявляется в первом-втором триместре.
- Асимметричная. Уменьшен только размер живота ребенка (на срок в 2 недели и более). Остальные показатели соответствуют сроку. Обычно возникает в 3-м триместре на фоне признаков фетоплацентарной недостаточности.
- Смешанная. Определяется более чем двухнедельное отставание от норматива размеров живота, другие показатели также незначительно уменьшены. Обычно признаки этого варианта задержки проявляются на поздних сроках.
Симптомы задержки развития плода
Расстройство протекает без острых клинических проявлений и обычно диагностируется при плановом УЗИ-скрининге. Гипотрофию плода можно заподозрить, если беременная медленно прибавляет в весе, у нее лишь незначительно увеличивается окружность живота. Задержка развития может сочетаться с нарушением двигательной активности ребенка как признаком возникшей фетоплацентарной недостаточности. В результате кислородного голодания плод чаще и интенсивнее шевелится, а при выраженной гипоксии его движения замедляются, что служит неблагоприятным прогностическим признаком.
Осложнения
При гипотрофии плода повышается риск его антенатальной гибели, травматизма и асфиксии в родах, аспирации мекония с тяжелым повреждением легких новорожденного. Перинатальные нарушения определяются у 65% младенцев с задержкой развития. В послеродовом периоде у таких детей чаще выявляются транзиторный гипотиреоз, неонатальная гипогликемия, перинатальная полицитемия и синдром повышенной вязкости крови, гипотермия. Может нарушаться функциональное созревание ЦНС с отставанием в становлении тонических и рефлекторных реакций, проявляться неврологические расстройства разной степени выраженности, активизироваться внутриутробные инфекции. По результатам исследований, отдаленными последствиями ЗВУРП являются повышенный риск инсулиннезависимого сахарного диабета и заболеваний сердца во взрослом возрасте.
Диагностика
Основными задачами диагностического этапа при подозрении на задержку развития плода являются определение степени и варианта гипотрофии, оценка состояния плацентарного кровотока, выявление возможных причин заболевания. После предварительного наружного акушерского исследования с измерением окружности живота и высоты стояния дна матки беременной рекомендованы:
- УЗИ плаценты. Сонография позволяет определить степень зрелости плацентарной ткани, ее размеры, структуру, положение в матке, выявить возможные очаговые повреждения. Дополнение метода допплерографией маточно-плацентарного кровотока направлено на обнаружение нарушений в сосудистом русле и зон инфаркта.
- Фетометрия плода. Ультразвуковое измерение окружностей головы, живота, грудной клетки, бипариетального и лобно-затылочного размеров, длины трубчатых костей предоставляет объективные данные о развитии плода. Полученные показатели сравнивают с нормативными для каждого периода гестации.
- Фонокардиография и кардиотокография плода. Диагностическая ценность методов состоит в косвенной оценке адекватности кровоснабжения плода по показателям его сердечной деятельности. Признаками фетоплацентарной недостаточности являются нарушения сердечного ритма — аритмия, тахикардия.
Сочетанная оценка данных ультразвукового и кардиотокографического исследований дает возможность составить биофизический профиль плода — выполнить нестрессовый тест, проанализировать двигательную активность, мышечную напряженность (тонус), дыхательные движения, объем околоплодных вод, зрелость плаценты. Получение результатов в 6-7 баллов свидетельствует о сомнительном состоянии ребенка, в 5-4 балла — о выраженной внутриутробной гипоксии.
Дополнительно для установления причин состояния выполняют лабораторные исследования по определению уровня гемоглобина и эритроцитов, содержания гормонов (эстрогенов, хорионического гонадотропина, прогестерона, ФСГ), инфекционных агентов (методы ПЦР, РИФ, ИФА). Возможные генетические аномалии и патологию плодных оболочек выявляют в ходе инвазивной пренатальной диагностики (амниоскопии, амниоцентеза под УЗИ-контролем, кордоцентеза). Дифференциальный диагноз осуществляют с генетически детерминированной конституциональной маловесностью ребенка, недоношенностью. По показаниям беременную консультируют эндокринолог, инфекционист, терапевт, иммунолог, гематолог.
Лечение задержки развития плода
При выборе врачебной тактики учитывают степень внутриутробной гипотрофии ребенка, выраженность фетоплацентарной недостаточности, состояние плода. Лечение назначается с проведением обязательного контроля — ультразвуковым определением фетометрических показателей каждую неделю или раз в 14 дней, допплерометрией плацентарного кровотока раз в 3-5 дней, оценкой состояния ребенка в ходе ежедневной КТГ. Беременной показаны:
- Препараты, улучшающие кровоснабжение плода. Качество кровотока в системе «матка-плацента-плод» повышается при назначении ангиопротекторов и средств, влияющих на реологию крови. Дополнительное введение токолитиков уменьшает тонус матки, облегчая кровоток в сосудах.
- Противогипоксические и мембраностабилизирующие средства. Применение актовегина, инстенона, антиоксидантов и мембраностабилизаторов делает ткани плода более устойчивыми к гипоксии. При сочетании с общеукрепляющими препаратами это позволяет стимулировать пластические процессы.
При I степени гипотрофии плода и компенсированной фетоплацентарной недостаточности с нормальными темпами прироста фетометрических показателей и функциональном состоянии ребенка беременность пролонгируется не менее чем до 37-недельного срока и подтверждения зрелости легочной ткани. Если параметры развития плода не удалось стабилизировать в течение 2 недель либо состояние ребенка ухудшилось (замедлился кровоток в основных сосудах, нарушилась сердечная деятельность), выполняется досрочное родоразрешение независимо от гестационного срока. II и III степени задержки развития с декомпенсацией плацентарной недостаточности (выраженными КТГ-признаками гипоксии, ретроградным кровотоком в пуповинной артерии или отсутствием его диастолического компонента) — показание для проведения досрочного кесарева сечения.
Прогноз и профилактика
При своевременной диагностике, правильной тактике ведения беременности, отсутствии тяжелых заболеваний женщины, грубых дефектов и выраженных расстройств со стороны плода прогноз благоприятный. Вероятность появления осложнений повышается с увеличением степени гипотрофии. Для профилактики задержки развития рекомендуется планировать беременность, заблаговременно пролечить экстрагенитальную и генитальную патологию, санировать очаги инфекции, рано встать на учет в женской консультации, регулярно посещать акушера-гинеколога, выполнять его рекомендации по обследованию и лечению. На развитие ребенка положительно влияют достаточный отдых и ночной сон, рациональная диета, умеренная двигательная активность, отказ от вредных привычек.
Нейробластома
Нейробластома – злокачественное новообразование симпатической нервной системы эмбрионального происхождения. Развивается у детей, обычно располагается в надпочечниках, забрюшинном пространстве, средостении, шее или области таза. Проявления зависят от локализации. Наиболее постоянными симптомами являются боли, повышение температуры и снижение веса. Нейробластома способна к регионарному и отдаленному метастазированию с поражением костей, печени, костного мозга и других органов. Диагноз устанавливается с учетом данных осмотра, УЗИ, КТ, МРТ, биопсии и других методик. Лечение – оперативное удаление неоплазии, радиотерапия, химиотерапия, пересадка костного мозга.
Нейробластома – недифференцированная злокачественная опухоль, происходящая из эмбриональных нейробластов симпатической нервной системы. Нейробластома является самой распространенной формой рака экстракраниальной локализации у детей раннего возраста. Составляет 14% от общего количества злокачественных новообразований у детей. Может быть врожденной. Нередко сочетается с пороками развития. Пик заболеваемости приходится на 2 года. В 90% случаев нейробластома диагностируется в возрасте до 5 лет. У подростков выявляется очень редко, у взрослых не развивается. В 32% случаев располагается в надпочечниках, в 28% - в забрюшинном пространстве, в 15% - в средостении, в 5,6% – в области таза и в 2% - в области шеи. В 17% случаев определить локализацию первичного узла не удается.
У 70% больных нейробластомой при постановке диагноза выявляются лимфогенные и гематогенные метастазы. Чаще всего поражаются регионарные лимфоузлы, костный мозг и кости, реже – печень и кожа. Крайне редко обнаруживаются вторичные очаги в головном мозге. Уникальной особенностью нейробластомы является способность к повышению уровня дифференцировки клеток с трансформацией в ганглионеврому. Ученые считают, что нейробластома в отдельных случаях может протекать бессимптомно и завершаться самостоятельной регрессией или созреванием до доброкачественной опухоли. Вместе с тем, часто наблюдаются быстрый агрессивный рост и раннее метастазирование. Лечение нейробластомы проводят специалисты в сфере онкологии, эндокринологии, пульмонологии и других областей медицины (в зависимости от локализации неоплазии).
Причины нейробластомы
Механизм возникновения нейробластомы пока не выяснен. Известно, что опухоль развивается из эмбриональных нейробластов, которые к моменту рождения ребенка не созрели до нервных клеток. Наличие эмбриональных нейробластов у новорожденного или ребенка младшего возраста не обязательно приводит к формированию нейробластомы – небольшие участки таких клеток часто выявляются у детей в возрасте до 3 месяцев. В последующем эмбриональные нейробласты могут трансформироваться в зрелую ткань или продолжить делиться и дать начало нейробластоме.
В качестве основной причины развития нейробластомы исследователи указывают приобретенные мутации, возникающие под влиянием различных неблагоприятных факторов, однако определить эти факторы пока не удалось. Отмечается корреляция между риском возникновения опухоли, аномалиями развития и врожденными нарушениями иммунитета. В 1-2% случаев нейробластома носит наследственный характер и передается по аутосомно-доминантному типу. Для семейной формы неоплазии типичен ранний возраст начала болезни (пик заболеваемости приходится на 8 месяцев) и одновременное или практически одновременное образование нескольких очагов.
Патогномоничным генетическим дефектом при нейробластоме является потеря участка короткого плеча 1-ой хромосомы. У трети пациентов в опухолевых клетках обнаруживаются экспрессия либо амплификация N-myc онкогена, подобные случаи рассматриваются как прогностически неблагоприятные из-за быстрого распространения процесса и устойчивости неоплазии к действию химиопрепаратов. При микроскопии нейробластомы выявляются круглые мелкие клетки с темными пятнистыми ядрами. Характерно наличие очагов кальцификации и кровоизлияний в ткани опухоли.
Классификация нейробластомы
Существует несколько классификаций нейробластомы, составленных с учетом размера и распространенности новообразования. Российские специалисты обычно используют классификацию, которую в упрощенном виде можно представить следующим образом:
- I стадия – выявляется одиночный узел размером не более 5 см. Лимфогенные и гематогенные метастазы отсутствуют.
- II стадия – определяется одиночное новообразование размером от 5 до 10 см. Признаки поражения лимфоузлов и отдаленных органов отсутствуют.
- III стадия – выявляется опухоль диаметром менее 10 см с вовлечением регионарных лимфоузлов, но без поражения отдаленных органов, либо опухоль диаметром более 10 см без поражения лимфоузлов и отдаленных органов.
- IVА стадия – определяется неоплазия любого размера с отдаленными метастазами. Оценить вовлеченность лимфоузлов не представляется возможным.
- IVВ стадия – выявляются множественные новообразования с синхронным ростом. Наличие либо отсутствие метастазов в лимфоузлы и отдаленные органы установить не удается.
Симптомы нейробластомы
Для нейробластомы характерно значительное разнообразие проявлений, что объясняется разными локализациями опухоли, вовлечением тех или иных близлежащих органов и нарушением функций отдаленных органов, пораженных метастазами. На начальных стадиях клиническая картина нейробластомы неспецифична. У 30-35% пациентов возникают локальные боли, у 25-30% наблюдается повышение температуры тела. 20% больных теряют в весе либо отстают от возрастной нормы при прибавке массы тела.
При расположении нейробластомы в забрюшинном пространстве первым симптомом заболевания могут стать узлы, определяемые при пальпации брюшной полости. В последующем нейробластома может распространяться через межвертебральные отверстия и вызывать компрессию спинного мозга с развитием компрессионной миелопатии, проявляющейся вялой нижней параплегии и расстройством функций тазовых органов. При локализации нейробластомы в зоне средостения наблюдаются затруднения дыхания, кашель, дисфагия и частые срыгивания. В процессе роста неоплазия вызывает деформацию грудной клетки.
При расположении новообразования в области таза возникают расстройства дефекации и мочеиспускания. При локализации нейробластомы в области шеи первым признаком болезни обычно становится пальпируемая опухоль. Может выявляться синдром Горнера, включающий в себя птоз, миоз, эндофтальм, ослабление реакции зрачка на свет, нарушения потоотделения, гиперемию кожи лица и конъюнктивы на стороне поражения.
Клинические проявления отдаленных метастазов при нейробластоме также отличаются большим разнообразием. При лимфогенном распространении выявляется увеличение лимфоузлов. При поражении скелета возникают боли в костях. При метастазировании нейробластомы в печень наблюдается быстрое увеличение органа, возможно – с развитием желтухи. При вовлечении костного мозга отмечаются анемия, тромбоцитопения и лейкопения, проявляющиеся вялостью, слабостью, повышенной кровоточивостью, склонностью к инфекциям и другими симптомами, напоминающими острый лейкоз. При поражении кожных покровов на коже больных нейробластомой образуются голубоватые, синеватые или красноватые плотные узлы.
Для нейробластомы также характерны метаболические расстройства в виде повышения уровня катехоламинов и (реже) вазоактивных интестинальных пептидов. У пациентов с такими расстройствами наблюдаются приступы, включающие в себя побледнение кожи, гипергидроз, диарею и повышение внутричерепного давления. После успешной терапии нейробластомы приступы становятся менее выраженными и постепенно исчезают.
Диагностика нейробластомы
Диагноз выставляют с учетом данных лабораторных анализов и инструментальных исследований. В список лабораторных методов, используемых в ходе диагностики нейробластомы, включают определение уровня катехоламинов в моче, уровня ферритина и мембрано-связанных гликолипидов в крови. Кроме того, в процессе обследования пациентам назначают тест на определение уровня нейронспецифической енолазы (NSE) в крови. Этот анализ не является специфичным для нейробластомы, поскольку увеличение количества NSE также может наблюдаться при лимфоме и саркоме Юинга, но имеет определенную прогностическую ценность: чем ниже уровень NSE, тем более благоприятно протекает заболевание.
План инструментального обследования в зависимости от локализации нейробластомы может включать в себя КТ, МРТ и УЗИ забрюшинного пространства, рентгенографию и КТ органов грудной клетки, МРТ мягких тканей шеи и другие диагностические процедуры. При подозрении на отдаленное метастазирование нейробластомы назначают радиоизотопную сцинтиграфию костей скелета, УЗИ печени, трепанобиопсию либо аспирационную биопсию костного мозга, биопсию кожных узлов и другие исследования.
Лечение нейробластомы
Лечение нейробластомы может проводиться с использованием химиотерапии, лучевой терапии и оперативных вмешательств. Тактику лечения определяют с учетом стадии болезни. При I и II стадии нейробластомы осуществляют хирургические вмешательства, иногда – на фоне предоперационной химиотерапии с использованием доксорубицина, цисплатина, винкристина, ифосфамида и других препаратов. При III стадии нейробластомы предоперационная химиотерапия становится обязательным элементом лечения. Назначение химиопрепаратов позволяет обеспечить регрессию новообразования для последующего проведения радикальной операции.
В некоторых случаях наряду с химиотерапией при нейробластомах применяют лучевую терапию, однако, в настоящее время этот метод все реже включают в схему лечения из-за высокого риска развития отдаленных осложнений у детей младшего возраста. Решение о необходимости лучевой терапии при нейробластоме принимают индивидуально. При облучении позвоночника учитывают возрастной уровень толерантности спинного мозга, при необходимости применяют защитные средства. При облучении верхних отделов туловища защищают плечевые суставы, при облучении таза – тазобедренные суставы и, по возможности, яичники. На IV стадии нейробластомы назначают высокодозную химиотерапию, выполняют трансплантацию костного мозга, возможно – в сочетании с хирургическим вмешательством и лучевой терапией.
Прогноз при нейробластоме
Прогноз при нейробластоме определяется возрастом ребенка, стадией заболевания, особенностями морфологического строения опухоли и уровнем ферритина в сыворотке крови. С учетом всех перечисленных факторов специалисты выделяют три группы больных нейробластомой: с благоприятным прогнозом (двухлетняя выживаемость составляет более 80%), с промежуточным прогнозом (двухлетняя выживаемость колеблется от 20 до 80%) и с неблагоприятным прогнозом (двухлетняя выживаемость составляет менее 20%).
Наиболее значимым фактором является возраст пациента. У больных младше 1 года прогноз при нейробластоме более благоприятный. В качестве следующего по значимости прогностического признака специалисты указывают локализацию неоплазии. Больше всего неблагоприятных исходов наблюдается при нейробластомах в забрюшинном пространстве, меньше всего – в средостении. Обнаружение в образце ткани дифференцированных клеток свидетельствует о достаточно высокой вероятности выздоровления.
Средняя пятилетняя выживаемость пациентов с нейробластомой I стадии составляет около 90%, II стадии – от 70 до 80%, III стадии – от 40 до 70%. У больных с IV стадией этот показатель существенно меняется в зависимости от возраста. В группе детей до 1 года, имеющих нейробластому IV стадии, пять лет с момента постановки диагноза удается прожить 60% пациентов, в группе детей от 1 до 2 лет – 20%, в группе детей старше 2 лет – 10%. Профилактические меры не разработаны. При наличии случаев заболевания нейробластомой в семье рекомендуется консультация генетика.
Нефробластома
UPD 13.04.2021
Нефробластома, или опухоль Вилмса – опухоль почки, составляет 6% от всех злокачественных опухолей детского возраста. Опухоль названа по фамилии немецкого хирурга Макса Вильмса, впервые описавшего это заболевание в конце XVIII века.
Стандартом в лечении нефробластомы является комплексный подход: химиотерапия, туморнефроуретерэктомия и лучевая терапия. Прогноз заболевания при современных подходах к терапии благоприятный: выживаемость достигает 80%.
Распространенность нефробластом у детей
- Нефробластома – врожденная эмбриональная злокачественная опухоль почки.
- Заболеваемость составляет 1:100000 детей в возрасте до 14 лет.
- Опухоль выявляется преимущественно в возрасте 1-6 лет.
- Нет различий заболеваемости по полу.
- В 5% случаев наблюдаются двусторонние нефробластомы.

Точные причины возникновения опухоли Вильмса не установлены. Предполагается связь развития заболевания с мутацией в гене 1 опухоли Вильмса (WT 1), расположенного на 11 хромосоме. Этот ген важен для нормального развития почек и любые поломки в нем могут приводить к возникновению опухоли либо других аномалий развития почек. В 12-15% случаев опухоль Вильмса развивается у детей с врожденными аномалиями развития. Чаще всего имеют место аниридия (отсутствие радужной оболочки), синдром Беквита-Видемана (висцеропатия, макроглоссия, пупочная грыжа, грыжа белой линии живота, олигофрения, микроцефалия, гипогликемия, постнатальный гигантизм), урогенитальные аномалии, синдром WAIR (опухоль Вильмса, аниридия, мочеполовые аномалии, олигофрения), синдром Дениса-Драша (Опухоль Вильмса, нефропатия, аномалия гениталий, задержка роста, аномалии ушной раковины).
Если у кого-либо в семье уже была опухоль Вильмса, то у ребенка из этой семьи повышается вероятность заболеть нефробластомой. Частота «семейных» случаев, однако, не превышает 1%, при этом, как правило, опухолью поражаются обе почки.
Классификация опухолей почек у детей
Существует гистологическое и клиническое стадирование опухоли Вильмса:
I) Гистологическое стадирование по Smidt/Harms проводится после удаления новообразования и предусматривает выделение 3х степеней злокачественности, влияющих на прогноз заболевания (низкой, средней и высокой) в зависимости от строения опухоли.
II) Клиническое стадирование
В настоящее время используют единую систему стадирования нефробластомы, которая является определяющей для лечения:
I стадия – опухоль локализуется в пределах почки, возможно полное удаление
II стадия – опухоль распространяется за пределы почки, возможно полное удаление, в т.ч.:
- прорастание капсулы почки, с распространением в околопочечную клетчатку и/или в ворота почки,
- поражение регионарных лимфатических узлов (стадия II N+),
- поражение внепочечных сосудов,
- поражение мочеточника
III стадия — опухоль распространяется за пределы почки, возможно неполное удаление, в т.ч.:
- в случае инцизионной или аспирационной биопсии,
- пред- или интраоперационный разрыв,
- метастазы по брюшине,
- поражение внутрибрюшных лимфоузлов, за исключением регионарных,
- опухолевый выпот в брюшную полость,
- нерадикальное удаление
IV стадия – наличие отдалённых метастазов
V стадия – двусторонняя нефробластома
Классификация нефробластомы по системе TNM в настоящее время сохраняет, в основном, историческое значение и в клинической практике не используется.
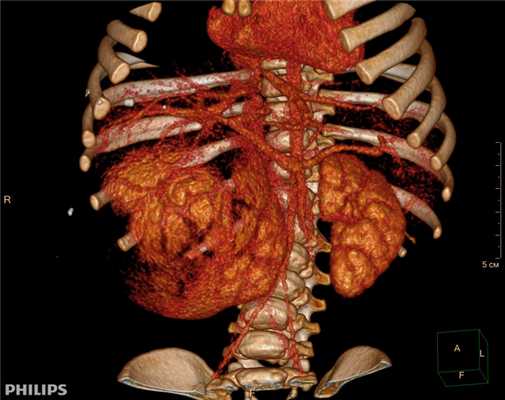
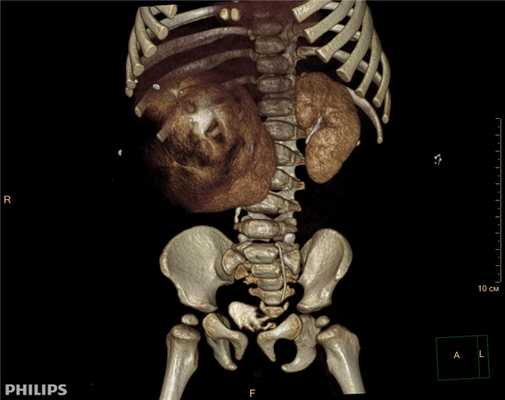
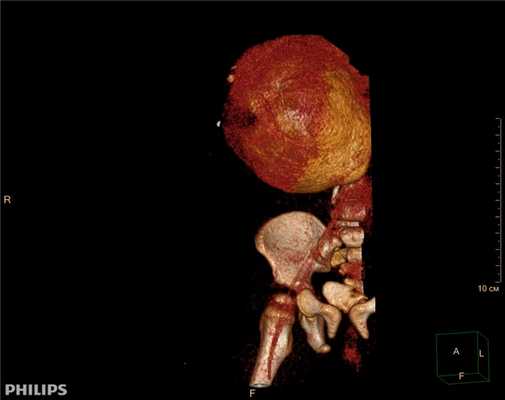
3D-реконструкции опухоли Вильмса пациентов детского отделения НМИЦ онкологии им. Н.Н. Петрова
Клинические симптомы опухоли почки у детей
Нефробластома может длительное время протекать бессимптомно. Первым признаком заболевания, который замечают родители, является увеличение размеров живота. Иногда ребенок жалуется на боли в животе. При микроскопическом исследовании мочи можно выявить микрогематурию.

Диагностика нефробластомы
Диагностические мероприятия при подозрении на опухоль Вильмса направлены, в первую очередь, на морфологическую верификацию диагноза и определение степени распространенности процесса в организме.
Основными инструментальными методами в диагностике опухоли почек у детей и подростков являются:
- и забрюшинного пространства.
- Компьютерная томография органов брюшной полости и забрюшинного пространства с оральным и внутривенным контрастированием.
- Магнитно-резонансная томография брюшной полости и забрюшинного пространства без и с контрастным усилением (даёт дополнительную информацию о распространённости и связи опухоли с окружающими органами).
- Радиоизотопное исследование почек – реносцинтиграфия позволяет оценить как суммарную функцию почек, так и отдельно функцию каждой из них.
- Для исключения метастатического поражения легких проводятся рентгенография и компьютерная томография органов грудной клетки.
Лабораторные исследования являются рутинными и включают в себя: клинический анализ крови, общий анализ мочи, биохимический анализ крови.
Непременным условием для постановки диагноза является выполнение тонкоигольной аспирационной биопсии опухоли под УЗИ-навигацией с проведением цитологического исследования полученного материала.
Опухоль Вильмса. Компьютерная томография
После удаления опухоли проводится ее морфологическое исследование. В зависимости от гистологического строения (мезобластическая нефрома, фетальная рабдомиоматозная нефробластома, кистозная частично дифференцированная нефробластома, классический» вариант без анаплазии, нефробластома с фокальной анаплазией, нефробластома с диффузной анаплазией) больные стратифицируются на группы риска.
Общие принципы лечения опухолей почки у детей и подростков
Лечение нефробластомы у детей проводится по стандартным методикам, принятым в европейских странах, и включает проведение неоадьювантного курса полихимиотерапии, операции – туморнефроуретерэктомии, послеоперационной химиотерапии и, по показаниям, лучевой терапии.
Предоперационный курс химиотерапии длится от 4 до 6 (при IV стадии) недель. Задача терапии – максимальное уменьшение размеров опухоли с целью предотвращения ее интраоперационного разрыва, т.е. во время операции и достижения максимальной резектабельности – возможности удалить больной орган. Базовыми препаратами, используемыми в данном курсе, являются винкристин и дактиномицин.
Оперативный этап лечения опухоли почки заключается в радикальном одномоментном удалении всей ткани опухоли. Туморнефроуретерэктомию проводят из срединного доступа. Обязательной является ревизия печени, контралатеральной почки и регионарных лимфатических узлов.
За последние десятилетия накоплен значительный опыт резекций почек при односторонней опухоли Вильмса, показавший сравнимые с классической нефрэктомией отдаленные результаты.
Лапароскопическая нефрэктомия при опухоли Вильмса впервые была выполнена в 2004 г. в университете Сан Пауло (Бразилия) у детей, получавших неоадъювантную терапию по протоколу SIOP-2001. К настоящему времени уже накоплен большой опыт ее применения, в том числе и в нашем Центре, позволяющий использовать минимально инвазивную хирургию не менее чем у 20% пациентов.
Метод лапароскопической ассистированной резекции почки возможен у пациентов с односторонней опухолью Вильмса только после неоадъювантной ПХТ и при соблюдении условий, оговоренных протоколом SIOP-RTSG 2016 «UMBRELLA»:
- объем первичной опухоли менее 300 мл;
- периферическая локализация и унифокальность;
- отсутствие инвазии в лоханку по данным предоперационной визуализации;
- отсутствие опухолевых тромбов и инвазии в соседние органы и ткани;
- отсутствие признаков разрыва капсулы, возможность радикального удаления опухоли при сохранении более 66% здоровой почечной ткани.
Послеоперационная химиотерапия проводится после разделения больных на группы риска в соответствии с гистологической структурой опухоли и стадии заболевания.
Лучевая терапия проводится параллельно послеоперационной полихимиотерапии, начинается на 2–3 неделе после удаления опухоли. Длительность лучевой терапии составляет 7–10 дней. Объем облучения зависит от результатов операции.
Диспансерное наблюдение при нефробластомах
Наблюдение за излеченными пациентами осуществляется для выявления рецидива и отдаленных последствий лечения.

В течение первых двух лет после окончания терапии пациенты обследуются каждые три месяца. Далее, до достижения пятилетнего срока наблюдения – каждые 6 месяцев. В алгоритм обследования включаются: УЗИ органов брюшной полости, рентгенография органов грудной клетки при каждом визите. При необходимости дополнительно рекомендуются проведение исследования функции почки (анализ мочи, биохимическое исследование крови, ренография), углубленное исследование сердечно-сосудистой деятельности (ЭКГ, ЭХО-КГ), исследование слуха методом аудиометрии.
После пяти лет наблюдения пациенты обследуются не чаще одного раза в год.
Все дети, закончившие программное лечение, могут продолжить посещение организованных детских коллективов (школа, детский сад).
Нейробластома – эмбриональная опухоль, возникающая в процессе внутриутробного или раннего постнатального периода жизни из стволовых нервных клеток – нейробластов.
Впервые описание этой опухоли, названной впоследствии «детской глиомой», дал Рудольф Людвиг Карл Вирхов в 1864 году. Позднее в 1891 году немецким ученым патоморфологом Феликсом Маршандом был определен источник опухоли – клетки симпатической нервной системы и надпочечники. Симпатическая нервная система – это часть автономной (вегетативной) нервной системы. Она контролирует непроизвольную работу внутренних органов человека, например, работу сердца, кишечника, мочевого пузыря, процесс кровообращения.
Эпидемиология
Нейробластома составляет около 7-8% от всех злокачественных новообразований в детском и подростковом возрасте. Это наиболее часто возникающий вид детских новообразований после опухолей кроветворной и центральной нервной системы. Примерно 40% случаев заболевания встречается на первом году жизни, с возрастом количество случаев уменьшается. Средний возраст на момент диагностирования составляет 19 месяцев.
Причины и риски
Причины появления опухоли до конца не изучены. Нейробластома возникает в том случае, когда нормальные нейробласты не созревают в нервные клетки. Вместо этого они продолжают бесконтрольно расти и делиться. Предполагают, что эти несозревшие (эмбриональные) нервные клетки начинают мутировать еще до рождения ребенка, когда начинают меняться хромосомы и/или происходит сбой в регулировании работы генов. Как подтверждают актуальные исследования, у большинства детей болезнь не является наследственной̆. Только около 1% случаев нейробластомы имеют наследственную основу, чаще всего, вследствие мутаций в гене, который̆ называется ALK (или ген киназы анапластической лимфомы), либо в гене PHOX2B. На сегодняшний̆ день нет клинических исследований, доказывающих, что внешние факторы (окружающая среда, вредные условия работы родителей ребенка, прием каких-либо медикаментов, курение и употребление алкоголя во время беременности) могут стать причиной болезни.
Клиническая картина при нейробластоме
Нейробластома может возникать в любой анатомической области, где располагается симпатическая нервная система: надпочечники, шейный, грудной и брюшной симпатический отделы, параганглии.
Самой частой локализацией нейробластомы является забрюшинное пространство (одинаково часто опухоль диагностируется в надпочечниках и паравертебральных забрюшинных ганглиях). У 15% детей нейробластома локализуется в заднем средостении. Реже опухоль возникает в области таза (6%) и шеи (2%) (рис. 1).
Рис. 1. Локализация нейробластомы
При ранних стадиях заболевания у многих детей может не быть никаких симптомов. Опухоль у них находят случайно, например, при плановом УЗИ обследовании младенцев при диспансеризации. Как правило, жалобы у детей появляются тогда, когда опухоль уже успела сильно вырасти и давит на соседние органы, нарушая их работу, или когда опухоль дала метастазы.
Среди общих симптомов заболевания можно выделить следующие: потеря веса, слабость, костные и суставные боли, некупируемая диарея.
Большинство проявлений болезни и их выраженность зависят от расположения опухоли и ее взаимосвязи с соседними органами и тканями. Так, для пациентов в возрасте до 2-х лет при забрюшинной локализации характерно увеличение размеров живота, лихорадка и потеря веса. Нейробластома забрюшинного пространства пальпируется через переднюю брюшную стенку в виде бугристого, несмещаемого опухолевого узла (рис. 2). У детей старшего возраста заболевание может манифестировать болевым синдромом, обусловленным метастатическим поражением костей, респираторными нарушениями, увеличением размеров живота, появлением запоров. У пациентов с большими забрюшинными опухолями можно обнаружить развитую сеть подкожных вен, развернутые края грудной клетки.
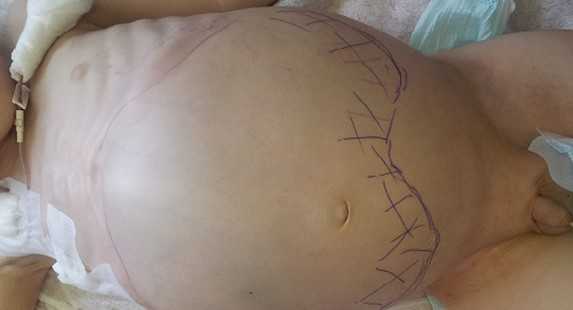
Рис. 2. Нейробластома забрюшинного пространства
Локализация опухоли в шейно-грудном отделе симпатического отдела позвоночника вызывает синдром Горнера (сужение зрачка, разные размеры зрачков, покраснение и/или опущение верхнего века и небольшое поднятие нижнего). Другими изменениями в области глаз могут быть кровоизлияния в кожу или слизистую оболочку, «синяки» на веках и под глазами. На поздней стадии болезни иногда появляются черные круги вокруг глаз (гематома в виде очков) (рис. 3).
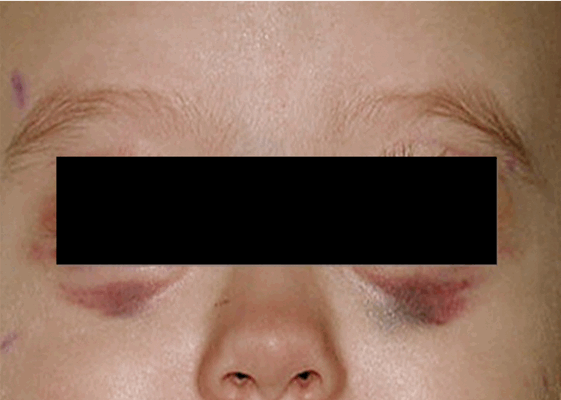
Рис. 3.1. Симптом «очков»
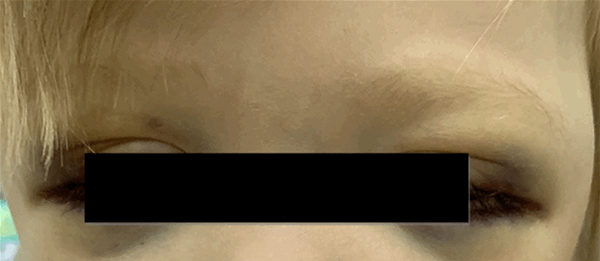
Рис. 3.2. Симптом «очков» при метастазах в орбиту
Поражение заднего средостения может стать причиной сухого кашля, дыхательных расстройств, деформации грудной клетки, частого срыгивания. При локализации опухоли в полости таза отмечают нарушение функции тазовых органов (периодическое недержание мочи, нарушение акта дефекации), отёки нижних конечностей.
При распространении опухоли в позвоночный канал и сдавлении ею спинного мозга могут развиваться слабость в ногах, неустойивость походки, параличи нижних конечностей, а также дисфункции органов малого таза (задержка мочеиспускания или непроизвольное мочеиспускание, запоры).
Редко, примерно в 2-4% всех случаев, у детей встречается ассоциированный с нейробластомой церебеллярный синдром («опсоклонус-миоклонус» или энцефалопатия Кинсбурна), характеризующийся некоординированными, нерегулярными движениями туловища и конечностей, миоклонусом и хаотичными движениями глазных яблок.
Нейробластома ‒ гормонопродуцирующая опухоль, способная к секреции физиологически активных веществ – катехоламинов ‒ адреналина, норадреналина и дофамина. В моче, как правило, повышено выведение их метаболитов ‒ ванилилминдальной и гомованилиновой кислот. В 95% случаев гормональная активность нейробластомы тем больше, чем выше степень её злокачественности. Эффекты секретируемых гормонов вызывают специфические клинические симптомы нейробластомы ‒ резкое повышение артериального давления, диарею (вызывается секрецией вазоактивного интестинального полипептида), потливость, эмоциональную лабильность, периодическое повышение температуры.
Нейробластома метастазирует чаще всего в костный мозг, кости, в отдаленные лимфатические узлы, печень или кожу, редко — в головной мозг или легкие. Признаки отдалённых метастазов можно обнаружить в виде экзофтальма, кровоизлияний в орбиты, опухолевых узлов на голове.
Среди особенностей течения нейробластомы можно выделить следующие:
- Регрессия – способность опухоли к спонтанному или индуцированному минимальной полихимиотерапией или лучевой терапией уменьшению (инволюции). Как правило, это происходит у детей до 1 года с IVS стадией заболевания.
- Реверсия – способность опухоли трансформироваться из более злокачественных форм в доброкачественные ганглионевромы (спонтанно или индуцированно).
- В некоторых случаях опухолевый процесс имеет обратную направленность: склонность к агрессивному течению и быстрому метастазированию.
Гистологическая классификация
Существующая гистологическая классификация нейробластомы INPC-Shimada основана на степени зрелости (дифференцировки) опухолевой ткани и выделяет 4 категории (от недифференцированных до зрелых форм):
1) нейробластома, бедная шванновской стромой: недифференцированная, низкодифференцированная, дифференцированная;
2) нодулярная ганглионейробластома;
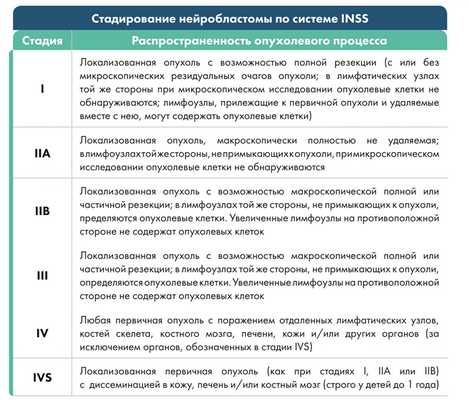
Стадии заболевания
Существует несколько систем стадирования нейробластомы. Наиболее точной является модифицированная система, разработанная Международным противораковым союзом (INSS) (табл. 1).
Лабораторные методы
В клиническом анализе крови при поражении костного мозга может наблюдаться снижение показателей крови: анемия, лейконейтропения, тромбоцитопения.
В сыворотке крови также можно определить специфические для нейробластомы маркеры: нейрон-специфическую енолазу (НСЕ), уровень метаболитов катехоламинов, лактатдегидрогеназу (ЛДГ) и ферритин.
Простым в выполнении специализированным тестом при диагностировании нейробластомы является определение уровня ванилилминдальной и гомованилиновой кислот в анализе мочи. Их также называют «тестом на оценку метаболитов катехоламинов в моче». Данный анализ может проводиться при сборе мочи ребенка в течение суток или в однократной порции мочи.
Перед началом специфической терапии всегда проводится верификация диагноза; диагноз нейробластомы ставится при гистологическом исследовании биоптата первичной опухоли или метастазов, или при сочетании наличия опухолевых клеток в костном мозге и повышенного уровня суточной экскреции катехоламинов.
Молекулярно-генетическое исследование
Для установления степени злокачественности нейробластомы выполняется ряд генетических исследований: мутация MYCN, делеция хромосом 1р или 11q . Наличие данных мутаций является неблагоприятным фактором прогноза заболевания.
Инструментальные методы
Ультразвуковое исследование
Ультразвуковой метод исследования позволяет выявить наличие опухоли и ее расположение по отношению к внутренним органам. УЗИ позволяет оценить степень местного и отдаленного распространения злокачественного процесса и выявляет метастатическое поражение печени и лимфатических узлов (рис. 4).
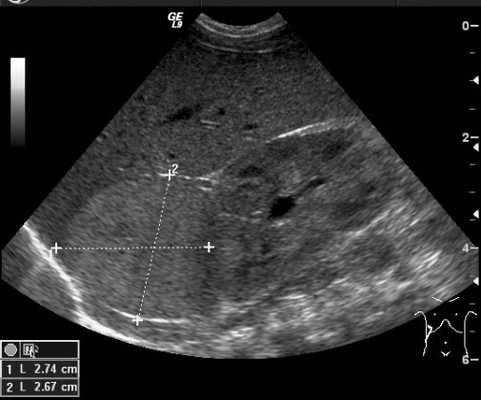
Рис. 4. УЗИ образования правого надпочечника
Компьютерная томография брюшной полости и забрюшинного пространства
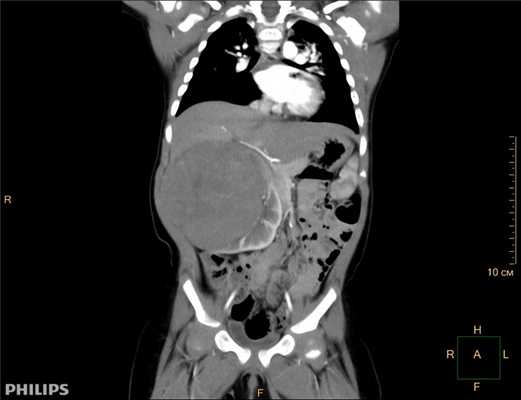
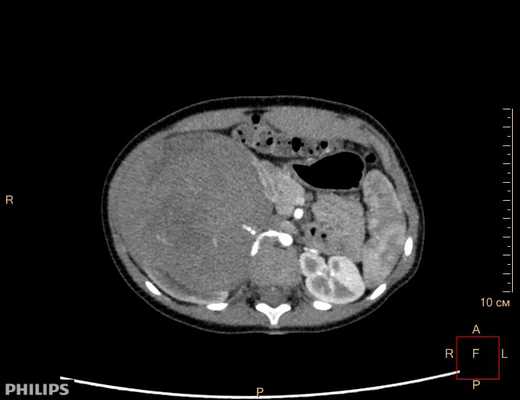
Компьютерная томография более детально дает информацию об анатомическом отношении опухоли к окружающим тканям и органам, позволяет оценить структуру опухоли (рис. 5).
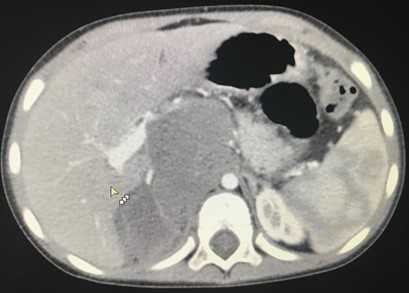
Рис. 5. КТ нейрогенного образования забрюшинного пространства справа
Магнитно-резонансная томография органов брюшной полости, забрюшинного пространства и позвоночника
МРТ органов брюшной полости и забрюшинного пространства ‒ это безопасный и высокоинформативный метод исследования, который позволяет не только уточнить локализацию опухоли, точные размеры новообразования и соотношение его с окружающими тканями, но и выявить метастатические очаги в печени и брюшной полости. Также МРТ дает возможность оценить состояние костных структур и мягких тканей позвоночного столба и позвоночного канала (рис. 6).
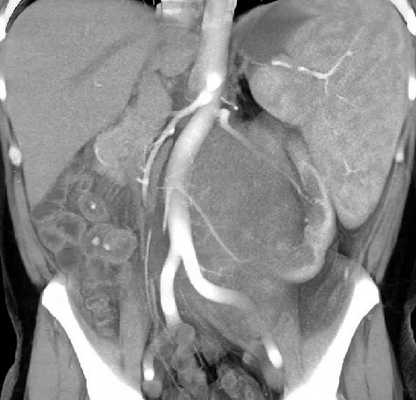
Рис. 6. МРТ нейрогенного образования забрюшинного пространства слева
Радиоизотопные исследования
Одним из наиболее информативных специфических методов топической диагностики нейробластом является сцинтиграфия с метайодбензилгуанидином (МЙБГ), меченным 123I. МЙБГ по своей химической структуре сходен с катехоламинами в организме. Это вещество концентрируется в тех опухолях, которые вырабатывают катехоламины. МЙБГ метят радиоактивным изотопом йода (например, 123I) в безопасной для жизни дозе, и готовый препарат внутривенно вводят в кровоток. Накапливаясь в клетках опухоли, он дает излучение. Эти сигналы регистрирует специальная камера и переводит их в изображение. Таким образом, метод позволяет выявить не только первичную опухоль, но и наличие регионарных и отдаленных метастазов (рис. 7).
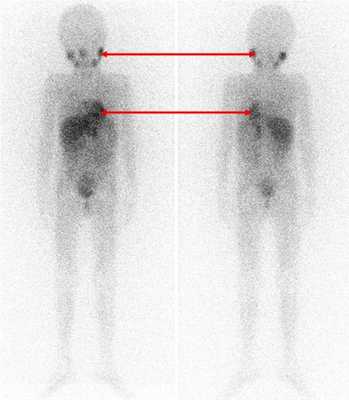
Рис. 7. Сцинтиграфия с метайодбензилгуанидином (визуализируется первичная паравертебральная опухоль с метастазами в кости черепа)
Остеосцинтиграфия – метод сканирования костей скелета с помощью внутривенного введения радиофармпрепарата. Радиофармпрепарат накапливается участками, пораженными опухолевыми клетками в костях, что видно на снимках, выполняемых гамма-камерой. Таким образом, данный метод исследования позволяет выявить возможные метастазы костей скелета.
Исследование костного мозга (миелограмма и трепанобиопсия) используется для уточнения наличия поражения опухолевыми клетками костного мозга.
Учитывая разнообразные сценарии развития исхода заболевания (от спонтанной регрессии до летального исхода от прогрессирования), в терапии нейробластомы предлагаются риск-адаптированные принципы. Стратификация пациентов проводится согласно факторам риска до начала лечения (как правило, это клинические и молекулярно-генетические данные) и на основании ответа опухоли во время лечения (response-adapted). При выделении групп риска перед началом лечения используются следующие прогностические критерии: стадия заболевания, возраст на момент диагностики, результаты молекулярно-генетических данных — амплификация MYCN и делеция короткого плеча 1р (рис. 8).
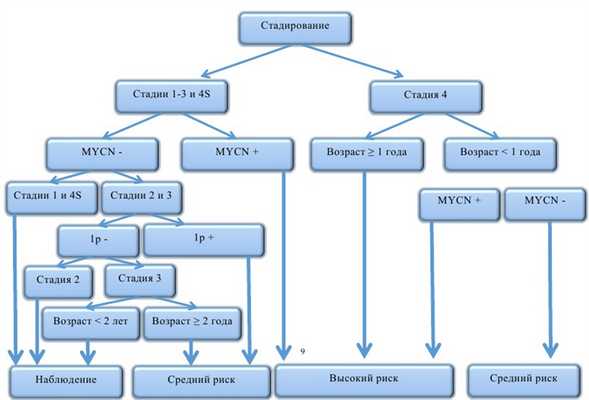
Рис. 8. Стратификация пациентов на группы риска согласно наличию факторов неблагоприятного прогноза
Неоадъювантная (предоперационая) полихимиотерапия
- Необходимость проведения полихимиотерапии определяется стадией заболевания и наличием или отсутствием неблагоприятных клинических и биологических факторов (n-myc амплификация, делеции короткого плеча 1р).
- Полихимиотерапия позволяет уменьшить размеры первичной опухоли, чтобы сделать хирургическое вмешательство более безопасным и радикальным.
- Базовыми препаратами для лечения нейробластомы являются винкристин, циклофосфамид, антрациклины, ифосфамид, препараты платины, этопозид.
Особенности хирургического лечения
- При локализованных стадиях заболевания лечение может ограничиться полным удалением опухоли.
- При III-IV стадиях заболевания оперативный этап проводится после проведения предоперационной (неоадъювантной) полихимиотерапии, которая направлена на сокращение размеров опухоли с целью последующего радикального удаления образования.
- В тех случаях, когда полное удаление опухоли невозможно, в послеоперационном периоде лечение дополняется лучевой терапией.
Адъювантная (постоперационная) полихимиотерапия
Лекарственное лечение необходимо начать через 5-7 дней после оперативного вмешательства. При отсутствии показаний для проведения 2-й линии полихимиотерапии в схемах лечения используются те же базовые препараты, как и при неоадъювантной терапии.
Лучевая терапия
- Лучевая терапия используется для уничтожения любых опухолевых клеток, которые невозможно удалить хирургическим путем и/или которые не были разрушены посредством предыдущих терапий.
- При нерадикальном характере операции с наличием активной остаточной опухоли проводится облучение остаточной опухолевой ткани, вовлеченных в процесс лимфатических узлов и зон связи опухоли с окружающими органами и тканями.
- Облучение осуществляется ежедневно, начиная с 5-7-го дня после операции.
- По показаниям проводится облучение метастатических очагов (с лечебной, иногда с противоболевой целью).
В случае наличия неблагоприятных прогностических факторов, в частности выявления в опухоли мутации MYCN онкогена, рекомендовано проведение высокодозной полихимиотерапии с аутологичной трансплантацией гемопоэтических стволовых клеток.
Для больных с высоким риском развития рецидива (распространенные стадии заболевания с наличием неблагоприятных молекулярно-генетических маркеров) рекомендовано проведение «поддерживающей» дифференцирующей терапии 13-цис-ретиноевой кислотой и пассивной иммунотерапией антиGD2 моноклональными антителами.
Иммунотерапия
Иммунотерапия – новый метод лечения нейробластомы, который используется для уничтожения раковых клеток. Дисиалоганглиозид GD2 – молекула- антиген, экспрессируемая клетками нейробластомы, это делает ее идеальной мишенью для иммунотерапии антителами: антитело действует против этой молекулы. Клетки иммунной системы могут способствовать гибели клеток нейробластомы.
В НМИЦ онкологии им. Н.Н. Петрова проводятся все этапы лечения, включая минимально-инвазивные операции (лапаро- и торакоскопические), тандемную трансплантацию и пассивную иммунотерапию.
Интенсифицируя терапию у детей с нейробластомой группы высокого риска (с включением тандемной высокодозной полихимиотерапии в консолидацию и пассивной иммунотерапии в постконсолидацию) удалось повысить результаты выживаемости на 20%.
Рекомендации после лечения
- После успешного лечения нейробластомы ребенку необходимо проходить врачебный контроль, который может включать осмотр и консультацию детского онколога, анализ крови на онкомаркеры (ЛДГ, НСЕ), анализ мочи на метаболиты катехоламинов, УЗИ и КТ/МРТ, сцинтиграфию с МЙБГ и другие исследования.
- Детский онколог проводит осмотр 1 раз в 1,5-2 мес в течение первого года после окончания лечения, 1 раз в 3 мес ‒ в течение 2-го года, 1 раз в 6 мес ‒ на протяжении следующих 2 лет, в дальнейшем ‒ 1 раз в год.
- С учета больных не снимают.
СПИСОК ЛИТЕРАТУРЫ
Авторы:

- Изможерова Рина Игоревна;
- Сенчуров Евгений Михайлович;
- Михайлова Елена Андреевна;
- Иванова Светлана Вячеславовна;
- Фасеева Наталья Дмитриевна;
- Борокшинова Ксения Михайловна;
- Жук Ирина Николаевна.

Под научной редакцией:
Кулева С.А.
Заведующий детским онкологическим отделением, врач-детский онколог, ведущий научный сотрудник, профессор, доктор медицинских наук, главный внештатный детский специалист-онколог Комитета по здравоохранению Санкт-Петербурга
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Читайте также:
