Зависимость доза-эффект
Добавил пользователь Владимир З. Обновлено: 17.01.2026
Постепенно накопилась довольно обширная информация о взаимосвязи между дозой и последствиями облучения для микроорганизмов, изолированных клеток, выращенных in vitro, и для животных. Естественно, что на разных уровнях биологической организации эти зависимости будут в той или иной мере отличаться друг от друга. Подойти к решению возникающих здесь задач позволяет количественная радиобиология, основывающаяся на двух положениях:
- 1) классической теории мишени и принципе попадания;
- 2) стохастической теории, являющейся логической ступенью в развитии классической теории.
Большой вклад в эту область внесли труды Д. Кроузера, Н. В. Тимо- феева-Рессовского, К. Циммера, Д. Ли, О. Хуга и А. Келлерера. В основе классической теории мишени, возникшей много десятилетий назад, лежат два принципа: принцип попаданий, отражающий дискретность процесса поглощения энергии и вероятностный его характер; и принцип мишени, отражающий структурированность клетки и ее гетерогенность в морфологическом и функциональном отношениях. Ответ на облучение зависит от вероятности попадания в те или иные резко различающиеся по функциональной значимости внутриклеточные структуры. Если при анализе зависимости эффекта от дозы принять в качестве регистрируемой реакции долю пораженных объектов, то легко обнаружить, что:
- 1) большинство клеточных реакций протекает при отсутствии порога;
- 2) с повышением дозы кривые выживания отражают не столько степень проявления эффекта у отдельных клеток, сколько увеличение доли пораженных единиц, т. е. возрастание вероятности проявления регистрируемой реакции.
При рассмотрении радиобиологических эффектов на молекулярном или клеточном уровнях термин «мишень» был использован для формального обозначения того микрообъема, в котором должны произойти одна, две или много ионизаций, приводящих к изучаемому эффекту. В этом плане различают одно-, двух- или многоударные объекты или реакции, причем учитываются попадания в одну или разные мишени, которые функционально связаны. Первые попытки применения теории мишени для объяснения природы и этапов формирования конечных лучевых реакций клеток и тем более организмов были недостаточно корректны. Причина состояла в том, что при формулировании самих понятий попадания или мишеней не имелись в виду какие-то конкретные физико-химические или биохимические процессы, происходящие в микрообъеме. Сейчас с помощью модернизированной теории количественной радиобиологии удается объяснить многие экспериментальные данные, например кривые выживания.
С целью анализа зависимостей «доза — эффект» обратимся сначала к классической теории мишени. Пусть количество попаданий прямо пропорционально дозе излучения и даже одно попадание поражает мишень. Тогда при малых дозах число пораженных мишеней пропорционально числу попаданий и зависимость доли пораженных мишеней от дозы оказывается линейной (рис. 4.4, а). С повышением дозы вероятность попадания в одну и ту же мишень увеличивается. Хотя общее число попаданий остается пропорциональным дозе, их эффективность (на единицу дозы) уменьшается, так как мы решили, что для поражения мишени достаточно одного попадания. Количество пораженных мишеней возрастает все медленнее, асимптотически приближаясь к 100 % (см. рис. 4.4, б). Можно показать, что количество жизнеспособных объектов с увеличением дозы уменьшается в экспоненциальной зависимости от дозы.
Для большинства клеток животного происхождения одно попадание не поражает объект и наблюдаются зависимости, имеющие S-образную форму (см. рис. 4.5). В этих случаях говорят о многоударном процессе, имея в виду то, что для поражения объекта необходимо два и более попаданий в единственную мишень или поражение двух мишеней одновременно.
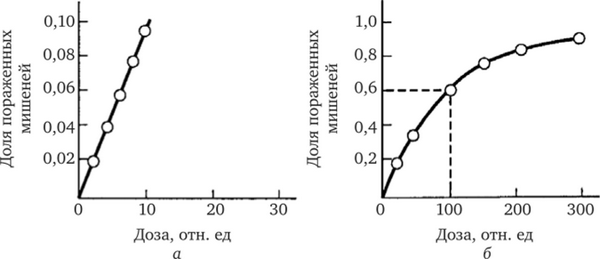
Рис. 4.4. Зависимости изменения эффекта от дозы в тех случаях, когда для поражения мишени достаточно одного попадания:
а и б — соответственно при малых и больших дозах
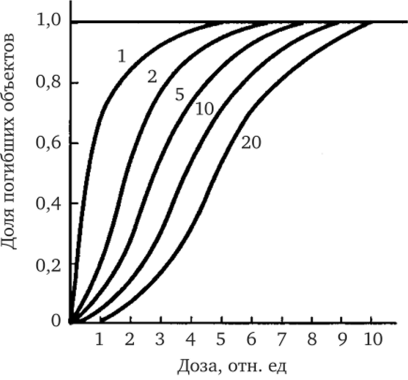
Рис. 4.5. Дозовые кривые выживания для объектов с различной ударностью (л) мишени:
п — число ударов (актов ионизации), которое нужно передать мишени для ее поражения. Все зависимости, кроме случая п = 1, это S-образные, или сигмоидные, кривые
В рамках теории мишени находит естественное объяснение радиобиологический парадокс — гибель клетки происходит в результате поглощения ничтожной по величине энергии, а именно в результате дискретного ее выделения в крошечном, но жизненно важном микрообъеме (мишени), например в молекуле ДНК.
Накопление новых данных, таких, например, как уже упоминавшаяся роль радиолиза, требовало модернизации классической теории и в 1960-ые гг. была развита «теория попаданий на основе стохастического принципа» [1] . Развивая дальше то положение, что зависимость «доза — эффект» является отражением квантованного характера взаимодействия излучения с веществом и наличия в клетках высокочувствительных объемов — мишеней, стохастическая теория позволила учесть и то, что при формировании радиобиологического эффекта всегда существует суперпозиция множества случайных событий.
Любой биологический объект, в том числе и клетка, выступает в качестве динамической системы, которая постоянно переходит из одного состояния в другое. Эти переходы связаны с множеством сопряженных реакций отдельных клеточных органелл и макромолекул. Поэтому любое критическое событие, например митоз или гибель клетки, можно предсказать лишь с известной вероятностью. Теперь мишенями оказываются все компоненты живой системы, а регистрируемая реакция обусловлена суперпозицией самых разных событий.
Стохастическая теория учитывает как физиологические, так и индуцированные излучением процессы в их динамике, в то время как классическая теория мишени рассматривает эффекты, вызванные облучением, как строго детерминированные первичными актами поглощения энергии. Выводы теории мишени могут быть получены как частный случай стохастического подхода.
Репаративные процессы, сказывающиеся на конечном эффекте, учитываются понятием компенсационной способности объекта. При анализе зависимостей «доза — эффект», с учетом функциональной изменчивости биологических объектов, стохастическая концепция позволяет понять следующее. При рассмотрении зависимостей, подобных представленным на рис. 4.4, б и 4.5 (n = 1), мы обнаруживаем отрезки кривых, соответствующих экспоненте. Это говорит о том, что система в этих случаях не обладает компенсаторными механизмами. Сигмоидные кривые соответствуют системам, обладающим такими механизмами. Эффективность компенсаторных механизмов снижается при возрастании дозы излучения. Число ударов, представленное на рис. 4.5, следует рассматривать как количественное выражение компенсационной способности облучаемого объекта, а не как «число мишеней».
Стохастическая концепция предлагает как бы более «биологическую» интерпретацию кривых «доза — эффект» по сравнению с их объяснением с позиций теории мишени, хотя основное положение последней о том, что эти кривые определяются в основном случайным характером поглощения энергии, остается незыблемым.
При современных теоретических рассмотрениях дискретность воздействия радиационного агента и функциональная негомогенность биологического объекта не ставятся под сомнение. Однако в классической теории мишеней негомогенность определяется наличием фиксированных мишеней, поражение которых уже определяет конечный эффект. Согласно современным представлениям такая точка зрения некорректна, она дополнена идеей об определяющей роли физиологических процессов и их радиационных нарушениях. Основные понятия классической теории: попадание и мишень — получили теперь расширительное толкование, поскольку в каждом конкретном случае критическими могут быть отдельные стадии клеточного цикла, разные виды клеток, тканей, органы и системы. Соответственно оказывается возможным более полное объяснение радиобиологического парадокса на уровне организма и зависимости эффектов от условий радиационного воздействия (качества излучения, величины дозы и ее распределения во времени).
В практическом плане мы уже разделили эффекты на детерминированные и стохастические и теперь рассмотрим зависимости «доза — эффект» с учетом этого обстоятельства. Мы уже отмечали, что при больших дозах гибель клеток может оказаться столь значительной, что приведет к заметным изменениям ткани. Чувствительность тканей in vivo в первую очередь определяется характеристиками выживания клетки. Чтобы достигнуть уровня обнаружения конкретного детерминированного повреждения, должна погибнуть заданная доля клеток, которая определяет порог, т. е. обнаруживаемое клинически патологическое состояние.
С увеличением дозы возрастает не только частота проявления эффекта, но и его тяжесть. На рис. 4.6, а представлены зависимости от дозы степени тяжести эффекта для группы лиц с тремя уровнями радиочувствительности. Степень тяжести патологического эффекта наиболее заметно возрастает у тех лиц в подгруппе, кто наиболее чувствителен (кривая а на рис. 4.6, а), и достигает порога обнаружения при меньшей дозе, чем в менее чувствительных подгруппах (кривые бив). Диапазон доз, в котором лица, принадлежащие разным подгруппам, достигают порога обнаружения эффекта, определяет размытие порога.
Это видно на нижнем графике (рис. 4.6, б), который отражает вероятностный характер возникновения патологического состояния, когда мы переходим от индивида к большой группе людей, имеющих по тем или иным причинам разную радиочувствительность. 100 %-я вероятность обнаружения эффекта происходит лишь при такой дозе, которая достаточна для превышения определенного порога тяжести у всех лиц в данной группе.
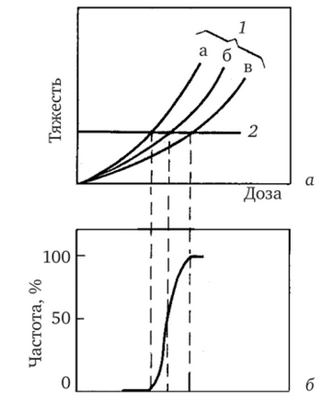
Puc. 4.6. Типичные зависимости «доза — эффект» для детерминированных эффектов, проявившихся в группе людей (Публикация МКРЗ 41):
а — зависимость тяжести проявления эффекта для трех групп облученных людей (1—3); 2 — порог патологического состояния; б — зависимость вероятности обнаружения эффекта от дозы
Рассмотрим теперь зависимости «доза — эффект» для стохастических эффектов. В основном речь идет о канцерогенезе. Эта проблема более сложная в научном отношении, вызывает повышенное беспокойство у населения и наиболее часто обсуждается СМИ и общественными движениями.
Если бы сведения о возникновении индуцированного излучением рака при воздействии излучения с малой ЛПЭ были непосредственно доступны в диапазоне доз, важном в экологическом отношении и для радиационной безопасности, т. е. от одного до нескольких десятков мГр, то форма зависимости «доза — эффект» мало кого интересовала бы. В действительности основная информации связана с дозами от 0,1 Гр и выше. Поэтому при установлении достоверных зависимостей «доза — эффект» для индуцированного излучением рака у людей при малых дозах необходимо использовать теоретические рассмотрения, все экспериментальные данные и ограниченный опыт наблюдения на людях.
Экспериментальные данные о зависимостях «доза — эффект» и влиянии мощности дозы указывают на то, что зависимость «доза — эффект» при больших дозах и большой мощности дозы имеет линейноквадратичный вид для большинства биологических систем (рис. 4.7, зависимость А). При облучении в малых дозах и при малой мощности дозы, что обычно имеет место в ситуациях, интересных в экологическом отношении, зависимость в действительности часто бывает линейной, как и следует ожидать при малой дозе из линейно-квадратичной зависимости.
При линейно-квадратичной форме зависимости эффекта — е от дозы:
е первоначально возрастает линейно с дозой, т. е. эффект, приходящийся на единицу дозы e/D = а, постоянен. Затем эффект возрастает быстрее, т. е. не сам эффект, а теперь эффект на единицу дозы — e/D возрастает линейно, по мере того как начинает действовать квадратичный член (e/D = (3D). При еще больших дозах эффективность часто снова спадает из-за того, что эффект гибели клеток уменьшает число клеток, подверженных риску. В линейно-квадратичном уравнении отношение а/(3 коэффициентов при линейном и квадратичном членах имеет размерность дозы, и его значение отражает относительный вклад линейного и квадратичного членов. Таким образом, если а/(3 = 1 Гр, то при 1 Гр вклады в эффект от линейного и квадратичного членов (кривая А) равны.
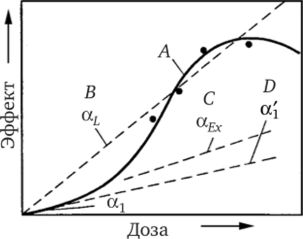
Рис. 4.7. Схематические представления вероятности возникновения эффекта в зависимости от поглощенной дозы:
А — линейно-квадратичная аппроксимация с учетом радиационной гибели клеток; В, С nD — линейные экстраполяции разных участков кривой А; аь а ось, и aL — коэффициенты, определяющие наклон кривых
Зависимость доза-эффект
Комплексное действие токсинов. Механизмы комплексного действия в токсикологии
По прямому смыслу слова "комплексное" (сложное, состоящее из взаимосвязанных, но разнородных частей) можно было бы думать, что речь идет о воздействии на организм более или менее сложного комплекса потенциально вредных факторов. Именно в этом смысле В.В.Кустов и соавт. назвали одну из глав своей монографии "Комплексное воздействие на организм токсических веществ, вибрации, шума и других производственных факторов".
Однако позднее этот термин по неясной причине стал применяться в гигиенической токсикологии для обозначения действия одного и того же токсического вещества при поступлении его в организм одновременно или попеременно разными путями.
Такая ситуация имеет немаловажное значение. Так, даже при загрязнении окружающей среды только атмосферными выбросами промышленных предприятий достаточно быстро тем или иным токсичным веществом оказывается загрязнен не только воздух, но и почва, а через нее — водоемы с водными биоценозами, а также продукты растениеводства и животноводства.

Следовательно, токсическая экспозиция населения осуществляется с вдыхаемым воздухом через легкие, с питьем и пищей — через ЖКТ; возможно, также через кожу (через загрязненные почвой руки или при использовании загрязненных водоемов для купания, стирки и т.п.). В производственных условиях ингаляционное поступление токсических паров и/или аэрозолей также может сочетаться с кожной резорбцией. Наряду с этим даже изолированная ингаляционная аэрозольная экспозиция неизбежно приводит к резорбции вещества не только в легких, но и по пути его элиминации из легких в ЖКТ, т.е. также может рассматриваться как "комплексная".
Поскольку речь идет об одном и том же веществе, рассмотренные ситуации выходят за рамки проблемы комбинированной токсичности. По сути дела в этом случае необходимо решить две взаимосвязанные задачи: во-первых, определить суммарную дозу вещества, поступающего в организм разными путями; во-вторых, выяснить, не могут ли иметь место достаточно существенные различия хемобиокинетики (имея в виду не только кинетику поступления, но и кинетику распределения яда в организме) в зависимости от места резорбции яда в кровь.
Например, достаточно существен вопрос о том, эквивалентно ли по возможности накопления в том или ином органа-мишени (прежде всего в печени) всасывание яда в кровь через легкие или через ЖКТ, не говоря уже о возможности местного токсического действия на орган, служащий входными воротами яда.
Для практических целей первый вопрос нередко решается с помощью математических моделей; такова, например, "биокинетическая модель", используемая Агентством охраны окружающей среды США (US EPA) для прогнозирования концентрации свинца в крови у детей с учетом различных путей поступления. Однако все такие модели пока слишком приблизительны, и обоснованность принятых в них кинетических параметров явно недостаточна.
Вопрос о возможных количественных и даже качественных особенностях действия равных доз того или иного яда при разных путях поступления чаще всего не только не решается, но даже не ставится. Не учитывается, что сравнительная оценка поступления в кровь через легкие и через ЖКТ вещества, первично отлагающегося в виде ингалированных аэрозольных частиц, существенно зависит от их распределения по размерам (дисперсности) и особенно от растворимости; тем самым то, что от этих характеристик аэрозоля может зависеть характер "комплексного" действия. В целом, несмотря на всю практическую значимость этой проблемы, она далека от теоретического и методического решения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Зависимость эффекта лекарства от дозы
Эффект лекарственного средства зависит от его количества, поступившего в организм, т. е. от дозы. Если назначенная доза ниже пороговой (подпороговая), эффект отсутствует. В зависимости от природы эффекта повышение дозы может привести к его усилению. Так, действие жаропонижающих или гипотензивных препаратов можно количественно выразить с помощью графика, на котором указывается, соответственно, степень снижения температуры тела или АД.
Вариации зависимости эффекта препарата от дозы обусловлены чувствительностью конкретного человека, принимающего препарат; для достижения одинакового эффекта разным пациентам требуются разные дозы. Различия в чувствительности особенно ярко проявляются в феноменах по типу «все или ничего».
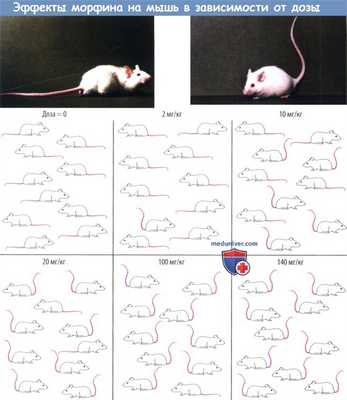
В качестве иллюстрации приведем эксперимент, в котором подопытные реагируют по принципу «все или ничего» — проба Штрауба. В ответ на введение морфина у мышей появляется возбуждение, которое проявляется в виде ненормального положения хвоста и конечностей. Зависимость этого явления от дозы наблюдается в группах животных (по 10 мышей в группе), которым вводят нарастающие дозы морфина.
При введении низкой дозы реагируют только наиболее чувствительные особи, при повышении дозы число реагирующих растет, и при максимальной дозе эффект развивается у всех животных в группе. Существует взаимосвязь между количеством реагирующих особей и введенной дозой. При дозе 2 мг/кг реагирует 1 из 10 животных; при дозе 10 мг/кг — 5 из 10 животных. Эта зависимость частоты развития эффекта и дозы является результатом различной чувствительности особей, для которой, как правило, характерно логарифмически нормальное распределение.
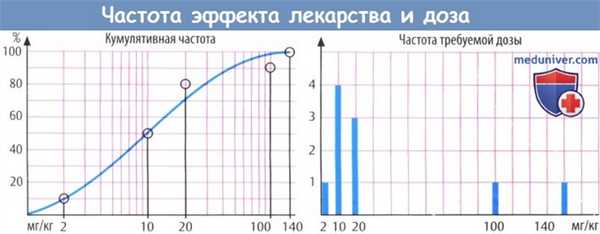
Если кумулятивную частоту (общее количество животных, у которых развивается реакция на конкретную дозу) отметить на логарифме дозы (ось абсцисс), появляется S-образная кривая. Нижняя точка кривой соответствует дозе, на которую реагирует половина животных в группе. Диапазон доз, охватывающий зависимость дозы и частоты эффекта, отражает вариации индивидуальной чувствительности к препарату. График зависимости дозы и частоты эффекта напоминает по форме график зависимости эффекта от дозы, однако имеются некоторые отличия. Дозозависимость можно оценить у одного человека, т. е. она представляет собой зависимость эффекта от концентрации препарата в крови.
Оценка зависимости эффекта от дозы в группе затруднена вследствие разной чувствительности у отдельных пациентов. Чтобы оценить биологические вариации, измерение проводят в репрезентативных группах, а результат усредняют. Таким образом, рекомендуемые терапевтические дозы оказываются адекватными для большинства пациентов, но не всегда для конкретного человека.
В основе вариаций чувствительности лежат различия в фармакокинетике (одинаковая доза — различная концентрация в крови) либо разная чувствительность органа-мишени (одинаковая концентрация в крови — различный эффект).
Для усиления терапевтической безопасности специалисты по клинической фармакологии пытаются выяснить причины, определяющие различия в чувствительности у разных пациентов. Эта область фармакологии называется фармакогенетикой. Часто причиной бывает разница в свойствах или активности ферментов. Кроме того, наблюдаются этническая вариабельность чувствительности. Зная об этом, врач должен постараться выяснить метаболический статус пациента, прежде чем назначать тот или иной препарат.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Термины и определения применяемые в клинической токсикологии
Абсолютная биологическая доступность (биодоступность). Применительно к лекарству, вводимому внесосуди-стым путем, — часть дозы, достигшая системного кровообращения, по сравнению с той же дозой, введенной внутривенно.
Аккумуляция. Повышение концентрации лекарства в цельной крови (плазме или сыворотке) или тканях либо количества вещества в организме до достижения равновесного состояния.
Безжировая масса тела. Масса тела без массы его жира.
Биологическая доступность (биодоступность). Относительное количество лекарства, достигающего системного кровообращения после введения однократной дозы, и скорость его появления в нем.
Биологический полупериод существования. См. Период полувыведения.
Биофаза. Среда, непосредственно окружающая место действия лекарства в организме.
Биофармацевтика. Физические и химические свойства лекарства, добавки к нему и его вводимой формы, а также биологическая эффективность лекарства и/или его вводимого продукта. Биоэквивалентность. Биоэквивалентность лекарственного продукта наблюдается, если масштабы и скорость его всасывания (биодоступность) не существенно отличаются от установленных для стандартной формы, вводимой в такой же молярной дозе.
Биоэквивалентности требование применяется при тестировании конкретного лекарственного продукта in vitro и/или in vivo как одно из условий его допуска в продажу.
Внесосудистое введение. В фармакокинетике — все пути введения лекарства, кроме тех, при которых оно сразу же попадает в кровоток. Например, внутримышечное (ВМ), подкожное (ПК), пероральное (ПО), оральное, ректальное, интраперитонеальное (ИП), т. е. внутрибрюшинное, и местное применение, когда необходимо учитывать абсолютную биодоступность.
Внутрисосудистое введение. В фармакокинетике — все способы введения лекарства, при которых оно сразу же попадает в кровоток: внутривенный (ВВ), внутриартериальный, внутрисердечный. Биодоступность при этом равна 100%, f=1.
Высвобождение лекарства. Поступление активного ингредиента из лекарственной формы в раствор. Растворителем служит либо биологическая (содержимое желудка), либо аналитическая жидкость. Высвобождение лекарства характеризуется скоростью (константой) растворения лекарства и его количеством в растворе.
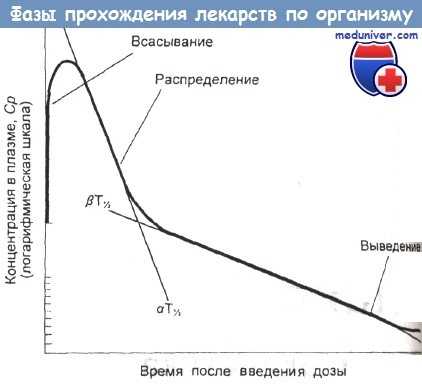
Фазы прохождения лекарства по организму согласно двухкомпартментной модели.
Гибридные константы скорости. Составные константы, образуемые несколькими микроконстантами, gl (альфа, бета) — гибридная константа.
Доза. Количество введенного лекарства.
Дозный интервал. Время между введением доз.
Желчная рециклизация. См. Кишечно-печеночная рециркуляция.
Зависимость от дозы или концентрации. Изменение фармакокинетических процессов (всасывания, распределения, метаболизации и выведения) при изменении дозы или концентрации лекарства.
Ингибирование фермента. Снижение скорости метаболизации субстрата (обычно из-за конкуренции) ферментной системой.
Индукция фермента. Увеличение содержания (активности или количества) фермента, которое может привести к ускорению метаболизации его субстрата. Инъекция. Быстрое введение дозы лекарства с помощью иглы или катетера.
Кажущийся коэффициент распределения. Применяемый in vitro параметр, соответствующий отношению равновесных концентраций вещества в липоидной (обычно n-октаноловой) и водной (обычно в буфере с рН 7,4) фазах. Не учитывает диссоциацию и ассоциацию вещества в этих фазах. Кишечно-печеночная рециркуляция. Феномен повторного всасывания лекарства, выделенного с желчью в тонкую кишку, из просвета кишечника в системный кровоток.
Клиническая фармакокинетика. Применение фармакокинетических принципов при выборе безопасной и эффективной фармакотерапии для конкретного пациента.
Клиренс. Отношение общей скорости выведения вещества к его концентрации в стандартной жидкости (плазме крови). При равновесных условиях клиренс связывает регулярно доступную дозу (т. е. поддерживающую дозу, вводимую через определенный интервал) со средней равновесной концентрацией лекарства в конкретной биологической жидкости. В определении клиренса надо указывать место измерения (кровь, плазма, плазменная вода). См. Печеночный клиренс, почечный клиренс, общий клиренс.
Клиренс креатинина. Отношение скорости выведения креатинина с мочой к его концентрации в плазме или сыворотке. Используется для описания почечной функции (скорости клубочковой фильтрации).
Компартмент. Математическое понятие, которое можно определить через объем (не обязательно физиологический) и концентрацию в нем лекарства. Концентрация. Отношение измеренного количества вещества к объему или массе жидкости, в которой оно распределено.
Коэффициент очищения. Отношение связанного с органом клиренса (например, печеночного, почечного) к скорости протекания через него крови или плазмы.
Кривая доза—реакция. График зависимости фармакологической или клинической эффективности или токсичности (т. е. реакции) от дозы. Кровоток. Скорость перфузии органа кровью.
Кумулятивные кривые экскреции с мочой. Графики, демонстрирующие общее количество лекарства и/или его метаболитов, выведенное с мочой в разные моменты времени после введения этого вещества различными путями.
Латентный период. Интервал времени между введением лекарства и появлением его поддающейся измерению концентрации в крови или момент времени (не нулевой), когда можно начать строить полиэкспоненциальную функцию, описывающую зависимость концентрации лекарства от времени. Латентный период часто наблюдается при пероральном введении и объясняется медленным растворением таблеток или капсул либо задержкой опорожнения желудка.
Лекарственный продукт (лекарственная форма, препарат). Готовая к введению фармацевтическая форма, содержащая активные ингредиенты (лекарства) и биологически инертные носители (растворитель, добавки и т. п.), необходимые для получения желаемых дозы, объема и консистенции поступающего в организм агента.
Лекарство. Синтетическое, полусинтетическое, природное или биологическое вещество, которое предупреждает, устраняет или облегчает болезнь либо дистресс у человека или других животных. Его действие можно выразить количественно.
Лимитирующий скорость процесс. В системе последовательных кинетических процессов тот из них, у которого самая низкая константа скорости. Если константы скорости нескольких процессов почти идентичны, определить лимитирующий трудно.
Микроконстанты. Константы скорости гипотетической фармакокинетической модели. Из отдельных микроконстант складываются гибридные константы.
Михаэлиса—Ментен кинетика. Определенные нелинейные или связанные с насыщением процессы, обычно сопровождающие ферментативные реакции.
Множественные дозы. Неоднократно вводимые дозы, чреватые аккумуляцией лекарства, если интервалы между введениями меньше времени, необходимого для выделения ранее принятого количества лекарства.
Нелинейная кинетика (кинетика насыщения). Протекание процесса со скоростью, не прямо пропорциональной концентрации реагента, как при кинетике первого порядка. Такие процессы описаны уравнениями Михаэлиса— Ментен, Лангмюра и др.
Общий клиренс, обычно сумма клиренсов различных выделительных органов. См. Печеночный и почечный клиренсы.
Объем распределения. Не "реальный", а гипотетический объем жидкости тела, который потребовался бы для растворения общего количества лекарства до достижения такой же его концентрации, что обнаруживается в крови или плазме. Коэффициент пропорциональности, связывающий количество вещества в организме с его концентрацией, измеряемой в биологической жидкости (крови, плазме, плазменной воде).
Однократная доза. Доза, не приводящая к аккумуляции лекарства. См. Поддерживающая доза.
Оральное введение. В узком смысле слова трансбуккальное (чресщечное), подъязычное и транслингвальное (чрезъязычное) введение, когда лекарство всасывается в ротовой полости без эффекта первого прохождения. Не путать с пероральным введением.
Относительная биологическая доступность (биодоступность). Термин, означающий как относительное количество лекарства, достигающего системного кровотока в неизменной форме, так и относительные скорости этого достижения при введении одному человеку разных форм того же лекарства одним или разными внесосудистыми способами.
Период полувыведения. Время, необходимое для снижения концентрации лекарства в крови, сыворотке или плазме (вдвое во время фазы выведения). Определяется объемом распределения и общим клиренсом вещества. Не всегда совпадает с терапевтическим полупериодом (полупериодом реакции).
Периферический компартмент. Совокупность частей тела (органов, тканей и т. д.), в которые распределяется лекарство, постепенно достигая в них равновесной концентрации с центральным компартментом. Периферический компартмент иногда подразделяют на поверхностный и глубинный.
Пероральное введение (ПО). Проглатывание лекарства, всасывание которого происходит в желудочно-кишечном тракте (возможен эффект первого прохождения). При таком пути введения некоторые лекарства, например активированный уголь, каолин и ряд антацидов не всасываются. См. Оральное введение.
Печеночный клиренс. Часть общего клиренса, обеспечиваемая печенью. Зависит от эндогенного печеночного клиренса, фракции несвязанного лекарства в крови и печеночного кровотока. Площадь под кривой. Концентрация вещества в крови (плазме или сыворотке), интегрированная по времени (от О до момента t или бесконечности) после введения одной дозы или во время ее введения в равновесном состоянии.
Поддерживающая доза. Доза, необходимая для сохранения клинической эффективности или терапевтической концентрации лекарства. Определяется его клиренсом, объемом распределения, скоростью выведения, желательной равновесной (стационарной) концентрацией и желательной лечебной эффективностью.
Почечный клиренс. Часть общего клиренса, обеспечиваемая почками. Зависит от клубочковой фильтрации, канальцевой секреции и реабсорбции, кровотока и связывания с белками.
Связывание с белками. Соединение лекарства с белками плазмы или тканей. В равновесии с биофазой находится только его несвязанная фракция.
Стационарное (равновесное) состояние. В узком смысле состояние, достигаемое только при постоянной скорости введения, когда выделение и поступление вещества взаимно уравновешиваются. Равновесная концентрация лекарств при использовании множественных доз колеблется между максимальной (пиковой) и минимальной стационарной концентрациями на протяжении интервала между введениями.
Схема введения. Дозы и интервал между ними, необходимые для достижения клинической эффективности или поддержания терапевтической концентрации лекарства в организме.
Токсикокинетика. Математическое описание изменений концентраций лекарства (токсина) и/или его метаболитов в организме после введения.
Триггерная модель. Феномен, при котором константа скорости на входе гораздо меньше константы скорости на выходе. В организме обычно наблюдается, когда всасывание происходит намного медленнее выведения.
Удаление. Все процессы и факторы, действующие с момента попадания лекарства в кровоток до того времени, когда оно или его метаболиты выделяются из организма с мочой, фекалиями, желчью, выдыхаемым воздухом и потом.
Ударная доза. Доза, используемая в начале лечения; обычно она выше поддерживающей и быстро обеспечивает терапевтическую концентрацию. Необходимость в ударной дозе зависит от периода полувыведения, интервала между дозами и планируемой терапевтической концентрации.
Уровень (в крови, сыворотке, плазме). В фармакологии то же, что и Концентрация (см.).
Хронофармакокинетика. Изучение изменений фармакокинетических параметров, связанных с циркадианным ритмом и другими суточными явлениями. Циркадианный ритм по своей природе эндогенный, но может сдвигаться по фазе под влиянием внешних синхронизаторов.
Центральный компартмент. Совокупность всех частей тела (органов, тканей, жидкостей), в которых концентрация вещества мгновенно приближается к равновесной с наблюдаемой в крови, плазме или сыворотке.
Экскреция. Окончательное выведение лекарства из системного кровообращения с мочой, фекалиями, потом, выдыхаемым воздухом, молоком и т. п.
Эндогенный клиренс. Теоретический, ничем не ограниченный максимальный клиренс несвязанного лекарства данным органом.
Эффект первого прохождения. Феномен метаболизации (не химической деградации) лекарства после всасывания, но до достижения системного кровотока. Печеночный эффект первого прохождения может наблюдаться после перорального или глубокого ректального введения. Его можно избежать при подъязычном или трансбуккальном способе введения. Легочного эффекта первого прохождения при внутривенном, трансбуккальном или подъязычном путях введения избежать невозможно.
Характеристика зависимости «доза — эффект»
Экологическая токсикология относится к классу токсикологических наук, в центре которых находится изучение механизмов токсического действия веществ, жизненно необходимых (эндогенных), но поступающих в организмы в избыточном количестве, или полностью чужеродных (ксенобиотики, поллютанты). Однотипность первичных механизмов токсического действия и в ряде случаев близость изучаемых объектов различных направлений медицинской токсикологии и экотоксикологии предопределяет близость методических подходов этих наук. Необходимо знать, как влияет увеличение токсической нагрузки на выраженность токсического эффекта. С этой целью оперируют зависимостью «доза — эффект» (Безель, 2006).
При этом возможны два подхода для выражения упомянутой зависимости:
- 1) градированный вид зависимости в количественной форме отражает изменение того или иного показателя состояния системы как функции внешнего воздействия. По мере увеличения токсической нагрузки постепенно возрастают проявления токсичности. Однако сами по себе градированные показатели еще не определяют однозначно статус организма, т.е. не позволяют сделать заключение о наличии или отсутствии поражения. Видимо, необходим некоторый предел действующего токсического фактора, превышение которого однозначно (альтернативно) означало бы наличие поражения (рис. 1.1 А);
- 2) переход к альтернативному выражению эффекта поражения предполагает известным некоторый критерий вредности градированного показателя, т.е. по существу подразумевает диагностику состояния «норма — патология». Альтернативная зависимость основывается на концепции пороговости поражающего действия. При этом речь идет о резком переходе количественных изменений к новому качественному состоянию (рис. 1.1 Б). Каждый такой переход соответствует переходу с одного уровня организации биологических систем на более высокий.
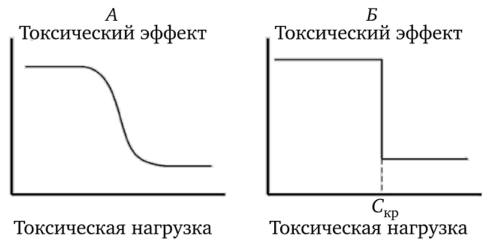
Рис. 1.1. Градированный (А) и альтернативный (Б) характер зависимости токсических эффектов от уровня токсической нагрузки
Эпидемиологический подход к зависимости «доза — эффект»
Спектры проявлений токсического процесса определяются строением токсиканта. Однако выраженность развивающегося эффекта является функцией количества действующего агента. В качестве вредного агента могут рассматриваться токсичные вещества, биологические субстанции, проникающая радиация и другие повреждающие факторы. В качестве эффектов могут учитываться самые разнообразные признаки. Например, летальный исход, выход показателя за пределы биологической нормы и т.п. Для обозначения количества вещества, действующего на биологический объект, используют понятие доза (воздействующая доза).
В связи с этим дозы конкретного вещества, в которых оно вызывает повреждение организмов одного и того же и тем более разных видов, порой очень существенно различаются. Следовательно, зависимость «доза — эффект» отражает свойства не только токсиканта, но и организма, на который он действует. На практике это означает, что количественную оценку токсичности, основанную на изучении зависимости «доза — эффект», следует проводить в эксперименте на различных биологических объектах и обязательно прибегать к статистическим методам обработки получаемых данных.
Поскольку смертельный исход после действия токсиканта — альтернативная реакция, реализующаяся по принципу «все или ничего», этот эффект считают наиболее удобным для определения токсичности веществ, его используют для определения величины среднесмертельной дозы ((LD50)). Средняя смертельная доза (LD50) (или концентрация LC50) — количество яда, вызывающее гибель 50 % стандартной группы подопытных животных при определенном сроке последующего наблюдения.
Концепция определения LD50 веществ была впервые сформулирована J. W. Trevan в 1927 г. С этого момента начинается становление токсикологии как настоящей науки, оперирующей количественными характеристиками исследуемого свойства (величина токсичности). В качестве других уровней смертности, подлежащих определению, могут быть выбраны величины LD5, LD95, которые согласно законам статистики близки соответственно к порогу и максимуму токсического действия и являются границами дозового интервала, в рамках которого в основном и реализуется эффект. При этом необходимо учитывать, что способ введения вещества самым существенным образом сказывается на величине токсичности (табл. 1.3).
Влияние способа введения на токсичность зарина и атропина для лабораторных животных
Читайте также:
- Механизмы развития сепсиса. Патогенез сепсиса в ветеринарии
- Псевдомембранозный энтероколит. Возбудитель псевдомембранозного энтероколита. Сlostridium difficile. Свойства, патогенез псевдомембранозного энтероколита. Лечение псевдомембранозного энтероколита.
- Инфекции Enterobius vermicularis и Strongyloides stercoralis: диагностика, лечение
- Парез лучевого нерва: атлас фотографий
- Системные заболевания и рот
