Новообразования при вич инфекции
Злокачественные опухоли развиваются у 40% больных с ВИЧ-инфекцией. Такая распространенность опухолевых заболеваний неудивительна, если учитывать нарушения работы иммунной системы, вызываемые ВИЧ-инфекцией. Однако определеные типы злокачественных опухолей (например, саркома Капоши, В-клеточная лимфома и анальная карцинома) преобладают у ВИЧ-инфицированных пациентов, что указывает на необходимость изучения их этиологии.
Первые два типа злокачественных опухолей связаны с клетками иммунной системы: эндотелиальньши клетками и В-клетками. Эндотелиальные клетки обладают характеристиками иммунных клеток, поскольку экспрессируют Fc- и С3-рецепторы, а также могут выполнять функцию дополнительных клеток при активации лимфоцитов.
При попытке найти общую связь между этими злокачественными опухолями рассматривалась возможность существования общих инфекционных агентов, в особенности герпесвирусов и папилломавирусов человека (HPV). Герпесвирус человека типа 8 (HHV-8) (также называемый ассоциированным с саркомой Капоши герпесвирусом [KSHV]) вызывает развитие саркомы Капоши и лимфом брюшной полости. Вирус Эпштейна-Барр (ВЭБ) обнаруживается в 60% случаев развития В-клеточных лимфом и при всех первичных лимфомах центральной нервной системы (ЦНС).
Тем не менее, несмотря на то, что ВЭБ, по-видимому, стимулирует пролиферацию В-клеток, он может не оказывать прямого влияния на их трансформацию (см. ниже). Наконец HPV способствует развитию анальной карциномы и шейки матки.
Развитие злокачественных опухолей при ВИЧ-инфекции может проходить в три этапа: инициация, промоция и трансформация. Инициация злокачественного процесса может происходить под действием различных факторов, вызывающих нарушения работы иммунной и других систем органов. В случае вирусной инфекции после этапа инициации может происходить индукция выработки цитокинов (или гормонов) иммунной системой, что приводит к усилению пролиферации клеток-мишеней (т.е. эндотелия, В-клеток или эпителиальных клеток).
Наконец, кластогенные явления (clastogenic event) могут вызвать автономный рост клеток или трансформацию.
Кроме того, иммунная система организма хозяина может оказывать влияние (т.е. активировать) на экспрессию этих новообразований. В некоторых случаях вирус сам по себе может играть роль прямого трансформирующего агента, но большинство данных, полученных к настоящему моменту, говорит о том, что вирусы выполняют функцию промоторов.
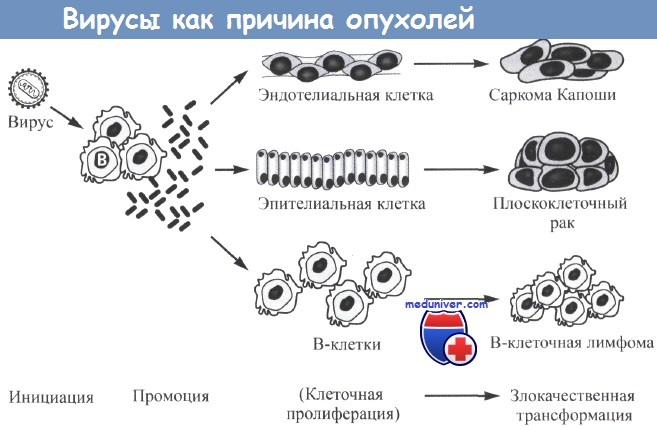
Потенциальная роль вирусов в индукции злокачественных заболеваний.
Вирус может инфицировать клетки хозяина и, как в представленном случае, индуцировать выработку клеткой цитокинов, стимулирующих пролиферацию определенных клеток-мишеней (например, эндотелиальных, эпителиальных или В-клеток).
При усилении репликации клеток другие факторы могут вызвать хромосомные изменения, стимулирующие автономный рост и злокачественную трансформацию.
Основная гипотеза, объясняющая связь злокачественных опухолевых заболеваний с ВИЧ-инфекцией, заключается в том, что иммуносупрессия препятствует осуществлению нормального надзора со стороны иммунной системы и подавлению репликации вируса или роста трансформированных клеток. Другой вариант связи между нарушениями иммунитета и развитием опухолей заключается в том, что злокачественные опухоли появляются вследствие патологической секреции повышенных концентраций определенных цитокинов.
Эти клеточные факторы могут продуцироваться гиперактивированными клетками вследствие нарушения равновесия в иммунной системе. Они способны стимулировать пролиферацию клеток и, возможно, способствовать активизации вируса. Некоторые лимфокины, например, могут стимулировать ангиогенез и таким образом способствовать развитию саркомы Капоши.
Появление злокачественных опухолей при ВИЧ-инфекции может, таким образом, происходить в результате подавления или усиления активности иммунной системы. В любом случае нарушения работы иммунной системы вносят свой вклад в развитие определенных злокачественных опухолей, обнаруживаемых при этой инфекции, как и оппортунистические инфекции и другие клинические состояния, развивающиеся в организме хозяина.
Обычно развитие злокачественных опухолей в присутствии ВИЧ-инфекции носит гораздо более агрессивный характер, чем у неинфицированных пациентов. Таким образом, реакция иммунной системы, по-видимому, играет важную роль в борьбе с прогрессированием опухолей.
С течением времени у ВИЧ-инфицированных людей возрастает риск развития других злокачественных заболеваний. В связи с этим частота возникновения опухолей при СПИДе с возрастом увеличивается сильнее, чем частота развития оппортунистических инфекций. Предполагается, что также происходит увеличение частоты встречаемости других злокачественных заболеваний, в частности болезни Ходжкина, множественных миелом и семином, а также лейомиом и лейомиосарком у ВИЧ-инфицированных детей. В развитии болезни Ходжкина и лейомиосарком может участвовать вирус Эпштейна-Барр.

Развитие опухоли, по-видимому, является множественным феноменом.
Различные агенты могут инициировать процесс, который поддерживается другими клеточными продуктами, например цитокинами и гормонами.
Наконец, происходит трансформация, которая обычно связана с хромосомными изменениями.
Этот процесс может непосредственно зависеть от эффектов вируса.
В большом исследовании пациентов с ВИЧ-инфекцией было показано повышение частоты встречаемости злокачественных опухолей губ, анального канала, легких, а также лейкемий; наибольший относительный риск со времени постановки диагноза ВИЧ преимущественно связан с развитием болезни Ходжкина и множественной миеломы. У людей с умеренным иммунодефицитом нет увеличенного риска развития злокачественных опухолей, не ассоциированных с диагнозом СПИД.
К немеланомным опухолевым заболеваниям кожи, риск которых возрастает при ВИЧ-инфекции, относится карцинома Меркеля, развитие которой связано преимущественно с иммуносупрессией. В Африке помимо саркомы Капоши и неходжкинских лимфом часто встречается чешуйчатый рак конъюнктивы, который, скорее всего, развивается в результате инфекции папилломавирусом (HPV).
После разработки и введения в практику антиретровирусной терапии возрасла частота развития рака легких у ВИЧ-инфицированных пациентов. При исследованиях таких раковых опухолей легких не были обнаружены нуклеотидные последовательности ни ВИЧ, ни папилломавируса. Чаще всего в опухолевых клетках есть признаки нестабильности генома.
Развитие злокачественных опухолей может происходить вследствие действия определенных канцерогенных факторов, например курения. Повышение частоты опухолевого поражения полового члена может быть связано с многократными контактами с папилломавирусом. Увеличение частоты развития других злокачественных опухолей, не связанных с присутствием уже известных вирусов, возможно, свидетельствует о недостаточности надзора со стороны иммунной системы, но также может быть следствием канцерогенных эффектов неких неизвестных микробных патогенов.
Далее в отдельнымх статьях представлен обзор исследований четырех типов злокачественных опухолей, часто встречающихся при ВИЧ-инфекции: саркомы Капоши, В-клеточной лимфомы, анальной карциномы и рака шейки матки. Кратко обсуждаются и другие опухоли, частота развития которых на фоне ВИЧ-инфекции увеличивается.
Редкий тип ВИЧ-ассоциированной лимфомы представляет собой первичную злокачественную эффузионную лимфому - PEL (primary effusion lymphoma). PEL, как правило, ассоциирована с инфекцией HHV-8.
Кодируемый вирусным геномом белок vFLIP, очевидно, необходим для выживания клеточных линий, полученных из клеток данной опухоли, что говорит о прямом участии вируса HHV-8 в патогенезе этой лимфомы. Эта опухоль может развиваться на поздних стадиях ВИЧ-инфекции и характеризуется быстрым клиническим течением. В некоторых случаях совместно с HHV-8 в клетках лимфомы обнаруживают вирус Эпштейна-Барр.
Некоторые исследования, проведенные на культурах клеток in vitro, указывают на то, что ВЭБ может способствовать инфицированию В-лимфоцитов еще и вирусом HHV-8 и таким образом соучаствовать в механизме развития этой опухоли.
Поскольку HHV-8 содержит последовательности нуклеотидов, ассоциированные с трансформацией клетки, а также последовательности нуклеотидов, кодирующие белок-гомолог IL-6, роль этого вируса в индукции таких В-клеточных лимфом заслуживает дальнейшего изучения.
Кроме того, было показано, что вирусный ген LANА вызывает В-клеточную гиперплазию и развитие лимфом у трансгенных по данному гену мышей. Интересно, что HHV-8 обнаруживается преимущественно в В-клеточных лимфомах, развивающихся в полостях тела, но не в других местах локализации.
Была описана связь вируса HHV-8 еще и с болезнью Кастельмана, лимфопролиферативным заболеванием, развивающимся из определенной субпопуляции лимфоцитов и называемого плазмобластной лимфомой.
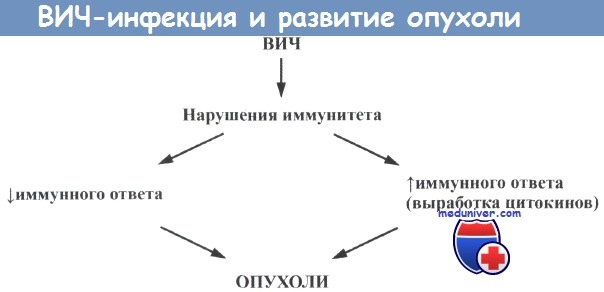
ВИЧ-инфекция и развитие опухолей. ВИЧ-инфекция может привести к нарушениям в иммунной системе, которые вызывают либо усиление, либо ослабление иммунных реакций.
Оба процесса способны участвовать в развитии опухолей.
ВИЧ-инфекция — один из факторов, который во много раз повышает вероятность развития рака. Выяснили, какие именно онкозаболевания чаще всего могут возникать при положительном ВИЧ-статусе, как их вовремя обнаружить, и на какие факторы риска еще нужно обратить внимание людям, живущим с ВИЧ.
Главная мишень вируса — CD4-Т-лимфоциты. Они передают сигнал другим клеткам, которые защищают организм от рака. В результате вмешательства вируса количество CD4-T-лимфоцитов постепенно уменьшается. Критически низкий уровень этих клеток - одна из причин отсутствия согласованной работы между звеньями иммунитета и главный механизм, приводящий к развитию СПИДа.
Иммунитет человека с ВИЧ-инфекцией перестает контролировать процессы избыточного клеточного деления и злокачественной трансформации клеток. Вместе с уменьшением количества CD4-T-лимфоцитов происходит накопление раковых клеток. В результате у человека развиваются несколько видов опухолей, которые называют СПИД-индикаторными: появление такого вида рака с очень большой вероятностью означает наличие у человека СПИДа.
Однако повышается риск появления не только СПИД-индикаторных опухолей, но и тех видов рака, которые развиваются из-за потери иммунного контроля над несколькими онкогенными инфекциями: вирусом герпеса человека 8 типа (ВГЧ-8), вирусом папилломы человека (ВПЧ), вирусами гепатита В и С (ВГВ, ВГС), вирусом Эпштейна-Барр (ВЭБ) и другими.
Все эти состояния развиваются у людей с ВИЧ-инфекцией преимущественно на фоне снижения количества CD4-T-лимфоцитов до уровня менее 200 клеток/мкл (при разбросе в норме от 500 до 1100 клеток), но также могут возникать при нормальном или близком к нормальному уровню CD4-T-лимфоцитов.
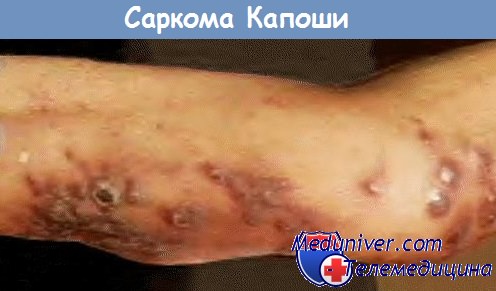
Саркома Капоши (СК) — СПИД-индикаторная опухоль, при которой происходит злокачественная трансформация клеток лимфатических и кровеносных сосудов. Риск развития СК у пациентов с ВИЧ-инфекцией увеличивается в несколько сотен раз. Различные белки ВИЧ-1 способны усиливать воспаление и нарушать регуляцию в эндотелиальных клетках. Это приводит к тому, что саркома Капоши может развиться до того, как уровень CD4-T-лимфоцитов упадет ниже 200 клеток/мкл. Еще одно обязательное условие для возникновения СК — наличие в организме вируса герпеса человека 8 типа.
Саркома Капоши развивается в виде папулы, пятна, узелка, бляшки коричневого, розового, красного или темно-красного цвета от нескольких миллиметров до нескольких сантиметров в диаметре. Обычно высыпания концентрируются на ногах, голове, шее, на слизистой оболочке — в области неба, десен, конъюнктивы.
До эры внедрения лекарств от ВИЧ — антиретровирусной терапии (АРТ) 5-летняя выживаемость (с момента диагностики опухоли) пациентов с саркомой Капоши составляла менее 10%. Применение АРТ значительно улучшило ситуацию — сейчас речь идет о 74%, — а также позволило снизить риск развития СК.
Более половины случаев СК (56%) диагностируются сейчас в локальной форме — до того, как опухоль распространится на лимфатические узлы, слизистую ЖКТ, печень, селезенку и другие органы. Прием антиретровирусной терапии помогает значительно замедлить прогрессию болезни и предотвратить распространение СК по всему организму.
К сожалению, обнаружить саркому Капоши до появления симптомов не получится
Однако, человеку с ВИЧ и его амбулаторному врачу-инфекционисту необходимо учитывать несколько факторов риска развития этой опухоли:
- Этническая принадлежность: люди еврейского или средиземноморского происхождения, а также экваториальные африканцы;
- Мужской пол;
- Иммунодефицит: Люди с уровнем CD4-клеток менее 200 кл/мкл, те, кто перенес трансплантацию органов или костного мозга или постоянно принимает глюкокортикостероиды;
- Сексуальная ориентация: мужчины, имеющие секс с мужчинами(МСМ), подвержены более высокому риску развития СК.
К онкологическим заболеваниям, ассоциированным с вирусом папилломы человека, относятся инвазивный рак шейки матки (ИРШМ), сквамозный (чешуйчатый) рак головы/шеи, рак анального канала, вульвы и влагалища. СПИД-индикаторной из них является только ИРШМ.
Распространенность генитальной онкогенной инфекции ВПЧ среди женщин, живущих с ВИЧ, в целом выше, чем у остального населения.
Вирус папилломы человека способен к самопроизвольной элиминации — исчезновению из организма. У ВИЧ-положительных женщин этот процесс занимает больше времени, что увеличивает вероятность появления патологических изменений в шейке матки.
Продолжительный прием АРТ приводит к более низкой распространенности ВПЧ высокого риска и поражений шейки матки и даже предотвращает новые случаи ИРШМ.
Раннее начало антиретровирусной терапии, приверженность лечению обеспечивают снижение вирусной нагрузки — количества вируса в крови. Эти меры очень эффективны в отношении местного иммунитета слизистой оболочки и профилактики ИРШМ.
Скрининг ИРШМ заключается в проведении ПАП-теста и ВПЧ-теста (ПЦР). Женщины с ВИЧ-инфекцией в возрасте от 21 до 29 лет должны пройти ПАП-тест во время первичной диагностики ВИЧ, затем — через 12 месяцев, если анализ не показал патологии. Некоторые эксперты рекомендуют делать следующий ПАП-тест через 6 месяцев после первого. Если результаты трех последовательных мазков без отклонений, повторные тесты следует проводить каждые 3 года. ВПЧ-тест не рекомендуется подключать к ПАП-тесту до 30 лет — высока вероятность положительного результата, при этом оснований для активных действий нет. Лечения ВПЧ не существует, а для развития РШМ требуется, как правило, от 10 лет.
После 30 лет ПАП-тест и ВПЧ-тест проводятся совместно
У пациентов с ВИЧ-инфекцией повышается риск развития:
- гепатоцеллюлярной карциномы (ГЦК), связанной с вирусами гепатита С и В (ВГВ и ВГС) — в три раза;
- рака желудка, ассоциированного с инфекцией H.pylori;
- лимфомы Ходжкина — 8-13 раз. Риск связан с сопутствующей Эпштейн-Барр-инфекцией. Важно, что повсеместное внедрение АРТ не повлияло на показатели заболеваемости лимфомой Ходжкина в популяции людей с ВИЧ.
К факторам риска развития ГЦК у пациентов с ВИЧ относятся: цирроз печени, ожирение, диабет, возраст старше 60 лет, мужской пол.
Скрининг ГЦК проводится с помощью анализа крови на альфа-фетопротеин (АФП), который может продуцироваться раковыми клетками, или инструментальных методик диагностики — УЗИ, КТ, МРТ.
В последние годы всё чаще используется фиброскан для оценки стадии фиброза и близости к циррозу, независимому фактору риска ГЦК.
Предотвратить появление гепатоцеллюлярной карциномы можно с помощью своевременной вакцинации и ревакцинации от вирусного гепатита В и контроля вирусной нагрузки.
Несмотря на появление АРТ, НХЛ остаются актуальной проблемой для людей, длительное время живущих с ВИЧ. Хотя в большом количестве случаев неходжкинские лимфомы являются СПИД-индикаторными, они способны развиваться при нормальном уровне CD4-клеток и являются одной из наиболее частых причин смерти среди ВИЧ-положительных.
Общая выживаемость у пациентов с этим диагнозом низкая: более половины умирают в течение пяти лет от момента постановки диагноза
Отсюда возникают факторы риска развития НХЛ при ВИЧ-инфекции:
- наличие ко-инфекции вирусными гепатитами В, C, H.pylori;
- наличие вирусной нагрузки вируса Эпштейна-Барр или цитомегаловируса;
- наличие аутоиммунных заболеваний до постановки диагноза ВИЧ-инфекция;
- наличие специфических изменений в протеинограмме до или во время ВИЧ-инфекции;
- наличие минимальной вирусной нагрузки ВИЧ, несмотря на АРТ;
- снижение CD4-Т-лимфоцитов.
К скринингу неходжкинских лимфом относятся мониторинг вирусной нагрузки ВЭБ, ВГС, ВГВ и проведение инструментальной диагностики (КТ, МРТ, УЗИ, ФГДС).
С помощью контроля факторов риска и своевременного скрининга можно не только найти опухоль на ранней стадии, но и предотвратить заболевание.
Если рак все же обнаружили, ни в коем случае нельзя прерывать антиретровирусную терапию — она проводится по жизненным показаниям, что означает высокую вероятность неблагоприятного исхода противоопухолевой терапии без сопутствующего противовирусного лечения.
Патологическая анатомия. Морфология ВИЧ-инфекции складывается из:
1) изменений лимфатических узлов,
2) характерных поражений ЦНС (связанных с ВИЧ) и
3) морфологии оппортунистических инфекций и опухолей.
В стадии СПИДа фолликулярная гиперплазия лимфатических узлов сменяется истощением лимфоидной ткани. Лимфатические узлы резко уменьшаются, определяются с трудом.
К специфическим проявлениям СПИДа относят ВИЧ - энцефаломиелит с поражением преимущественно белого вещества и подкорковых узлов. Микроскопически характерно образование глиальных узелков, многоядерных симпластов. Характерны очаги размягчения и вакуолизация белого вещества, особенно боковых и задних рогов спинного мозга. Благодаря демиелинизации белое вещество приобретает серый оттенок.
Для оппортунистических инфекций при СПИДе характерны тяжелое рецидивирующее течение с генерализацией процесса и устойчивость к проводимой терапии.
Могут вызываться простейшими (пневмоцистами, токсоплазмами, криптоспоридиями); грибами (рода Candida, криптококками), вирусами (цитомегаловирусами, вирусами герпеса, некоторыми медленными вирусами); бактериями (Mycobacterium avium intracellulare, легионеллой, сальмонеллой).
Одна из самых характерных оппортунистических инфекций - пневмоцистная пневмония. Происходят отек и десквамация клеток альвеолярного эпителия, заполнение альвеол пенистой жидкостью.
Развивается гипоксия, при быстром прогрессировании болезни нарастает дыхательная недостаточность с развитием отека легких, полнокровие и клеточная инфильтрация межальвеолярных перегородок с возможной деструкцией. Может протекать в виде смешанной инфекции с присоединением другой микрофлоры (грибы, цитомегаловирус, кокки, микобактерии и др.).
Токсоплазменная инфекция, возникает токсоплазменный энцефалит, для него характерны фокусы некроза и абсцедирования.
При криптоспоридиозе поражается кишечник, развиваются колиты и энтериты, проявляющиеся длительной профузной диареей.
Часто отмечаются кандидозс вовлечением пищевода, трахеи, бронхов, легких, а также криптококкоз, склонный к диссеминации процесса.
Из вирусных инфекций наиболее типична цитомегаловирусная с развитием ретинита, эзофагита, гастрита, колита, пневмонита, гепатита, энцефалита. Ретинит характеризуется некротическим поражением сетчатки.
Герпетической инфекции свойственно длительное поражение слизистых оболочек и кожи.
Среди бактериальных инфекций наиболее типична микобактериальная инфекция, которая приводит к развитию диссеминированного процесса с поражением лимфатических узлов и внутренних органов.
Туберкулез у больных ВИЧ-инфекцией может возникнуть задолго до развития оппортунистических инфекций.
Злокачественные опухоли при ВИЧ-инфекции встречаются в 40 % случаев. Наиболее характерными являются саркома Капоши и злокачественные лимфомы.
Саркома Капоши (множественная идиопатическая геморрагическая саркома) - редкое заболевание, возникающее обычно у мужчин старше 60 лет, характеризуется медленным течением.
Проявляется багровыми пятнами, бляшками, узлами, расположенными обычно на коже дистальных отделов конечностей. Могут наблюдаться изъязвления. Возможна самопроизвольная инволюция с возникновением на месте опухоли рубцов и депигментированных пятен.
Микроскопически опухоль состоит из множества новообразованных хаотично расположенных тонкостенных сосудов и пучков веретенообразных клеток. Часто видны кровоизлияния и скопления гемосидерина, отличается генерализацией процесса с поражением лимфатических узлов, желудочно-кишечного тракта, легких и других внутренних органов.
Злокачественные лимфомы при ВИЧ-инфекции преимущественно В-клеточные. Часто встречается лимфома Беркитта. Нередко наблюдаются первичные лимфомы ЦНС, желудочно-кишечного тракта (особенно ректоанальной зоны).
Оппортунистические инфекции и злокачественные опухоли настолько типичны для ВИЧ-инфекции, что получили название индикаторных болезней, или указателей ВИЧ-инфекции. Наличие этих заболеваний позволяет заподозрить и диагностировать ВИЧ-инфекцию.
В России среди оппортунистических инфекций зарегистрированы грибковые и герпетические поражения, пневмоцистная пневмония, туберкулез, токсоплазмоз.
Клинические варианты. Многообразие оппортунистических инфекций, часто сочетающихся между собой, а также с опухолями, делает клиническую картину ВИЧ-инфекции чрезвычайно разнообразной.
В связи с этим выделяют несколько наиболее типичных клинических вариантов ВИЧ-инфекции:
1) легочный,
2) синдром поражения центральной нервной системы, 3) желудочно-кишечный синдром,
4) лихорадку неясного генеза.
Легочный вариант - самый частый. Он представлен сочетанием пневмоцистной пневмонии, цитомегаловирусной и атипичной микобактериальной инфекции и саркомы Капоши.
Синдром поражения центральной нервной системы включает ВИЧ-энцефалит, поражения, связанные с токсоплазмозом, криптококкозом и цитомегаловирусной инфекцией, а также лимфому; приводит к развитию деменции.
Желудочно - кишечный синдром - это сочетание кандидоза, цитомегаловирусной инфекции, криптоспоридиоза и атипичной микобактериальной инфекции; сопровождается диареей и развитием в финале кахексии.
Лихорадка неясного генеза: в ряде случаев удается обнаружить атипичную микобактериальную инфекцию или злокачественную лимфому.
Причины смерти. Смерть наступает чаще от оппортунистических инфекций и генерализации опухолей. В развитых странах 50 % больных умирают в течение 18 мес со дня постановки диагноза (СПИД) и
80 % - в течение 36 мес. Летальность при СПИДе достигает 100 %.
Амилоидоз.
Амилоид представляет собой белок, который откладывается между клетками в различных тканях и органах. Его распознавание в клинике зависит исключительно от обнаружения в биоптатах.
При светооптическом исследованиис использованием традиционных окрасок амилоид выглядит как аморфное, эозинофильное, гиалиноподобное межклеточное вещество, в результате прогрессирующего накопления и давления которого развивается атрофия клеток.
Чтобы отличить амилоид от других депозитов, используют гистохимический метод - окраску Конго красным.
Химически амилоид неоднороден. Различают две основные формы. Они образуются с участием разных патогенетических механизмов. Поэтому амилоидоз представляет собой группу заболеваний, основным признаком которой является отложение похожих веществ белкового строения.
Физическая природа амилоида.
При электронной микроскопии амилоид состоит из неветвящихся фибрилл длиной приблизительно 7,5-10 нм. Эта структура амилоида одинакова при всех видах амилоидоза. Второй компонент (Р-компонент).
Химическая природа амилоида.
Приблизительно 95% амилоида состоит из фибриллярного белка, остальные 5% остаются на долю гликопротеинового
Р-компонента.
Выделены два основных:
амилоид из легких цепей (AL), который образуется плазматическими клетками (иммуноцитами) и содержит легкие цепи иммуноглобулина;
связанный амилоид (АА) - уникальный неиммуноглобулиновый белок, синтезируемый печенью из более крупных предшественников, циркулирующих в крови (амилоид, связанный с сывороткой крови). АА-белок образуется при вторичном амилоидозе.
Сывороточный Р-компонент обладает сродством к фибриллам амилоида и необходим для образования депозитов в тканях.
Классификация амилоидоза основана на химическом строении амилоида (AL, АА, ATTR) и клинических синдромах.
Амилоидоз может быть
1) системным (генерализованным) с поражением нескольких систем органов или
2) местным, когда депозиты обнаруживаются только в одном органе.
Системный (генерализованный) амилоидоз бывает первичным, если связан с дискразией иммуноцитов, или вторичным, когда возникает как осложнение хронического воспаления или деструктивных процессов в тканях.
Врожденный (семейный) амилоидоз образует отдельную гетерогенную группу.
Дискразия иммуноцитов с амилоидозом (первичный амилоидоз).
Носит системный характер.
AL-амилоид встречается в 75% всех наблюдений этого типа амилоидоза. В основе заболевания лежит развитие дискразии плазматических клеток. Встречается у больных с множественной миеломой.
Реактивный системный амилоидоз.
Для этого вида амилоидоза характерно образование
АА-амилоида. Называют вторичным амилоидозом, так как он связан с хроническим воспалением.
Встречается при туберкулезе, бронхоэктатической болезни, хроническом остеомиелите. Чаще всего осложняет течение ревматоидного артрита и других заболеваний соединительной ткани, таких как анкилозируюший спондилит и воспалительные заболевания кишечника.
Амилоидоз, связанный с гемодиализом, возникает у больных после длительного гемодиализа, проводимого в связи с почечной недостаточностью. Примерно у 70% больных обнаруживаются депозиты амилоида в синовии, суставах и сухожилиях.
Врожденный семейный амилоидоз встречается в определенных географических районах, например, семейная средиземноморская лихорадка. Клинически характеризуется приступами лихорадки, сопровождающимися воспалением серозных оболочек, включая брюшину, плевру и синовиальные оболочки.
Аутосомно-доминантный семейный амилоидоз характеризуется выпадением амилоида, преимущественно, в периферических нервах. Семейная амилоидная полинейропатия описана в разных регионах мира.
Локализованный амилоидоз. Депозиты амилоида чаще всего встречаются в легких, гортани, коже, мочевом пузыре, языке и около глаз. На периферии амилоидных масс находят инфильтрацию лимфоцитами и плазматическими клетками.
Эндокринный амилоидоз. Депозиты амилоида обнаруживаются в некоторых эндокринных опухолях: медуллярный рак, опухоли островков поджелудочной железы, феохромоцитома, низкодифференцированные карциномы желудка, а также в островках поджелудочной железы при II типе сахарного диабета.
Амилоид старения. При старении встречаются два вида амилоидных депозитов. 1) Старческий сердечный амилоидоз характеризуется выпадением амилоида в сердце престарелых больных (на 8-9-м десятке лет жизни).
Заболевание течет бессимптомно, но может вызывать тяжелые нарушения сердечной деятельности. Депозиты амилоида одновременно обнаруживаются в легких, поджелудочной железе и селезенке.
2) Старческий церебральный амилоидоз развивается в результате отложения депозитов в мозговые кровеносные сосуды и бляшки у больных болезнью Альцгеймера.
У пациентов со СПИДом часто возникают опухоли, особенно саркома Капоши, неходжкинская В-клеточная лимфома, рак шейки матки у женщин и рак анальной области у мужчин. Подсчитано, что у 25-40% ВИЧ-инфицированных пациентов без терапии со временем развивается злокачественное новообразование.
Все эти опухоли, как полагают, вызваны онкогенными ДНК-вирусами, т.е. герпес-вирусом саркомы Капоши (KSHV), EBV (В-клеточная лимфома) и HPV (карцинома шейки матки и анальной области). Даже у здоровых людей любой из этих вирусов способен вызвать инфекцию, остающуюся латентной, если иммунная система функционирует нормально.
Повышенный риск развития опухолей при СПИДе существует главным образом вследствие реактивации вирусов и неспособности организма больного сдерживать развитие инфекции, а также из-за ослабления противоопухолевого иммунитета.
В начале эпидемии СПИДа до 30% гомо- или бисексуальных мужчин имели саркому Капоши, однако в последние годы с введением HAART наблюдается заметное уменьшение ее частоты — с 15 случаев на 1000 пациентов до менее 5 случаев.
Поражение при саркоме Капоши характеризуется пролиферацией веретенообразных клеток, экспрессирующих маркеры как эндотелиальных (сосудистых или лимфатических) клеток, так и клеток гладких мышц. В изобилии также присутствуют щелевидные сосудистые пространства, указывающие на то, что источником патологии могут быть примитивные мезенхимальные предшественники сосудистых каналов. Кроме того, при саркоме Капоши обнаруживаются хронические воспалительные клеточные инфильтраты.
Многие признаки саркомы Капоши свидетельствуют о том, что она не относится к злокачественным опухолям (несмотря на свое зловещее название). Так, веретенообразные клетки при многих саркомах Капоши имеют поликлональный или олигоклональный характер, хотя в запущенных случаях иногда становятся моноклональными. Веретенообразные клетки часто являются диплоидными, которым для пролиферации необходимы факторы роста.
Когда веретенообразные клетки имплантируют иммунодефицитным мышам, опухоль не образуется, но кратковременно индуцируется образование новых кровеносных сосудов, прерываемых щелевидными пространствами, и воспалительных инфильтратов в окружающих тканях. Эти элементы напоминают признаки саркомы Капоши человека, однако имеют мышиное происхождение, и, когда элиминируются клетки саркомы Капоши человека, воспалительные и неоваскулярные элементы также регрессируют.
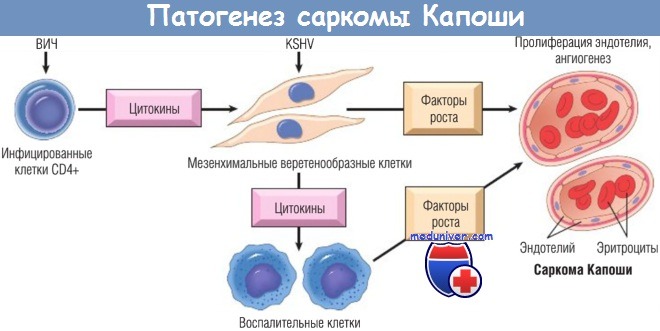
Патогенез саркомы Калоши.
Предполагаемая роль ВИН, герпес-вируса саркомы Капоши (KSHV) и цитокинов в развитии саркомы Капоши.
Цитокины образуются мезенхимальными клетками, инфицированными KSHV, или ВИЧ-инфицированными клетками CD4+.
В-клетки также могут быть инфицированы KSHV; вероятно, эти клетки связаны с лимфомами полостей тела, а также ассоциированы с KSHV-инфекцией, однако их роль при саркоме Капоши неясна.
ВИЧ — вирус иммунодефицита человека.
Существующая модель патогенеза саркомы Капоши, основанная на этих наблюдениях, заключается в том, что веретенообразные клетки продуцируют провоспалительные и ангиогенные факторы, которые мобилизуют воспалительные и неоваскулярные элементы, и последние секвестрируют факторы, способствующие выживаемости или росту веретенообразных клеток.
Однако что именно инициирует этот цикл? Существуют убедительные данные, что сам ВИЧ не является виновником и что саркому Капоши вызывает KSHV, называемый также герпес-вирусом человека 8-го типа (HHV-8). С помощью эпидемиологических и молекулярных исследований установлена связь между KSHV и развитием саркомы Капоши. ДНК KSHV обнаружена практически при всех саркомах Капоши, включая те опухоли, которые встречаются у ВИЧ-отрицательных лиц. KSHV локализован строго в веретенообразных клетках и вызывает преимущественно латентную инфекцию.
Однако для развития саркомы Капоши только KSHV-инфекции недостаточно, нужно участие кофакторов. При СПИДе в качестве такого фактора выступает ВИЧ. (Соответствующий кофактор при ВИЧ-отрицательной саркоме Капоши остается неизвестным.) Продолжается дискуссия о том, каким образом ВИЧ способствует развитию саркомы Капоши. Согласно простейшей модели, опосредованная ВИЧ иммуносупрессия дает возможность KSHV распространяться в организме-хозяине, получая доступ ко все большему числу веретенообразных клеток и направляя их по пути неконтролируемого роста.
Другая гипотеза заключается в том, что ВИЧ-инфицированные Т-клетки продуцируют цитокины или другие белки, способствующие пролиферации и выживаемости веретенообразных клеток. Ясно, что эти предположения не являются взаимоисключающими.
Также еще неизвестно, каким образом KSHV-инфекция приводит к развитию саркомы Капоши. Подобно другим герпес-вирусам, KSHV вызывает латентную инфекцию, во время которой образуется ряд белков, имеющих потенциальное значение в стимуляции пролиферации веретенообразных клеток и предотвращении апоптоза. К этим белкам относятся вирусный гомолог циклина D и различные ингибиторы р53. Такие белки могут давать латентно инфицированным клеткам преимущество в росте и выживаемости in vivo, стимулируя начало их пролиферации.
Кроме того, в небольшой субпопуляции клеток при саркоме Капоши происходит литическая вирусная репликация со смертью клеток и высвобождением прогени вируса. Литический цикл KSHV примечателен продукцией множества паракринных сигнальных молекул, включая вирусные гомологи цитокина IL-6 и различные хемокины. Возможно, последние играют существенную роль в индукции образования воспалительных инфильтратов, важного признака саркомы Капоши. Вклад вирусного IL-6 до сих пор неясен. Другой вирусный белок, продуцируемый во время литической инфекции, представляет собой конститутивно активный рецептор, связанный с G-белком.
Этот белок привлекает внимание, поскольку его экспрессия активирует высвобождение сосудистого эндотелиального фактора роста, способствующего ангиогенезу в окружающей ткани. Следует отметить, что экспрессия вирусного рецептора, связанного с G-белком, у трансгенных мышей приводит к образованию неоваскулярных пространств, отдаленно напоминающих таковые в саркоме Капоши. Таким образом, есть достаточные основания полагать, что и латентная, и литическая KSHV-инфекции вносят свой вклад в патогенез саркомы Капоши.
KSHV-инфекция не ограничена эндотелиальными клетками. Филогенетически вирус родственен подсемейству лимфотропных герпес-вирусов, соответственно его геном обнаруживается в В-клетках инфицированных индивидов. KSHV-инфекция у пациентов со СПИДом также связана с редкой В-клеточной лимфомой (называемой первичной лимфомой, связанной с полостями тела) и мультицентрической болезнью Кеслмена (В-клеточным лимфопролиферативным расстройством).
Саркома Капоши, ассоциированная со СПИДом, клинически отличается от спорадической формы. У ВИЧ-инфицированных индивидов опухоль обычно распространяется, поражая кожу, слизистые облочки, лимфоузлы и легкие. Эта опухоль имеет тенденцию к большей агрессивности, чем классическая саркома Капоши.
б) Лимфомы. Ассоциированные со СПИДом лимфомы разделяют на 3 группы в зависимости от локализации: системные лимфомы, первичные лимфомы ЦНС и лимфомы, связанные с полостями тела. Системные лимфомы поражают лимфоузлы и участки внутренних органов вне лимфоузлов. Частота системных лимфом — 80% всех связанных со СПИДом лимфом. ЦНС является наиболее часто поражаемой областью вне лимфоузлов, за ней следует ЖКТ, реже опухоль возникает практически в любом другом месте, включая глазницы, слюнные железы и легкие.
Подавляющее большинство таких лимфом представляют собой агрессивные В-клеточные опухоли, выявляемые на поздней стадии. ЦНС, помимо поражения системными неходжкинскими лимфомами, является также местом первичной локализации лимфоматоза у 20% пациентов с ВИЧ-инфекцией, у которых возникла лимфома. Первичную лимфому ЦНС регистрируют у пациентов со СПИДом в 1000 раз чаще, чем в общей популяции. Лимфомы, связанные с полостями тела, встречаются редко, однако привлекают внимание необычным проявлением в виде плевральных, перитонеальных и перикардиальных выпотов.
В основе патогенеза В-клеточных лимфом, ассоциированных со СПИДом, лежит, вероятно, длительная поликлональная активация В-клеток, вследствие чего появляются моноклональные или олигоклональные В-клеточные популяции. Предполагают, что в ходе безудержной пролиферации в некоторых клонах происходят мутации или хромосомные транслокации, затрагивающие онкогены или гены-супрессоры опухолей, с последующей неопластической трансформацией (см. главу 7). Есть морфологические данные об активации В-клеток в лимфоузлах; считают, что такая стимуляция В-клеток является многофакторным процессом.
У пациентов со СПИДом отмечаются высокие уровни различных цитокинов, некоторые из них, включая IL-6, являются факторами роста В-клеток. Кроме того, играет определенную роль EBV, известный как поликлональный В-клеточный митоген. 50% системных В-клеточных лимфом и практически все лимфомы, первично возникшие в ЦНС, латентно инфицированы.
Другим признаком, указывающим на инфекцию EBV, служит волосистая лейкоплакия полости рта (белые пятна на языке), возникающая в результате индуцированной EBV плоскоклеточной пролиферации слизистой оболочки рта. Если методом молекулярного футпринтинга EBV не определяется, вероятно, поликлональную активацию В-клеток инициировали другие вирусы и микробы. Отсутствуют доказательства того, что сам ВИЧ способен вызывать неопластическую трансформацию. Редкие эффузионные лимфомы, связанные с полостями тела, постоянно латентно инфицированы KSHV.
В результате увеличения продолжительности жизни пациентов со СПИДом количество лиц с неходжкинской лимфомой неуклонно растет. Считают, что у 6% всех пациентов со СПИДом в течение жизни развивается лимфома. Таким образом, риск возникновения неходжкинской лимфомы среди пациентов со СПИДом в
120 раз выше, чем в общей популяции. В отличие от саркомы Капоши иммунодефицит здесь прочно занял центральное место как предрасполагающий фактор. Предположительно пациенты с числом Т-клеток CD4+ менее 50 в 1 мкл относятся к группе крайне высокого риска.
в) Другие опухоли. У пациентов со СПИДом также повышена частота карциномы шейки матки и анальной области. Вероятно, это обусловлено реактивацией латентной инфекции, вызванной HPV, в результате иммуносупрессии. Считают, что этот вирус тесно связан с плоскоклеточной карциномой шейки матки и предшествующими ей дисплазией шейки матки и карциномой in situ. Ассоциированную с HPV цервикальную дисплазию регистрируют у ВИЧ-инфицированных женщин в 10 раз чаще, чем у неинфицированных женщин, поэтому гинекологическое исследование должно быть частью рутинного обследования ВИЧ-инфицированных женщин.
- Рекомендуем ознакомиться со следующей статьей "Болезни ЦНС при СПИДе"
Читайте также:


