Основные резервуары вич в организме
Все мы хорошо знаем, что АРВТ достигла больших успехов, она весьма эффективна. Благодаря чему? Благодаря тому, что в клетке, в которой размножается вирус, есть специальные мишени для АРВТ-препаратов. Что это за мишени? Это ферменты вируса, отвечающие за проникновение в клетку, обратную транскрипцию, интеграцию и, наконец, созревание вирусных частиц.
Цель АРВТ — это стабильное снижение вирусной нагрузки. Каждый, кто лечит ВИЧ-инфекцию, хорошо знает, что сначала вирусная нагрузка снижается очень быстро. Практически за несколько недель она теоретически может упасть до неопределяемого уровня. Почему он достигается так быстро? Потому что на первом этапе применения АРВТ основной мишенью для лекарств являются СД4 лимфоциты, которые находятся, как мы понимаем, в кровотоке и легко доступны для препаратов.
Сейчас мы можем констатировать, что кроме уже названного этапа есть еще и второй этап снижения нагрузки. Этот этап связан с вирусом, попавшим в клетки-макрофаги. Лекарства сюда проникают намного хуже, намного медленнее. Тем не менее продолжение терапии позволяет несколько снизить вирусную нагрузку и в них.
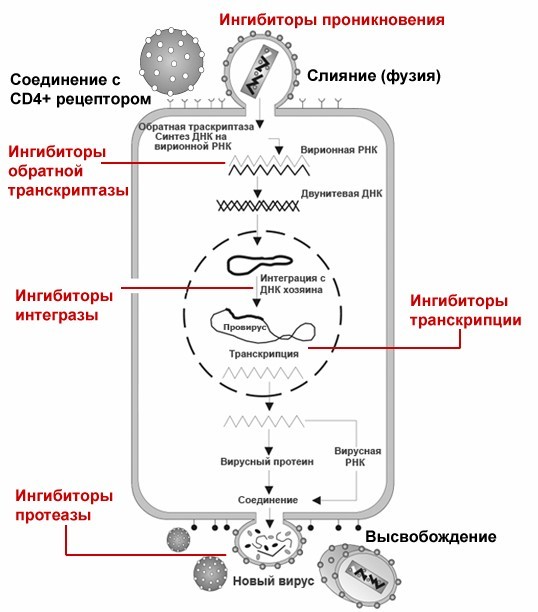
Схема работы антиретровирусной терапии.
Но что происходит с вирусной нагрузкой после того, как она стала неопределяемой? Чтобы ответить на этот вопрос, существуют так называемые ультрачувствительные методы. После того как вирусная нагрузка наконец выходит на плато, мы видим лишь единичные копии РНК вируса, но снизить ее еще больше уже не представляется возможным.
На заре такого рода исследований первой мыслью, которая пришла в голову ученым, было увеличить интенсивность терапии, чтобы достичь полного уничтожения вирусных частиц в организме. Для этого были испробованы несколько вариантов, которые были связаны с повышением дозировок, с увеличением количества препаратов в схеме, с применением новых препаратов. Но ни один из перечисленных инструментов не привел к желаемым результатам. Это, очевидно, указывало на то, что размножение вируса не является главным источником остаточной виремии. Так, к настоящему времени сформировалось представление о так называемых резервуарах ВИЧ.
Спящие хелперы
Резервуары бывают двух видов: анатомические и клеточные. Анатомические резервуары — это такие зоны организма, куда не проникает либо плохо проникает лекарство. Таких зон в организме немало. Прежде всего, это центральная нервная система, лимфоузлы, это ЖКТ и костный мозг.
Главный клеточный резервуар — так называемые латентно-инфицированные клетки. Дело в том, что почти все клетки-мишени вируса, в первую очередь хелперные клетки, в определенный момент своей жизни, чтобы выполнить свою функцию, приходят в состояние активации, а после того, как они ее выполнили, дают себе команду апоптоза и погибают.
Клетки памяти сохраняют способность к делению. И делятся простым митозом. Часть из них погибает, но другие могут реактивироваться. Состояние их реактивации достигается разными способами. Иногда это химическое воздействие, иногда физическое, иногда какая-то дополнительная инфекция, которая оказывается в организме.
Т-хелпер
Как только латентно инфицированная клетка оказывается реактивирована, она начинает производить новые вирусные частицы. Что и дает ту самую остаточную виремию, о которой мы говорили выше.
Что делать с этим? Существуют две стратегии излечения. Одна из них называется стерилизующей терапией, или радикацией. Другая — функциональное излечение. Радикация — это полное уничтожение всех резервуаров в организме таким образом, чтобы в нем не осталось ни одной молекулы РНК и ни одной молекулы ДНК вируса.
Функциональное излечение предполагает, что вирус в организме остается в очень небольшом количестве, но при этом излечивающее воздействие приводит к тому, что последующая терапия такому пациенту больше не требуется.
Два пути
Первый случай радикации, о котором мы все уже слышали, — это, конечно, так называемый Берлинский пациент.
Для того, чтобы вирусу присоединиться к клетке, ему нужны два рецептора: один СД4, а другой CCR5. Полноценный CCR5 рецептор кодирует ген CCR5 дикого типа. Но бывает, что в составе этого гена встречается делеция, то есть потеря части хромосомы. Она называется дельта32. В этом случае у человека формируется неполноценный рецептор, а вирус не может присоединиться к клетке-мишени.
Люди с такой мутацией встречаются, и если эта мутация у них в гомозиготе, то они полностью защищены от инфицирования ВИЧ — за редкими исключениями.
Берлинскому пациенту, который был гетерозиготен по дельта32, в результате острого миелогенного лейкоза пришлось сделать полное облучение организма и химиотерапию. АРВТ временно пришлось отменить. После переливания стволовых клеток дельта32 двенадцать лет назад в его организме не удалось встретить ни РНК, ни ДНК вируса.
Так человечество столкнулась с первым случаем полного излечения от ВИЧ-инфекции.
Макрофаг
Уже в этом году, летом, мы услышали еще о двух таких пациентах. У них ситуация была попроще. Лимфома Ходжкина. Лечение было менее тяжелым, им не делали полного облучения, да и химиотерапия была не такая тяжелая. Однократно каждому из них перелили стволовые клетки. В итоге: Лондонский пациент находится в ремиссии уже более двух лет, а Дюссельдорфский — приближается к году.
Считается, что это тоже случаи полного излечения. Но для всех пациентов такая терапия не подойдет. Несмотря на то, что инициатива продолжается и существует целая программа, которая собирает коллекцию стволовых клеток дельта32. На данный момент собрана коллекция потенциальных доноров: около 40 тысяч человек. Безусловно, не всем удастся подобрать донора.
Модификация этого подхода — генная терапия, которая предполагает, что можно взять клетки у человека, уже инфицированного ВИЧ, и вырезать ген CCR5, получив клетки, аналогичные стволовым клеткам дельта32.
В целом, теоретически, это вполне возможно сделать. Такие технологии недавно были использованы на мышах. Более того, в этом году подобную геннотерапевтическую манипуляцию, хоть эксперимент и был воспринят научным сообществом неоднозначно, провели на человеческих эмбрионах. Это знаменитые китайские близнецы.
Впрочем, тут же, появилось несколько публикаций о том, что отсутствие гена CCR5 не совсем безразлично для организма, и люди, у которых такой рецептор отсутствует, подвержены многим другим рискам.

Здесь речь идет о реактивации латентных клеток, чтобы сделать их доступными для АРВТ. На первый взгляд, идея очень хорошая, но на пути этой стратегии уже встретилось немало трудностей. Хотя в некоторых экспериментах объем резервуаров все-таки удавалось снизить, вирусная нагрузка остаточной виремии у пациентов сохранилась. То есть уничтожить вирус в организме врачам так и не удалось.
Основная проблема связана с тем, что резервуары неоднородны. Все клетки в организме, которые имеют на своей поверхности соответствующие рецепторы, могут быть инфицированы. Но они все разные. И разработать препарат, который одинаково работал бы со всеми ними, ученым еще не удалось.
Лабиринт из тупиков
Как этого добиться? На эту тему сейчас проходят исследования. Некоторые из них касаются ограничения процесса инициации транскрипций, в котором принимает участие белок, носящий название Tat. Это самый главный вирусный трансактиватор транскрипций. А также клеточные белки, которые связаны с этим же этапом.
Некоторые связаны с идеей блокирования окружения провирусной ДНК и изменением структуры хроматина. Новые препараты, работающие по этой технологии, так называемые ингибиторы фактора LEDGF/p75, скоро будут апробированы в клинике.
Итак, проблема полного излечения ВИЧ волнует сейчас очень многих ученых, но мы находимся в начале этого сложного лабиринта, который рано или поздно приведет нас к искомой цели.
В каком состоянии находится проблема на данный момент в целом? В этом лабиринте, как вы понимаете, много тупиков. И некоторые из этих тупиков уже пройдены, а это тоже очень важно. Важно понимать, куда ходить не стоит, потому что по мере того, как ошибочные решения будут исключаться, мы, наверное, найдем правильный ответ и придем к искомой цели.
Лично мне кажется, что сейчас настает очень интересный момент. Накопление новых данных идет с огромной скоростью. Во всем мире еженедельно публикуется множество исследований и многие выглядят очень и очень перспективно. А стало быть, в ближайшие несколько лет нам можно ожидать прорыва.

Рис. 1. Модель вируса иммунодефицита человека. Темно-зеленым цветом показаны гликопротеиновые комплексы gp120, бурым — липидная мембрана вируса. Рисунок с сайта questiongene.com
Борьба с вирусом иммунодефицита человека (ВИЧ) не прекращается, и пока он остается нерешенной проблемой человечества. Современные методы лечения продлевают жизнь инфицированных людей практически до продолжительности жизни здоровых, но при этом они лишь подавляют репликацию вируса, не позволяя добиться полного излечения. Некоторая доля зараженных ВИЧ клеток не погибает и становится латентным (скрытым) резервуаром вируса. Ученые из США разработали специальные антитела, направляющие цитотоксичные Т-клетки на атаку латентных ВИЧ-клеток. Перспективы прямого применения этого подхода не очевидны, но полученные результаты могут оказаться важным шагом на пути разработки средств и методов полного излечения от СПИДа.
По данным Всемирной организации здравоохранения, на конец 2014 года с момента определения вируса иммунодефицита человека в 1981 году в мире заразились ВИЧ-инфекцией более 70 миллионов человек. Из них более 35 миллионов умерли, почти 37 миллионов живут инфицированными. Из-за широкого распространения и относительно быстрого роста числа зараженных ВИЧ присвоен статус пандемии (см. Epidemiology of HIV/AIDS). Особенно широко ВИЧ распространен на юге Африки (в некоторых странах этого региона, например в ЮАР и Ботсване, заражено больше 20% населения). В России, по данным на начало 2016 года, зафиксировано около миллиона ВИЧ-инфицированных, но по статистике только около половины больных знает о том, что они заражены ВИЧ, так что реальная картина может оказаться гораздо хуже.
ВИЧ заражает клетки иммунной системы и перестраивает их функции под свои потребности. В результате иммунная система подавляется и развивается синдром приобретенного иммунного дефицита (СПИД). Организм больного теряет возможность защищаться от инфекций и опухолей. Без лечения человек, зараженный ВИЧ, погибает в течение 9–11 лет от так называемых оппортунистических заболеваний, с которыми здоровый организм обычно успешно справляется.
ВИЧ во внешней среде нестабилен и передается только через кровь или биологические жидкости. Заражение происходит через поврежденные кожу и слизистые оболочки или при медицинских процедурах. В цикле репродукции ВИЧ вирусная РНК с помощью вирусной обратной транскиптазы превращается в ДНК и включается в геном клетки (рис. 2). Затем она транскрибируется в РНК, которая направляет синтез вирус-специфических белков, обеспечивающих размножение вируса и формирующих вирусную частицу, которая затем отпочковывается от клетки.

Рис. 2. Строение ВИЧ. Вирус окружен липидной мембраной, вследствие чего он нестабилен во внешней среде. В мембрану встроены поверхностные белки вируса. Антитела, использованные в обсуждаемых работах, направлены против поверхностного гликопротеина gp120. Рисунок с сайта ru.wikipedia.org
На разработку вакцин против ВИЧ были брошены значительные силы и средства, но об окончательной победе остается только мечтать. Причины неудач — в удивительной способности вируса изменять иммунологические свойства и таким образом уклоняться от действия антител, индуцированных вакциной.
Впрочем, в последние годы достигнут значительный прогресс в поддержании качества жизни больных СПИДом. Применение высокоэффективной комбинированной терапии, направленной против вирусных обратной транскриптазы и протеазы, при условии своевременного диагноза заражения позволяет продлить жизнь инфицированных людей практически до продолжительности жизни здоровых. Но некоторая доля клеток, зараженных ВИЧ (примерно одна из миллиона), не погибает и остается латентным резервуаром вируса, в котором ДНК ВИЧ интегрирована в геном, — и если противовирусную терапию прекратить, резервуар может активироваться и болезнь возобновится. Поэтому терапию приходится продолжать на протяжении всей жизни зараженного человека. Но противовирусная терапия стоит весьма дорого и может быть сопряжена с нежелательными побочными эффектами. Поэтому разработка подходов для ликвидации ВИЧ-резервуаров весьма актуальна и с медицинской, и с экономической точки зрения.
Недавно два коллектива исследователей, независимо друг от друга, практически одновременно опубликовали статьи, в которых описали оригинальный подход для ликвидации латентных ВИЧ-клеток. Обе статьи подготовлены научными коллективами из США. В обсуждаемых работах сделана попытка подойти к решению этой проблемы с помощью биспецифических антител (bi-specific antibodies).
Разработку биспецифических антител можно считать одним из наиболее важных достижений последнего времени в иммунологии и медицине, особенно в лечении онкологических заболеваний. Такой подход к лечению стали изучать в середине 80-х годов ХХ века, и довольно быстро исследования in vitro показали, что у него большой потенциал. В отличие от обычных природных антител (рис. 3), биспецифические антитела представляют собой искусственные белковые конструкции состоящие из фрагментов двух различных антител (рис. 4) и поэтому связывающиеся с двумя различными антигенами. Наиболее часто и успешно они используются для лечения рака. В этих случаях они чаще всего устроены так, что связывают цитотоксические Т-клетки (T-киллеры) иммунной системы (по их поверхностному антигену CD3) с раковыми клетками-мишенями, подлежащими уничтожению (по их поверхностному антигену).



Но на пути ученых возникали трудности: биспецифические антитела непросто производить в больших количествах, а всевозможные испытания заняли много времени. К тому же применение таких антител оказалось сопряжено с рядом побочных эффектов, таких как иммуногенность (способность вызывать иммунный ответ), выделение токсичных веществ, а также короткое время существования в организме.
Следует отметить, что впервые биспецифические антитела против клеток, продуцирующих ВИЧ, были разработаны еще 25 лет назад, но они были несовершенны, и как средство для лечения не применялись (см. J. Berg et al., 1991. Bispecific antibodies that mediate killing of cells infected with human immunodeficiency virus of any strain и А. Traunecker et al., 1991. Bispecific single chain molecules (Janusins) target cytotoxic lymphocytes on HIV infected cells). Это было в период, когда еще не были созданы эффективные противовирусные лекарства и исследователи испытывали разные пути борьбы c ВИЧ. Авторы обсуждаемых статей пошли дальше: конструкции биспецифических антител стали более совершенны, а главное, они были направлены против латентных ВИЧ-резервуаров.


Рис. 6. А, B — схема строения искусственно сконструированных биспецифических антител к антигену CD3 цитотоксических Т-клеток и поверхностному антигену ВИЧ; вариабельный домен из тяжелой белковой цепи (VH) соединен с вариабельным доменом из легкой цепи (VL). C — схема атаки клеток, зараженных ВИЧ. Изображение из обсуждаемой статьи J. Sung et al.
Авторы обеих работ полагают, что созданные ими биспецифические антитела потенциально могут стать эффективным иммунотерапевтическим средством для истребления латентных резервуаров ВИЧ. И научное сообщество, и общество в целом должны приветствовать и поддерживать исследования, направленные на полное излечение от ВИЧ. Но в данном случае перспективы клинического применения описанного подхода пока не вполне очевидны, необходимы дополнительные детальные исследования. Описанные исследования проводились in vitro, и неизвестно, в какой мере достигнутые эффекты будут иметь место в организме. Известно, что иммунотерапия с помощью чужеродных антител вызывает в организме иммунный ответ, направленный против этих антител. И такой побочный эффект действительно наблюдался группой A. Pegu et al. в опытах на обезьянах.
Агент, который бы индуцировал продукцию антигенов ВИЧ в латентно зараженных клетках, не повреждая при этом здоровые клетки, пока неизвестен. Более того, латентные резервуары ВИЧ могут находиться, например, в центральной нервной системе, куда проникновение белковых молекул затруднено из-за наличия гематоэнцефалического барьера. В общем, до применения полученных результатов пока очень далеко, и необходимо провести еще много исследований. Тем не менее, обсуждаемые работы представляются важным шагом на пути разработки средств и методов полного избавления от ВИЧ.
Источники:
1) Julia A. M. Sung et al. Dual-Affinity Re-Targeting proteins direct T cell-mediated cytolysis of latently HIV-infected cells // The Journal of Clinical Investigations. 2015. V. 125. P. 4077–4090.
2) Amarendra Pegu et al. Activation and lysis of human CD4 cells latently infected with HIV-1 // Nature Communications. 2015. V. 6. Article number: 8447.
3) Douglas D. Richman. HIV: Cure by killing // Nature. 2015. V. 528. P. 198–199. (Популярный синопсис к обсуждаемым статьям.)
ВИЧ/СПИД - РЕАЛЬНОСТЬ ИЛИ ВЫМЫСЕЛ?
Борьба со СПИДом идёт во всём мире уже более 30 лет. Однако, есть и такое мнение, что вируса иммунодефицита человека не существует в природе, и поэтому вся эта борьба совершенно бессмысленна.
Это альтернативное мнение разделяют тысячи людей по всему миру, включая известных учёных, врачей, журналистов, а также тех, кто лично столкнулся с этой проблемой, получив диагноз ВИЧ-инфекция, или этот диагноз был поставлен их близким.
Большинству людей практически ничего не известно об этом альтернативном мнении. И когда им предлагают, а зачастую можно сказать навязывают пройти обследование на ВИЧ-инфекцию, они делают это, совершенно не зная о том, какие последствия может вызвать это обследование. Причём эти последствия могут оказаться весьма и весьма неприятными, и даже трагическими.
Противники официальной теории ВИЧ/СПИДа считают, что тестирование на ВИЧ необходимо немедленно прекратить, а также прекратить назначение ВИЧ-позитивным пациентам так называемой антиретровирусной терапии против ВИЧ. По их мнению, эта практика, основанная на ложной ВИЧ/СПИД-теории, не несёт населению ничего, кроме геноцида.
Чтобы каждый человек смог самостоятельно разобраться в этой проблеме, и сделать для себя свои собственные выводы, и решить, стоит ли ему когда-либо тестироваться на ВИЧ-инфекцию или принимать лекарственные препараты против ВИЧ, стоит ознакомиться с этим альтернативным мнением. Ниже по ссылкам Вы можете найти 6 книг, 6 статей и 6 фильмов, достаточно подробно раскрывающих это мнение.
Если ранее Вы были абсолютно уверены в истинности официальной ВИЧ/СПИД-теории, то Вам стоит обратить внимание на эти материалы, чтобы избежать возможных негативных последствий, связанных с тестированием на ВИЧ или приёмом антиретровирусной терапии.
ВИЧ-инфекция - инфекция, вызываемая ретровирусами, обусловленная инфицированием лимфоцитов, макрофагов и нервных клеток; проявляется медленно прогрессирующим иммунодефицитом: от бессимптомного носительства до тяжёлых и смертельных заболеваний.
Синдром приобретённого иммунодефицита (СПИД) - вторичный иммунодефицитный синдром, развивающийся в результате ВИЧ-инфекции.
Частота. К 1995 г. число инфицированных достигло 6,4 млн человек. Прогноз на 2000 г. - 100 млн человек, из них - 25 млн с выраженными проявлениями СПИДа, что выводит проблему на уровень глобальной катастрофы.
ЭТИОЛОГИЯ
- Возбудители - вирусы иммунодефицита человека (ВИЧ) рода Retrovirus подсемейства Lentivirinae семейства Retroviridae. ВИЧ погибают при температуре 56 °С в течение 30 мин, но устойчивы к низким температурам; быстро погибают под действием этанола, эфира, ацетона и обычных дезинфицирующих средств. В крови и других биологических средах при обычных условиях сохраняют жизнеспособность в течение нескольких суток. Известно 2 типа вируса.
- ВИЧ-1 (HIV-1) - основной возбудитель ВИЧ-инфекции и СПИДа (ранее известен как HTLV-III или LAV) в Северной и Южной Америке, Европе, Азии, Центральной, Южной и Восточной Африке.
- ВИЧ-2 (HIV-2) - менее вирулентный вирус; редко вызывает типичные проявления СПИДа; основной возбудитель СПИДа в Западной Африке.
ЭПИДЕМИОЛОГИЯ
Источник инфекции - человек в любой стадии инфекционного процесса. Вирус выделяют из крови, спермы, влагалищного секрета, материнского молока (эти жидкости определяют пути передачи вируса), слюны. Пути передачи - половой, парентеральный, трансплацентарный, через материнское молоко.
ГРУППЫ РИСКА
Источник инфекции - человек в любой стадии инфекционного процесса. Вирус выделяют из крови, спермы, влагалищного секрета, материнского молока (эти жидкости определяют пути передачи вируса), слюны. Пути передачи - половой, парентеральный, трансплацентарный, через материнское молоко.
- Гомосексуальные и бисексуальные мужчины (43%)
- Наркоманы, использующие наркотики в/в (31%)
- Гетеросексуалы (10%)
- Реципиенты крови и её компонентов, трансплантируемых органов (2%)
- Больные гемофилией (1%).
ПАТОГЕНЕЗ
Популяции клеток, поражаемые ВИЧ:
ВИЧ поражает активированные С04-клетки (моноциты, макрофаги и родственные клетки, эксп-рессирующие С04-подобные молекулы), используя молекулу CD4 в качестве рецептора; эти клетки распознают Аг и выполняют функции Т-хелперов/амшшфикаторов
Инфицирование возможно при фагоцитозе иммунных комплексов, содержащих ВИЧ и AT. Заражение моноцитов и макрофагов не сопровождается цитопатическим эффектом, и клетки становятся пероистивной системой для возбудителя.
Резервуары ВИЧ в организме заражённого индивида:
Основной резервуар - лимфоидные ткани. Возбудитель репродуцируется постоянно, даже на ранних стадиях
В ЦНС - микроглия эпителий кишечника.
Ранняя виремическая стадия
Вирус реплицируется в течение различных промежутков времени в небольших количествах
Временное уменьшение общего числа СD4+-клеток и возрастание числа циркулирующих ВИЧ-инфицированных СD4+-Т-лимфоцитов.
Циркуляцию ВИЧ в крови выявляют в различные сроки; вирусе-мия достигает пика к 10-20 сут после заражения и продолжается до появления специфических AT (до периода сероконверсии).
Бессимптомная стадия.
В течение различных периодов времени (до 10-15 лет) у ВИЧ-инфицированных симптомы болезни отсутствуют. В этот период защитные системы организма эффективно сдерживают репродукцию возбудителя
Гуморальные реакции - синтез AT различных типов, не способных оказывать протективный эффект и не предохраняющих от дальнейшего развития инфекции.
Клеточные иммунные реакции - способны либо блокировать репродукцию возбудителя, либо предотвращать проявления инфекции. Вероятно, цитотоксические реакции доминируют у ВИЧ-инфицированных с длительным отсутствием клинических проявлений.
Иммуносупрессия
Уменьшение количества циркулирующих СD4+Т-клеток, что существенно для репликации интегрированного ВИЧ. Репликацию интегрированного ВИЧ in vitro активирует митотическая или антигенная стимуляция инфицированных Т-клеток или сопутствующая герпетическая инфекция.
Возможная причина уменьшения числа Т-клеток - проявление цитопатического эффекта, вызванного репликацией вируса. Заражение Т-клеток in vitro не всегда продуктивно; вирусный геном в интегрированном состоянии может оставаться неэкспрессированным в течение долгого периода времени, в то время как число Т-клеток постоянно уменьшается.
Появление вирусных гликопротеинов в мембране заражённых Т-клеток - пусковой механизм для запуска иммунных механизмов, направленных против подобных клеток. Механизмы реализации - активация цитотоксических Т-клеток и реакция АТ-зависимой цитотоксичности.
Аккумуляция неинтегрированной вирусной ДНК в цитоплазме инфицированных клеток обусловливает бурную репликацию ВИЧ и гибель клеток
ВИЧ инфицирует клетки-предшественники в тимусе и костном мозге, что приводит к отсутствию регенерации и уменьшению пула С04-лимфоцитов. Снижение числа С04-лимфоцитов сопровождается падением активности ТНt-субпопуляции Т-клеток (однако доказательств того, что возрастает активность клеток ТН2, нет). Дисбаланс между субпопуляциями клеток ТН, и ТН2 предшествует развитию СПИДа. Уменьшается активность цитотоксических Т-клеток и клеток естественных киллеров, что связано с дефицитом кле-ток-хелперов. Ответ В-клеток тоже ослабевает по мере численного сокращения ТН2-субпопуляции.
Дефекты гуморальных реакций на различные Аг о0условлены дефицитом Т-хелперов. В-лимфоциты находятся в состоянии постоянной поликлональной активации.
Вследствие поликлональной активации и дефекта регуляторных механизмов В-клетки продуцируют AT к Аг ВИЧ с низкой специфичностью, перекрёстно реагирующие с ядерными, тромбоцитарными и лимфоцитарными ауто-Аг.
Механизмы, позволяющие ВИЧ избегать действия факторов иммунологического надзора
- Повышенный гуморальный анти-ВИЧ-ответ, ещё более выраженный на фоне СПИДа
- Интеграция генома ВИЧ в ДНК хозяина при минимальной экспрессии вирусных генов
- Мутации ВИЧ в эпитопе gp120. ВИЧ мутирует гораздо чаще, чем большинство других вирусов, т.к. обратная транскриптаза ВИЧ работает с ошибками и лишена корригирующей активности
- Клеточные иммунные реакции.
КЛИНИЧЕСКАЯ КАРТИНА
Стадия сероконверсии. В течение нескольких недель или месяцев после инфицирования в крови обнаруживают вирус и вирусные Аг при отсутствии специфических AT в сыворотке, появляющихся у большинства инфицированных ВИЧ-1 через 3-6 мес после заражения. После короткого (2-4 нед) инкубационного периода у 50-90% больных отмечают симптомы, напоминающие инфекционный мононуклеоз или простуду (головная боль, лихорадка, кожная сыпь и лимфаденопатия), спонтанно исчезающие в течение нескольких недель. Бессимптомная стадия. Больной остаётся сероположитель-ным при отсутствии симптомов, либо проявления минимальны (обычно диффузная реактивная лимфаденопатия и головная боль). Пациента без выраженных симптомов обследуют и, если это необходимо, проводят лечение болезней, часто наблюдаемых у ВИЧ-инфицированных (например, сифилис, гепатит В и туберкулёз).
Ранняя симптоматическая стадия
О переходе бессимптомной ВИЧ-инфекции в симптоматическое заболевание свидетельствуют лихорадка, повышенное ночное потоотделение, слабость, хроническая диарея, рассеянная лимфаденопатия и головная боль при отсутствии какой-либо специфической или оппортунистической инфекции
Сопутствующие инфекции: саркома Копоши, кандидоз ротовой полости, лейкоплакия слизистой оболочки полости рта (часто бессимптомная), инфекции верхних и нижних дыхательных путей и заболевания периодонта. Поздняя симптоматическая стадия
При прогрессирующем уменьшении СВ4+-клеток возрастает риск развития оппортунистических инфекций
Основное проявление оппортунистических инфекций - пневмоцистная пневмония (заболеваемость возрастает при уменьшении числа С04+-лимфоцитов ниже 200/мм3) и токсоплазмоз с частым поражением головного мозга
При падении числа С04+-клеток ниже 100/мм3 возрастает частота инфицирования Mycobacterium avium-intracellulare, ци-томегаловирусом; часто отмечают кандидозы пищевода, крип-тококковые пневмонии, менингиты, рецидивирующие герпетические инфекции на фоне общего истощения. Высвобождение а-фактора некроза опухолей (кахектина) вносит свой вклад в синдром истощения (известен как болезнь худобы в Африке), характерный для прогрессирующего СПИДа. Стадия прогрессирования заболевания
Сокращение числа С04-лимфоцитов до 50/мм3 и ниже приводит к полной дисфункции иммунной системы и развитию оппортунистических инфекций.
Оппортунистические инфекции, ассоциированные со СПИДом
- Пневмония, вызванная Pneumocystis carinii
- Хронический крипто-споридиоз или изоспориоз, вызывающие трудноизлечимую диарею
- Токсоплазмоз
- Внекишечный стронгилоидоз
- Кандидозы полости рта, пищевода, бронхов и лёгких
- Криптококкоз
- Гистоплазмоз
- Инфекции, вызванные атипичными микобактериями, например Mycobacterium avium-intracellulare
- Лёгочный и внелёгочный туберкулёз (часто устойчивый к терапии)
Генерализованная цитоме-галовирусная инфекция (может поражать глазные оболочки и вызывать слепоту) - Генерализованная инфекция ВПГ
- Генерализованные проявления опоясывающего лишая
- Рецидивирующая сальмонел-лёзная бактериемия
- Прогрессирующая многоочаговая лейкоэнце-фалопатия
- Инвазивный нокардиоз.
Стадия СПИДа
На развитие СПИДа указывают оппортунистические инфекции и прогрессирующий синдром истощения у взрослых или задержка развития у подростков
Наиболее часто у детей и подростков со СПИДом выявляют необычно частые инфекции, не рассматриваемые как оппортунистические, например, рецидивирующие бактериальные пневмонии или туберкулёз лёгких. Специфичными признаны некоторые неопластические заболевания, например, саркома Копоши и др. Неврологические заболевания и психические расстройства (деменция; значительная задержка роста и нарушения развития у детей)
Лимфоцитарные интерстициальные пневмони-ты у подростков и детей.
Сопутствующие заболевания
Сифилис (у ВИЧ-инфицированных протекает тяжелее)
Туберкулёз. Больных туберкулёзом исследуют на ВИЧ, или, при отсутствии такой возможности, их лечат комплексно, по схеме, применяемой для лечения туберкулёза у ВИЧ-инфицированных.
МЕТОДЫ ИССЛЕДОВАНИЯ
Твёрдофазный ИФА выявляет AT к ВИЧ
Метод мало пригоден для ранней диагностики ВИЧ-инфекции. AT, выявляемые ИФА, появляются в крови примерно через 2 мес с момента заражения. У 95% инфицированных они появляются лишь через 5-8 мес
Антигене-мию выявляют модифицированной иммуноферментной пробой, обнаруживающей р24 Аг в сыворотке, обработанной кислотой (в результате процедуры разрушаются иммунные комплексы и высвобождаются Аг).
Вестерн-блоттинг (иммуноблоттинг) применяют для подтверждения диагноза ВИЧ-инфекции. Метод обнаруживает специфические AT в сыворотке и является только подтверждающим тестом. Результаты рассматривают как положительные после обнаружения AT к р24, р31, gp41, gp120
Рекомендовано применение реакций с двумя Аг из трёх групп: р24, gp41 и gp120/160. При неопределённых результатах исследование повторяют через 3 и 6 мес
AT к р24 Аг появляются через 6 нед после заражения (AT к gp120 и gp41 обнаруживают раньше). Поскольку AT во время первичных проявлений инфекции обычно отсутствуют, то серонегативный больной, относящийся к группе повышенного риска, должен пройти повторный тест спустя 6 нед. В редких случаях сероконверсия может развиваться через год или более. Проба на р24 Аг положительная у 85-95% заражённых детей в возрасте 4-6 мес; значительно реже Аг обнаруживают у детей младше 4 мес
На поздних стадиях ВИЧ-инфекции результаты серологических исследований могут быть ложноотрицательными, что обусловлено снижением титров AT и уровня образования дочерних популяций возбудителя из-за общего снижения чувствительных иммунокомпе-тентных клеток
Методы, выявляющие AT, не пригодны для диагностики ВИЧ-инфекции у новорождённых, т.к. материнские IgG могут присутствовать в сыворотке ребёнка до года и более.
Альтернативные методы исследования
Виремию выявляют в культуре клеток in vitro и ПЦР с кровью пациента
Выделение вируса in vitro и выявление генетического материала возбудителя ПЦР. Результаты положительны у 35-55% инфицированных новорождённых в возрасте менее 1 нед и у 90-100% детей в возрасте 3-6 мес
Выявление специфического IgA в плазме крови и моче. IgA образуется в организме плода: у заражённых детей достоверный рост отмечают после 3 мес. В некоторых случаях положительные результаты у неинфицированных новорождённых обусловлены трансплацентарным транспортом некоторой части материнского IgA.
Определение прогрессирующего уменьшения числа СD4+-лимфоцитов
Выявление маркёров активации лейкоцитов, например, молекул, выделяемых при активации Т-лимфоцитов (В2-микроглобулин, растворимый рецептор интерлейкина-2, растворимый CD8), и молекулы, выделяемой при активации моноцитов (неоптерин)
Постоянное возрастание содержания р,,-микроглобулина и неоптерина характерно для слабого развития симптоматической инфекции. Сочетание уменьшения числа клеток CD4 и повышения уровня (32-микроглобулина или неоптерина, либо снижение С04-клеток и обнаружение Аг р24 свидетельствует о более обоснованном прогнозе развития СПИДа, чем просто низкое содержание СВ4-лимфоцитов.
Серологические исследования на токсоплазмоз. У 80% токсоплаз-моз развивается после уменьшения количества СВ4-клеток до 100/мкл и ниже.
Исследование биопсийного материала кожи перианальной области у ВИЧ-позитивных женщин, т.к. они более подвержены папиллома-вирусной инфекции.
ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ
При обнаружении любого из перечисленных симптомов, синдромов и заболеваний показано исследование крови на наличие AT к БИЧ. ВИЧ-инфекция напоминает проявления многих заболеваний. При необъяснимо затяжном течении конкретной нозологии необходимо обследование на специфические AT. Последние обычно появляются через 2 нед-3 мес после заражения и сохраняются до смерти больного (их титры могут уменьшаться в последние недели жизни).
ЛЕЧЕНИЕ
Тактика ведения
Сбор максимально полной информации о прошлых заболеваниях и результатах их лечения
Тщательный осмотр пациента по органам и системам, обращают внимание на лихорадку неясного генеза, продолжительную диарею, снижение массы тела, аденопатию, язвы в ротовой полости, дисфагию, кашель, учащение дыхания, одышку при нагрузке, кожные высыпания, синуситы.
Частоту обследований определяют по клинической картине, психическому статусу больного, необходимости в контроле над функцией иммунной системы и развитием побочных эффектов лекарственных средств
Во время последующих визитов к врачу проводят полное и тщательное физикальное обследование всех систем органов.
Определение содержания Т-хелперов проводят в зависимости от стадии заболевания каждые 3-6 мес
Активность репродукции возбудителя определяют качественной ПЦР
У ВИЧ-инфицированных женщин отмечают повышенный риск развития рака шейки матки. Необходимо выполнять мазки по Папаниколау каждые б мес или чаще.
Этиотропное лечение
Назначают одновременно не менее 2 препаратов для предупреждения быстрого развития резистентности. Следует учесть вероятность развития множества побочных эффектов ЛС.
Ингибиторы обратной транскриптазы ВИЧ
Зидовудин 500-1 500 мг/сут в 4-6 приёмов. Рекомендован при содержании С04+-клеток >500/мкл; беременным ВИЧ-се-ропозитивным женщинам (между 14 и 34 нед беременности); лицам, заразившимся ВИЧ (например, при уколе иглой); детям до 6 нед, рождённым от ВИЧ-инфицированных матерей. Противопоказан при выраженной нейтропении, значительном снижением уровня Нb. При лечении рекомендовано проводить исследования крови каждые 2 нед в течение первых 3 мес, затем не реже 1 р/мес.
Зальцитабин по 0,75 мг 3 р/сут; рекомендован при поздней стадии заболевания (монотерапия при непереносимости или неэффективности зидовудина или в сочетании с зидовуди-ном). При появлении побочных эффектов (чаще всего анемии и нейтропении) препарат отменяют или корректируют схему лечения. Крайне осторожно следует применять при периферической невропатии, панкреатите и застойной сердечной недостаточности в анамнезе, кардиомиопатии. Во время лечения рекомендовано систематическое исследование общего и биохимического анализа крови.
Диданозин 125-200 мг каждые 12ч за 30 мин до приёма пищи; наиболее эффективен в сочетании с азидотимиди-ном. Побочные эффекты: панкреатит, тошнота, рвота, боли в животе, диспепсия, периферическая невропатия и др. При появлении признаков панкреатита лечение следует прекратить. С осторожностью назначают при панкреатите в анамнезе, злоупотреблении алкоголем, нарушении функций почек. Антациды, содержащие магний или алюминий, усиливают побочные эффекты. Не рекомендован одновременный приём с тетрациклином.
Ингибиторы протеаз (наиболее эффективны в сочетании с ингибиторами обратной транскриптазы).
Саквиновир по 600 мг 3 р/сут. Противопоказан детям до 13 лет. Побочные эффекты; головные боли, миалгия, сыпь, зуд, изъязвление слизистой оболочки ротовой полости, тошнота, диарея и др. Следует применять с осторожностью при поражении печени и почек. Кетоконазол повышает, а ри-фампицин снижает концентрацию препарата в плазме.
Индинавир по 800 мг 3 р/сут (при печёночной недостаточности, нефролитиазе, в комбинации с кетоконазолом - по 600 мг 3 р/сут). Противопоказан детям. При приёме препарата рекомендовано выпивать не менее 1,5 л жидкости в сутки. Необходим контроль за появлением признаков не-фролитиаза. Совместим с ко-тримоксазолом, флуконазолом, изониазидом, кларитромицином, пероральными контрацептивами. Не рекомендованы комбинации с рифампицином, астемизолом, цисапридом.
Ингибиторы сборки и созревания дочерних популяций, например, а-интерферон.
Профилактика оппортунистических инфекций
Пневмонии, вызванной Pneumocystis carinii, - всем пациентам с пневмоцистозами в анамнезе; с содержанием С04-клеток
Читайте также:


