Поможет ли операция стволовых клеток убить вич
Агрессивный новичок
- Вадим Альбертович, ВИЧ был обнаружен еще в конце прошлого века. Почему лекарство так сложно было создать? Чем этот вирус отличался от других?
- С точки зрения биологии этот вирус очень похож на многие другие. Единственное, его фатальное отличие от других вирусов – это поражение иммунной системы человека, именно поэтому организм не может с ним бороться самостоятельно.
- Это своего рода агрессивный новичок?
Мыши на вес золота
- Вы уже дошли до клинических испытаний?
- До клинических - нет, но лабораторных мышей мы уже успешно лечим.
- Зачем в этом проекте мы и американцы нужны друг другу?
- Во-первых, потому что работа с вирусом ВИЧ требует астрономических денежных ресурсов. Ни одна сторона не хотела брать на себя всю тяжесть потенциальных финансовых потерь, поскольку велик риск, что мы будем много работать, но в итоге не сможем создать препарат принципиально нового поколения. Во-вторых, это крайне сложная работа, ее невозможно было сделать только в России, у нас нет ни адекватных моделей на животных, ни биологических технологий для проведения тестов. Например, для экспериментов на животных надо использовать безумно дорогих мышей, которые есть только в США. В то же время, российская химическая школа является ведущей мировой школой в области тонкого химического синтеза. Мы были лидерами 100 лет назад, и надеюсь, останемся ими в будущем. Именно поэтому наших ученых и привлекли для участия в совместном проекте.
- Почему нужны безумно дорогие мыши? Нельзя было найти подешевле?
- А это особые мыши - гуманизированные. У них с помощью современных технологий создали иммунную систему, которая идентична человеческой, можно сказать, что это просто человеческая иммунная система. Такие мыши - очень удобный лабораторный объект, можно испытать препарат и понять, как он будет воздействовать на человека.
- Как с американцами делили зоны ответственности?
- Как я уже сказал, российская сторона отвечает за химическую составляющую, дизайн и синтез соединений. Американские коллеги занимаются биологической частью и компьютерным моделированием. Выглядело это так: сначала мы с американскими партнерами обсуждали идеи, затем их специалисты на суперкомпьютерах проверяли насколько наши предположения реалистичны. Так формировался некий список перспективных соединений. Синтез этих соединений осуществляется здесь в Москве , в ФИЦ Биотехнологии РАН. И в конечном итоге готовые соединение тестируются в США.
От лаборатории до аптеки дистанция 10 лет
- Когда готовое лекарство может появиться в аптеках?
- От лаборатории до аптеки очень длинная дистанция. При благоприятном раскладе понадобится минимум 10 лет. Быстрее невозможно. Это связано с определенной последовательностью экспериментов и необходимым количеством данных, которые надо накопить. А отчасти с тем, что человечество само себе создало огромное количество преград на пути появления новых лекарств. Пройти согласование во всех регулирующих инстанциях очень тяжело и очень дорого. И это не только у нас, это практика всех стран мира. Кроме того, через год наш совместный проект заканчивается и надо будет искать финансирование под практические работы. Многие фармкомпании и фонды не стремятся вступать в такие долгие и дорогостоящие проекты, именно поэтому и сегодня наши исследования финансируются государственными фондами как со стороны России, так и со стороны США. Разработка лекарства для борьбы с ВИЧ это скорее задача государства.
- Я с большой осторожностью отношусь к заявлениям, что кто-то от чего-то вылечился на единичном примере. Мы не знаем достоверно, вылечился он или нет, это не клинические испытания, которые делаются в соответствии с очень строгим протоколом и которым можно доверять. Вирус может затаиться в нейронах и проснуться, когда пройдет много времени. Мы в своей работе придерживаемся позиций доказательной медицины, когда есть слепые клинические испытания на большой выборке. Что касается стволовых клеток, то это вопрос неоднозначный. Безусловно, есть примеры, когда стволовые клетки работают успешно, но это не касается вируса ВИЧ. Поэтому мы исходим из традиционных подходов: с одной стороны, есть вирус, с другой стороны - надо найти вещество, которым этот вирус можно уничтожить.
- А откуда все-таки появился ВИЧ? Существуют самые разные теории, по одной из версий вирус - это побочный эффект разработок биологического оружия…
- Происхождение вируса не является областью моей компетенции, моя ответственность - это разработка вещества, способного убить вирус. На самом деле есть только одна серьезная научная версия происхождения ВИЧ. Вирус появился в процессе мутации в Африке . Сначала он возник у человекообразных приматов, потом был перенесен на человека. Все остальные версии: космические, Божественные, конспирологические, не имеют отношения к здравому смыслу и научным сообществом не рассматриваются. И это не последний случай появления неизвестных ранее смертельных инфекций. Мы считаем, что новые вирусы будут появляться по мере развития человека, а мы будем придумывать вещества для их уничтожения. Это бесконечный непрерывный процесс.
ЧИТАЙТЕ ТАКЖЕ
В Лондоне выздоровел пациент с ВИЧ: случайный успех или победа человечества над СПИДом?
Пациенту, у которого болезнь перешла в смертельно тяжелую стадию, пересадили костный мозг, и ВИЧ пропал из организма (подробности)
Уникальное лекарство
Мужчина из Лондона, имя его не называется, проходил лечение рака, в ходе которого ему был пересажен костный мозг. Ему поставили страшный диагноз ВИЧ в 2003 году, в 2012-м у него также диагностировали запущенную лимфому Ходжкина. В ходе лечения рака была использована химиотерапия, а также ему были пересажены стволовые клетки от донора, резистентного к ВИЧ. Это привело к тому, что и рак, и ВИЧ перешли в стадию ремиссии. В настоящее время мужчина уже более 18 месяцев находится в состоянии ремиссии, он больше не принимает лекарство от ВИЧ.

Ученые из университета Лондона, Имперского колледжа Лондона, а также Кембриджского и Оксфордского университетов говорят, что еще рано говорить о полном выздоровлении пациента. А само лечение стволовыми клетками может оказаться не подходящим для многих людей с ВИЧ, но оно однажды может помочь найти лекарство от страшного заболевания.
Излечение возможно?
Это второй случай, когда человек, который проходил терапию стволовыми клетками, заканчивался ремиссией ВИЧ. Десять лет назад другой мужчина в Берлине прошел пересадку костного мозга от донора, который не был поражен ВИЧ-инфекцией.
Таким образом, первый, кто победил ВИЧ/СПИД, был Тимоти Браун. Ему провели две пересадки костного мозга, он прошел лучевую терапию, так как у него был лейкоз.
Это второй случай ремиссии ВИЧ, которая произошла благодаря использованию аналогичного подхода. Он доказал, что излечение пациента в Берлине не было аномалией. Именно пересадка стволовых клеток помогла устранить ВИЧ у этих двух людей. Об этом говорил профессор из UCL Равиндр Гупт.

Есть ли надежда?
Несмотря на то что это большой прогресс в поисках лекарства от ВИЧ, такой подход не может быть применим для многих лиц, страдающих данным заболеванием. Ведь агрессивное лечение этих людей использовалось для устранения онкологии, а не ВИЧ.
Современные методы терапии иммунодефицита действительно эффективны, люди с этой болезнью могут прожить долгую и вполне счастливую жизнь. Но эти случаи очень важны для ученых, которые ищут новые методы борьбы с ВИЧ, способные полностью устранить его. А понимание того, как организм человека может противостоять инфекции, дает надежду на полное выздоровление людей, даже если до этого еще далеко.
Профессор из Имперского колледжа Лондона Эдуардо Олаваррия, который принимал участие в исследовании, говорит, что успешная трансплантация стволовых клеток дает надежду на то, что вскоре могут быть разработаны новые стратегии для борьбы с вирусом. Но он утверждает, что такое лечение не подходит в качестве стандартной терапии ВИЧ, так как химио- и лучевая терапия достаточно токсичны.

Как это работает?
CCR5 – часто используемый рецептор ВИЧ-1, который применяют во всем мире. Он проникает в пораженные клетки. Но есть огромное количество людей, которые устойчивы к вирусу и имеют две мутированные копии рецептора CCR5. Это значит, что вирус не может попасть в клетки организма, которые он обычно заражает.
Мужчина из Лондона получил донорские стволовые клетки с этой специфической генной мутацией, которая его и сделала устойчивым к вирусу. Но клетки, которые были поражены ВИЧ, все еще могут находиться в организме в состоянии покоя на протяжении многих лет.
Поиски продолжаются
Ученые из Британии утверждают, что можно применять генную терапию, направленную на рецептор CCR5 у людей с ВИЧ. Ведь теперь известно, что выздоровление пациента из Берлина не было разовым.
Профессор Грэм Кук из Имперского колледжа в Лондоне говорит, что результаты являются обнадеживающими. Необходимо только понять, как это сработало у двух пациентов, тогда можно будет стать ближе к конечной цели лечения ВИЧ. Но на данный момент пересадка стволовых клеток несет большой риск для пациентов, которые поражены вирусом, но не имеют онкологии.

Вклад в науку
Доктор Эндрю Фридман считает, что эти два случая внесли огромный вклад в дальнейшие исследования и поиски лекарства от ВИЧ. Но еще необходимо наблюдать за излечившимися пациентами, ведь неизвестно, может ли вирус появиться со временем. Тем не менее это может помочь в разработке лекарство от вируса.
Также доктор акцентирует внимание на том, что необходимо своевременно диагностировать заболевание и проводить лечение при помощи комбинированной антиретровирусной терапией на протяжении всей жизни.
Таким образом, пока рано говорить о полном успехе лечения. Медики полагают, что такой метод хоть и не может быть универсальным и доступным для всех, но поможет найти лекарство от болезни в будущем.
Тимоти родился в США, но успел активно покататься по миру. В начале 1990-х он переехал в Барселону, где преподавал английский язык. Как сам он потом вспоминал, заработал инфекцию именно там. Параллельно учил немецкий и решил переехать в Берлин. В первую неделю в городе он остановился в квартире своего друга, который в это время был в отъезде в Исландии.
Тимоти нездоровилось, его свалила высокая температура, и почти всю неделю он провалялся на диване под одеялом. Страшный диагноз ему поставили в 1995 году в государственной клинике. Доктор, который поставил диагноз, по количеству T-лимфоцитов предположил, что инфекция в организме Тимоти обитает уже давно.
— Вам нужно немедленно начать прием лекарств, — заявила ему доктор и прописала азидотимидин (AZT). Тимоти боялся этого лекарства. Оно было самым первым разработанным от ВИЧ в 1980-х годах и обладало рядом довольно неприятных побочных эффектов: вплоть до анемии и проблем с печенью. И это было самое быстро разработанное лекарство на тот момент. Между демонстрацией эффективности AZT в лабораторных условиях и одобрением прошло всего 25 месяцев.
Благо уже в следующем году на рынок вышло более совершенное лекарство, которое ознаменовало собой начало эры высокоактивной антиретровирусной терапии (ВААРТ). ВИЧ довольно быстро приспосабливался к AZT из-за своей высокой мутагенности. И для подавления различных стадий развития вируса исследователи решили использовать комбинацию из трех-четырех препаратов, которую нужно было принимать не только ежедневно, но и по определенному расписанию по часам до конца жизни. Которая при ВААРТ значительно продлевалась.
От ВИЧ до лейкоза
— Я жил практически нормальной жизнью. Так продолжалось следующие 10 лет. После посещения свадьбы в Нью-Йорке я почти постоянно чувствовал себя истощенным. Вернулся в Берлин, проехал 16 км до работы на велосипеде и почувствовал себя опустошенным. В обед не смог проехать чуть больше километра до ресторана: пришлось сойти с велосипеда на полпути.
Тимоти отправили к онкологу. Биопсия костного мозга показала, что у него развился острый миелоидный лейкоз — злокачественная опухоль крови, при которой белые кровяные клетки подавляют рост нормальных клеток крови. Без должного лечения больной выгорает за несколько месяцев. В особо острых случаях — за несколько недель.

Для борьбы с лейкозом назначили четыре курса химиотерапии, каждый по семь дней с перерывом в несколько недель. Первый курс прошел легко. Дальше было только хуже: грибковая пневмония, сепсис, искусственная кома. В середине лечения началась ремиссия, и врач настаивал на том, чтобы провести трансплантацию стволовых клеток. Благо он уже нашел донора, который был согласен пожертвовать свои клетки с редкой мутацией CCR5 Delta 32. Она делала CD4-клетки практически неуязвимыми к ВИЧ.
— У многих пациентов не находилось подходящих доноров в банке стволовых клеток. У меня было 267 совпадений. Врачебная команда с 61-й попытки сумела найти донора с мутацией нужного гена. И он был согласен на пересадку.
Но я сказал нет! В этом не было необходимости: лейкоз находился в ремиссии, а принимать препараты против ВИЧ я мог бесконечно. Я не хотел быть морской свинкой и рисковать своей жизнью ради трансплантации, которая могла меня убить.
Второй день рождения
Тимоти был уверен, что трансплантация стволовых клеток — это очень опасная процедура, а выживает после нее только половина пациентов. Но в конце 2006 года у него уже не было другого варианта — лейкемия вернулась. И единственным шансом задержаться в этом мире была пересадка костного мозга.
К концу года лейкоз вернулся. Доктор назначил срочную вторую трансплантацию стволовых клеток на февраль 2008 года. И после этой операции восстановление шло куда хуже.
— Я бредил, почти ослеп и был почти полностью парализован. Заново учился ходить в центре для пациентов с экстремальными повреждениями мозга. Полное восстановление наступило только через шесть лет после пересадки.
Тимоти утверждает, что часть проблем после второй трансплантации были вызваны биопсией мозга сразу после процедуры. Точнее, пузырьком воздуха, который остался в его мозгу после биопсии. Он нанес ему некоторые повреждения, которые стали причиной двигательных проблем.
В это время в научных кругах уже вовсю шло обсуждение случая излечения Тимоти от ВИЧ. Все последующие анализы крови указывали на то, что присутствия инфекции в его организме нет.
Правда, скепсиса вокруг этого случая было предостаточно. Научный журнал New England Journal of Medicine дважды отверг публикацию лечащего врача Геро Хюттера. Дабы убедить научное сообщество, Тимоти пришлось самому выйти на сцену перед учеными, чтобы они смогли удостовериться, что он не похож на человека, зараженного ВИЧ.

Тимоти уже давно не принимает лекарства против ВИЧ в том же объеме, как лет 15 назад. Однако не отказывается от предэкспозиционной профилактики ВИЧ. От иммунодепрессантов, положенных после трансплантации, он отказался еще в 2010 году. Никаких болезней, связанных с отторжением транспланта, не возникло. Тимоти упоминал об этом в интервью 2017 года. Тогда же он отметил, что не боится того, что ВИЧ снова вернется в его жизнь.
А что дальше?
Но три этих пациента — это по-прежнему всего лишь капля в море десятков миллионов человек, которые каждый день проживают с вирусом.
После случая Тимоти Брауна было много неудачных попыток повторить его успех. И каждый раз вирус возвращался после того, как пациенты останавливали прием антиВИЧ-препаратов.

— Пускай это не жизнеспособная крупномасштабная стратегия лечения, но это действительно критический момент в поисках лечения от ВИЧ, — заявил глава Международного сообщества по СПИДу Антон Позняк в комментарии The Guardian. — Эти новые результаты подтверждают нашу убежденность в том, что существуют доказательства возможности вылечить ВИЧ. Есть надежда, что это в конечном итоге приведет к безопасной, экономически эффективной и простой стратегии с использованием генных технологий или методов, связанных с антителами.
Как мы уже знаем, мутация delta 32 возникает в гене, ответственном за производство белка под названием CRR5. Он находится на поверхности некоторых имунных клеток. Именно он необходим для того, чтобы распространенный тип ВИЧ мог заразить клетку. С помощью современных инструментов генной терапии можно отредактировать ген CRR5.
И в 2014 году ученые университета Пенсильвании поделились своими успехами в этой области. Они работали с 12 ВИЧ-пациентами, которые получали ВААРТ. Шесть из них прервали курс лечения через четыре недели после того, как им перелили кровь с 11—28% модифицированных клеток. Но такой объем клеток оказался недостаточным, чтобы сделать кого-нибудь устойчивым к ВИЧ. После отказа от ВААРТ вирусная нагрузка на организм только росла. Впрочем, это направление все еще считается одним из самых перспективных в борьбе с ВИЧ.
Другие группы ученых работают над доставкой ферментов, способных редактировать гены прямо в организме, с помощью наночастиц. Но этот способ явно не для ближайших нескольких лет.
Во всем мире насчитывается свыше 36 млн человек, инфицированных ВИЧ. Сегодня они вынуждены до конца жизни принимать препараты, которые не дают их организму умереть. Это продолжается десятилетиями. Для кого-то это стало рутиной, для кого-то стабильным заработком, а для развивающихся стран — проблемой серьезных издержек.
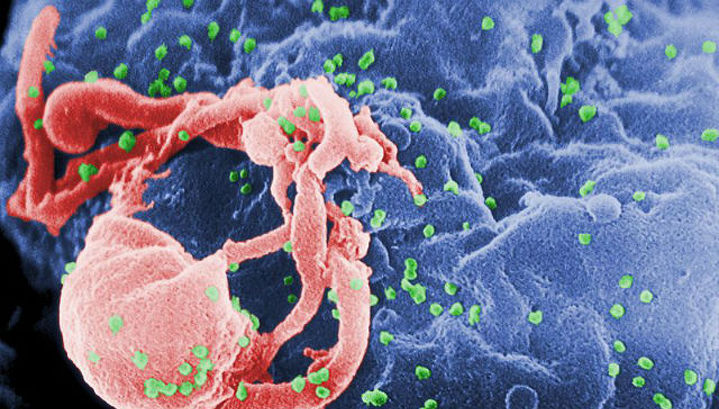
ВИЧ в первую очередь атакует белые кровяные клетки, разрушая таким образом иммунную защиту
(фото Wikimedia Commons).


Индуцированные плюрипотентные стволовые клетки (ИПСК) могут стать эффективной терапией против множества заболеваний, особенно в сочетении с современными методиками генной инженерии. В рамках нового исследования учёные доказали, что изменения генома ИПСК может стать единственным надёжным и безопасным методом лечения от ВИЧ.
Команда исследователей во главе с профессором Юэтом Каном (Yuet Kan) из Калифорнийского университета в Сан-Франциско доказала, что редактирование генома ИПСК приводит к появлению редкой природной мутации, позволяющей некоторым пациентам обретать устойчивость к ВИЧ.
Редактирование генома в работе Кана подразумевает "вырезание" какой-либо определённой части ДНК и замену этого участка другим. Этот метод гораздо более точный, чем любые другие традиционные формы генной инженерии, при которых последовательности ДНК добавляются в геном в случайных локациях.
Для "редактирования" генома стволовых клеток команда Кана использовала систему CRISPR-Cas9, которая считается наиболее эффективным методом редактирования генома. Он основан на работе бактериальной "иммунной системы". Эта система защищает микроорганизмы от вторжения вирусов, внедряя фрагменты их генетического кода в ДНК своей клетки. Учёные поясняют, что система CRISPR-Cas9 будто бы развешивает плакаты с портретами вирусов и надписью "особо опасен": так организм понимает, что и как ему нужно атаковать.

Данная работа является попыткой увеличить число людей, устойчивых к ВИЧ. На сегодняшний день около 1% европеоидов обладают "иммунитетом" к этому заболеванию, поскольку несут две копии мутаций в гене, экспрессирующем белок CCR5. Вирус иммунодефицита человека сначала должен прикрепиться к этому белку, прежде чем он атакует белые кровяные тельца и разрушит иммунитет, а мутации в гене не позволяют вирусу этого сделать.
Науке уже известны случаи излечения от заболевания после пересадки костного мозга естественного носителя мутаций в гене CCR5. Кан хочет достичь того же результата без необходимости поиска живых подходящих доноров костного мозга, которых, конечно же, крайне мало.
Использование ИПСК с отредактированным геномом является наиболее простым и бюджетным способом решения проблемы. Собственные клетки пациента возвращаются к эмбриональному состоянию, затем в ген CCR5 добавляются мутации, после чего полученную культуру пересаживают обратно больному, где она становится, к примеру, частью костного мозга.

Испытания показали, что белые кровяные тельца после пересадки стволовых клеток с мутациями в CCR5, оказывались полностью устойчивыми к ВИЧ. Но впечатляющие результаты экспериментов, впрочем, не означают, что методика будет внедрена в широкую клиническую практику уже завтра, предупреждают исследователи.
Кан ещё не успел вырастить ИПСК в определённый тип белых клеток крови CD4+ T-клетки, которые в первую очередь разрушаются ВИЧ. Вместо этого он планирует "запрограммировать" ИПСК на преобразование в кроветворные стволовые клетки, которые при пересадке в организм формировали бы все типы клеток, обнаруженных в крови.
"Одна из наиболее больших проблем технологии — это преобразование ИПСК в трансплантируемый тип клеток. Мы также должны быть уверены, что клетки, которые были подвергнуты обширной генетической манипуляции, безопасны для пациента", — поясняет Кан.
Результаты исследования Кана и его коллег изложены в статье журнала PNAS.

Китайские врачи опробовали CRISPR-отредактированные клетки на пациенте с ВИЧ-инфекцией и Т-клеточной лейкемией. После облучения больному ввели его собственные кроветворные клетки, в которых разрушили ген CCR5. Отредактированные клетки прижились в организме и образовали разные типы клеток крови. Серьезных побочных эффектов не возникло. Правда, защитить пациента от вируса они не смогли — из-за низкой эффективности редактирования. Статья опубликована в журнале New England Journal of Medicine.
В 2017 году Лей Сюй (Lei Xu) из Центра исследований стволовых клеток пекинского университета и его коллеги запустили небольшое клиническое исследование, чтобы попробовать создать устойчивость к ВИЧ в клетках крови с помощью CRISPR/Cas9. В своей статье ученые отчитываются о первом пациенте, который прошел их новую терапию. Кроме технологии редактирования, которую использовали китайские ученые, есть и еще одна деталь, которая отличает их эксперимент от исследования Sangamo Therapeutics. Китайцы забирали у пациента не Т-клетки, а стволовые клетки крови. Расчет был на то, что кроветворные клетки приживутся в красном костном мозге и будут постоянно поставлять в организм пациента устойчивые к ВИЧ Т-лимфоциты.
Ученые работали с 27-летним пациентом, у которого кроме ВИЧ-инфекции диагностировали еще и Т-клеточную лейкемию. Его планировали лечить лучевой терапией, которая убивает существенную часть клеток крови, и пересадка кроветворных клеток ему понадобилась бы в любом случае. Ученые решили совместить лечение с экспериментальной процедурой: после облучения ввели больному уже отредактированные собственные клетки. В этот момент антиретровирусную терапию пришлось прервать, чтобы можно было оценить результат эксперимента.
CRISPR-модифицированные клетки прижились в организме и не вызвали острого отторжения. С начала эксперимента прошло уже 19 месяцев, и клетки с разрушенным геном CCR5 все еще можно найти в крови пациента — причем не только Т-лимфоциты, но и другие клетки крови. Это значит, что отредактированные кроветворные клетки работают полноценно и производят разные типы клеток, у которых мутация сохраняется.
Тем не менее, полностью отредактировать кроветворение пациента не удалось. Среди всех клеток, которые ученые у него забрали для редактирования, внести изменения в геном получилось лишь у 17,8 процентов. После возвращения в организм новые клетки начали конкурировать со старыми за заселение красного костного мозга. И в течение всего времени наблюдения они составляли лишь 5-8 процентов от общей кроветворной популяции.
Однако сделать пациента устойчивым к вирусу не удалось: после отмены ретровирусной терапии количество вирусной РНК в крови начало расти, и ему пришлось снова назначить лечение, чтобы инфекция не прогрессировала. В этом смысле китайский эксперимент, равно как и испытание Sangamo Therapeutics, не достиг заявленной цели. Причиной тому стала низкая эффективность редактирования. В китайском эксперименте она была ниже 20 процентов, в исследовании Sangamo Therapeutics — 11-28 процентов, и этого количества клеток недостаточно, чтобы справиться с инфекцией. Для того, чтобы ввести технологию редактирования генов в клиническую практику борьбы с ВИЧ, исследователям придется сначала повысить эффективность метода.
Тем не менее, авторы работы отмечают, что у их исследования есть и позитивный результат. Этот эксперимент — самое долгое на сегодняшний день наблюдение за CRISPR-отредактированными клетками в организме человека, и оно показывает, что такие клетки могут быть безопасны. Исследователи не обнаружили в клетках никаких незапланированных изменений (то есть следов нецелевого редактирования генома). Клетки также не превратились в опухолевые — о чем предупреждали некоторые ученые в 2018 году. Таким образом, китайская работа стала демонстрацией принципа: CRISPR-модифицированные клетки можно использовать в терапевтических целях без риска для пациента.

Ребята, мы вкладываем душу в AdMe.ru. Cпасибо за то,
что открываете эту красоту. Спасибо за вдохновение и мурашки.
Присоединяйтесь к нам в Facebook и ВКонтакте

Тимоти родился в США, а в 25 лет решил изменить свою жизнь и рванул в Европу. После нескольких лет путешествий Браун осел в Берлине. Здесь он работал официантом и готовился поступить в университет. В 1995 году герой нашей статьи узнал о своем ВИЧ-положительном статусе.
В отличие от других людей с ВИЧ, у Тимоти не было побочных эффектов от лекарств, он смог вести нормальный образ жизни. Браун поступил в Берлинский университет, ходил в спортзал и продолжал работать. Но спустя 10 лет жизнь подкинула ему второе испытание.
В 2006 году Тимоти внезапно почувствовал себя плохо: он не смог проехать на велосипеде даже милю и свалился с высокой температурой. Скоро берлинские врачи нашли у Брауна острый миелобластный лейкоз — агрессивное онкологическое заболевание крови. Так на Тима свалилась вторая болезнь, которая могла убить его за считанные месяцы.
Молодой онкогематолог Геро Хюттер никогда не лечил ВИЧ-инфицированного пациента от рака. Однако он принялся помогать Тимоти с энтузиазмом: доктор нашел информацию о редкой генетической мутации, которая делает клетки крови невосприимчивыми к ВИЧ-инфекции. Мутация гена CCR5 закрывает дверь, через которую вирус пробирается в клетки.

Геро Хюттер и Тимоти Браун.
Геро Хюттер предложил пациенту рискованный шаг — пересадку костного мозга человека с мутацией гена CCR5. Эта операция могла излечить лейкоз и, вероятно, ВИЧ. Операция была опасной: ослабленный организм Брауна мог не выдержать пересадки. Тимоти не принял предложение лечащего врача:

Доктор Хюттер назначил Тиму химиотерапию, которая пошла не по плану. После первого курса у пациента началась пневмония, а после второго Тимоти впал в кому. Лечение пришлось прервать.
Тем временем доктор начал поиски донора: пересадка оказалась единственным шансом Тима на жизнь. Тут и пригодился сумасшедший план с мутацией CCR5. Тимоти повезло еще раз: наибольшая концентрация людей с мутацией этого гена наблюдается именно в Северной Европе. Из 267 подходящих доноров у одного нашли нужную мутацию и взяли материал для трансплантации.

6 февраля 2007 года — второй день рождения Тимоти Брауна: берлинские врачи пересадили ему мутировавшие стволовые клетки. После операции Тим перестал принимать антивирусные препараты, и через 3 месяца ВИЧ исчез из его организма. Браун снова вышел на работу, начал заниматься спортом и заметил, что чувствует себя здоровым. Казалось, удача наконец улыбнулась Тиму. Однако лейкоз вернулся меньше чем через год.
Происходящее дальше иначе как шагом отчаяния не назовешь. Доктор Хюттер и Тимоти приняли решение о повторной пересадке. Шансы на выживание составляли 5 %, но они рискнули.
Вторая операция чуть не убила Брауна. Тимоти парализовало, он почти ослеп, но лейкоз отступил. Для того чтобы встать на ноги, пациенту понадобилось 6 лет реабилитации. Врачи взяли у Тима сотни анализов крови, делали костную и кишечную пункцию, но не нашли ВИЧ.
На помощь пришли журналисты: после заметки в The Wall Street Journal мир узнал о первом человеке, который смог избавиться от ВИЧ-инфекции. Тимоти в один миг стал иконой: врачи со всего мира хотели получить образец его крови, а журналисты умоляли об интервью. Однако Браун долго не решался выступить публично: слишком тяжело ему дались лечение и реабилитация.

Способ, с помощью которого вылечился Браун, — не панацея от ВИЧ. Чтобы повторить успех доктора Хюттера, нужно уничтожить родную иммунную систему пациента с помощью химиотерапии, а потом пересадить ему стволовые клетки стоимостью $ 250 000.
У ВИЧ есть другой штамм, который легко обходит защитные маханизмы мутации CCR5. Ему не нужна та самая дверь в клетке — он проходит в окно. Фактически Тимоти и другие потенциальные реципиенты стволовых клеток CCR5 могут снова заразиться ВИЧ.
Надежда остается, хотя до изобретения доступного и безвредного лекарства очень далеко. История лечения Тимоти дала ученым новый материал для исследований. Возможно, в борьбе с ВИЧ поможет генная терапия или создание некоего суперантитела.
Читайте также:


