Профилактика пневмоцистной пневмонии у вич инфицированных у детей
Количество пациентов со сниженным иммунитетом постоянно растет, что обусловлено: увеличением диапазона применения цитостатической терапии с целью лечения злокачественных опухолей; внедрением в практику пересадки донорских органов, трансплантации кос
Количество пациентов со сниженным иммунитетом постоянно растет, что обусловлено:
- увеличением диапазона применения цитостатической терапии с целью лечения злокачественных опухолей;
- внедрением в практику пересадки донорских органов, трансплантации костного мозга и других форм гематологических манипуляций, выполняемых с гематопоэтической и гематопротезирующей целью;
- эпидемией СПИДа/ВИЧ-инфекции;
- врожденными нарушениями иммунитета, а также ростом числа лиц с аутоиммунными заболеваниями;
- проводимыми многолетними курсами иммуносупрессивной терапии у пациентов с болезнями соединительной ткани;
- алкоголизмом, наркоманией и расширением контингента лиц с асоциальным типом поведения [11].
Объединяющим свойством различных популяций пациентов в данном случае является их повышенная восприимчивость к различным инфекционным агентам, что объясняется снижением пороговых значений вирулентности [1, 6]. Повреждения легочной ткани как инфекционной, так и неинфекционной природы являются едва ли не самой часто описываемой патологией среди пациентов с различными нарушениями иммунитета. При этом легочная инфекция занимает лидирующее положение среди всех инвазивных инфекций, которые диагностируются у такого рода больных [6, 9, 10].
Риск возникновения инфекций нижних дыхательных путей (ИНДП) в группе больных со сниженным иммунитетом весьма различается и зависит от ряда факторов, наиболее важными среди которых являются: нейтропения, аспирация, характер и степень выраженности изменений со стороны иммунной системы (табл. 1), а также эпидемиологическая ситуация в регионе. Одним из наиболее серьезных факторов риска возникновения ИНДП у данной категории пациентов является выраженная и продолжительная нейтропения [5, 8].
Пациент с нарушениями иммунитета, с одной стороны, постоянно находится под воздействием патогенов окружающей среды, а с другой — именно наличие дефекта иммунитета определяет тип легочной инфекции, которая у него развивается. У таких пациентов наиболее распространенными причинами развития ИНДП являются: нозокомиальная инфекция, зачастую резистентная к антибиотикам; воздействие факторов окружающей среды (воздушно-капельная инфекция и/или инфекция, передающаяся через питьевую воду); инфекции, порог вирулентности которых высок среди популяции; реактивация ранее перенесенных инфекций (например, туберкулез) [10, 12].
Каковы же основные особенности респираторных инфекционных процессов у больных со сниженным иммунитетом, знание которых помогает своевременно распознать и как можно быстрее начать проводить специфическое, адекватное терапевтическое лечение.
- При выявлении незначительных по степени интенсивности затемнений легочной ткани во время обычного рентгенологического исследования органов грудной клетки (ОГК) в данной группе пациентов должна в обязательном порядке назначаться компьютерная томография ОГК.
- В случае выявления многофокусных легочных инфильтраций инфекционной (вирусной, бактериальной или грибковой) этиологии, неинфекционной природы, а также при подозрении на метастатическое поражение легочной ткани выполнение рентгенографии ОГК в сочетании с исследованием мокроты не может являться адекватной диагностической процедурой из-за низкой результативности.
- Серологическая диагностика обычно малоинформативна у этих пациентов, в организме которых не генерируется своевременная выработка антител в ответ на инфекцию; в силу этого чаще используются методики, основу которых составляет определение антигена и/или ДНК - полимеразные цепные реакции (ПЦР).
- Выполнение в наиболее сжатые сроки компьютерного томографического исследования легких, а также постановка патоморфологического диагноза (по результатам гистологического и культурального исследований полученных образцов тканей и смывов из трахеи и бронхов) в значительной степени повышают выживаемость пациентов в данной группе.
- В легочной ткани одновременно могут протекать несколько процессов, в частности инфекционный с наличием одного или нескольких патогенов (Pneumocystis сarinii/jiroveci, цитомегаловирусная инфекция (ЦМВ) и т. д.). Нередко выявляется суперинфекция на фоне течения других процессов (например, на фоне развития острого респираторного дистресс-синдрома (ОРДС) или лекарственного поражения легочной ткани).
- Использование сокращенных схем назначаемой иммуносупрессивной химиотерапии (особенно кортикостероидами) может являться столь же значительным фактором риска развития инфекции, как и назначаемая антибактериальная терапия.
Успешность проводимой эмпирической антибактериальной терапии во многом зависит от предварительно проведенного микробиологического обследования и идентификации возбудителя. В абсолютном большинстве случаев речь идет о грибковой или смешанной бактериально-грибковой флоре. Этиологическая расшифровка ИНДП у данной категории больных представлена следующим образом [1–3, 6, 11]:
- типичные бактерии - 37%;
- грибы - 12%;
- вирусы - 15%;
- Pneumocystis carinii/jiroveci - 8%;
- Nocardia asteroides - 7%;
- Mycobacterium tuberculosis - 1%;
- микст-инфекция - 20%.
Довольно часто в популяции пациентов с нейтропенией [11, 12] возникают микст-инфекции, основу которых составляют: инфекции респираторно-сентициального вируса, либо ЦМВ, или инвазия Aspergillus spp. в сочетании с грамотрицательной флорой или P. carinii/jiroveci. Пневмоцистоз в виде моноинфекции и/или в виде микст-инфекции чаще всего описывается у пациентов, получающих системную кортикостероидную терапию (это касается как длительных курсов монотерапии кортикостероидами, так и использования их в качестве составной части режима химиотерапевтической поддержки у онкологических больных).
В современной литературе описывается увеличение количества грибковых поражений и их торпидное течение у пациентов со сниженным иммунитетом, несмотря на применение новейших противогрибковых препаратов [8, 11, 12]. В настоящее время наиболее актуальными являются три инфекционных агента, вызывающих легочные изменения: Pneumocystis carinii/jirovici, представители рода Aspergillus (особенно A. fumigatus) и Cryptococcus neoformans [12, 14].
Таксономически пневмоцисты относят к грибам. В начале нового тысячелетия тип Pneumocystis carinii, вызывающий инфекции у человека, был выделен в отдельный вид Pneumocystis jiroveci — в честь чешского ученого-паразитолога Отто Йировеца, впервые описавшего этот микроорганизм как причину заболевания у человека.
P. jiroveci, являющийся внеклеточным паразитом с преимущественным тропизмом к легочной ткани, поражает пневмоциты 1-го и 2-го порядков. Сложности при проведении дифференциальной диагностики в случае подозрения на развитие у пациента пневмоцистной пневмонии (ПП) в основном объясняются тем фактом, что стандартное обследование больных малоинформативно, до 20% из них имеют стертую клинику, а рентгенологическое обследование не выявляет патологии. Первыми признаками развивающейся ПП являются медленно нарастающая гипоксемия, одышка и кашель при скудности данных физического осмотра и рентгенологических проявлений.
С клинических позиций выделяют три стадии болезни.
- Отечная стадия, продолжительностью в среднем 7-10 дней, характеризуется медленно нарастающей одышкой, которая неуклонно прогрессирует, вплоть до выраженной одышки в покое, и сопровождается сухим непродуктивным кашлем. В легких хрипы не выслушиваются, дыхание, как правило, ослабленное. Симптомы общей интоксикации незначительны (субфебрилитет, общая слабость). Рентгенологическая картина в начале заболевания неясная, чаще всего описываемая как вариант нормы; реже выявляется прикорневое снижение пневматизации легочной ткани и усиление интерстициального рисунка.
- Для ателектатической стадии (продолжительность около 4 нед) характерна выраженная одышка в покое (до 30-50 дыхательных движений в 1 мин), пациентов беспокоит малопродуктивный кашель с выделением вязкой мокроты, нередко описывается вздутие грудной клетки. Часто отмечается фебрильная лихорадка. Аускультативная картина характеризуется жестким и/или ослабленным дыханием (локально или над всей поверхностью легких), иногда выслушиваются сухие хрипы. На более поздних этапах в клинической картине заболевания на первый план выходят симптомы дыхательной и сердечно-сосудистой недостаточности. Рентгенологи на этой стадии более чем в половине случаев выявляют билатеральные облаковидные инфильтраты (симптом "бабочки"), а также - обильные очаговые тени ("ватное" легкое).
- Последняя, эмфизематозная стадия характеризуется развитием эмфизематозных лобулярных вздутий и, возможно, разрушением альвеолярных перегородок с развитием пневмоторакса. Клинически может наблюдаться некоторое улучшение состояния больных, уменьшение одышки.
Диагностические мероприятия, направленные на выявление Pneumocystis jiroveci, начинают с получения индуцированной мокроты. Материал исследуют методом прямой микроскопии окрашенных мазков. В последнее время для более точной диагностики разработаны и применяются метод ПЦР, иммунофлюоресцентные методы с моно- и поликлональными антителами. Бронхоскопия с бронхоальвеолярным лаважем в сочетании с трансбронхиальной биопсией позволяет почти в 100% случаев обнаружить возбудителя и, следовательно, является наиболее эффективным и достоверным методом диагностики ПП. В тех случаях, когда пациенты прибегали к лечению пентамидином, эффективность диагностики с использованием бронхоальвеолярного лаважа снижалась до 60%. Окончательный диагноз пневмоцистоза ставится при обнаружении цист или трофозоидов в ткани или альвеолярной жидкости [7, 9].
В настоящее время обследование пациентов с подозрением на развитие ПП проводится по следующей схеме — всем больным с пневмонией лечение назначается эмпирически, и только при тяжелом легочном процессе проводится легочная биопсия. В отсутствие адекватного специфического лечения пневмоцистоза летальность достигает 100% у пациентов с иммунодефицитами и 50% — у недоношенных детей. Прогноз остается неблагоприятным (зависит от фонового состояния), и без коррекции иммунного статуса у 15% пациентов возникают рецидивы ПП [4, 8].
У пациентов, не получающих триметоприм-сульфаметоксазол (или иные антибактериальные препараты, назначаемые в режиме химиопрофилактики при высоком риске развития пневмоцистоза (табл. 2), сохраняется высокая вероятность возникновения пневмоцистоза на фоне развития ЦМВ-инфекции, что, возможно, связано с блокировкой альвеолярных макрофагов и снижением функции CD4-лимфоцитов.
Относительно частоты выявления пневмоцистоза в группе пациентов с иммунодефицитными состояниями (в которую не вошли пациенты с ВИЧ-инфекцией), следует отметить, что при отсутствии своевременно проводимых профилактических мероприятий примерно у 5–12% пациентов развивается развернутая клиника пневмоцистоза [13]. Применение активной антиретровирусной терапии существенно снижает риск развития ПП при СПИДе. В случае снижения уровня CD4 Рисунок 1. Обзорная рентгенография органов грудной клетки от 11.11.04.
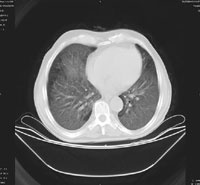
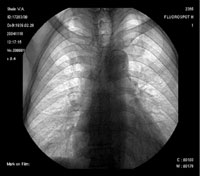
На момент госпитализации: состояние средней степени тяжести, обусловленное дыхательной недостаточностью. При осмотре кожных покровов видны сухие следы расчесов, акроцианоз. В подмышечных, паховых областях с обеих сторон пальпируются единичные, мягко-эластичной консистенции безболезненные лимфатические узлы. В легких при аускультации выслушивается жесткое дыхание, хрипов нет. Частота дыхания — 23–24 в минуту, пульс — 87 в минуту, артериальное давление — 140/80 мм рт. ст. Со стороны пищеварительной, мочеполовой, нервной систем патологии не выявлено. Больному была назначена антибактериальная терапия, включающая ципрофлоксацин, рифампицин. Помимо антибиотиков пациент получал муколитики, фестал, альмагель, бисакодил. На фоне проводимого лечения сохранялись гектические подъемы температуры, нарастала дыхательная недостаточность. С учетом затяжного течения пневмонии больной повторно был осмотрен фтизиатром, данных, подтверждающих туберкулез, снова не было выявлено. В ходе обследования методом иммуноферментного анализа и иммунного блотинга были выявлены антитела к ВИЧ, что заставило пересмотреть диагностический алгоритм и предположить развитие у больного ПП либо поражения легких в рамках ЦМВ-инфекции; окончательно не был исключен из диагностического ряда и вариант развития туберкулезного процесса в легких. Ввиду вышесказанного к проводимой терапии был добавлен бисептол в адекватных дозах. При иммунологическом исследовании выявлено абсолютное снижение CD4 до 19,3/ мкл. Все вышеперечисленное позволило диагностировать у больного ВИЧ-инфекцию в стадии 3Б (СПИД-ассоциированный комплекс), двустороннюю субтотальную пневмонию. При проведении (11.11.04) повторного рентгенологического исследования ОГК (рис. 1) отмечалась отрицательная динамика в виде нарастания объема и интенсивности инфильтрации легочной ткани. При ультразвуковом исследовании органов брюшной полости обнаружены диффузные изменения печени, поджелудочной железы, селезенки, увеличение лимфоузлов подмышечных, паховых областей. При контрольной компьютерной томографии ОГК отмечалась отрицательная динамика в виде прогрессирования диффузных изменений в обоих легких (рис. 2, 3). На фоне лечения у больного нарастала дыхательная недостаточность, сохранялись гектические подъемы температуры, развился ОРДС, в связи с чем пациент был переведен в отделение реанимации и интенсивной терапии, где осуществлялись респираторная поддержка, проводились антибактериальная, дезинтоксикационная терапия, противоязвенное и антитромботическое лечение, симптоматическая терапия. Однако, несмотря на все перечисленные мероприятия, 23.11.04 г. наступила остановка сердечной деятельности по типу асистолии.
 |
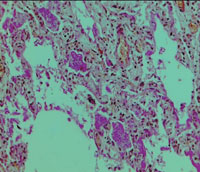
| Рисунок 4. Гиалиновые мембраны на стенках альвеол (окраска гематоксилином и эозином). Микрофотография |
 |
| Рисунок 5. Скопления Pneumocystis jiroveci в просветах альвеол (окраска PAS-методом). Микрофотография |
Согласно материалам аутопсии у больного было подтверждено наличие двухсторонней полисегментарной ПП, ОРДС: полнокровие капилляров альвеолоцитов и наличие гиалиновых мембран на стенках альвеол (рис. 4, 5).
- Collin B. A., Ramphal R. Pneumonia in the compromised host including cancer patients and transplant patients//Infect. Dis. Clin. North. Am. 1998; 12: 781.
- Junghanss C., Marr K. A. Infectious risks and outcomes after stem cell transplantation: are nonmyeloablative transplants changing the picture?//Curr. Opin. Infect. Dis. 2002; 15: 347.
- Bodey G., Rodriguez V., Chang H. et al. Fever and infection in leukemic patients: A study of 494 consecutive patients. Cancer. 1978; 41: 1610.
- Coker D. D., Morris D. M., Coleman J. J. et al. Infection among 210 patients with surgically staged Hodgkin's disease//Am. J. Med. 1983; 75: 97.
- Sickles E. A., Greene W. H., Wiernik P. H. Clinical presentation of infection in granulocytopenic patients//Arch. Intern. Med. 1975; 135: 715.
- Rubin R. H., Greene R. Clinical approach to the compromised host with fever and pulmonary infiltrates//In: Clinical Approach to Infection in the Compromised Host, 3rd edition, Rubin R. H., Young L. S. (Eds), Plenum Press, New York. 1994; 121.
- LiPuma J. J., Spilker T., Coenye T., Gonzalez C. F. An epidemic Burkholderia cepacia complex strain identified in soil//Lancet. 2002; 359: 2002.
- Escalante C. P., Rubenstein E. B., Rolston K. V. Outpatient antibiotics therapy for febrile episodes in low-risk neutropenic patients with cancer//Cancer Invest. 1997; 15: 237.
- Talcott J. A., Whalen A., Clark J. et al. Home antibiotic therapy for low-risk cancer patients with fever and neutropenia: A pilot study of 30 patients based on a validated prediction rule//J. Clin. Oncol. 1994; 12: 107.
- Rosenow E. C., Wilson W. R., Cockerill F. R. Pulmonary disease in the immunocompromised host//Mayo. Clin. Proc. 1985; 60: 473.
- Junghanss C., Marr K. A., Carter R. A. et al. Incidence and outcome of bacterial and fungal infections following nonmyeloablative compared with myeloablative allogeneic hematopoietic stem cell transplantation: a matched control study//Biol. Blood. Marrow. Transplant. 2002; 8: 512.
- Ascioglu S., Rex J. H., de Pauw B. et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus//Clin. Infect. Dis. 2002; 34: 7.
- Fishman J. A. Prevention of infection due to Pneumocystis carinii//Antimicrob. Agents. Chemother. 1998; 42: 995.
- Fishman J. A. Treatment of infection due to Pneumocystis carinii//Antimicrob Agents. Chemother. 1998; 42: 1309.
- Furrer H., Egger M., Opravil M. et al. Discontinuation of primary prophylaxis against Pneumocystis carinii pneumonia in HIV-1-infected adults treated with combination antiretroviral therapy. Swiss HIV Cohort Study//N. Engl. J. Med. 1999; 340: 1301.
А. Ф. Шепеленко, доктор медицинских наук, доцент
М. Б. Миронов, кандидат медицинских наук
А. А. Попов
Главный военный клинический госпиталь им. Н. Н. Бурденко,
ММА им. И. М. Сеченова, ГИУВ МО РФ, Москва

Ежегодное увеличение числа случаев ВИЧ-инфекции среди населения Российской Федерации со свойственной ей прогрессирующей иммуносупрессией обусловливает увеличение числа инфекционной патологии у данной категории больных. Если раньше о некоторых из них информация носила фрагментарный характер, то в настоящее время практическим врачам необходимо владеть достаточным объемом знаний по диагностике и лечению вторичных заболеваний при ВИЧ-инфекции.
Развитие вторичных инфекционных заболеваний является основной причиной смертности больных и определяет продолжительность жизни больного СПИДом. Пневмонии являются причиной смерти примерно 20 % больных, однако в большинстве случаев этиология пневмонии остается неустановленной. У 98 % больных отмечено наличие нескольких сопутствующих диагнозов, среди которых регистрируются пневмония, туберкулез легких, вирусный гепатит С. Пневмоцистная пневмония занимает третье место среди причин летальных исходов у ВИЧ- инфицированных больных.
В Сибирском федеральном округе с увеличением количества ВИЧ-инфицированных растет количество летальных исходов среди данной группы больных. В 2012 году умерло 4089 больных, в 2013 – 4738, а в 2014 году был зарегистрирован летальный исход у 5305 больных ВИЧ-инфекцией. Общее число умерших ВИЧ-инфицированных в Сибирском федеральном округе (СФО) составило 30 608 (главным образом потребители инъекционных наркотиков). Кумулятивная летальность от ВИЧ-инфекции в СФО на начало 2015 года составила 16,7 %.
В настоящее время стадия ВИЧ-инфекции на территории Омской области определяется как концентрированная, то есть характеризуется укоренением и распространением вируса в среде потребителей инъекционных наркотиков, переходом ВИЧ в общую популяцию населения посредством сексуальных контактов и распространенностью ВИЧ среди беременных менее 1 % (0,46 % в 2014 году).
Несмотря на внедрение в практику лечения больных ВИЧ-инфекцией высокоактивной антиретровирусной терапии (ВААРТ), показатель смертности увеличивается, что объясняется отсутствием приверженности к лечению. Многие пациенты не состоят на учете, не посещают СПИД-центры и обращаются за медицинской помощью уже в разгар заболевания, когда оказание адекватной помощи не всегда удается.
Летальные исходы чаще связаны с поздней диагностикой. Смертельные исходы от ВИЧ- инфекции, как правило, регистрируются у пациентов, не получавших ВААРТ или не соблюдавших режим лечения, при этом наиболее частой причиной является прогрессирование туберкулеза. Второй по значимости причиной смерти является наличие пневмоцистной пневмонии (ПЦП) более чем у четверти больных. На долю ПЦП среди пациентов с ВИЧ-инфекцией приходится 20 %.
Известно, что частота, этиологический спектр и тяжесть поражения нижних дыхательных путей у больных ВИЧ-инфекцией зависит от количества CD4+лимфоцитов в крови. При сохранении количества этих лимфоцитов в крови более 500 клеток/мкл наиболее часто (88,2 % случаев) встречаются бактериальные бронхиты и пневмонии. При содержании CD4+ в крови от 500 до 200 в 1 мкл регистрируются случаи бактериальной пневмонии (67,1 %) и туберкулеза легких (28,1 %), а при снижении количества лимфоцитов CD4 менее 200 клеток/мкл – туберкулез, цитомегаловирусная инфекция (11,2 %) и пневмоцистоз (7,2 % случаев).
При внедрении в клиническую практику антипневмоцистной профилактики в Европе, например, наблюдалось снижение к 1992 году частоты развития ПЦП у взрослых с ВИЧ-инфекцией с 53 до 42 %. Применение высокоактивной антиретровирусной терапии также способствовало снижению частоты возникновения ПЦП с 4,9 до 0,3 случаев на 100 ВИЧ-инфицированных в год.
Кроме пациентов с ВИЧ-инфекцией, пневмоцистная пневмония может встречаться у недоношенных новорожденных детей (68,1 % всех заболевших ПЦП); у пациентов с лейкозами (12,3 %); при других злокачественных опухолях (7,3 %); при трансплантации органов (3,6 %); первичной иммунной недостаточности (2,0 %); коллагенозах (0,6 %); нарушениях питания (0,3 %); множественной миеломе (0,2 %), а также при невыясненных причинах (4,5%).
Уровень инфицированности Р. jirovecii в Москве составляет до 75 %. Носительство встречается у 10 % здоровых, более 90 % имеют антитела к данному возбудителю. Зараженность Р. jirovecii среди ВИЧ- инфицированных больных и медицинских работников отделений СПИДа и пульмонологии колеблется от 28 до 84 %. Это может свидетельствовать о развитии внутрибольничной пневмонии с воздушно-капельным механизмом передачи. Известно о развитии лекарственной устойчивости у больных с ПЦП при длительном нахождении пациентов в стационаре в связи с передачей Р. jirovecii от больных друг другу.
Пневмоцистоз – антропонозная респираторная инфекция, проявляющаяся преимущественно интерстициальной пневмонией с аэрогенным путем передачи возбудителя. Пневмоцисты широко распространены среди многих видов диких и домашних животных. Благодаря иммунологическим, цитохимическим и генетическим методам исследования установлено, что хромосомы пневмоцист от человека, мышей, хорьков сходны по размерам, но имеют индивидуальный кариотип. Это свидетельствует о строгой видовой специфичности P. carini.
При моделировании пневмоцистной пневмонии животных (крыс, мышей, хорьков) было выявлено наличие вместе с пневмоцистами большого количества вирусных частиц, структура которых соответствовала строению коронавируса – от 80 до 130 нм, что подтверждает тезис об усилении пневмоцистной инфекции в присутствии эндогенного кофактора – вирусов или бактерий.
Таксономическое положение Pneumocystis jirovecy(carini) не вполне определено, иногда пневмоцист рассматривают как спорообразующее простейшее, но большинство исследователей свидетельствуют об их принадлежности к дрожжевым грибам.
Р. jirovecii является внеклеточным паразитом, весь жизненный цикл которого происходит в альвеоле и включает четыре стадии: трофозоит, прециста, циста, спорозоит. Размножение паразита сопровождается появлением большого числа трофозоитов – вегетативной формы величиной 1-5 мкм, одноядерных, с двухслойной клеточной тонкой мембраной. Трофозоит округляется, формирует утолщенную клеточную стенку и превращается в раннюю прецисту, которая имеет овальную форму, размер 5 мкм, характеризуется наличием одного крупного ядра и тонкой пелликулы.
Пневмоцистная пневмония развивается при нарушениях гуморального и клеточного иммунитета. В макрофагах имеется лимфоцитозависимый дефект, что мешает им распознавать размножающиеся пневмоцисты. Клетками- мишенями для пневмоцист являются апьвеолоциты 1-го типа, поражение которых проявляется деструкцией клеток, нарушением целостности альвеолярной выстилки и развитием экссудативных явлений. Альвеолоциты 2-го типа активируются возбудителем при интенсивном размножении в альвеолах с использованием специфических белков сурфактанта.
При этом активность макрофагов направлена не на поглощение возбудителя, а на защиту альвеол от избыточного заполнения материалом сурфактанта. При высокой поглотительной способности макрофагов протеолитические функции истощаются быстрее секреторных возможностей апьвеолоцитов 2-го типа, что ведет к гиперпродукции сурфактанта, и это позволяет ряду авторов относить пневмоцистоз легких к функциональному альвеолярному липопротеинозу.
При морфологическом исследовании наличие пневмоцистоза было выявлено как в одном, так и в обоих легких, а при гистобактериоскопии определяли несколько возбудителей в одном поле зрения. При этом активность сочетанных инфекций имела различный характер с активным прогрессированием одного заболевания и подострым проявлением другого.
Пневмоцистная пневмония встречаются у новорожденных с низкой массой тела при рождении (недоношенных и детей с задержкой внутриутробного развития). Данный факт объясняется иммунологической незрелостью и дефицитом материнских антител. Наиболее вероятным способом передачи Р. jiroveci от матери к новорожденному является внутриутробный путь.
Известны случаи заболевания ПЦП у детей с врожденной ВИЧ-инфекцией, что часто заканчивается летальным исходом. При этом необходимо понимать, что развитие оппортунистических заболеваний у ВИЧ-инфицированных детей первого года будет оставаться еще много лет актуальной темой, ввиду роста числа ВИЧ-инфицированных матерей.
Нередки случаи сочетания пневмоцистной пневмонии с туберкулезом легких, что крайне усложняет диагностику и лечение больного. Пациенту с бактериовыделением назначается специфическая терапия в стандартных режимах, не приводящая к положительной клинико-рентгенологической динамике. Смерть наступает от нарастания легочно-сердечной недостаточности, что является частой причиной летального исхода при распространенном туберкулезе легких. Однако при патологоанатомическом исследовании, помимо микобактерий туберкулеза, обнаруживаются еще и пневмоцисты.
Иногда отмечается сходство клинической симптоматики при туберкулезе и пневмоцистной пневмонии у больных с поздними стадиями ВИЧ. При пневмоцистной пневмонии, как было уже указано ранее, наиболее ранним признаком является одышка, появляющаяся при умеренной нагрузке, а впоследствии и в покое – до 30-50 в минуту. В последующем возникает возвратная, неустановленной причины фебрильная лихорадка, которая может сохраняться даже при эффективном лечении.
Кашель, как правило, сухой или с незначительным количеством мокроты. При прогрессировании заболевания кашель становится постоянным, особенно в ночное время. Отмечаются снижение аппетита, бледность, тахикардия, потеря веса, ночная потливость, нередки осложнения в виде спонтанного пневмоторакса, пневмомедиастинума, подкожной эмфиземы.
Однако заподозрить пневмоцистную пневмонию можно, опираясь на клинико-анамнестические данные: длительное начало (от 1 до 6 месяцев) с нарастающей одышкой, высокая лихорадка и сухой кашель, появление в разгаре заболевания выраженной дыхательной недостаточности. У пациентов отмечаются высокие показатели СОЭ (в среднем 41,3±3,2 мм/ч), суммарная активность ЛДГ (737±194,5 МЕ/л), снижение р02 в крови (29,8±2,7 мм рт. ст.).
Качественная диагностика пневмоцистной пневмонии предполагает проведение компьютерной томограммы легких, бронхоскопии, биопсии периферических лимфоузлов, магнитно-резонансной томографии головного и спинного мозга, использование молекулярных и паразитологических методов диагностики.
Бронхоскопия с бронхоальвеолярным лаважем в сочетании с трансбронхиальной биопсией позволяет обнаружить пневмоцисты с частотой от 72 до 100 % и является наиболее эффективным методом диагностики пневмоцистной пневмонии. Однако необходимо помнить о возможных осложнениях при проведении данного исследования в виде кровотечения и пневмоторакса.
При рентгенологическом исследовании органов грудной клетки могут выявляться различные изменения, которые носят неспецифический характер с наличием двусторонних и обычно симметричных инфильтратов в легких. В отечную стадию продолжительностью в среднем 7-10 дней у трети пациентов в начале может быть рентгенологически нормальная картина легких, реже выявляются прикорневое снижение пневматизации легочной ткани и усиление интерстициального рисунка.
Наличие плеврального выпота для пневмоцистной пневмонии не характерно, поэтому при его обнаружении необходимо исключить другие заболевания: туберкулез, бактериальную пневмонию, саркому Капоши с поражением легких.
Эмфизематозная (последняя) стадия характеризуется формированием многочисленных воздушных полостей, пневматоцеле, которые являются причиной спонтанного пневмоторакса, что легко выявляется с помощью КТ-исследования.
Эффективным молекулярно-биологическим методом является метод амплификации фрагментов генов пневмоцист с помощью ПЦР, которая выявляет участки ДНК возбудителя в любых биологических материалах. Для диагностики пневмоцистоза необходима разработка количественных критериев оценки выявления цист в субстратах от больных.
Возможно применение паразитологического метода, основанного на прямом морфологическом выявлении пневмоцист в биологическом материале (легочной ткани, бронхоальвеолярном лаваже, индуцированной мокроте).
Основным препаратом первого выбора для лечения пневмоцистной пневмонии является комбинация триметоприм-сульфаметоксазол (ко-тримоксазол) в соотношении 1:5 (в 1 таблетка/ампула содержится 80 мг триметоприма и 400 мг сульфаметоксазола). Препарат назначают из расчета по триметоприму по 20 мг на 1 кг массы тела в сутки (со 100 мг сульфаметоксазола) каждые 6-8 ч в течение 7-21 дня (таким образом, расчетная доза для ко-тримоксазола составит 120 мг/кг/сут в 3-4 приема).
В тяжелых случаях используется внутривенная форма препарата, которая при улучшении самочувствия заменяется на пероральную. Однако у 60 % пациентов с ВИЧ-инфекцией в таких дозах регистрируются нежелательные токсические явления (сыпь, лейкопения, лихорадка, тремор, головная боль, неврозы, бессонница и др.). Не исключено отсутствие эффекта от проводимой терапии, что встречается при лекарственной резистентности.
При непереносимости и недостаточной эффективности ко-тримоксазола назначают пентамидин парентерально в дозе 4 мг/кг/сут внутривенно, 600 мг/сут ингаляционно. Пентамидин имеет одинаковую эффективность по сравнению с ко-тримоксазолом, однако на пентамидин чаще встречаются неблагоприятные побочные реакции, и он не зарегистрирован на территории Российской Федерации.
Другим часто применяемым препаратом резерва при пневмоцистной пневмонии, является дапсон, обычно используемый для терапии лепры. Дапсон (100 мг 1 раз в сутки) рекомендуется сочетать с триметопримом (15-20 мг/кг/сут каждые 8 ч в течение 21 дня). Известно, что препарат обладает высокой токсичностью.
Иной резервной схемой лечения пневмоцистной пневмонии умеренной степени тяжести является комбинация клиндамицина 600-900 мг каждые 6-8 ч внутривенно капельно или 300-450 мг каждые 6 ч внутрь в сочетании с примахином по 30 мг внутрь в сутки в течение 21 дня.
В литературе имеются сведения о препарате атоваквон (антипротозойное средство) – 750 мг, 3 приёма в день внутрь. Атоваквон не является препаратом выбора, используется для лечения токсоплазмоза и профилактики пневмоцистной пневмонии в случаях выраженных аллергических реакций на вышеперечисленные препараты или при их неэффективности.
Триметрексат (антипротозойное средство) применяется только у взрослых, в/в инфузия: 45 мг/м2 поверхности тела в течение 1 часа 1 раз в сутки в течение 21 суток. Является антагонистом фолиевой кислоты, поэтому одновременно назначают фолинат кальция, внутрь или в/в, 20 мг/м2 поверхности тела 4 раза в сутки в течение 24 суток. Препарат обладает высокой токсичностью.
В первые 3-5 дней после начала лечения пневмоцистной пневмонии отмечается выраженное ухудшение состояния, связанное с массовой гибелью паразитов, в связи с чем необходимо назначение преднизолона per os по 40 мг 2 раза в день в течение 5 дней, затем – 40 мг 1 раз в день в течение еще 5 дней, затем – 20 мг 1 раз в день в течение 11 дней.
Без специфического лечения от пневмоцистной пневмонии летальный исход был зарегистрирован у 50 % детей раннего возраста, 40 % старших детей, у 70 % больных ВИЧ- инфекцией, а иногда и у 90-100 %. В период разгара заболевания летальность достигает 20-27 %. Ранняя эффективность лечения пневмоцистной пневмонии у больных с ВИЧ-инфекцией достигает 75-80 %. Только у 43 % пациентов через 5 месяцев исчезают патологические изменения на рентгенограммах. У 10-40 % возникают рецидивы, иногда до 5-7 раз в течение жизни. Несмотря на относительную эффективность лечения, средняя продолжительность жизни больного пневмоцистной пневмонии с ВИЧ-инфекцией составляет около 9 месяцев; в течение 21 месяца умирает подавляющее большинство больных.
В. С. Боровицкий описывает следующие прогностические критерии. Существуют три независимых показателя, связанных со смертностью от ПЦП: систолическое кровяное давление
Читайте также:


