Транспортная среда для гонококков
Возбудителем гонореи является Neisseria gonorrhoeaе, вызывающая острые и хронические воспалительные поражения мочеполовых органов, слизистой оболочки ротоглотки и конъюнктивы глаза.
Материалом для исследования является гнойное отделяемое мочеполовых органов, прямой кишки или конъюнктивы глаз (при бленорее), суставной и перитонеальный экссудат. Строго регламентированными методами лабораторной диагностики гонореи являются микроскопическое и бактериологическое (культуральное) исследование. Методы микробиологической диагностики гонореи отражены в схеме 18 .
Схема 18. Методы микробиологической диагностики гонореи
Микроскопический метод заключается в исследовании мазков из исследуемого материала, окрашенных по Граму и метиленовым синим. При окрашивании препаратов на гонорею используют модификацию метода Грама (краситель генциан-виолет заменяют кристал-виолетом, а вместо фуксина применяют нейтральный красный; промывку препарата осуществляют после каждого этапа окраски). В мазках при острой гонорее обнаруживают большое количество полиморфноядерных лейкоцитов, внутри и вне которых расположены бобовидные грамотрицательные диплококки; сопутствующая микрофлора либо минимальна, либо отсутствует вовсе (рис. 25). При хронической гонорее в ряде случаев типичный гонококк в мазках не выявляется, либо выглядит нетипично в виде мелких пылевидных или крупных шарообразных образований, нередко 2 клетки гонококка располагаются под углом друг к другу, при этом обнаруживается обильная сопутствующая микрофлора, лейкоциты, эпителиальные и другие клетки. В качестве экспресс-метода диагностики может использоваться ИФМ.
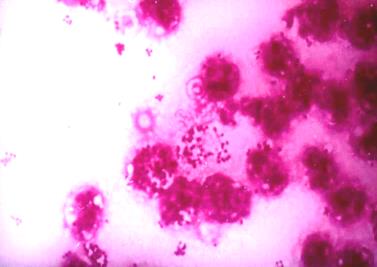
Рис. 25. Возбудитель гонореи(Neisseria gonorrhoeaе) в мазках из уретры больного острой гонореей. Внутри и внеклеточно расположенные грамотрцательные диплококки, обилие лейкоцитов.
Бактериологический метод.Гонококк отличается высокой чувствительностью к различным неблагоприятным факторам, поэтому культуральное исследование необходимо проводить сразу после отбора материала. Посев производят на специальные питательные среды. Основой этих сред является МПА из кроличьего мяса с добавлением дрожжевого аутолизата, гидролизата казеина или гемогидрализата и сыворотки крупного рогатого скота. Асцитическая жидкость и яичный желток в качестве добавок к среде для культивирования гонококка в настоящее время не применяются. Второй тип питательных сред является селективным и включает в свой состав, помимо вышеуказанных компонентов, антибиотики (полимиксин, линкомицин, а для диагностики фарингеальной гонореи – оротовую кислоту). Посевы выращивают при 37 0 С в течение 24-72 часов в атмосфере с повышенным содержанием СО2. Колонии гонококков круглые, прозрачные, в виде капелек росы. Типичные для гонококков колонии пересевают в пробирки со средой для культивирования гонококка для получения чистых культур, которые идентифицируют по морфологическим и сахаролитическим свойствам на средах "пестрого" ряда (полужидкий агар с сывороткой и углеводом) или с помощью микротест-систем. В мазках из чистых культур гонококки располагаются не попарно, а отдельно. В биохимическом отношении гонококки малоактивны и ферментируют только глюкозу с образованием кислоты, вырабатывают оксидазу. Для выявления оксидазы применяют пробу с 1% водным раствором диметилпарафенилендиамина или диэтилпарафенилендиамина, которые окрашивают колонии гонококка сначала в розовый, затем в красный, а через несколько минут – в черный цвет. Исследуют также чувствительность гонококков к антибиотикам и его бета-лактамазную активность.
Серологический метод (определение антител к гонококку в крови пациентов с помощью РСК и ИФА) не является строго регламентированным, не представляет диагностической ценности, не является методом контроля эффективности проводимого лечения и в реальной практике в настоящее время не используется.
Генодиагностика. Направлена на обнаружение специфических фрагментов ДНК гонококка с помощью ПЦР и может быть использована в качестве дополнительного высокоинформативного метода диагностики гонореи.
Эффективность бактериологического метода исследования в
значительной степени определяется качеством питательных сред. В
нашей стране наиболее широко апробированы и используются два вида
питательных сред: асцит-агар и безасцитные питательные среды.
Основой обеих сред является мясопентонный агар (МПА) из мяса
кроликов или свежих бычьих сердец. Методика его приготовления
заключается в следующем. Мясо кролика освобождают от жира и
сухожилий, пропускают через мясорубку или измельчают ножом,
взвешивают, заливают двойным объемом водопроводной воды и в таком
виде оставляют в холодильнике при 4ё на сутки для экстрагирования.
Затем массу нагревают до кипения, кипятят 10 минут, охлаждают и
фильтруют через марлю. К фильтрату добавляют 2% агар-агара, 1%
пептона и 0,5% хлорида натрия, нагревают до растворения агар-агара
и устанавливают рН=7,5-7,6 (подщелачивание производят 20%
раствором едкого натрия). Среду доводят до кипения, фильтруют
через ватно-марлевый фильтр, разливают по стерильным флаконам или
колбам и стерилизуют в автоклаве 15-20 минут при 0,5 атмосферы по
Техника приготовления МПА из свежих бычьих сердец та же,
только кипячение массы измельченных сердец в воде следует
производить 20 минут вместо 10.
Возможно приготовление основы питательной среды без пептона.
При этом пользуются вышеизложенной методикой приготовления МПА, но
исключают из его состава пептон, измельченное мясо кролика кипятят
5 минут вместо 10 и стерилизуют среду в автоклаве в течение 10
минут при 0,8 атмосферы по манометру (117ё).
Асцитическая жидкость должна быть получена от больных с
асцитом, причиной которого является сердечная недостаточность, и
не должна содержать желчных пигментов. Забор асцитической жидкости
производят через троакар в стерильную бутыль и добавляют к ней 5%
хлороформа для наркоза. В течение 10 дней жидкость перемешивают с
хлороформом путем вращения бутыли, затем ее оставляют при
комнатной температуре до полного оседания хлороформа на дно бутыли
и просветления жидкости. После этого по мере надобности прозрачную
асцитическую жидкость разливают по 50 мл в стерильные колбы с
ватными пробками и ежедневно в течение 3 дней их помещают в
водяную баню при температуре 56ё на 1 час для испарения хлороформа
через ватную пробку. После проверки асцитической жидкости на
стерильность она может быть использована для обогащения
питательной среды для выделения гонококка в концентрации 1/3 и 1/4
объема среды, что определяют опытным путем.
Рецепты безасцитных питательных сред
1. МПА из кроличьего мяса или свежих бычьих сердец
(рН=7,4-7,5) - 100 мл, гидролизат казеина для парентерального
белкового питания - 2 мл, дрожжевой аутолизат - 2 мл, сыворотка
крови крупного рогатого скота - 20 мл (среда КДС-1).
2. МПА из кроличьего мяса или свежих бычьих сердец
(рН=7,4-7,5) - 100 мл, 5% раствор гемогидролизата - 2 мл,
дрожжевой аутолизат - 2 мл, сыворотка крови крупного рогатого
скота - 20 мл (среда ГДС-2).
3. МПА из кроличьего мяса или свежих бычьих сердец
(рН=7,4-7,5) - 100 мл, среда 199 для культур тканей без
антибиотиков - 20 мл, дрожжевой аутолизат - 2 мл, сыворотка крови
крупного рогатого скота - 20 мл (среда 199-СДС).
4. МПА из кроличьего мяса или свежих бычьих сердец
(рН=7,4-7,5) - 100 мл, желток свежего куриного яйца - 10 мл,
сыворотка крови крупного рогатого скота - 20 мл (среда ЖС).
Яичный желток получают стерильно из диетических куриных яиц
непосредственно перед приготовлением среды. Для этого,
предварительно обработав спиртом, скорлупу вскрывают стерильным
пинцетом и содержимое яйца выливают в стерильную воронку. После
того как белок вытечет, оставшийся в воронке желток переносят в
стерильную посуду и мерной пипеткой берут необходимый для
изготовления питательной среды объем желтка.
Приготовление дрожжевого аутолизата заключается в следующем.
Пекарские дрожжи измельчают и закладывают в бутыль, превышающую по
объему взятые дрожжи в 4 - 5 раз, и оставляют для аутолиза на двое
суток в сушильном шкафу или термостате при 60ё. Затем густую
коричневую массу разбавляют тройным объемом теплой водопроводной
воды, хорошо перемешивают и дважды центрифугируют по 10 минут при
1000 оборотов в минуту (до просветления жидкости). Надосадочную
жидкость сливают, добавляют к ней 0,5% хлористого натрия, доводят
рН до 7,4-7,5 и автоклавируют 30 минут при 1 атмосфере по
манометру (120ё). Хранят в мелкой расфасовке в холодильнике при
Дрожжевой аутолизат может быть заменен 1,5% раствором
экстракта кормовых дрожжей (ЭКД) в том же количестве (2 мл) 1,5%
раствор ЭКД готовят в лаборатории из сухого ЭКД, растворяя его в
стерильной дистиллированной воде. Приготовленный таким образом
жидкий экстракт разливают по стерильным пробиркам и стерилизуют в
автоклаве при 0,5 атмосферы по манометру в течение 20 минут.
Во всех вышеуказанных питательных средах сыворотка крови
крупного рогатого скота может быть заменена нормальной нативной
сывороткой для бактериологических питательных сред, которая
является той же самой сывороткой, но с добавлением консерванта.
Приготовление обогащенной среды
МПА, находящийся во флаконе или колбе, растапливают в водяной
бане, охлаждают до 56-58ё и добавляют к нему ингредиенты в
соотношениях, указанных ранее в рецептах. Обогащенный МПА по 3-3,5
мл разливают в стерильные пробирки, среду скашивают и увлажняют
0,5 мл стерильного мясопептонного бульона или изотонического
раствора хлорида натрия после того, как она застынет. Для проверки
на стерильность среду помещают в термостат при 35-37ё на сутки.
Все вышеуказанные безасцитные среды, кроме яичной, прозрачны,
на них легко дифференцировать колонии микроорганизмов. Среда,
обогащенная яйцом, отличается мутностью, она желтая, выросшие на
ней колонии, в частности, гонококки, плохо различимы. Однако рост
гонококка на этой среде обильный и его колонии легко могут быть
обнаружены путем обработки роста 1% раствором
диметилпарафенилендиамина или другого реактива на оксидазу,
который окрашивает колонии гонококка в красный цвет, хорошо
контрастирующий на желтом фоне среды. Использование желточной
среды без обработки роста микроорганизмов реактивом на оксидазу не
Качество каждой новой серии питательной среды лабораторного
изготовления необходимо проверять путем посева на нее
патологического материала от больных, у которых бактериоскопически
Срок хранения МПА в холодильнике при 4ё не должен превышать 1
месяц, обогащенной среды - 7 суток.
В связи с тем, что для вышеуказанной среды возможен малый срок
хранения, разработана методика производственного изготовления
лиофилизированной безасцитной питательной среды, которая под
названием "Питательная среда для выделения гонококков, сухая"
выпускается в двух флаконах: часть I (основа среды) и часть II
(обогащающие вещества). Для приготовления рабочей среды в часть I
нужно добавить 100 мл стерильной дистиллированной воды и подогреть
в водяной бане при 100ё до полного растворения содержимого флакона
(в пределах 30 минут). Лишнее время выдерживать среду в водяной
бане не следует, т.к. это снижает ее качество. В часть II вносят
24 мл стерильной дистиллированной воды (растворение обогащающих
веществ наступает немедленно). Затем при соблюдении условий
стерильности часть II переносят в охлажденную до 56ё часть I,
смешивают, разливают по стерильным пробиркам, скашивают и
увлажняют как описано ранее.
Сухая среда готовится из кроличьего мяса или бычьих сердец,
помимо приведенных в рецепте 1 (среда КДС-1) обогащающих веществ
она содержит оротовую кислоту в концентрации 1 мкг/мл. Среда
высокого качества, удобна для использования в бактериологических
лабораториях, т.к. для перевода сухой среды в рабочую требуется
лишь стерильная дистиллированная вода.
Использование безасцитной питательной среды с добавлением
антибиотиков и оротовой кислоты дает хорошие результаты при
бактериологической диагностике, в том числе экстрагенительной
гонореи: гонореи миндалин и глотки, прямой кишки. Антибиотики
добавляют для подавления роста сопутствующей гонококку
бактериальной флоры, что повышает интенсивность роста гонококка,
облегчает обнаружение его единичных колоний и выделение в чистой
культуре. Добавляют 20,0 ЕД/мл полимиксина М сульфата и 6,2 ЕД/мл
ристомицина сульфата; вместо последнего можно использовать
линкомицин гидрохлорид - 2 мкг/мл. Оротовую кислоту вводят в
состав питательной среды в количестве 1 мкг/мл.
Для этого берут навеску оротовой кислоты 1 мг (1000 мкг) и
разводят в 1,0 мл стерильной дистиллированной воды (получают
рабочий раствор, содержащий 1000 мкг который может сохраняться в
холодильнике в течение 10 дней) и стерилизуют в водяной бане 15
минут, затем отбирают 0,1 мл полученного раствора и добавляют к
100 мл обогащенной питательной среды. Среду с антибиотиками
необходимо использовать одновременно со средой без антибиотиков
(одна пробирка со средой с антибиотиками, другая - без них), т.к.
хотя и редко, но встречаются штаммы гонококка, чувствительные к
Среда сохранения (транспортировки)
Состав среды сохранения: 1) 1 литр дистиллированной воды,
свободной от хлора, 30 г агар-агара; 2) 900 мл дистиллированной
воды, свободной от хлора, 2 мл тиогликоловой кислоты, 12 мл 1М
раствора едкого натрия, 100 мл 20% водного раствора натрия
фосфорнокислого однозамещенного, 20 мл 1% раствора хлористого
кальция. Последнюю смесь (2) прибавляют к свежеприготовленному
агару (1), доводят рН до 7,3-7,4, по 10 мл среду разливают в
стерильные пробирки, стерилизуют текучим паром в течение 1 часа.
Ватные тампоны на деревянных палочках или стержнях из
нержавеющей стали диаметром около 2 мм, вмонтированные в ватные
пробки, кипятят 20 минут в фосфатном буфере, рН=7,4, и
импрегнируют в течение 24 часов в 1% водной суспензии тонко
измельченного древесного угля. После высушивания ватные тампоны
подправляют, вставляют в бактериологические пробирки
соответствующего диаметра (равного диаметру пробирок со средой) и
стерилизуют в автоклаве 20 минут при 1 атмосфере (температура
Для приготовления фосфатного буфера готовят два раствора: 1
раствор - в 1 л дистиллированной воды растворяют 28,4 г натрия
фосфорнокислого двухзамещенного (0,2М); 2 раствор - в 1 л
дистиллированной воды растворяют 27,8 г лимонной кислоты (0,1 М).
Смешивают 181,7 мл 1 раствора и 18,3 мл 2 раствора.
Производство посева с использованием среды сохранения
осуществляется следующим образом. Врач, осматривающий больного,
извлекает из пробирки тампон, вводит его в очаг заболевания на
несколько секунд для пропитывания (можно сделать несколько
движений по и против часовой стрелки), извлекает его, не касаясь
окружающих предметов, в пробирку со средой сохранения. Поверх
ватной пробки пробирку закрывают резиновой соской. До отправки
материала в бактериологическую лабораторию посевы сохраняют при 4ё
в холодильнике минимальный срок, но не более суток. Одновременно
берут патологический материал и делают мазки для
бактериоскопического исследования, которые направляют в
лабораторию вместе с посевом. В бактериологической лаборатории
немедленно после поступления тампоны с патологическим материалом
вынимают из среды сохранения и ими производят посев по поверхности
скошенной питательной среды в пробирках. Каждым тампоном делают
посев на питательную среду в двух пробирках. Посев по поверхности
питательной среды следует производить зигзагообразными движениями
вдоль поверхности среды, вращая тампон. Если диаметр пробирок со
средой сохранения и питательной средой аналогичен, можно тампон
после посева оставить во второй пробирке в соприкосновении с
питательной средой. Посевы помещают в термостат и выращивают при
36-37ё в эксикаторе. Следует иметь в виду, что при использовании
среды сохранения рост гонококка может наступить позже, чем при
непосредственном посеве патологического материала на питательную
Работа с культурами
Выращивание гонококков можно производить в пробирках или
чашках Петри; первый способ обеспечивает значительную экономию
среды. Для повышения процента высеваемости гонококков засеянные
питательные среды помещают в термостат в эксикаторе с 20%
содержанием углекислого газа, который получают в результате
реакции между серной кислотой и бикарбонатом натрия: в эксикатор
объемом 5 литров помещают стакан с 50 мл 10% серной кислоты, в
Транспортные среды широко используются в лабораторной практике. Они дают возможность получить надежные результаты даже в условиях длительного хранения и транспортировки биопроб. Для понимания принципов работы широкоизвестной транспортной среды Эймса (Amies) мы предлагаем Вам ознакомиться с ее физико-химическими характеристиками.
Правильный забор и транспортировка микроорганизмов критично важны для их восстановления и определения в культуре при последующем посеве. Если патогенные микробы погибают на преаналитическом этапе исследований, достоверность анализов падает, что сильно искажает их результаты. Для поддержания жизнеспособности чувствительных микроорганизмов (например, рода Neisseria) после их забора до лаборатории Стюартом была разработана одноименная транспортная питательная среда. После ее модификации Эймсом этот состав стал одним из самых широко используемых сегодня.
Классическая формула Стюарта
Модифицированный состав Эймса
pH 7.4 ± 0.2 при 25°C
рH 7.2 ± 0.2 при 25°C
Главное отличие среды Эймса от оригинальной среды Стюарта состоит в том, что глицерофосфат был заменен неорганическим фосфатным буфером. Из-за того, что колиформные организмы и некоторые другие грамотрицательные палочки метаболизируют глицерофосфат в среде Стюарта, их количество в бакпосевах из ран, горла, фекальных образцов увеличивалось, что искажало количественные результаты анализов.
Также Эймсом было показано, что для поддержки жизнеспособности штаммов Neisseria gonorrhoeae концентрация NaCl 0,3 г/л является оптимальной. Ионы Са2+ и Mg2+ были добавлены в состав среды, так как считается, что они регулируют проницаемость клеточной стенки бактерий и таким образом влияют на их выживаемость.
Стюарт обнаружил, что выживаемость Neisseria gonorrhoeae резко увеличивалась при взятии мазков палочками с углем. Проблема была в том, что из-за черной угольной пыли они не пользовались популярностью среди пациентов. Эймс предложил оригинальное решение: добавить активированный уголь непосредственно в транспортную среду.
Выживаемость N. gonorrhoeae при 22°C [1] вне среды:
85 штаммов
С углем
Без угля
Время
К-во выживших штаммов
К-во выживших штаммов
и в транспортных средах:
100 штаммов
Среда Стюарта
Среда Amies
Time
К-во выживших штаммов
К-во выживших штаммов
Активированный уголь благодаря большой удельной поверхности обладает высокой адсорбционной способностью. Таким образом, роль угля в высокой выживаемости бактерий в среде Эймса состоит в адсорбции молекул веществ, токсичных для микроорганизмов.
Концентрация агара в среде Эймса была немного увеличена по сравнению с классической формулой среды Стюарта, поскольку присутствие частиц угля негативно влияло на гелеобразующие свойства агара. Также из-за наличия угля Эймс убрал из оригинального состава транспортной среды метиленовый синий, который раньше использовался в качестве редокс-индикатора.
В итоге, во многих исследованиях было показано высокую эффективность использования транспортной среды Стюарта с модификациями Эймса для поддержания даже таких прихотливых микроорганизмов как Haemophilus influenzae, Streptococcus pneumoniae, Streptococcus pyogenes and Corynebacterium diphtheriae [2, 3].
Сегодня на украинском рынке выбор транспортных сред достаточно широкий. Мы предлагаем Вам серию заметок, которые помогут Вам лучше разобраться в особенностях их состава и применения. Если же у Вас возникают вопросы, касающиеся использования транспортных сред, квалифицированные специалисты компании Sente-Lab будут рады Вам помочь.
1. Amies C. R. A modified formula for the preparation of Stuart's transport medium //Canadian Journal of Public Health/Revue Canadienne de Sante'e Publique. – 1967. – P. 296-300.
2.Barry A. L., Fay G. D., Sauer R. L. Efficiency of a transport medium for the recovery of aerobic and anaerobic bacteria from applicator swabs //Applied microbiology. – 1972. – Vol. 24. – №. 1. – P. 31-33.
3.Bartlett J. G. et al. Anaerobes survive in clinical specimens despite delayed processing //Journal of clinical microbiology. – 1976. – Vol.. 3. – №. 2. – P. 133-136.

| Hiculture Transport Swabs W/ CVTR Medium (Modified) in polystyrene tube Транспортная система со средой CVTR (для микоплазм, хламидий и вирусов) (модифицированная) в полистироловая пробирке с тампоном |
 |
| Каждая упаковка содержит стерильную полистироловую пробирку, содержащую среду и тампон на пластиковой палочке с пробкой для взятия мазка. бактериальные культуры гарантированно сохраняют жизнеспособность до 48 часов при комнатной температуре. |
Hiculture Transport Swabs W/ CVTR Medium (Modified) in polystyrene tube
Транспортная система со средой CVTR (для микоплазм, хламидий и вирусов) (модифицированная) в полистироловой пробирке с тампоном (для выделения вирусов, в том числе, коронавирус) (на основе среды 199, пригодна для ПЦР) (в комплекте два тампона- для носоглотки и горла)
РУ (ФСЗ 2009/03708)
Срок годности: 1 год с момента изготовления.
Комбинированная система предназначена для сбора и транспортировки клинических образцов от места сбора до лаборатории. Пригодна для ПЦР-исследований и для выделения вирусов, в том числе, коронавируса. Стерильная система содержит пробирку с 3мл транспортной среды HiViral на основе среды 199, предназначенной для поддержки широкого спектра вирусов, таких как коронавирус , вирус простого герпеса, аденовирус, вирус гриппа типа A (H1N1, H5N2, H3N2), респираторно-синцитиальный вирус, энтеровирус, вирус паротита и риновирус.
Комплект содержит:
- один вискозный стерильный тампон без точки перелома для взятия проб из носа или носоглотки.
- один вискозный стерильный тампон без точки перелома для взятия пробы позади миндалин.
Транспортировка биоматериала:
Материал должен быть доставлен в лабораторию максимально быстро. После забора его необходимо охладить до 2 - 8°С или транспортировать в тающем льду в течение 48 часов. При более длительной задержке материал должен сохраняться при температуре -70 °С.
Транспортная система сохраняется при температуре не выше 25 °С.
| Hiculture Transport Swabs with Cary-Blair Medium in polystyrene tube Транспортная система со средой Кари-Блэйра в полистироловой пробирке |
| Hiculture Transport Swabs with Stuart Transport Medium in polystyrene tube Транспортная система со средой Стюарта в полистироловой пробирке |
| Hiculture Transport Swabs with Amies Medium w/Charcoal in polystyrene tube Транспортная система со средой Амиеса с активированным углем в полистироловой пробирке |
|
| Hiculture Transport Swabs with Stuart Transport Medium in polystyrene tube Транспортная система со средой Амиеса с активированным углем в полистироловой пробирке с тампоном на металлической палочке | |
| Hiculture Transport Swabs with Amies Medium w/o Charcoal in polystyrene tube Транспортная система со средой Амиеса без активированного угля в полистироловой пробирке | MS684 |
Amies модифицировал транспортную среду Stuart путем замены глицерофосфата на неорганический фосфатный буфер и добавления в среду активированного угля. В данном виде среда имеет низкий редокс-потенциал (за счет присутствия тиогликолята натрия и небольшого количества агар-агара). Уголь помогает нейтрализовать вещества, токсичные для некоторых возбудителей, например, гонококков. Соли кальция, магния, калия и натрия способствуют выживанию гонококков и поддерживают жизнеспособность других бактериальных клеток.
Данная среда является модификацией ранее предложенной среды Кэри-Блера и используется для транспортировки и хранения материала, предназначенного для микробиологического исследования. Исходная транспортная среда была предназначена для материала, содержащего гонококки. Кэри и Блер отметили избыточный рост на ней контаминирующих микроорганизмов из фекалий, содержащих шигеллы. Контаминирующие микроорганизмы использовали глицерофосфат для получения энергии и поэтому для придания буферных свойств лучше было использовать неорганические соли. В среде Амиеса нет метиленового синего.
Для выделения и идентификации микроорганизмов образец по возможности быстро и асептично извлекают из пробирки и делают посевы на соответствующих средах.
Транспортная система со средой Амиеса с углем или без угля в полистироловой пробирке рекомендуется для сбора, транспортировки и хранения проб, содержащих E.coli, K.pneumoniae, Haemophilus influenzae, Neisseria gonorrhoeae, Streptococcus pneumonie и другие микроорганизмы.
Каждая упаковка содержит стерильную полистироловую пробирку, со средой Амиеса с углем или без угля и стерильный тампон для взятия мазка на пластиковой или металлической палочке с пробкой.
Бактериальные культуры гарантированно сохраняют жизнеспособность
до 48 часов при t° 15-22 °C.
Транспортные системы хранить при температуре не выше 25°C.
Не допускать замораживания.
| Hiculture-TM Transport Swabs w/CVTR Medium in polystyrene tube Recommended for transporting viral specimens at ambient temperature. Транспортная система со средой CVTR ( для микоплазм, хламидимий и вирусов) в полистироловой пробирке с тампоном |
| HicultureTM Transport Swabs w/ Dey-Engley Neutralizing Broth in polystyrene tube Транспортная система с нейтрализующей средой Ди-Ингли в полистироловой пробирке с тампоном |
| HicultureTM Transport Swabs w/ Chlamydospore Medium in Polystyrene tube Транспортная система со средой для грибов рода Candida в полистироловой пробирке |
| HiCulture Transport Swabs w/ Modified Campylobacter Thioglycollate Medium in Polystyrene tube Транспортная система с модифицированной тиогликолевой средой для кампилобактерий |



