Вич и его механизм действия
Иммунная система - это главное защитное средство организма против вторжения микроорганизмов, которые могут проникать через кожу или слизистую оболочку и вызывать болезнь. Для нейтрализации микроорганизмов иммунная система вырабатывает антитела и активирует специальные клетки крови, которые убивают и удаляют эти микроорганизмы из организма человека. Если у человека иммунная система не функционирует нормально, то это называется иммунодефицитом. ВИЧ-инфекция также вызывает у человека иммунодефицит.
Попав тем или иным путём в кровь, ВИЧ избирательно поражает Т-лимфоциты - помощники белой крови заражённого человека. В этих клетках вирус ведёт “двойную игру”: во-первых, благодаря наличию специального фермента ревертазы, РНК преобразуется в ДНК и встраивается в хромосомы поражённых Т-помощников, а во-вторых, ВИЧ разрушает поражённую клетку.
Таким образом, в лимфоцитах развиваются как бы два взаимопротивоположных процесса. С одной стороны, клетка после изменения своего генома становится носительницей вируса и может передавать его дочерним клеткам при делении, а с другой - ее ждёт гибель. Эти процессы могут идти с различной скоростью, что вместе с количеством полученных при заражении вирусов, в конечном счёте, и определяет длительность скрытого периода - срока, походящего от заражения до момента заболевания. Он может быть весьма коротким - всего лишь 4-5 месяцев, но чаще измеряется годами.
Когда значительное число Т-лимфоцитов разрушается вирусом, иммунная система - в опасности. У больного развивается клинически выраженный иммунный дефицит, который, в свою очередь, будет проявляться в виде различных инфекций, возникших у больного в результате потери им возможности сопротивляться любым заразным или потенциально заразным агентам, а это ведёт к возникновению тяжело протекающих инфекционных болезней, опухолей кожи, головного мозга и др.
В течении ВИЧ-инфекции можно выделить несколько стадий, постепенно переходящих одна в другую.
Первичная реакция организма на внедрение ВИЧ проявляется выработкой антител. От момента заражения до выработки антител обычно проходит в среднем от трёх недель до трёх месяцев. Нередки случаи появления антител только через 6 месяцев. У 15-25% инфицированных появление антител к ВИЧ в организме проявляется клиническими симптомами первой стадии заболевания.
Первая стадия. В течение трёх-пяти недель после инфицирования у человека, как правило, развивается острое заболевание, длящееся две-три недели, с такими симптомами, как высокая температура, сыпь, боли в суставах и мышцах, боли в горле при глотании. Симптомы могут быть слабыми и обычно полностью проходят. Но вирус продолжает размножаться внутри организма. Человек годами может оставаться практически здоровым, хорошо себя чувствовать, несмотря на то, что он инфицирован ВИЧ.
Вторая стадия наступает вслед за первой или после продолжительного латентного периода - 3-5 лет и более.
Увеличиваются группы лимфоузлов - затылочные, шейные, подмышечные и другие. Они эластичные, безболезненные и держатся длительно.
По мере снижения уровня иммунных клеток к увеличению лимфоузлов присоединяются похудание, лихорадка, длительные поносы, различные повторные инфекции - ангины, отиты и др., которые пока имеют благоприятное течение и лечатся общепринятыми средствами. Почти у всех больных отмечается поверхностное поражение кожи - гнойники, себорея, опоясывающий лишай, грибковые поражения. Такое состояние свидетельствует о переходе заболевания в третью стадию - пре-СПИД.
Далее по мере развития заболевания к увеличению лимфоузлов начинают присоединяться некоторые сопутствующие инфекции - в первую очередь, распространённые вирусные поражения нескольких органов или инфекционные процессы, локализованные в кишечнике либо лёгких. Периодически наступают улучшения, и больной может даже забывать о своём страдании, но затем - новые эпизоды болезни, более тяжёлые, чем прежде. Постепенно, без каких-то резких перемен болезнь переходит в последнюю стадию - собственно СПИД.
Наиболее частой, достаточно тяжёлой и относительно плохой в плане прогноза является лёгочная форма СПИДа. Она может развиваться в связи с поражением ткани лёгких бактериями, вирусами, микроскопическими грибами. Но чаще всего регистрируется такое их поражение, как пневмоцистная пневмония - тяжёлое воспаление лёгких, которое плохо поддаётся лечению.
Головной мозг и вся нервная система при СПИДе так же страдают довольно часто. Неврологические больные, как правило, теряют ориентировку во времени и пространстве, утрачивают способность к контакту с внешней средой и, в конечном итоге, нередко погибают в состоянии полного маразма, распада человеческой личности.
Третье место по частоте при СПИДе занимают поражения пищеварительного тракта, начиная со слизистых оболочек полости рта и пищевода, где нередко выявляется “молочница” (поражение грибами рода кандида), герпетическая вирусная инфекция, и кончая тяжёлыми язвенно-некротическими очагами в толстой кишке. Могут быть и “традиционные” кишечные инфекции - дизентерия и сальмонеллёзы, протекающие тяжело и плохо поддающиеся лечению.
Особое место в ряду проявлений СПИДа занимают опухоли и, прежде всего, саркома Капоши. Этот вид новообразований характеризуется множественным поражением мелких кожных кровеносных сосудов, протекает злокачественно и быстро распространяется на внутренние органы. Саркоматозные узлы с большим трудом поддаются лечению, а их быстрое разрушение может приводить к развитию смертельных кровотечений.
Инфицирование человека ВИЧ происходит путем его попадания в кровь или на поврежденные слизистые оболочки. Возбудитель обладает уникальной способностью поражать разные типы дифференцированных клеток, в первую очередь Т4-лимфоциты (хелперы), а также моноциты/макрофаги и большое количество других чувствительных к нему клеток органов и тканей: фолликулярные дендритные клетки лимфатических узлов, клетки олигодендроглии и астроциты головного мозга, альвеолярные макрофаги легких, эпителиальные клетки кишечника и шейки матки, клетки Лангерганса.
Проникновение вируса внутрь клетки осуществляется связыванием его со специфическим рецептором клеточной оболочки (молекулярной СД4) путем эндоцитоза или прямым внедрением через плазматическую мембрану. Внутри клетки генетическая информация с вирусной РНК переходит на ДНК с помощью обратной транскриптазы. Однонитевая структура ДНК достраивается второй ее нитью, а промежуточная форма ДНК сливается с ядром клетки и интегрируется с ее ДНК, становясь ДНК-провирусом. С этого момента наступает стадия латентной инфекции, которая длительное время не проявляется никакими симптомами болезни, и человек находится в состоянии вирусоносительства.
Главным вопросом механизма патогенеза ВИЧ-инфекции является выяснение причин активации провируса. Допускают, что активация латентной инфекции может происходить под влиянием различных антигенов, цитокинов, собственных клеточных и гетерологичных транскрипционных факторов и других причин. Активация транскрипции и синтез белков-предшественников вируса принимает иногда взрывообразный характер, когда происходит завершающая сборка частиц вируса и выход его из клетки, следствием чего является ее прямая деструкция и цитолиз (цитонекроз), который дополняется образованием синцитиев с другими клетками, пораженными вирусом и не пораженными им, но имеющими на наружной мембране авидитентные молекулы СД4.
Это позволяет вирусу фиксироваться на клетках ЦНС, эпителиоцитах легких, кишечника и т. д. и вызывать развитие хронической (медленной) инфекции.
Уменьшение количества СД4-клеток в крови инфицированных ВИЧ может быть обусловлено действием цитокинов, секретируемых ВИЧ-макрофагами, таких, как фактор некроза опухолей и интерлейкины-1. Повышенная их секреция запускает запрограммированный механизм гибели клетки - апоптоз. СД8-лимфоциты, напротив, способны затормозить процесс гибели клетки с помощью секреции ими других цитокинов, благодаря чему сдерживается развитие инфекции на уровне бессимптомного течения. Прогрессирование ВИЧ-инфекции и цитолиз лимфоцитов определяют темп развития патологического процесса.
Дисгармония взаимодействия цитокинов, вырабатываемых субпопуляциями Т-хелперов 2-го типа (интерлейкин-4 и интерлейкин-10) и уменьшение Т-хелперов 1-го типа (интерлейкин-2, гамма-интерферон) лежат в основе прогрессирования инфекции ВИЧ.
По своей природе ВИЧ является иммунотропным, поэтому в дальнейшем развитии болезни все большую патогенетическую роль приобретает состояние иммунной системы организма. В основе иммунной супрессии лежит не только прямое цитопатическое действие на Т-хелперы - главную мишень ВИЧ, но и ряд опосредованных процессов. Уже в начале болезни идет выработка специфических противовирусных антител, но остановить развитие инфекционного процесса с их участием, как это наблюдается при многих других инфекционных болезнях, не удается. Вирус, первично поражая иммунную систему человека, упреждает ее защитную функцию.
Кроме того, поликлональная активация В-лимфоцитов ведет к общему нарастанию иммуноглобулинов и циркулирующих иммунокомплексов (ЦИК). ЦИК, содержащие антигены и антитела к ним, циркулируя в крови, способствуют генерализации процесса, вовлекая новые клеточные образования, не пораженные ранее вирусом. Развиваются глубокие иммунопатологические процессы, которые преобладают над защитными иммунными реакциями организма. Вследствие иммунодефицита возникают вторичные патологические процессы. Активация собственной микрофлоры тела человека обусловливает развитие оппортунистических инфекций. Иммунодефицит влечет за собой более легкое присоединение экзогенных инфекций и возникновение опухолей. Патологический стресс, возникающий у человека при диагностике у него ВИЧ-инфекции, опосредовано дополнительно угнетает ослабленную иммунную систему организма.
Немалую отрицательную роль при этом играет и поражение самого головного мозга, с состоянием которого связывают общую реактивность организма. Таким образом, снижается участие механизмов естественной регуляции иммунитета и адаптации организма во время болезни. На этом фоне вирус ВИЧ прямо и с дополнительным участием иммунопатологических процессов поражает практически все органы и системы организма, обуславливая полиорганность в стадии развернутой клинической картины СПИДа.
14 октября 2013
- 19742
- 15,7
- 2
- 3
Распространенность СПИДа в мире на 2009 год.

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система
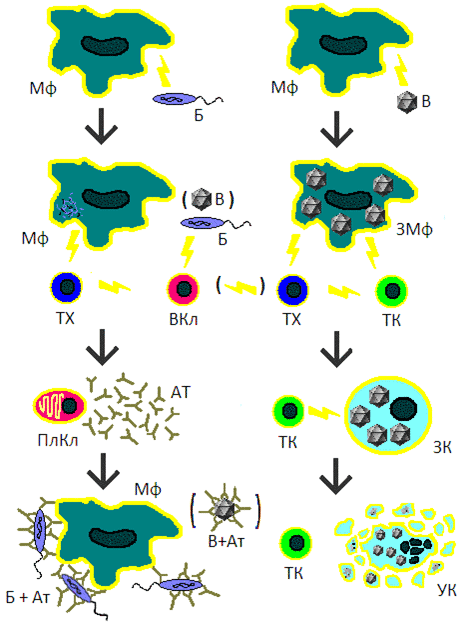
Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Видео. Жизненный цикл ВИЧ.
Обратная транскрипция осуществляется вирусным белком обратной транскриптазой [31]. Обратная она потому, что обычно в клетке все наоборот — информация переносится с ДНК на РНК (а с РНК — в последовательность аминокислот белков). РНК по сравнению с ДНК очень нестабильна, и поэтому для ВИЧ характерна огромная скорость мутации — в десятки тысяч раз быстрее, чем для человека. Если скорость нейтральных мутаций для ДНК составляет у различных видов и для различных генов в среднем меньше 10 −9 замен на сайт в год, то скорость мутирования генетического материала РНК-вирусов — около 10 −3 замен на сайт в год (у гена env ВИЧ: 10 −2 –10 −3 замен на сайт в год [21]). Это одна из причин, почему иммунная система не может справиться с ВИЧ — он слишком быстро изменяется.
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
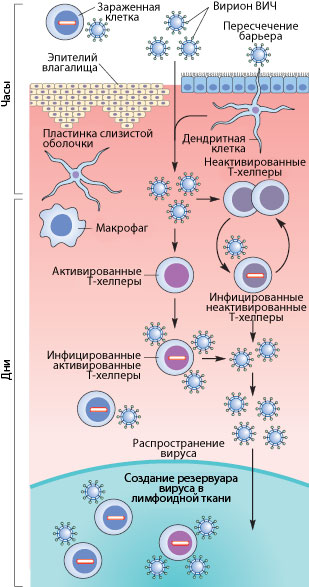
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
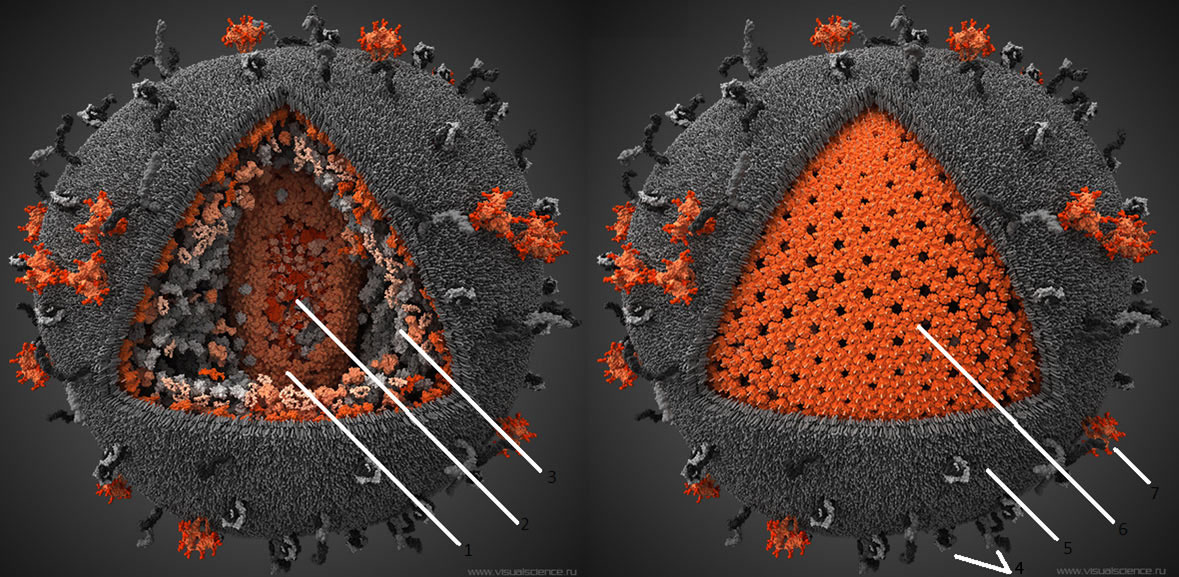
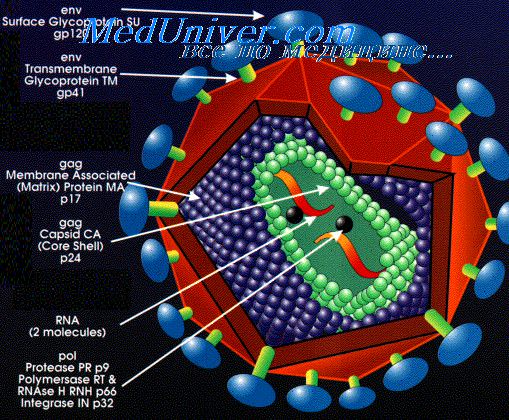
10000 нуклеотидов в каждой. Всего геном включает девять генов, которые в результате альтернативного сплайсинга кодируют 15 различных белков. 3 — Различные белки, захваченные вирусом из хозяйской клетки. 4 — Человеческие белки, обычно находящиеся на поверхности мембраны клеток. Захваченые в результате отпочковывания, они увеличивают вирулентность вируса. 5 — Внешняя оболочка ВИЧ, ведущая свое происхождение от цитоплазматической мембраны клетки, от которой когда-то отпочковался вирион. 6 — Матрикс, образованный тримерами белка р17. 7 — Тримерные комплексы белков gp120 и gp41, при помощи которых вирус проникает в клетку. На поверхности среднего вириона насчитывается около 20 таких тримеров. Чтобы увидеть рисунок в полном размере, нажмите на него.
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.

— болезнь, вызванная вирусом иммунодефицита человека. Это антропонозное инфекционное хроническое заболевание, характеризующееся специфическим поражением иммунной системы, приводящим к медленному ее разрушению до формирования синдрома приобретенного иммунодефицита (СПИД), сопровождающегося развитием оппортунистических инфекций и вторичных злокачественных новообразований.
Диагноз ВИЧ-инфекции устанавливается на основании эпидемиологических, клинических и лабораторных данных. ВИЧ - вирус, с которым организму сложно бороться. Дело в том, что вирус для собственного воспроизводства использует такие же клетки, которые организм расходует для сопротивления инфекции. Вирус иммунодефицита человека заставляет инфицированные клетки погибать быстрее, а также давать сигналы другим клеткам отмирать быстрее. Главным показателем состояния иммунитета человека при является количество лимфоцитов CD4. Источником являются люди, инфицированные ВИЧ на любой стадии заболевания, в том числе в инкубационном периоде.
Механизм и факторы заражения
может передаваться при реализации как естественного, так и искусственного механизма передачи.
К естественному механизму передачи ВИЧ относятся:
- контактный, который реализуется преимущественно при половых контактах (как при гомо -, так и гетеросексуальных) и при контакте слизистой или раневой поверхности с кровью.
- вертикальный (инфицирование ребенка от матери: во время беременности, в родах и при грудном вскармливании.
К искусственному механизму передачи относятся:
- при немедицинских инвазивных процедурах, в том числе внутривенном введении наркотиков (использование шприцев, игл, другого инъекционного оборудования и материалов).
- нанесение татуировок, при проведении косметических, маникюрных и педикюрных процедур нестерильным инструментарием.
- при инвазивных вмешательствах в ЛПО: инфицирование ВИЧ может осуществляться при переливании крови, ее компонентов, пересадке органов и тканей, использования донорской спермы, донорского грудного молока от донора, через медицинский инструментарий для парентеральных вмешательств, изделия медицинского назначения, контаминированные ВИЧ и не подвергшиеся обработке.
Основными факторами передачи возбудителя являются биологические жидкости человека (кровь, компоненты крови, сперма, вагинальное отделяемое, грудное молоко).
Основные уязвимые группы населения:
- потребители инъекционных наркотиков (ПИН),
- коммерческие секс-работники (КСР),
- мужчины, имеющие секс с мужчинами (МСМ).
- Группу повышенного риска заражения ВИЧ представляют
- клиенты КСР, половые партнеры ПИН,
- заключенные, беспризорные дети, лица, имеющие большое число половых партнеров,
- мигрирующие слои населения (, сезонные рабочие, в том числе иностранные граждане, работающие вахтовым методом и другие),
- люди, злоупотребляющие алкоголем и не инъекционными наркотиками, поскольку под воздействием психоактивных веществ они чаще практикуют более опасное сексуальное поведение.
Инкубационный период при — это период от момента заражения до ответа организма на внедрение вируса составляет, как правило, 2–3 недели, но может затягиваться до 3–8 месяцев, иногда до 12 месяцев. В данном периоде у инфицированного антитела к ВИЧ не обнаруживаются, в связи с чем возрастает риск передачи от него инфекции во внутрибольничных очагах, в том числе при переливании крови и ее компонентов.
- острая (лихорадка, лимфаденопатия, сыпь на лице, туловище, иногда на конечностях, миалгии или артралгии, диарея, головная боль, тошнота и рвота, увеличение печени и селезенки, неврологические симптомы);
- субклиническая (клинические проявления кроме лимфоаденопатии отсутствуют);
- стадия вторичных заболеваний (инфекционные и онкологические).
Стандартным методом лабораторной диагностики служит определение антител/антигенов к ВИЧ с помощью ИФА. Для подтверждения результатов в отношении ВИЧ применяются подтверждающие тесты (иммунный, линейный блот).
Освидетельствование на проводится добровольно, за исключением случаев, когда такое освидетельствование является обязательным.
Просветительская работа с населением по профилактике
Просветительская работа с населением по профилактике является одним из основных методов профилактики данного заболевания. Ни одно мероприятие по отдельности не может предотвратить или остановить эпидемию . Должна проводиться комплексная, адресная программа профилактики, лечения и ухода для различных групп населения.
Такая просветительная работа включает в себя предоставление населению подробной информации:
- о ;
- мерах неспецифической профилактики ;
- основных симптомах заболевания;
- важности своевременного выявления заболевших лиц;
- необходимостью взятия их на диспансерный учет и других мероприятий с использованием средств массовой информации, листовок, плакатов, бюллетеней, проведением индивидуальной работы, направленной на формирование поведения, менее опасного в отношении заражения ВИЧ.
Учебные программы образовательных учреждений (муниципальные образовательные учреждения, высшие учебные заведения, средние специальные учебные заведения, учреждения начальной профессиональной подготовки, профессиональные училища) должны включать вопросы профилактики .
Необходимо также обеспечить внедрение профилактических программ по среди групп населения с высоким риском заражения ВИЧ (потребители инъекционных наркотиков, мужчины, имеющие сексуальные контакты с мужчинами, работники коммерческого секса).
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.


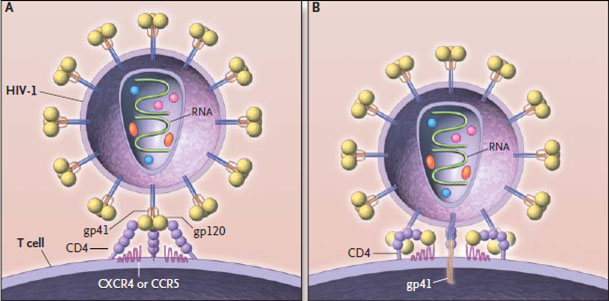
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.

После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Читайте также:


