Вич изначально заражает клетки экспрессирующие
11 октября 2016
- 2459
- 2,1
- 2
- 10
Комплекс-белок Cas9/sgRNA/viral RNA (слева) и модель вируса иммунодефицита человека (справа), построенная коллективом Visual science.

Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсор публикации этой статьи — Виктор Татарский.
Врага нужно знать в лицо
Об иммунитете, апоптозе и вообще.
Иммунная система развивалась сотни миллионов лет. По типу реакции ее обычно делят на врожденный (неспецифичный) и приобретенный (специфичный) иммунитет [1], [2]. Считается, что специфичный (то есть вырабатываемый к конкретному патогену) иммунитет впервые появился у челюстноротых (рыб и всех вышестоящих по эволюционному древу таксонов) после отделения от бесчелюстных (миног и миксин), хотя у вторых имеется аналогичная система защиты [3]. К клеткам специфичного иммунитета относят В-лимфоциты, Т-лимфоциты и NK-клетки (естественные киллеры, natural killer cells). Помимо этого существуют моноциты, которые хоть и не являются истинными инструментами приобретенного иммунитета, однако выполняют некоторые функции по нейтрализации патогена: фагоцитоз, презентация антигена, выделение бактерицидных веществ и цитокинов.
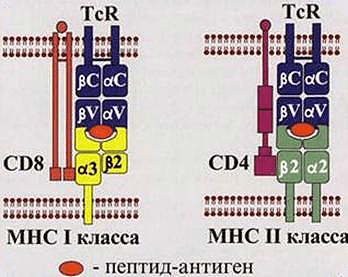
Рисунок 1. Взаимодействия Т-киллеров (слева) и Т-хелперов (справа) с зараженными клетками. Для передачи сигнала о заражении необходимо выполнение двух условий: контакт комплекса МНС-патоген с TcR (T-cell Receptor, рецептор Т-клеток) и CD. Двигаясь по организму, Т-лимфоциты проверяют каждую клетку на предмет наличия у нее антигена в комплексе с МНС. Их можно сравнить с подслеповатой глуховатой бабушкой, пришедшей забирать дитятко из детского сада. Для опознания ей надо подойти вплотную и по нескольким (в данном случае по двум) признакам определить, ее ли это чадо или нет.
Т-лимфоциты, в свою очередь, необходимы для уничтожения клеток, зараженных внутриклеточными паразитами, и опухолевых клеток. Они делятся на два основных типа в зависимости от класса рецепторов, находящихся на внешней стороне их мембраны.
Т-киллеры несут CD8 рецепторы и отвечают за:
Т-хелперы имеют CD4 рецепторы и ответственны за секрецию цитокинов, которые:
- активируют макрофаги для борьбы с внутриклеточными паразитами;
- способствуют продукции антител В-лимфоцитами.
Но не менее важна роль Т-хелперов в подготовке зрелых Т-киллеров из клеток-предшественниц, активации NK-клеток и моноцитов.
Как же происходит опознавание антигена на молекулярном уровне? Здесь надо упомянуть еще об одном очень важном классе рецепторов — МНС (Major Histocompability Complex или главном комплексе гистосовместимости). Они бывают двух классов: I и II. МНС I присутствует на поверхности всех ядерных клеток организма человека. Он необходим для опознавания клетки натуральным киллером и Т-киллером (рис. 1, 2). Если по какой-то причине МНС I изменен, несет на себе антиген или отсутствует, клетка будет подвергнута апоптозу. МНС II находится на поверхности В-лимфоцитов, макрофагов и дендритных клеток. Он необходим для презентации антигена Т-хелперам (рис. 1, 2). Жизнь пула Т-хелперов можно представить как прогулку с ребенком в зоопарке, только вместо животных — антигены, вместо ребенка — Т-хелпер, а вместо взрослых, объясняющих, кто есть кто, — три перечисленных типа клеток.
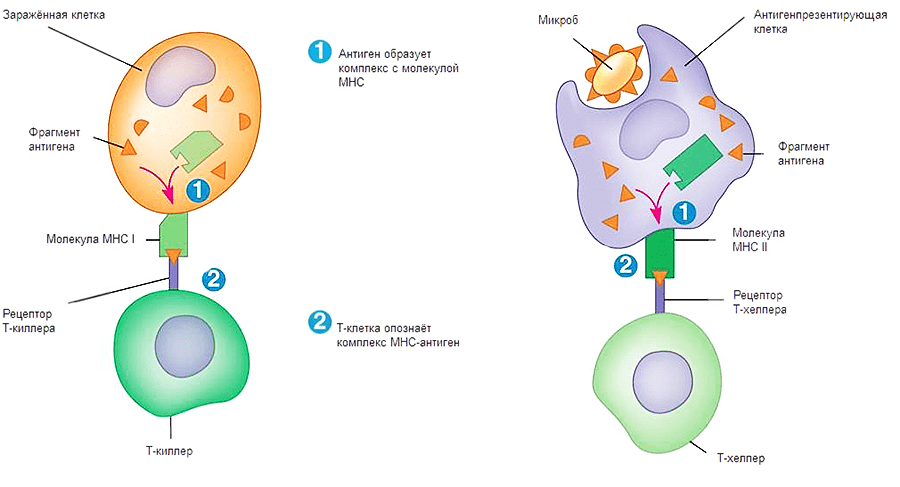
Рисунок 2. Процесс передачи сигнала Т-киллеру и Т-хелперу. Первый этап — сборка комплекса МНС-антиген, второй этап — презентация комплекса на поверхности клетки.
Первый этап проникновения вируса в клетку — взаимодействие вирусного белка gp120 (рис. 3) с рецептором CD4. Отсюда понятно, почему ВИЧ размножается именно в Т-хелперах. Взаимодействию способствуют корецепторы CCR5 и CXCR4 [8]. В норме они являются рецепторами цитокинов, а при взаимодействии ВИЧ с клеткой их связь является необходимым условием проникновения вируса внутрь. Мутации в генах этих рецепторов обеспечивают частичную устойчивость носителей таких мутаций (таких людей около 2%, причем некоторые штаммы вируса все равно могут их поражать) [9]. Затем в мембрану клетки погружается белок gp41, после чего мембрана вируса сливается с клеточной, и происходит распаковка генетического материала. По принципу обратной транскрипции с РНК-матрицы вируса с помощью фермента ревертазы (обратной транскриптазы) синтезируются молекулы кДНК (комплементарной ДНК). Синтезированная кДНК вставляется вирусной интегразой в геном клетки хозяина. После попадания в геном хозяина вирус может никак себя не проявлять до нескольких лет — протекает так называемый инкубационный период. Только когда клетки активно пролиферируют, а значит, синтезируют белки на матрице ДНК, начинается сборка вирусных частиц , выход их из клеток и гибель последних (так как каждая частица забирает с собой часть клеточной мембраны клетки, вирусы попросту разрывают клетку).
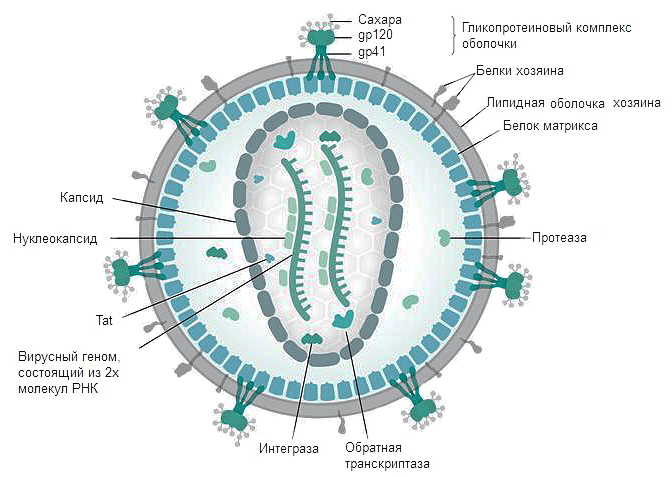
Рисунок 3. Строение ВИЧ. Белки gp120 и gp41 участвуют в рецепции вируса клеткой и проникновении вирусной частицы внутрь. Липидная оболочка захватывается от клетки хозяина вместе с частью мембранных белков. Белки матрикса синтезируются в клетке после встраивания кДНК в геном в момент наработки клеточных белков для деления. Протеаза, возможно, необходима для разрезания противоапоптотического фактора Bcl-2 [9]. Ферменты обратная транскриптаза и интеграза создают кДНК на матрице РНК и встраивают кДНК в геном Т-хелпера соответственно. Tat — белок, вовлеченный в индукцию апоптоза. Нуклеокапсид — комплекс из РНК и белков вируса, представляющий собой компактную упакованную форму генома. Капсид — белковая оболочка, защищающая содержимое от воздействия внешних условий.
Как иммунитет бактерий правит геномы
Система редактирования геномов CRISPR/Cas известна уже довольно давно (впервые локус описал в 1987 году Есизуми Исино из университета Осаки), но только недавно (в 2005 году) ученые поняли ее истинное предназначение [11], [12].
Как вы уже поняли, система состоит из двух компонентов: CRISPR-локуса (Clustered Regularly Interspaced Short Palindromic Repeats или сгруппированные и регулярно разделенные короткие палиндромные повторы) и белков Cas, которые, являются нуклеотид-специфичными эндонуклеазами (а название получили за работу в команде с CRISPR — Crispr associated).
Помимо CRISPR-локуса и блока генов Cas в ДНК бактерии (не обязательно в нуклеоиде [12]) находится ген tracrРНК (transactivated crispr RNA), частично комплементарной палиндромам.
Для формирования специфичной устойчивости к вирусу бактерия, как и человек, должна встретиться с ним дважды.
Первый раз после внедрения вирусной ДНК в клетку происходит разрезание ДНК белками Cas1 и Cas2 на протоспейсеры и встраивание их в начало CRISPR-локуса. Cas1 и Cas2 формируют при этом комплекс, причем Cas2 играет только структурную роль, удерживая ДНК, тогда как Cas1 встраивает ее. Каждый протоспейсер вставляется в CRISPR-локус так, чтобы от другого (уже имеющегося) спейсера его отделял палиндром.
Соответственно, после транскрипции ДНК всего комплекса образуются три продукта (рис. 4):
- tracrРНК;
- РНК белка Cas (наиболее изученным является Cas9, поэтому далее повествование пойдет о нем), далее транслирующаяся;
- pre-crРНК (poly-spacer precursor crRNA или многоспейсерный предшественник crРНК), которая представляет собой транскрипт спейсеров, разделенных образовавшимися из палиндромов шпильками или петлями.
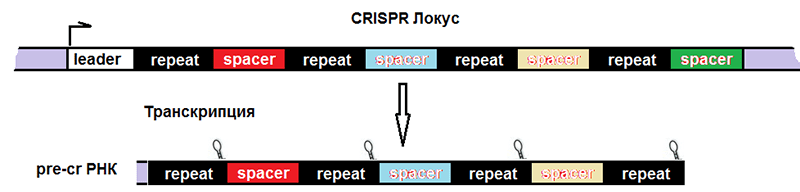
Рисунок 4. Строение CRISPR-локуса и результат транскрипции. leader — лидерная последовательность, отвечающая за начало транскрипции, со стороны которой вставляется новый спейсер. repeat — палиндромный повтор, который после транскрипции превращается в шпильку или петлю.
Второй этап — образование комплекса pre-crРНК/Cas9/РНКаза III. Очевидно, что вся длинная pre-crРНК не может участвовать в опознавании инвазивной ДНК, так как, во-первых, очень длинна, что конформационно неудобно, а во-вторых, при сравнении спейсеров РНК с протоспейсерами инвазивной ДНК длинный транскрипт начнет путаться и в итоге образует клубок, непригодный для дальнейшей работы. Самое логичное — разделить длинную последовательность на короткие участки, которые могли бы проверятся на соответствие инвазивной ДНК белком Cas9. И тащить за собой не надо, и не запутается.
С помощью фермента РНКазы III и при участии tracrРНК pre-crРНК разделяется по границам повторов так, что в белково-нуклеиновый комплекс входят один спейсер и один повтор, комплементарно связанный с tracrРНК (рис. 5) [13]. Повтор полностью теряет свою вторичную структуру, tracrРНК же оставляет несколько шпилек (обычно три).
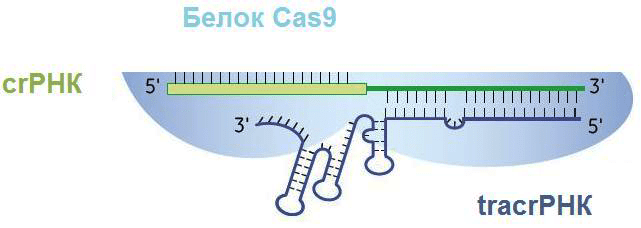
Рисунок 5. Белково-нуклеиновый комплекс после созревания транскрипта. crРНК состоит из спейсера (слева) и повтора, соединенного с частью tracrРНК (справа). Три петли на tracrРНК нужны для удержания ее эндонуклеазой Cas9.
- комплементарность спейсера комплекса Cas9/crРНК/tracrРНК протоспейсеру инвазивной (например, вирусной) ДНК;
- наличие в геноме вируса около протоспейсера последовательности из трех нуклеотидов — РАМ (Protospacer Adjacent Motif, прилежащий к протоспейсеру мотив).
Таким образом клетка страхуется от уничтожения своей ДНК. Но даже просто разрезанная в одном месте вирусная ДНК может представлять опасность, поэтому завершает инактивацию негомологическое сращивание концов (non-homologous end joining, NHEJ). При этом происходит инсерция/делеция одного или нескольких нуклеотидов, что приводит к потере инфекционности.
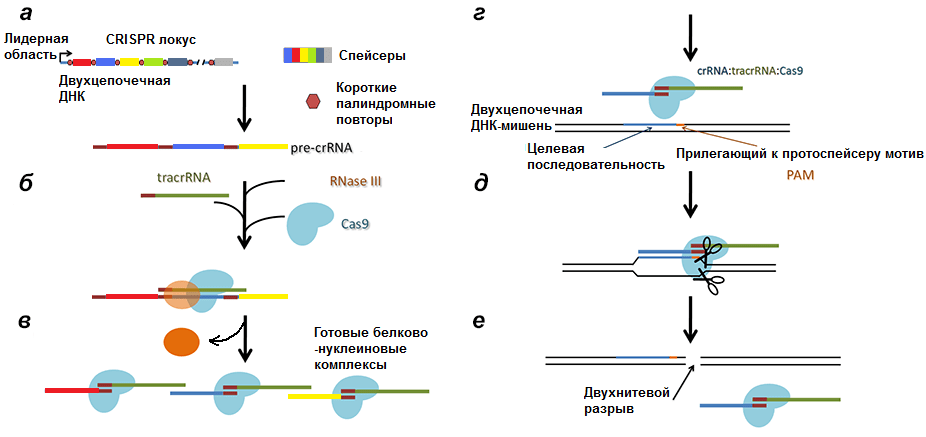
Рисунок 6. Полная схема механизма работы CRISPR/Cas9 системы. а — Транскрипция CRISPR локуса с образованием pre-crРНК. б, в — Разрезание РНК РНКазой III и образование комплексов Cas9/tracrРНК/crРНК. г — Вторичное проникновение в клетку чужеродной ДНК. д — Соединение комплекса с инвазивной ДНК. е — Образование двухнитевого разрыва в протоспейсере.
А где же тут редактирование геномов? А вот где:
- во-первых, таким образом можно просто нокаутировать целевой ген и добиться прекращения экспрессии того или иного белка;
- во-вторых, после создания двухцепочечного разрыва в образовавшуюся брешь можно вставить нужный нам ген и заставить организм синтезировать нужный нам белок.
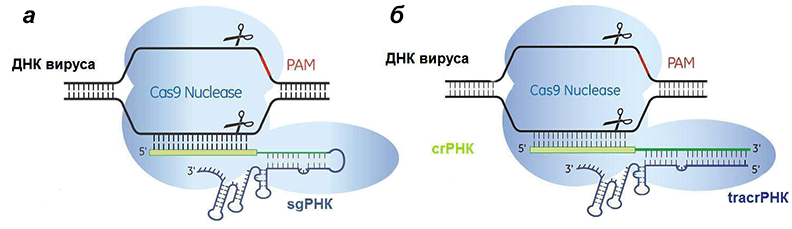
Рисунок 7. Сравнение искусственной (а) и естественной (б) систем CRISPR/Cas9. Отличие состоит лишь в том, что искусственная РНК едина, а природная — состоит из двух частей, гены которых разделены.
Битва века
Однако вернемся к теме этой статьи.
Так как система редактирования геномов может помочь в избавлении от ВИЧ? Очень просто: вирус можно вырезать! Нацелив Cas9, путем создания sgРНК с последовательностью, комплементарной вирусной кДНК.
Некоторое время назад группа ученых из немецкого Института экспериментальной вирусологии и иммунологии уже пыталась использовать инструмент редактирования геномов для удаления ВИЧ из культуры HeLa [15]. Они модифицировали Cre-рекомбиназу методом направленной эволюции и один из полученных вариантов использовали для удаления вируса путем контролируемой рекомбинации [16]. Однако надо учитывать, что между Т-хелперами и опухолевой HeLa есть немало различий, к тому же, авторы не предлагают вариантов доставки или экспрессии гена Tre-рекомбиназы (усовершенствованный вариант фермента Cre).
С другой стороны, группа американских исследователей опубликовала в марте этого года статью [17], где подробно описывались метод доставки и механизм удаления вируса. Ученые ставили перед собой задачу не только полностью избавить клеточную культуру Т-хелперов от вируса, но и проверить отсутствие цитотоксического действия самой CRISPR/Cas9 системы. Единственный недостаток этого геномного инструмента в том, что из-за сравнительно небольшой длины спейсера, даже при наличии страхующего элемента PAM, в больших геномах могут быть найдены нецелевые сайты, подверженные разрезанию (off-target sites). Именно поэтому исследователи уделяли данной проблеме немало внимания.
Работа проводилась с использованием штамма ВИЧ-1 и клеточной линии Т-хелперов 2D10, зараженной вирусом в покоящейся стадии. Доставка и экспрессия sgРНК/Cas9 осуществлялась с помощью лентивирусного вектора.
Для оценки того, вырезался ли вирус из двух мест встраивания (1-я и 16-я хромосомы), было проведено полногеномное секвенирование. Оно показало, что в клетках, где экспрессировались и гены Cas9, и sgРНК, провирусная ДНК отсутствует.
Был проведен анализ того, могут ли гены, куда встроился провирус (RSBN1 и MSRB1), и близлежащие гены нормально транскрибироваться после его вырезания. Ученые показали, что как RSBN1, так и MSRB1 нормально экспрессируются. Соседние гены также не претерпели изменений.
С помощью биоинформатических методов и анализа баз данных было показано, что sgРНК/Cas9 не проявляет активности по отношению к нецелевым сайтам.
Таким образом, можно с уверенностью сказать, что группа Камински впервые успешно удалила ВИЧ из культуры зараженных Т-хелперов. Данное достижение приблизило человечество к победе на ВИЧ. Да, это только культура клеток. Да, до внедрения данной техники в медицину пройдут годы, а может и десятки лет, но данная работа является уникальной в своем роде, ибо ученые не только бросили вызов одному из страшнейших заболеваний на планете, но и смогли победить его — пусть даже масштаб сражения пока невелик.
Перспективы применения данной технологии очевидны: введя пациенту вектор, содержащий гены Cas9 и sgРНК, мы добьемся их экспрессии и полного удаления вируса из клеток. Современная терапия, направленная против ретровирусов, являющаяся основным средством борьбы с ВИЧ, не удаляет вирус из клеток, так как провирус остается встроенным в ДНК хозяина. В свою очередь, данный подход не оставляет вирусу шансов укрыться.

Группа ученых из Гладстона и их коллег из Xyphos Biosciences Inc. описала новый способ обнаружения и уничтожения в организме клеток, пораженных ВИЧ. Работа, опубликованная на этой неделе в журнале Cell, рассказывает о модифицированной версии технологии CAR-T, известной своими недавними успехами в борьбе с раком крови. Благодаря ряду усовершенствований, обеспечивающих большую широту охвата и универсальность, новая технология ConvertibleCAR продемонстрировала большие перспективы в борьбе с ВИЧ, подтвердив, что ее можно использовать для сокращения числа клеток, образующих вирусный резервуар.
Скрытый резервуар является основным барьером на пути к искоренению ВИЧ / СПИДа, и борьба с ним – давняя цель многих ученых, в том числе д-ра Уорнера С. Грина, директора Центра исследований по лечению ВИЧ-инфекции в Институте Гладстона.
Использование технологии может быть весьма многообещающим, однако сейчас ее разработка находятся лишь на ранней стадии.
Обычные клетки CAR-T оказались чрезвычайно эффективны в борьбе с раком крови, в частности, некоторыми типами лимфом и лейкемии у детей.
Однако в качестве терапии ВИЧ-инфекции они оказались далеко не так успешны.
ВИЧ – патоген, чрезвычайно быстро изменяющий свою форму и способный со временем выработать устойчивость к терапии одним лекарственным средством. Ввиду этого инфицированный человек вынужден принимать сразу несколько препаратов, имеющих различные векторы воздействия на вирус.
Вместо того чтобы изготавливать отдельную ячейку CAR для каждой цели, ученые теперь могут управлять одной ячейкой ConvertibleCAR и комбинировать ее с выбранными MicAbody.
Но будет ли технология работать на чем-то, кроме рака крови, для которого она была первоначально разработана?
Мощная комбинация
Но одних только bNAb недостаточно, чтобы уничтожить пораженные ВИЧ клетки. Необходимы также Т-клетки-киллеры, и проблема для пациентов с ВИЧ заключается в том, что их Т-киллеры крайне истощены или их латентный резервуар содержит вирусы, устойчивые к этим клеткам.
Херциг и Грин рассуждали, что, комбинируя bNAb и конвертируемые клетки CAR, они смогут получить необходимое им оружие.
Они принимали участие в совместной работе с учеными из Xyphos, целью которой было создать MicAbody на основе bNAb и протестировать конвертируемые клетки CAR в сочетании с Mic-bNAb на различных образцах.
Результаты оказались превосходными: клетки ConvertibleCAR в сочетании с Mic-bNAb целенаправленно уничтожали инфицированные CD4 T-клетки, не трогая здоровые. При этом необходимый эффект наблюдался только в сочетании с Mic-bNAb. Они уничтожали CD4 Т-клетки, пораженные различными штаммами вируса.
Интересно, что сочетание Mic-bNAb и MicAbody, направленное на раковые клетки, ConvertibleCAR способен эффективно бороться как с раком, так и с ВИЧ.
Другими словами, ConvertibleCAR продемонстрировал ожидаемую от него универсальность и специфику.
Наконец, Херциг и Грин проверили, способна ли трансформируемая платформа CAR / Mic-bNAb атаковать скрытый резервуар в крови ВИЧ-позитивных на АРВТ.
Перспективы
Тем не менее, все еще остается достаточно много препятствий внедрения технологии в клиническую практику.
Кроме того, клетки ConvertibleCAR, полученные в лаборатории, способны вызывать нежелательные иммунные ответы у хозяина, если они получены не из собственных клеток пациента. Это делает технологию крайне дорогой. В настоящий момент специалисты изучают варианты с универсальными донорскими клетками, генетически модифицированными, чтобы избежать иммунной атаки или отторжения организмом пациента. Эта работа может привести к созданию единой клетки ConvertibleCAR для всех пациентов, всех мишеней и множества заболеваний.
Благодаря этим достижениям, перспективы ConvertibleCAR в сочетании с bNAb неоспоримы.
Систематика вируса иммунодефицита человека
Царство Вирусы .
Семейство Retroviridae .
Подсемейство Lentivirus .
В настоящее время выделено 2 типа вируса иммунодефицита человека (ВИЧ):
ВИЧ-1 - это основной возбудитель ВИЧ-инфекции; основные места распространения - Северная и Южная Америка, Европа и Азия.
ВИЧ-2 - это менее вирулентный аналог ВИЧ-1, редко вызывает типичные проявления синдрома приобретенного иммунодефицита и не так широко распространен. Впервые выделен Монтанье из крови выходцев из Гвинеи с подтвержденным диагнозом синдрома приобретенного иммунодефицита. В эволюционном плане ВИЧ-2, безусловно, родственен ВИЧ-1. Место распространения - преимущественно Западная Африка.
Кроме того, был обнаружен вирус иммунодефицита обезьян (ВИО). ВИЧ-2 по серологическим (иммунологическим) свойствам занимает промежуточное положение между ВИЧ-1 и ВИО. Возможно, что они произошли от общего предка, а затем эволюционировали самостоятельно.
История открытия вируса иммунодефицита человека
Выявлен вирус синдрома приобретенного иммунодефицита был следующим образом.
5 июня 1981 года в ряде крупных городов США была зарегистрирована вспышка инфекционного заболевания, вызываемого Pneumocystis carinii - грибком, который при нормальном состоянии иммунитета не вызывает заболевания.
В ходе проверки выяснилось, что заболевание распространяется среди лиц, которые имели интимные контакты с инфицированным человеком. В основе ранее неизвестного заболевания лежало резкое ослабление иммунитета. Неизвестную ранее форму подавления работы иммунной системы стали обозначать как синдром приобретенного иммунодефицита.
Ретроспективный анализ сывороток, хранящихся в Национальном Центре контроля за инфекционными заболеваниями, показал, что первые случаи синдрома приобретенного иммунодефицита у человека относятся к 50-м годам нашего столетия, и, что заболевание возникло в Африке, а затем распространилось на территории Европы и США.
По данным Всемирной организации здравоохранения на конец 2000 года со времени открытия вируса иммунодефицита человека от СПИДа умерло почти 22 млн. человек, число инфицированных перевалило за 36 млн. Сейчас можно говорить о пандемии ВИЧ-инфекции.
Строение вируса иммунодефицита человека
Вирус иммунодефицита человека относится к сложным вирусам, то есть имеет суперкапсид сферической формы, образованный двойным липидным слоем с гликопротеиновыми "шипами". "Шипы" образованы гликопротеином gp 160 (gp - glycoprotein; 160 - молекулярная масса белка в килодальтонах), состоящим из 2 субъединиц.
gp 120 - высокоиммуногенный белок, содержащий консервативные и гипервариабельные участки, а также область, связывающую молекулу CD4 Т-лимфоцитов (рецептор Т-хелперов). Белок gp 120 расположен на поверхности вируса.
gp 41 - пронизывает липидный бислой насквозь и нековалентно связан с gp 120. Он обусловливает слияние вируса с Т-лимфоцитом (после того как gp 120 связался с CD4). Кроме того, gp 41 может опосредовать проникновение вируса в клетки с дефицитом рецепторов CD4.
Под суперкапсидом расположен матриксный белок p 17 (p - протеин).
Глубже всего располагается сердцевина, имеющая форму усеченного цилиндра - это нуклеокапсид.
Капсид образует белок p 24.
Внутри капсида находится геном вируса, представленный двумя идентичными нефрагментарными нитями РНК+, соединенными вблизи их 5' концов.
Белки р9 и р7 связывают нуклеиновые кислоты (структурные белки);
B состав ВИЧ входят следующий ферменты:
Собственно геном вируса состоит из 9 генов, часть которых перекрывается между собой и имеет экзон-интронную структуру. 9 генов вируса контролируют синтез 9 структурных и 6 регуляторных белков.
Группы риска инфицирования вирусом иммунодефицита человека
Клетки, ткани и органы, которые поражает вирус иммунодефицита человека
Проникая в кровяное русло, вирус иммунодефицита человека инфицирует активированные CD4+ Т-лимфоциты, а также моноциты, макрофаги и родственные им клетки, экспрессирующие CD4-подобные молекулы. Инфицирование также возможно при фагоцитозе иммунных комплексов ВИЧ+Ат (антитело).
Основной резервуар вируса иммунодефицита человека - это лимфоидная ткань.
В центральной нервной системе поражаются клетки микроглии.
Поражаются также клетки эпителия кишечника (в данном случае рецепторами для проникновения вируса иммунодефицита человека служат мембранные гликолипиды). Кишечная инфекция может вызвать хроническую диарею, типичную для синдрома приобретенного иммунодефицита.
Механизм взаимодействия вируса иммунодефицита с клеткой
Проникнув в организм,
Инфекционная фаза репродукции
Сначала вирус распознает CD4 рецепторы с помощью своего белка gp 120.
Далее следует рецепторопосредованная адсорбция вируса на клетке.
Потом образуется окаймленная ямка, окаймленный пузырек, рецепторсома.
Далее происходит раздевание вириона - мембрана вириона сливается с мембраной рецепторсомы, и нуклеокапсид, освобожденный от суперкапсида, выходит в цитоплазму.
На пути к ядру нуклеокапсид разрушается, и высвобождается геномная РНК и ассоциированные с ней белки.
РНК с ферментами проникают в ядро.
Собственно фаза репродукции.
Обратная транскриптаза синтезирует на вирионной РНК минус цепь ДНК:
РНК+ => ДНК- РНК+
РНК-аза Н разрушает вирионную РНК:
ДНК- РНК+ => ДНК-
Вирусная ДНК-полимераза синтезирует плюс цепь ДНК:
ДНК- => ДНК- ДНК+
На обоих концах этой двухцепочечной ДНК находятся длинные концевые повторы нуклеотидов (LTR - long terminal repeat).
Какое-то время ДНК-провирус может находиться в неактивной форме, но рано или поздно с помощью своей эндонуклеазы он встраивается в хромосому клетки - мишени.
Интегрированный провирус находится в неактивном состоянии до тех пор, пока данный Т-лимфоцит не будет активирован микробными антигенами или другими иммунокомпетентными клетками.
При активации и пролиферации Т-лимфоцитов и моноцитов в большом количестве вырабатывается ДНК-связывающий белок.
ДНК-связывающий белок связывается с определенными последовательностями клеточной ДНК и сходными последовательностями LTR ДНК-провируса.
Таким образом индуцируется транскрипция как клеточной ДНК, так и ДНК провируса. При этом ДНК провируса переходит из неактивного состояния в активное, а инфекция - из персистентной в продуктивную.
Пребывание вируса в неактивном состоянии может продолжаться очень долго. С момента инфицирования вирусом клетки начинается период вирусоносительства, который может продолжаться 10 и более лет. С момента активации вируса начинается сама болезнь.
Транскрипция вируса носит сложный характер. Она включает в себя:
- образование РНК
- сплайсинг мРНК
Далее происходит трансляция структурных и регуляторных белков.
Затем транслируются полипептиды разной длины. От одного из них отщепляется протеаза, которая разрезает полипептиды на несколько частей: белки p17, р24, р7, р9, молекулу полимеразного комплекса и молекулу эндонуклеазы.
Белки р7, р9 и р24 проникают в ядро.
Белки р7 и р9 связываются с 2 молекулами вирусной РНК и белками - ферментами. Образуется нуклеокапсид.
Белок р24 покрывает нуклеокапсид и придает сердцевине форму усеченного конуса.
Белок р17 проникает в ядро и вытаскивает оттуда нуклеокапсид, транспортируется к клеточной мембране и заякоривается в месте, где его ожидают гликопротеиды gp41 и gp120.
Затем вирус отпочковывается.
Все начинается с начала.
В патогенезе можно выделить несколько стадий.
Ранняя вирусемическая стадия
На ранних стадиях инфекции вирус реплицируется очень слабо в различные промежутки времени. Можно обнаружить уменьшение CD4 + клеток и возрастание количества циркулирующих ВИЧ-инфицированных CD4 Т-лимфоцитов. Растворимый р24 антиген может быть выявлен в кровотоке не ранее, чем через 10 суток после заражения. Виремия достигает пика к 20-ым суткам после заражения. К этому времени в крови появляются специфические антитела.
Анализ лабораторных данных долгоживущих пациентов показывает, что в редких случаях ВИЧ может элиминироваться из организма.
Одним из факторов резистентности считается особенность генетической конституции индивидуума (особенности главного комплекса гистосовместимости).
Важную роль может играть локализация первичного проникновения вируса иммунодефицита человека. Например, попадание низких доз вируса на слизистые оболочки может привести к развитию местных иммунных реакций при повторных контактах с возбудителем.
В некоторых случаях долгоживущие индивидуумы бывают заражены штаммами с пониженной патогенностью.
Бессимптомная стадия
В течение 10 - 15 лет у ВИЧ инфицированных можно не обнаружить никаких симптомов болезни. В этот период защитные системы организма более или менее эффективно сдерживают репродукцию возбудителя.
Гуморальные реакции: синтез антител.
Нейтрализующие антитела против gp41 и gp120 ингибируют вирус иммунодефицита человека. Скорость развития синдрома приобретенного иммунодефицита и смертность среди индивидуумов,
Антитела, обусловливающие реакции антителозависимой цитотоксичности, реагируют с gp 160, экспрессируемыми на мембране инфицированных клеток.
Амплифицирующие (усиливающие) антитела реагируют с gp 41 и усиливают инфекционность вируса иммунодефицита человека по неизвестному механизму.
Клеточные иммунные реакции осуществляются за счет CD 8+ Т-лимфоцитов (цитотоксических лимфоцитов).
Иммуносупрессия
Активация Т-лимфоцитов и прогрессирующее уменьшение количества CD 4+ лимфоцитов.
Активации Т-лимфоцитов способствуют:
сопутствующая инфекция (например, венерические заболевания);
некоторые вирусные компоненты могут действовать как антигены и непосредственно активировать Т-лимфоциты;
потребление кокаина может усиливать репликацию вируса иммунодефицита человека.
Усиленная репликация вируса иммунодефицита человека снова приводит к волне вирусемии, выявляемой не более чем за 14 мес. перед клиническим развитием СПИДа. Со второй волной виремии совпадает падение уровня антител.
Уменьшение количества Т-лимфоцитов. Причины:
цитопатический эффект, вызванный репликацией вируса;
образование синцитиев (на мембранах Т-клеток происходит экспрессия gp 120 => CD 4 лимфоциты связываются с gp 120 => происходит слияние мембран и образование синцитиев);
иммунный ответ (цитотоксические лимфоциты уничтожают Т-хелперы с gp 120 на мембране);
сопутствующая инфекция (например, цитомегаловирус) стимулирует репликацию ВИЧ и гибель клеток;
инфицирование клеток-предшественников приводит к отсутствию регенерации и уменьшению пула CD 4 Т-лимфоцитов.
Другие факторы, вносящие свой вклад в развитие иммунодепрессии при СПИДе:
снижение числа Т-хелперов приводит к потере активности других клеток иммунной системы;
циркулирующие иммунные комплексы Аг+Ат ингибируют развитие иммунных реакций, так как связываются с CD 4 - рецептором Т-хелперов и блокируют их активацию.
Супрессия гуморальных иммунных реакций и стимуляция аутоиммунных реакций:
антитела к gp 120 могут связываться и с главным комплексом гистосовместимости, так как эти антигены обладают определенным сходством.
Механизмы, позволяющие ВИЧ избегать иммунологического надзора
ВИЧ может избегать действия иммунных механизмов за счет интеграции в геном клетки-хозяина и минимальной экспрессии вирусных генов.
Выделено большое количество подтипов ВИЧ. Вирусы мутируют очень часто, так как обратная транскриптаза ВИЧ работает с ошибками и лишена корригирующей активности.
Читайте также:


