Effects of salmonella typhimurium
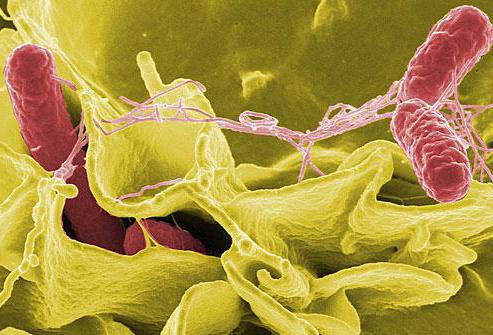
Бактерия сальмонелла тифимуриум известна в медицине как Salmonella enterica serovar typhimurium. Она является грамотрицательной, палочковидной бактерией со жгутиками (фиолетовыми волосковидными структурами), с помощью которых этот микроорганизм передвигается.
Названная бактерия - основная причина пищевого отравления (сальмонеллеза) у людей. Инфицирована ею бывает чаще всего свинина, мясо домашней птицы, яйца. Домашние животные ее тоже могут передавать.
Как сальмонеллы классифицируются?
Итак, нас интересует сальмонелла тифимуриум - возбудитель такого опасного недуга как сальмонеллез. Вид salmonella enterica имеет в своем составе 6 подвидов:
Подвид salmonella enterica enterica включает следующие серогруппы:
- A (paratyphi A).
- B (derby, typhimurium, agona, heidelberg).
- С (cholerae suis, newport, muenchen, virchowinfantis).
- D (dublin, enteritidis, rostock, sendai, typhi).
- E (anatum).
Сальмонелла тифимуриум (S. typhimurium)

Вид enterica считается патогенным для человека и животных, а также птиц, но наиболее значимы для человека лишь несколько из них. И большинство случаев сальмонеллеза приходится на S. typhimurium.
Многие штаммы сальмонелл устойчивы к современным антибиотикам, и поэтому распространяются по всему миру. Так, внутрибольничный сальмонеллез - серьёзная проблема в настоящее время. А в 80 % случаев возбудитель нозокомиального (внутрибольничного) сальмонеллеза - это S. typhimurium.
Факторы патогенности
Течение и опасность упомянутого заболевания обуславливают следующие факторы патогенности:
- Жгутиками обеспечивается быстрое передвижение микроорганизма.
- Капсулой бактерия защищается от фагоцитов. А из-за неполноценности фагоцитоза развивается сепсис.
- Особенность инвазии делает ее проникновение беспрепятственным в глубоколежащие ткани.
- По причине хорошей адгезии (крепления), обеспечивающейся фибриллами, пектинами, ЛП-сахаридным комплексом, бактерия удерживается в организме.
- Экзотоксины (продукты ее жизнедеятельности) формируют диарею с дальнейшим обезвоживанием, быструю сосудистую проницаемость.
- Эндотоксин выделяется на фоне разрушающего фагоцитоза. Это липополисахаридный комплекс, который формирует интоксикацию. Агрегация тромбоцитов в мелких капиллярах приводит к воспалению, наблюдается ДВС-синдром. А секреция Na и Cl приводит к сокращению гладкой мускулатуры и усилению перистальтики кишечника.
Насколько устойчивы бактерии?
Сальмонеллы тифимуриум имеют устойчивость к различным факторам внешней среды:
- Три месяца они сохраняются при комнатной температуре предметами обихода.
- Четыре года хранятся в сухих испражнениях животных.
- Пять месяцев - в воде, полгода - в молочных продуктах и мясе, на яичной скорлупе - до месяца.
- Гибель наступает только при 100°С. В мясных продуктах устойчивость к высокой температуре возрастает (полкило мяса необходимо кипятить на протяжении двух часов, только после этого оно будет безопасно). При помощи соления и копчения сальмонеллу не убить.
- Данный возбудитель выдерживает понижение температуры до -80°С.
- Он устойчив к ультрафиолету.
- Дезинфицирующее средство требуется выдерживать 20 минут, чтобы уничтожить бактерию.
Вспышки заболеваемости сальмонеллезом наблюдается в летнее время, чаще диагностируется у маленьких детей из-за несовершенства их иммунной системы.
Патология передается алиментарным путем, также контактным и контактно-бытовым. Кстати, важно при употреблении яиц обращать внимание на вид белка и желтка. При замутнении, кровоизлиянии, тухлом запахе, яйцо, вероятнее всего, заражено. Его нужно выбросить, посуду залить хлором, руки также им обработать. Мыло в этих случаях не помогает.
Зимние вспышки, высокая летальность и контактно-бытовой механизм передачи происходят по причинам антибиотикоустойчивости и из-за того, что продовольственное обеспечение централизовано.
Инкубационный период
Инкубационный период длится от шести часов до восьми суток, но чаще всего первые симптомы появляются уже в первые сутки-двое после употребление в пищу зараженного продукта.
Болезнь начинается остро, характеризуется слабостью, вялостью, умеренными болями в животе (область эпигастрия и пупка). Живот болезнен при пальпации, слышно урчание и заметно вздутие.

Сальмонелла тифимуриум - лабораторная диагностика
На постановку диагноза влияют следующие показатели:
- повышено СОЭ;
- лейкоциты со сдвигом влево;
Возбудитель обнаруживается из биологических сред (испражнений, крови, мочи, поражённых органов) и подозрительных продуктов бактериологическим методом. Окончательный результат, как правило, готов к пятому дню.
При заражении сальмонеллой тифимуриум, симптомы следующие:
Лечение
Данный недуг может иметь летальный исход в младенческом возрасте, у пожилых людей, а также у лиц со сниженным иммунитетом. Этим и опасна сальмонелла тифимуриум.
Терапия должна проходить под строгим наблюдением врача, а в тяжелых случаях применяют реанимационные меры. Из сорбентов для дезинтоксикации организма целесообразно использование следующих препаратов:

Активные в отношении сальмонелл salmonella enterica антибиотики

Бактерия сальмонелла тифимуриум известна в медицине как Salmonella enterica serovar typhimurium. Она является грамотрицательной, палочковидной бактерией со жгутиками (фиолетовыми волосковидными структурами), с помощью которых этот микроорганизм передвигается.
Названная бактерия - основная причина пищевого отравления (сальмонеллеза) у людей. Инфицирована ею бывает чаще всего свинина, мясо домашней птицы, яйца. Домашние животные ее тоже могут передавать.
Как сальмонеллы классифицируются?
Итак, нас интересует сальмонелла тифимуриум - возбудитель такого опасного недуга как сальмонеллез. Вид salmonella enterica имеет в своем составе 6 подвидов:
Подвид salmonella enterica enterica включает следующие серогруппы:
- A (paratyphi A).
- B (derby, typhimurium, agona, heidelberg).
- С (cholerae suis, newport, muenchen, virchowinfantis).
- D (dublin, enteritidis, rostock, sendai, typhi).
- E (anatum).
Сальмонелла тифимуриум (S. typhimurium)
Вид enterica считается патогенным для человека и животных, а также птиц, но наиболее значимы для человека лишь несколько из них. И большинство случаев сальмонеллеза приходится на S. typhimurium.
Многие штаммы сальмонелл устойчивы к современным антибиотикам, и поэтому распространяются по всему миру. Так, внутрибольничный сальмонеллез - серьёзная проблема в настоящее время. А в 80 % случаев возбудитель нозокомиального (внутрибольничного) сальмонеллеза - это S. typhimurium.
Факторы патогенности
Течение и опасность упомянутого заболевания обуславливают следующие факторы патогенности:
- Жгутиками обеспечивается быстрое передвижение микроорганизма.
- Капсулой бактерия защищается от фагоцитов. А из-за неполноценности фагоцитоза развивается сепсис.

- Особенность инвазии делает ее проникновение беспрепятственным в глубоколежащие ткани.
- По причине хорошей адгезии (крепления), обеспечивающейся фибриллами, пектинами, ЛП-сахаридным комплексом, бактерия удерживается в организме.
- Экзотоксины (продукты ее жизнедеятельности) формируют диарею с дальнейшим обезвоживанием, быструю сосудистую проницаемость.
- Эндотоксин выделяется на фоне разрушающего фагоцитоза. Это липополисахаридный комплекс, который формирует интоксикацию. Агрегация тромбоцитов в мелких капиллярах приводит к воспалению, наблюдается ДВС-синдром. А секреция Na и Cl приводит к сокращению гладкой мускулатуры и усилению перистальтики кишечника.
Насколько устойчивы бактерии?
Сальмонеллы тифимуриум имеют устойчивость к различным факторам внешней среды:
- Три месяца они сохраняются при комнатной температуре предметами обихода.
- Четыре года хранятся в сухих испражнениях животных.
- Пять месяцев - в воде, полгода - в молочных продуктах и мясе, на яичной скорлупе - до месяца.
- Гибель наступает только при 100°С. В мясных продуктах устойчивость к высокой температуре возрастает (полкило мяса необходимо кипятить на протяжении двух часов, только после этого оно будет безопасно). При помощи соления и копчения сальмонеллу не убить.
- Данный возбудитель выдерживает понижение температуры до -80°С.
- Он устойчив к ультрафиолету.
- Дезинфицирующее средство требуется выдерживать 20 минут, чтобы уничтожить бактерию.
Вспышки заболеваемости сальмонеллезом наблюдается в летнее время, чаще диагностируется у маленьких детей из-за несовершенства их иммунной системы.
Патология передается алиментарным путем, также контактным и контактно-бытовым. Кстати, важно при употреблении яиц обращать внимание на вид белка и желтка. При замутнении, кровоизлиянии, тухлом запахе, яйцо, вероятнее всего, заражено. Его нужно выбросить, посуду залить хлором, руки также им обработать. Мыло в этих случаях не помогает.
Зимние вспышки, высокая летальность и контактно-бытовой механизм передачи происходят по причинам антибиотикоустойчивости и из-за того, что продовольственное обеспечение централизовано.
Инкубационный период
Инкубационный период длится от шести часов до восьми суток, но чаще всего первые симптомы появляются уже в первые сутки-двое после употребление в пищу зараженного продукта.
Болезнь начинается остро, характеризуется слабостью, вялостью, умеренными болями в животе (область эпигастрия и пупка). Живот болезнен при пальпации, слышно урчание и заметно вздутие.
Сальмонелла тифимуриум - лабораторная диагностика
На постановку диагноза влияют следующие показатели:
- повышено СОЭ;
- лейкоциты со сдвигом влево;
Возбудитель обнаруживается из биологических сред (испражнений, крови, мочи, поражённых органов) и подозрительных продуктов бактериологическим методом. Окончательный результат, как правило, готов к пятому дню.
При заражении сальмонеллой тифимуриум, симптомы следующие:
Лечение
Данный недуг может иметь летальный исход в младенческом возрасте, у пожилых людей, а также у лиц со сниженным иммунитетом. Этим и опасна сальмонелла тифимуриум.
Терапия должна проходить под строгим наблюдением врача, а в тяжелых случаях применяют реанимационные меры. Из сорбентов для дезинтоксикации организма целесообразно использование следующих препаратов:
Активные в отношении сальмонелл salmonella enterica антибиотики

Основной причиной распространения микроорганизмов в различных экологических условиях является их способность к адаптации, которая усиливает резистентность к неблагоприятным условиям среды. Данная устойчивость характеризуется: клеточной дифференциацией в специализированных структурах [1] и специфической индукцией генов стресс-ответа, усиливающих метаболическую устойчивость вегетативных клеток [2].
К инфекционным болезням относится большая группа заболеваний, которые вызывают патогенные возбудители. Главное отличие инфекционных заболеваний – контагиозность, т.е. данные болезни передаются от больных людей или животных к здоровым. Для данных болезней характерны специфичность возбудителя, цикличность течения и формирование в процессе болезни иммунитета. Инфекционные заболевания способны к массовому (эпидемическому) распространению [3].
Особое значение уделяется инфекционным поражениям желудочно-кишечного тракта (ЖКТ). Возбудителями данных поражений являются патогенные и условно-патогенные микроорганизмы [4]. Помимо этого, заболевания ЖКТ могут вызываться вирусами и некоторыми протозоа. Общим для этой группы инфекций является орально-фекальный путь заражения (через пищу, воду). В зависимости от особенностей возбудителя инфекции, патогенеза, характера течения и тяжести процесса, определяющих тактику терапии, каждое заболевание в зависимости от этиологии рассматривается отдельно [5, 6].
В настоящее время глобальное распространение сальмонеллеза, рост заболевания, развитие вспышек внутри больниц, антибиотикорезистентность возбудителя, тяжесть течения локализованных форм и высокая летальность при генерализованных формах служат причиной многочисленных исследований.
Целью исследования является изучение влияния дикого Salmonella typhimurium 14028S WT и генномодифицированного штаммов Salmonella typhimurium 14028S ΔluxS на организм лабораторных животных. В данной работе представлены данные по определению количества колониеобразующих единиц (КОЕ) S. typhimurium 14028S ΔluxS, S. typhimurium 14028S WT в фекалиях и крови лабораторных животных
В качестве объектов исследования нами использовались: S. typhimurium 14028S WT – дикий штамм, S. typhimurium 14028S ΔluxS – в данном штамме вырезан ген luxS, который отвечает за кодирование белка LuxS (синтаза аутоиндукторов II типа) и белка S-рибозилгомоцистеинлиазы (семейство углерод-сералиаз, катализирует реакцию расщепления S-(5-дезокси-D-рибозил-5)-L-гомоцистеина).
В качестве модели in vivo в эксперименте были использованы лабораторные крысы линии Wistar в количестве 27 штук. Животные отбирались в соответствии общепринятых принципов подбора аналогов сходных по возрасту (четырехмесячные крысы), физиологическому состоянию, питанию и поведению, находившиеся в пределах физиологической нормы животных, живой массе (от 200 до 250 грамм), пол лабораторного животного – самцы.
Крысы являются одними из основных экспериментальных систем в биологических и медицинских исследованиях. За долгие годы были выведены специальные лабораторные крысы. Благодаря быстрому метаболизму, неагрессивности и неприхотливости они до сих пор остаются одним из основных объектов во многих отраслях биологии.
Область использования: токсикологические исследования, изучение вопросов питания, стандартизация гормональных препаратов, различные исследования, а также изучение опухолей и инфекционных заболеваний.
Так как механизм передачи сальмонеллеза является фекально-оральным, а основной путь передачи – пищевым, то очагами воспаления этого заболевания являются селезенка, печень.
Для решения поставленной задачи использовали метод определения КОЕ исследуемых микроорганизмов в фекалиях на протяжении всего эксперимента (с 1 по 12 сутки исследования).
Перед проведением количественных высевов определяли массу образца(ов) из каждой группы и помещали их в пробирки Эппендорф, содержащие изотонический раствор хлорида натрия в объеме, соответствующем весу образца. Далее производилась гомогенизация на приборе TissueLyser LT (QIAGEN – фирма производитель) с использованием металлических шариков при 20 оборотах/мин в течение 30 секунд. Затем мы проводили осаждение непереваренных остатков пищи на приборе Вортекс. После осаждения отбирали надосадочную жидкость, которую высевали на среду Плоскирева в чашках Петри, в разведениях с 10-1 по 10-4.
После инкубации чашек Петри с посевом суспензий фекальных масс в течение суток при температуре 37 °С определяли число выросших колоний и подсчитывали количество КОЕ.
Штаммы бактерий Salmonella typhimurium вводили перорально в дозе 5 × 108 КОЕ/мл. Убой животных производили на 3, 6, 9 и 12 сутки после заражения путем декапитации, предварительно усыпляя диэтиловым эфиром. Забор крови осуществляли путем сбора с места зареза для последующего изучения биохимических показателей.
Вскрытие производилось следующим образом. Труп животного переворачивали на спину, лапы растягивали и фиксировали, шерсть передней половины туловища обрабатывали дезинфектантом, делали ножницами продольный разрез вдоль белой линии живота к конечностям. Кожу отпрепаровывали скальпелем. Вскрывали брюшную полость от разреза под линией диафрагмы до лонной кости, заменив инструменты. В качестве материала, содержащего бактерии, из брюшной полости забирали кусочки печени и селезенки.
Отобранные органы помещали в стерильную ступку, тщательно растирали пестиком, добавляли стерильный физиологический раствор и смешивали в гомогенную суспензию. Количество физиологического раствора зависит от взвешенного кусочка органа. Полученную суспензию дозатором помещали на среду ЭНДО и шпателем Дригальского растирали до полного впитывания. Посевы инкубировали при 37 °С в течение 24 ч. После этого производили учет результатов выросших колоний. На среде ЭНДО колонии Salmonella typhimurium имели вид нежно-розовых колоний.
На первом этапе нашего исследования мы проводили отбор фекалий для бактериологического анализа и делали высевы из разведений на среду Плоскирева.
По данным графика видно, что пиковая концентрация в группе, где применялся штамм S.typhimurium 14028S с удаленным геном ΔluxS (О2), была достигнута на первый день эксперимента, в группе же, где в качестве инфекционного агента применялся дикий штамм S. typhimurium 14028S WT (О1), максимальная концентрация достигалась на вторые сутки исследования. В дальнейшем концентрация в обеих опытных группах снижалась: в группе О1 минимальная концентрация фиксировалась на шестые сутки, вплоть до 12 дня эксперимента она находилась в пределах минимума; в группе О2 снижение концентрации было плавным, минимальное ее значение достигалось только на 12 сутки.
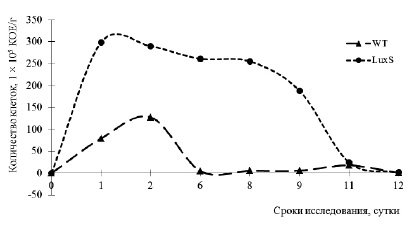
Динамика изменения КОЕ в фекалиях экспериментальных животных
Исходя из выше изложенного, можно сделать предположение о том, что в организме лабораторных животных в первые сутки шло активное размножение микроорганизмов с дальнейшей активацией процессов иммунной системы.
Изменение уровня патогенности и вирулентности различных микроорганизмов связано с различными факторами окружающей и внутренней среды макроорганизма, а также обусловлены мутациями уже хорошо изученных штаммов микроорганизмов. В данной работе было рассмотрено влияние на организм дикого Salmonella typhimurium 14028S WT и генномодифицированного штаммов Salmonella typhimurium 14028S с удаленным геном ΔluxS по средству оценки показателей крови экспериментальных животных, а также на основании выделения микроорганизмов из внутренних органов и фекалий. Проведенные исследования позволили сделать следующий вывод: установлено, что оба исследуемых штамма – Salmonella typhimurium 14028S WT и Salmonella typhimurium 14028S Δ luxS приводят к развитию генерализованной инфекции с максимальным поражающим эффектом на 6 день исследования, о чем свидетельствует выделение вышеперечисленных микроорганизмов из крови, печени, селезенки и фекалий.
Изобретение относится к ветеринарной микробиологии. Штамм бактерий Salmonella typhimurium 14 обладает морфологическими, культуральными и ферментативными свойствами, присущими роду сальмонелла. По серологическим свойствам предложенный штамм агглютинируется с сальмонеллезными монорецепторными сыворотками 04 (1 и 2 комплекс) Н-I. Штамм является продуцентом эндотоксина и гемолизина. Штамм имеет белковую структуру. Нуклеотидный состав ДНК (% ГЦ) - 53,1. Содержит плазмиды с м.в. 64 МД. Лизируется с сальмонеллезным поливалентным бактериофагом. Вирулентность ЛД50 для белых мышей внутрибрюшинно 1,7х10 6 живых микробных клеток. Патогенен для телят, при заражении в концентрации 10 млрд. м.к. на 2 сутки отмечают профузный понос, а на 3-4 сутки - гибель животного. Концентрация микробных клеток при выращивании штамма составляет 40-50 млрд. м.к. по оптическому стандарту мутности ГИСК, защитный эффект от заражения вирулентными штаммами наступает на 5-7 сутки. Штамм пригоден для изготовления вакцин против сальмонеллеза животных, а также диагностических препаратов и для получения гипериммунных лечебных сывороток и глобулинов.
Изобретение относится к области ветеринарной микробиологии, в частности к получению штамма Salmonella typhimurium, пригодного для использования в вакцинах и диагностических препаратах против сальмонеллеза сельскохозяйственных животных.
Сальмонеллез крупного рогатого скота - инфекционная болезнь, характеризующаяся явлениями бактериемии, токсемии, абортами или рождением нежизнеспособного молодняка. Наиболее подвержен молодняк в возрасте 10-30 дней. При остром течении у молодняка проявляется угнетение, отказ от корма, повышение температуры до 41 o С, затем парезы передних конечностей и при несвоевременном лечении через 36-48 ч наступает смерть. При затяжном течении болезни на 2-3 сутки у телят появляется диарея.
Заболевание распространяется по типу энзоотии, нарастает постепенно и длительное время держится на высоком уровне. Нередко переболевают до 80-90% телят при уровне летальности 20-80%.
Ущерб складывается из затрат на лечение, гибели молодняка.
Заболевание регистрируется во всех регионах страны, в связи с этим становится очевидным актуальность борьбы с данным заболеванием.
Известен штамм Salmonella typhimurium ВГНКИ 3 для изготовления "Вакцины против сальмонеллеза молодняка". Накопление микробных клеток (м.к.) штамма в вакцине составило 30-45 млрд. в 1 см 3 [1].
Известен также штамм Salmonella typhimurium 159, который используется для изготовления "Инактивированной эмульсин-вакцины против сальмонеллеза телят".
Штамм Salmonella typhimurium 159 обладает следующими свойствами: Культурально-морфологические признаки. Грамотрицательные, подвижные, мелкие, слегка изогнутые палочки, формирующие на МПА выпуклые колонии 1-3 мм в диаметре, прозрачные или беловатого цвета. Хорошо растут на обычных питательных средах, на МПБ образуют пленку и пристеночное кольцо.
Физико-биологические свойства. Аэроб, способный расти в микроанаэробных условиях. Оптимум рН 7,2 при температуре 37 o С.
Ферментативные свойства. Не изменяет молоко, не разжижает желатин, не выделяет индол, не разлагает мочевину; выделяет сероводород, сбраживает глюкозу, маннит, сорбит, арабинозу, инозит, мальтозу с образованием кислоты; лактозу и сахарозу не сбраживает; имеет ферменты лизиндекарбоксилазу и орнитиндекарболазу.
Агглютинирующие свойства. Агглютинируется сальмонеллезными сыворотками: "О" - 1, 4, 5, 12; Н-I; 1, 2.
Патогенные свойства. Патогенен для белых мышей: ЛД50 составляет 5х10 3 клеток при внутрибрюшинном заражении [2].
В задачу наших исследований входило получить штамм Salmonella typhimurium, обладающий стабильно низкой остаточной вирулентностью, высокой иммуногенностью и пригодный для использования в приготовлении вакцин против сальмонеллеза телят и пушных зверей, а также для диагностических препаратов.
Предложенный штамм Salmonella typhimurium 14 - возбудитель сальмонеллеза - отнесен к семейству Enterobacteriaceae, к роду Salmonella, выделен в НИЛ инфекционной патологии и биотехнологии из органов поросенка в 1988 г. в свинокомплексе "Ефремовский" Тульской обл.
Предложенный штамм депонирован 27 апреля 2001 г., регистрационный номер - "штамм Salmonella typhimurium 14 - МГАВМиБ - ДЕП" во Всероссийской государственной коллекции штаммов микроорганизмов, используемых в ветеринарии и животноводстве (123022, Россия, Москва, Звенигородское шоссе, 5, ВГНКИ).
Местом хранения производственного штамма Salmonella typhimurium 14, возбудителя сальмонеллеза телят, определена коллекция НИЛ инфекционной патологии и биотехнологии МГАВМиБ им. К.И. Скрябина (109472, Москва, ул. Ак. Скрябина, 23), дублирующее хранение НИИ микробиологии МО РФ (610024, Россия, г.Киров, Октябрьский пр., 121, в/ч 23527).
Предложенный производственный штамм Salmonella typhimurium 14 обладает следующими свойствами: Морфологические, культуральные и ферментативные свойства. Грамотрицательные подвижные полиморфные палочки, образуют полупрозрачные S-формы колонии через 18-24 ч роста на плотной питательной среде при температуре 36-38 o С.
Ферментативная активность. Ферментирует с образованием кислоты и газа глюкозу, рамнозу, сорбит, маннит, не ферментирует лактозу, сахарозу, мальтозу, инозит, не гидролизует мочевину, образует сероводород, не образует индол и ацетилметилкарбинол в реакции Фогес-Проскауэра.
Серологические свойства. Агглютинируется с сальмонеллезными сыворотками 04 (1 и 2 комплекс) и H-I.
Токсигенность. Штамм является продуцентом эндотоксинов и гемолизинов.
Вирулентные свойства. Вирулентность ЛД50 для белых мышей внутрибрюшинно 6 живых м.к.
Патогенен для телят. При пероральном заражении телят 10 млрд. м.к. на 2-3 сутки отмечают профузный понос, а гибель животных наступала на 2-4 сутки, с характерными для сальмонеллеза паталогоанатомическими изменениями.
Нуклеотидный состав ДНК (% ГЦ) - 53,1.
Содержит плазмиды с м.в. 64 МД.
Лизируется с сальмонеллезным поливалентным бактериофагом.
Применяемый способ хранения и поддержания штамма. В лиофилизированном состоянии под вакуумом в герметично запаянных ампулах при минус 18-20 o С после пассажа через организм белых мышей.
Периодичность пересева на питательных средах 15-20 суток.
Условия транспортировки. В лиофилизированном состоянии под вакуумом в герметично запаянных ампулах.
Срок хранения 10 лет.
Пример. Штамм Salmonella typhimurium 14 выращивают в реакторах в казеиновом бульоне. Посевная доза составляет 150-300 млн. м.к. на 1 см 3 питательной среды.
Культивирование проводят в течение 16-18 часов при температуре 36-37 o С при постоянном перемешивании и интенсивной аэрации из расчета объем стерильного воздуха на объем среды в минуту (в соотношении 1:3).
Концентрация микробных клеток через 16-18 ч составляет 40-50 млрд. м.к. по оптическому стандарту мутности ГИСК им. К.А. Тарасовича, что дало возможность применить штамм для изготовления вакцины против сальмонеллеза сельскохозяйственных животных и пушных зверей.
Вакцина, изготовленная с использованием предложенного штамма, обеспечивает 90%-ный защитный эффект от заражения вирулентными эпизоотическими штаммами на 5-7 сутки.
Вакцина из производственного штамма Salmonella typhimurium 14 апробирована с положительным результатом с 1995 по 2001 гг. на территории России и стран СНГ: Беларусь, Кыргызстан, Узбекистан и др. на 11550 головах стельных коров, 7290 супоросных свиноматок, 4270 овцематок, 2290 пушных зверей.
Сохранность поголовья составляет 96-99%.
Предложенный штамм может быть использован для производства сальмонеллезных вакцин и диагностикумов, а также для получения гипериммунных лечебных сывороток и глобулинов.
Источники информации: 1. Патент РФ 1197187, кл. A 61 K 39/112, 1998 г.
2. Патент РФ 2154495, кл. A 61 K 39/112, C 12 N 1/20, 2000 г.
Штамм бактерий Salmonella typhimurium ВГНКИ 14 - МГАВМ и Б-ДЕП, используемый для изготовления вакцин и диагностических препаратов.
























Effects of the hisT Mutation of Salmonella typhimurium on Translation .
JOURNAL OF BACTERIOLOGY, Jan. 1983, p. 357-363 0021-9193/83/010357-07$02.00/0 Copyright C 1983, American Society for Microbiology
Effects of the hisT Mutation of Salmonella typhimurium on Translation Elongation Rate DONNA T. PALMER, PAUL H. BLUM, AND STANLEY W. ARTZ* Department of Bacteriology, University of California, Davis, California 95616 Received 30 August 1982/Accepted 19 October 1982
The hisT mutation in Salmonella typhimurium which results in loss of pseudouridine base modifications in the anticodon regions of many tRNAs was shown to reduce the rate of protein synthesis in vivo by about 20 to 25% as compared with that measured in hisl+ strains. Reduced protein synthesis rate occurred predominantly at the level of translation rather than transcription. Increased sensitivity of hisT mutants to growth inhibition by antibiotics that inhibit translation elongation, but not by those that inhibit translation initiation, transcription initiation, or transcription elongation, indicates that the hisT mutation leads to a defect in one or more of the steps in the polypeptide chain elongation mechanism. These results can account for effects of the hisT mutation on regulation of certain amino acid biosynthetic operons, including the his, leu, and ilv operons. The hisT gene in Salmonella typhimurium codes for an enzyme, pseudouridine synthetase I, that converts uridine residues to pseudouridine in the anticodon regions of approximately half of the tRNA species in the cell (39). At least one isoaccepting tRNA species for 13 of the 20 common amino acids, including the single species of tRNAH1S, contains a hisT-specified pseudouridine modification. The hisT mutation leads to highly derepressed, constitutive expression of the his operon (26) and nonrepressibility of the leu and ilvGEDA operons (9). As compared with wild-type strains, hisT mutants show altered sensitivity to growth inhibition by a number of amino acid analogs, suggesting widespread, pleiotropic effects of the mutation on cellular metabolism and regulation (39). On the other hand, the hisT-specified pseudouridine modification is dispensable for the life of the cell since amber and frameshift hisT mutations are not lethal (7); hisT mutants do grow with slightly increased generation times (26). Evidence has indicated that his operon expression is regulated by translational control (2) of attenuation (21). A specific regulatory model was recently described based on the structure of the hisO regulatory region as revealed by DNA sequence analysis (20). The model proposed that his operon derepression occurs during slowed translation of a putative 16amino acid peptide-coding sequence containing seven adjacent His codons. This model can account for the previous demonstration that his operon derepression in vivo is inversely correlated with the absolute amount of charged tRNAHiS (26), since it is easy to envision how decreased levels of charged tRNAHiS would lead
to slowed translation of the His codons. Derepressed his operon expression in hisT mutants, however, cannot be explained in this way because pseudouridine-deficient tRNA'iS is charged normally both in vivo (26) and in vitro
This paper reports that the hisT mutation leads to a slowed rate of polypeptide chain elongation. These results can account for the effects of the hisT mutation on gene regulation. MATERIALS AND METHODS Bacterial strains, transductions, and matings. Properties of the S. typhimurium and Escherichia coli strains used in this study are summarized in Table 1. Transductions in S. typhimurium strains were done with phage P22 HT105/int-201 as described (36). Tetracycline-resistant transductants carrying a TnlO insertion were selected on nutrient agar plates containing 10 Fag of tetracycline per ml. Nonlysogenic phage-free isolates were obtained after streaking for single colonies three times successively on green indicator medium (38). Since streptolydigin-sensitive (Stl5) derivatives failed to grow on green indicator medium, transductants were purified on nutrient agar and tested for their ability to plaque phage P22. hisT mutants were scored by their wrinkled colony morphology (28). In all cases when hisr' strains and hisT mutants were compared, the strains were made as isogenic as possible. Matings were done with fresh nutrient broth inocula of donor and recipient strains by spreading 0.1 ml of the recipient on a selective plate and streaking a loopful of the donor for single colonies on the plate. After growth at 37°C, transconjugants were picked and purified twice nonselectively before testing their properties. In experiments with Flac strains, cultures were tested at the end of the experiment for retention of the episome. Greater than 98% of the population maintained the Flac in all experiments. 357
PALMER, BLUM, AND ARTZJ.BCEO. J. BACTERIOL. TABLE 1. Genotype and origin of bacterial strains S.
TA265 TA253 TR2241
Wild-type LT2 hisTl504 hisC3072 A(hisGa)242 A(proAB)47 serAl3/F128 lac' AZ88 proAlS TA471TT317 A(hisGpeaGDCBH-)2253 hisTISO4 purF::TnlO AZlOl hisTr proAlS AZ105 AZ102
AZ106 JL2456 AZ81 AZ82
Source or reference
Transduction of AZ88 to Tetr with TA471TT317 donor; eduction of purF::TnlO hisl' proAJS/F128 lac' Mating of AZlOl with TR2241 donor his TIS04 proAlS Transduction of AZ88 to Tetr with TA471TT317 donor; eduction of purF::TnIO hisTlS04 proAlS/F128 lac' Mating of AZ102 with TR2241 donor amtAl argIS39 metE338 A(proAB)47 J. Ingraham
pyrB692::TnlO trp-130 hisTJS04 Stls hisTr Stls
This work Transduction of AZ81 to Tetr with purF::TnlO donor; transduction to purF+ with TA265 donor AZ117 Transduction of AZ82 to Tetr with JL2456 donor; educargIS39 hisT+ Stls tion of pyrB692::TnJO AZ118 Transduction of AZ81 to Tetr with JL2456 donor; educargJS39 hisTJ504 Stls tion of pyrB692::TnlO AZ119 argIS39 hisTr Stls/F128 lac+ Mating of AZ117 with TR2241 donor AZ120 argJS39 hisTJSO4 Stl5/F128 lac+ Mating of AZ118 with TR2241 donor a All S. typhimurium strains were LT2 derivatives except strains TR2241 and JL2456 which were LT7 derivatives. Media. Complex media were Difco nutrient broth (NB; Difco Laboratories, Detroit, Mich.) containing 0.5% (wt/vol) NaCl or Luria broth (27). Minimal media were the E medium of Vogel and Bonner (40) or the AB medium of Clark and Maaloe (8). Unless otherwise indicated, carbon sources were supplied at 0.4% (wt/vol). Solid media contained Difco agar at 1.5% (wt/vol). Isolation of a streptolydigln-sensitive (Stl5) strain of S.
typhimurium. An overnight NB culture of strain TA253 (hisTl504) was diluted 1:10 into 5 ml of NB and allowed to undergo two doublings at 370C. The culture was washed twice and suspended in 4 ml of 0.1 M citrate-NaOH buffer (pH 5.5). The suspension was mutagenized with N-methyl-N'-nitro-N-nitrosoguani-
dine at 50 pg/ml -for 30 min at 370C without aeration, washed twice with 0.1 M KH2PO4-NaOH buffer (pH 7.0), suspended in 5 ml of NB, and grown overnight at 370C to allow phenotypic expression. This mutagenized NB culture was diluted 1:100 into 5 ml of fresh NB, grown to an optical density at 650 nm of about 0.1, and treated by addition of streptolydigin at 100
Lg/ml followed 10 min later by addition of ampicillin at 40
..g/ml. After ampicillin counterselection for 60 min at 370C, the culture was washed twice and suspended in 5 ml of NB and grown ovemnight at 370C. The counterselection was repeated two more times before mutants sensitive to growth inhibition by 100 t..g of streptolydigin per ml on nutrient agar plates were screened. Of eight Stls strains tested we chose one (strain AZ81) for further use. This strain grows in minimal or complex media with the same generation times as its parent; it can be used as a recipient in
transductions with phage P22 and reverts to Stl' at a frequency of about 10-8. In addition to being Stl5, strain AZ81 is also more sensitive than its parent to
growth inhibition by rifampin, actinomycin D, puromycin, and novobiocin, and it fails to grow on MacConkey or green (38) plates, indicating a general permeability defect. Antibiotic sensitivity tests. Samples (0.1 ml) of overnight NB cultures of strains to be tested were mixed with 2.5 ml of top agar (0.6% [wt/vol] Difco agar in 0.5% [wt/voll NaCI) held at 450C and overlaid on plates containing the indicated media. After the top agar had solidified, a sterile paper disk (6 mm diameter) was placed on the plate and 15 0d of antibiotic solution was applied. Plates were incubated at 370C,
and the diameter of the zone of inhibition was measured after 36 h. 13-Galctudaeand lacZ mRNA induction kinetics. Cultures (150 ml) were grown through at least four doublings at 370C in the indicated media to an optical density at 650 nm of about 0.3, and the lac operon was induced by addition of isopropyl-13-D-thiogalactopyranoside at 1.0 mM. To stop translation, 1.0-ml samples taken at brief intervals were added to 1.0 ml of ice-cold 0.1 M sodium phosphate buffer (pH 7.0) containing chloramphenicol to give a final concentration of 300
.ag/ml. Before lysis and assay, samples were agitated and incubated at 370C for 15 min to ensure assembly of 13-galactosidase subunits into active tetramers. To stop transcription elongation, 1.0-ml samples were added to 1.0 ml of prewarmed (370C) 0.1 M sodium phosphate buffer (pH 7.0) containing 5% (vol/vol) dimethyl sulfoxide and streptolydigin to give a final concentration
SLOWED TRANSLATION RATE IN hisT MUTANTS
of 1.0 mg/ml. Streptolydigin-treated samples were incubated for 20 min with gentle shaking to allow translation of completed lacZ mRNA and assembly of ,-galactosidase and then chilled, centrifuged to remove streptolydigin (which has a color that interferes with the P-galactosidase assay), and suspended in 2.0 ml of ice-cold 0.1 M sodium phosphate buffer (pH 7.0) containing chloramphenicol at 300 pLg/ml. Cell samples were permeabilized (33) and assayed for f-galactosidase activity (27) as described. Enzyme units were given as absorbance units at 420 nm per minute and were normalized to the optical density of the samples at 650 nm. Chemicals. Streptolydigin was the very generous gift of Joseph Grady (The Upjohn Company, Kalamazoo, Michigan). All other chemicals were obtained from commercial suppliers.
RESULTS Reduced protein synthesis rate in a hisT mutant. To test whether the hisT mutation slows the rate of protein synthesis, we measured 1galactosidase induction lags in otherwise isogenic hisT+ and hisT1504 strains of S. typhimurium. The chain growth rate of polypeptide synthesis (cgrp) can be estimated from the time required after induction of the lac operon to detect finished chains of 13-galactosidase above the uninduced (basal) level. In Fig. 1, 13-galactosidase activity (EJ) measured at the indicated points is plotted as a function of time (t) after addition of isopropyl-1-D-thiogalactopyranoside. Protein synthesis was stopped by sampling into chloramphenicol. The induction curves closely approximate parabolas (Et a t2), reflecting the mathematical relationship by which enzyme is accumulated early after induction (10, 35). The parabolic nature of the curves is maintained until the rate of decay of functional lacZ mRNA becomes significant (10). In the inset of Fig. 1, the data are replotted as the square root of the difference between Et and Eo (basal level) versus t. The square root plot converts the parabolic portions of the induction curves to straight-line functions (Vt-o t), which extrapolate on the abscissa at the time of completion of the first 13-galactosidase subunit after induction (35). It was apparent that this time was longer in the hisT mutant (95 s) than in the hisT+ strain (73 s). Based on a chain length of 1,021 amino acids for the ,3-galactosidase subunit (13), we calculated cgrp values in this experiment of 10.7 and 14.0 amino acids/s for the hisT and hisT+ strains, respectively. The value for the hisT+ strain agrees closely with cgrp values measured in wild-type E. coli strains under similar conditions (10, 14, 35), allowing for the revised downward estimate in chain length of the ,B-galactosidase subunit (13). Because hisT mutants grow more slowly than hisT+ strains (26) and the relationship between
cgrp and bacterial growth rate has been somewhat controversial (10), we measured ,B-galactosidase induction lags in cultures growing at different rates (Table 2). Within experimental error, the 20 to 25% difference between cgrp values in the hisT+ and hisT strains was maintained over about a threefold range of growth rates. The reduced cgrp in the hisT mutant corresponded to a similar relative reduction in growth rate under each of the three growth conditions tested. The observation that the difference in growth rates was maintained in a complex medium as well as in minimal media argues that the reduction in growth rate of the hisT mutant does not result from limitation of small molecule nutrients and may be a direct consequence of the reduced rate of protein synthesis. Effect of the hisT mutation on transcription elongation rate. The increased lag in induction of 1-galactosidase in the hisT mutant could result from a reduced rate of transcription rather than translation. Measurements of transcription elongation rates depend on use of antibiotic inhibitors, such as streptolydigin or actinomycin D, to which gram-negative bacteria are normally impermeable. We attempted to adapt the TrisEDTA E. coli permeabilization procedure of Leive (25) for use with S. typhimurium but were unsuccessful in obtaining actinomycin D inhibition of transcription greater than 95%. This was insufficient for reliable estimation of transcrip0.8
Читайте также:






