Иммуноферментный анализ на листериоз
| Стоимость услуги: | 470 руб.* Заказать |
Не менее 3 часов после последнего приема пищи. Можно пить воду без газа.
Метод исследования: ПЦР
Листериоз - инфекционное заболевание человека и животных, вызываемое патогенными представителями рода Listeria, характеризуется множеством источников и резервуаров инфекции, разнообразием путей и факторов передачи возбудителя, полиморфизмом клинических проявлений, высокой летальностью у новорождённых и лиц с иммунодефицитами. Иногда отмечается бессимптомное течение болезни. Из шести известных в настоящее время видов листерий (L.monocytogenes, L.seeligeri, L.welshimeri, L.innocua, L.ivanovii, L.gray), только L.monocytogenes патогенен для человека и животных. При листериозе имеют место многообразные механизмы передачи возбудителя инфекции: фекально-оральный, контактно-бытовой, аспирационный, трансплацентарный. Клиника листериоза отличается полиморфизмом, клинические формы заболевания зависят от преобладания поражений отдельных органов и систем. Различают висцеральную, нервную, железистую, гастроэнтеритическую и смешанную формы, а также бессимптомное носительство листерий.
Показания к назначению исследования:
- Обследование лиц с клиникой инфекционного заболевания при наличии связи с животноводческим хозяйством, неблагополучным по листериозу;
- Обследование беременных с отягощенным акушерско-гинекологическим анамнезом, с катаральными явлениями;и
- Обследование пожилых лиц и лиц с иммунодефицитом с признаками менингита и менингоэнцефалита без установленной ранее причины.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ:
Референсные значения (вариант нормы):
| Параметр | Референсные значения |
|---|---|
| Листерии (Listeria monocytogenes), качественное определение ДНК | Не обнаружено |
" ["serv_cost"]=> string(3) "470" ["cito_price"]=> NULL ["parent"]=> string(2) "25" [10]=> string(1) "1" ["limit"]=> NULL ["bmats"]=> array(1) < [0]=>array(3) < ["cito"]=>string(1) "N" ["own_bmat"]=> string(2) "12" ["name"]=> string(22) "Кровь с ЭДТА" > > >
| Тип | В офисе |
|---|---|
| Кровь с ЭДТА |
Не менее 3 часов после последнего приема пищи. Можно пить воду без газа.
Метод исследования: ПЦР
Листериоз - инфекционное заболевание человека и животных, вызываемое патогенными представителями рода Listeria, характеризуется множеством источников и резервуаров инфекции, разнообразием путей и факторов передачи возбудителя, полиморфизмом клинических проявлений, высокой летальностью у новорождённых и лиц с иммунодефицитами. Иногда отмечается бессимптомное течение болезни. Из шести известных в настоящее время видов листерий (L.monocytogenes, L.seeligeri, L.welshimeri, L.innocua, L.ivanovii, L.gray), только L.monocytogenes патогенен для человека и животных. При листериозе имеют место многообразные механизмы передачи возбудителя инфекции: фекально-оральный, контактно-бытовой, аспирационный, трансплацентарный. Клиника листериоза отличается полиморфизмом, клинические формы заболевания зависят от преобладания поражений отдельных органов и систем. Различают висцеральную, нервную, железистую, гастроэнтеритическую и смешанную формы, а также бессимптомное носительство листерий.
Показания к назначению исследования:
- Обследование лиц с клиникой инфекционного заболевания при наличии связи с животноводческим хозяйством, неблагополучным по листериозу;
- Обследование беременных с отягощенным акушерско-гинекологическим анамнезом, с катаральными явлениями;и
- Обследование пожилых лиц и лиц с иммунодефицитом с признаками менингита и менингоэнцефалита без установленной ранее причины.
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ:
Референсные значения (вариант нормы):
| Параметр | Референсные значения |
|---|---|
| Листерии (Listeria monocytogenes), качественное определение ДНК | Не обнаружено |
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 - 2020

! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Антитела к возбудителю листериоза (Listeria monocytogenes) – это специфические белки-иммуноглобулины, вырабатываемые иммунной системой в ответ на инфицирование возбудителем листериоза.
* В ходе исследования определяются только IgG-антитела.
Антитела к возбудителю листериоза.
Синонимы английские
Anti-Listeria monocytogenes antibodies, Anti-Listeria monocytogenes Ab, L. monocytogenes antibodies.
Иммуноферментный анализ (ИФА).
Ед/мл (единица на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до сдачи крови.
Общая информация об исследовании
Листериоз – это инфекционное заболевание с различными путями передачи, в том числе и от матери к плоду. Возбудителем листериоза является Listeria monocytogenes. Источники инфекции – грызуны, травоядные животные и птицы. Инкубационный период может длиться от 2 до 70 дней, но в среднем составляет 2-3 недели. Главную роль в развитии листериоза играет состояние иммунитета. Как правило, заболевание протекает в легкой, или стертой, форме или в виде бактерионосительства. Более тяжелое течение наблюдается обычно у пациентов с ослабленным иммунитетом. Симптомы заболевания неспецифичны. Острая форма начинается с лихорадки, явлений общей интоксикации, тошноты, рвоты и диареи. Возможно поражение печени, сердца, суставов, кожи. В ряде случаев развивается менингит, энцефалит и сепсис.
У беременных женщин риск развития листериоза в 20 раз выше, чем у остальных людей, клиническая картина заболевания напоминает острую вирусную инфекцию или ангину, а трансплацентарное инфицирование плода может привести к его гибели. Листериоз новорожденных сопровождается менингитом, сепсисом и частыми смертельными исходами.
Возбудитель листериоза имеет ряд факторов патогенности (болезнетворности), среди которых главным является листериолизин О, обладающий выраженным токсическим действием. В ответ на инфицирование возбудителем листериоза иммунной системой вырабатываются специфические антитела, в том числе и к листериолизину О. Титр антител начинает повышаться с 3-5-го дня после инфицирования и сохраняется на высоком уровне на протяжении нескольких недель.
При хроническом бактерионосительстве титр антител может быть невысоким.
Для чего используется исследование?
- Для диагностики листериоза у пациентов из группы высокого риска: у беременных женщин (особенно при отягощенном акушерском анамнезе), пожилых людей (старше 60 лет), у новорожденных и у других лиц с иммунодефицитными состояниями, в том числе получающих иммуносупрессивную терапию.
- Для диагностики листериоза у людей, профессиональная деятельность которых связана с животными (если есть признаки инфекционного заболевания).
- Для диагностики листериоза при инфекциях неустановленного происхождения.
- Как часть дифференциальной диагностики (наряду с другими тестами) при заболеваниях, протекающих со сходными симптомами (инфекционном мононуклеозе, дифтерии, туляремии, острых кишечных инфекциях, энцефалитах и менингитах, токсоплазмозах и др.).
- Чтобы выявить скрытое бактерионосительство L. monocytogenes.
Когда назначается исследование?
- При симптомах листериоза (особенно у пациентов из группы высокого риска), таких как гастроэнтерит с лихорадкой после употребления той или иной пищи (при условии, что рутинное исследование не выявило возможного патогена), менингит, менингоэнцефалит, сепсис, – двукратно с интервалом в 10-14 дней.
- Женщинам, планирующим беременность, – до беременности, при нормально протекающей беременности – на 11-13-й и 34-36-й неделе, а при симптомах листериоза – на любом сроке.
- При подозрении на носительство L. monocytogenes.
Что означают результаты?
Концентрация: 0 — 0,89 Ед/мл.
Обнаружение антител к Listeria monocytogenes указывает на недавно перенесенный листериоз или на хроническое бактерионосительство. Возрастание титра антител в 4 раза и более в парных исследованиях свидетельствует об острой форме заболевания (при соответствующей клинической картине). Наличие антител к L. monocytogenes у беременных связано с повышенным риском инфицирования и, соответственно, гибели плода.
Низкий титр антител свидетельствует об отсутствии листериоза.
Причины повышения титра антител:
- острый или перенесенный листериоз,
- хроническое носительство L. monocytogenes.
Причины снижения титра антител:
- отсутствие листериоза,
- слабый иммунный ответ (или его отсутствие) к возбудителю листериоза вследствие нарушений в иммунной системе.
Что может влиять на результат?
- Проведение антибактериальной терапии.
- Ложноположительные результаты иногда встречаются при перекрестных реакциях с сывороточными антителами к стрептококкам, стафилококкам, клостридиям.
Кто назначает исследование?
Инфекционист, терапевт, врач общей практики, акушер-гинеколог, педиатр-неонатолог.
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed
Аннотация научной статьи по биотехнологиям в медицине, автор научной работы — Васильев Дмитрий Аркадьевич, Хлынов Дмитрий Николаевич
Разработана схема получения различных типов антигенных препаратов. Лучшим способом разрушения бактериальной суспензии оказался метод ультразвуковой дезинтеграции . Подобраны оптимальные параметры дезентегрирования, разработана схема фракционирования дезинтеграта для получения фракции цитоплазмы и препарата клеточной стенки .
Похожие темы научных работ по биотехнологиям в медицине , автор научной работы — Васильев Дмитрий Аркадьевич, Хлынов Дмитрий Николаевич
OBTAINING ANTIGENS LISTERIA MONOCYTOGENES FOR ENZYME IMMUNOASSAY
The scheme of obtaining different types of antigen preparations. The best way to destroy the bacterial suspension was the method of ultrasonic disintegration. To find the optimal parameters dezentegrirovaniya, a scheme for the fractionation dezintegrata fraction of the cytoplasm and cell wall preparation.
ПОЛУЧЕНИЕ РАЗЛИЧНЫХ ТИПОВ АНТИГЕНОВ LISTERIA MONOCYTOGENES ДЛЯ ИММУНОФЕРМЕНТНОГО АНАЛИЗА
Васильев Дмитрий Аркадьевич, доктор биологических наук, профессор,
Хлынов Дмитрий Николаевич, ассистент
Ключевые слова: листерия, бактериальная масса, дезинтеграт, дезинтеграция, антиген, биопрепарат, фракционирование, фракция цитоплазмы, препарат клеточной стенки.
Разработана схема получения различных типов антигенных препаратов. Лучшим способом разрушения бактериальной суспензии оказался метод ультразвуковой дезинтеграции. Подобраны оптимальные параметры дезентегрирования, разработана схема фракционирования дезинтеграта для получения фракции цитоплазмы и препарата клеточной стенки.
Большое разнообразие методов и аппаратов, применяемых для физической дезинтеграции микроорганизмов, позволяет решить проблему выбора адекватного способа разрушения клеток при решении конкретных экспериментальных задач. Решающий критерий выбора обусловлен тем, что механические свойства микроорганизмов, определяемые главным образом прочностными характеристиками стенки клеток бактерий, варьируют в широких пределах.
Перед нами стояла задача получить разные по структурным компонентам типы листериозного антигена:
• препарат клеточной стенки;
• препарат фракции цитоплазмы.
Полученные антигенные препараты
мы планируем использовать в дальнейшем изучении их возможности применения в
ключевым пунктом в решении этого вопроса является дезинтеграция микробных тел. Известно, что при этом процессе изменяются свойства, а следовательно, теряется часть той информации, которую несёт в себе микроогранизм. Поэтому необходимо было провести весь комплекс экспериментов таким образом, чтобы свести к минимуму изменения сохранившихся морфологических структур и их биологических свойств.
тест-объектами в проводимых опытах служили клетки Listeria monocytogenes. в качестве критериев для оценки гомогенатов были использованы показатели:
1) количество разрушенных клеток;
2) однородность антигенного препарата;
3) стерильность полученного гомоге-
Наработку бактериальной массы Listeria monocytogenes проводили на мясопеп-тонном агаре с 1% глюкозы и 1% глицерина. 24-часовую бульонную культуру по 5см3 с примерной концентрацией 1х106м. т/см3 вносили в матрас с питательной средой, расплодочный материал равномерно распределяли по поверхности агара путем покачивания матраса, оставляли при комнатной температуре на 15 мин., затем матрасы переворачивали агаром вверх и помещали в термостат с температурой 37°С на 24 часа.
Микробиологическую чистоту выращенных культур оценивали визуально по характеру роста и микроскопией мазков, окрашенных по Граму.
Если культура не содержала посторонней микрофлоры, то ее смывали с поверхности агара физиологическим раствором. Полученный смыв культуры листерий центрифугировали при 3000 об/мин в течение 30 минут. Надосадочную жидкость отбрасывали, а осадок ресуспендировали в физиологическом растворе и вновь центрифугировали при указанном режиме (отмывание остатков питательной среды). Затем удаляли надосадочную жидкость и осадок ресуспендировали в стерильной дистиллированной воде при рН 7,2.
Далее проводили определение концентрации исходной суспензии с применением стандарта мутности ОСО 42-28-85(10МЕ). Из исходной суспензии готовили рабочие бактериальные взвеси с концентрациями 1 млрд. микр тел в 1 мл.
Согласно литературным данным, наиболее оптимальным вариантом для решения поставленной задачи явилось бы применение криогенного метода дезинтеграции, позволяющего получить клеточные компоненты при минимальной потере их биологических свойств. Одним из методов криогенной дезинтеграции является способ разрушения бактериальных клеток, предложенный Грассе.
Проведённая нами проверка данного способа с целью применения его для собственных исследований показала, что 24-кратное замораживание и оттаивание листериозной культуры не обеспечивает высокого процента разрушения бактериальных клеток.
Это видно на фотографии дезинтегра-та листериозной культуры, подвергнутой обработке указанным методом (рис.1).
Увеличение числа манипуляций по замораживанию - оттаиванию не принесло значительного увеличения процента разрушенных клеток.
Выход их был по-прежнему низок (до 20%) и не мог удовлетворить потребность в клеточных компонентах, необходимых для проведения исследований.
Поэтому возникла необходимость перейти к другому способу дезинтеграции, который бы позволил получить больший процент разрушенных клеток, а значит, и больший выход клеточных компонентов.
Одним из таких способов явилась дезинтеграция бактерий с помощью ультразвука.
Метод ультразвуковой де-Рис.1. Дезинтеграт клеточной суспензии листерий, зинтеграции является одним из полученный по способу Грассе, окраска по Граму. Ув. наиболее широко распространенных. Он позволяет получить
Рис. 2. Дезинтеграт клеточной суспензии листерий, полученный методом ультразвуковой дезинтеграции, окраска по Граму. Ув. 15х90: а) - исходная бактериальная взвесь; б) - амплитуда 6 мк, экспозиция УЗ 4 мин.; в) - амплитуда 6 мк, экспозиция УЗ 6 мин.; г) - амплитуда 6 мк, экспозиция УЗ 8 мин.; д) - амплитуда 6 мк, экспозиция УЗ 10 мин.
дезинтеграты, в которых выявляются различные клеточные структуры и широкий спектр антигенов разной химической природы. Устойчивость микроорганизмов к ультразвуковой вибрации различна.
Каждый вид требует отработки определенного режима.
При обычной ультразвуковой дезинтеграции микроорганизмов кавитация является основной причиной разрушения клеток. Объясняется это тем, что при возникновении кавитации происходит резкое перераспределение акустической энергии; образующиеся вокруг кавитационных полостей градиенты давления и скорости жидкости на много порядков выше, чем в исходной акустической волне. При отсутствии же кавитации не происходит нарушения целостности микробной клетки из-за малости её размера (по сравнению с длиной ультразвуковой волны).
Режимы УЗ-дезинтеграции листери-озных клеток подбирали в экспериментах. в 14 проведённых опытах варьировали показатели концентрации бактериальной суспензии, время воздействия, амплитуду зонда, способы охлаждения суспензии.
Образцы бактериальной суспензии озвучивали при амплитуде 2 мк, 4 мк, 6 мк, 8мк, 10 мк, 12 мк, 14 мк. Варьировали временем экспозиции до 20 мин. В течение всего времени из образцов делали мазки и окрашивали их по Граму для фиксации степени разрушения бактериальных клеток в
озвучиваемой суспензии (рис.2.).
При озвучивании бактериальной суспензии ультразвуком с амплитудой волны в 8 мк. в течение длительного времени мы не добились высокого процента разрушения бактерий. При воздействии ультразвуком с амплитудой в 12 мк. клетки бактерий разрушались в течение 2 минут, но в связи с быстрым перегревом образца произошла денатурация белка.
Был определён оптимальный режим разрушения бактериальной клетки (рис. 3.), заключающийся в следующем: бактериаль-
ную суспензию концентрацией 1 млрд микробных клеток в 1 мл дистиллированной воды с рН - 7,2 подвергали ультразвуковой обработке на дезинтеграторе Soniprep 150 фирмы MSE (Англия) с амплитудой зонда - 6
Рис. 3. Графики разрушения бактериальной суспензии с помощью ультразвуковой дезинтеграции. Озвучивание бактериальной суспензии: а) - при амплитуде 2 мк; б) - при амплитуде 6 мк; в) - при амплитуде 12 мк.
мк, экспозицией обработки - 10 мин, объём суспензии - 1 мл.
В качестве охлаждающей смеси стакана дезинтегратора использовали смесь спирта со льдом.
Эффективность разрушения листери-озных клеток оценивали по данным световой микроскопии, а также по данным под-
счёта жизнеспособных клеток в исходной и разрушительной клеточной суспензии путём высева их на питательные среды.
таким образом, мы подобрали оптимальные условия получения дезинтеграта листерий.
Следующим этапом нашей работы, согласно поставленной задаче, явилось фракционирование дезинтеграта для получения изолированного препарата клеточной стенки и однородного препарата фракции цитоплазмы. Данная задача решалась несколькими методами. Проанализировав литературные данные, в основу разработанной нами схемы выделения клеточных компонентов листерий из дезинтегрированной суспензии мы положили принцип дифференциального центрифугирования, предложенный Salton (1964). Этот метод основан на различиях в скорости седиментации частиц, отличающихся друг от друга размерами и плотностью. Разделяемый материал центрифугируют при ступенчатом увеличении центробежного ускорения, которое выбирается так, чтобы на каждом этапе на дно пробирки осаждалась определённая фракция из дезинтеграта.
Полученные препараты необходимо было проверить на однородность и на-тивность. только после этого можно было
Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Этот опыт показывает, что изолированные клеточные стенки, полученные согласно разработанной методике, сохраняют специфические рецепторы фага и являются нативными.
Для определения нативности фракции цитоплазмы была проверена активностью ферментов окислительно-восстановитель-
I - Фракция цитоплазмы
II - Клеточные стенки
230 240 2S0 260 270 280 290 300
Рис. S. Спектрограмма препаратов клеточной стенки и фракции цитоплазмы.
ного комплекса и, в частности, каталазы.
Результаты исследований показывают, что активность каталазы у фракции цитоплазмы достаточно высока и в среднем равна 12 мг перекиси водорода на 1 мг белка за одну минуту при активности 10-12 мг перекиси водорода на 1 мг белка за 1 минуту у живых листериозных клеток.
Указанная активность каталазы дает основание утверждать, что нативность ци-топлазменного препарата в процессе его получения сохраняется, так как данный фермент не инактивируется.
Таким образом, проведённые экспериментальные исследования позволили разработать методы получения различных типов антигена:
• препарат клеточной стенки;
Наработанные по указанным выше методам препараты из листериозной бак-массы в дальнейшем будут использованы при разработке метода иммуноферментно-го анализа листериоза.
2. Кольпикова Т.И., Бакулов И.А., Кот-ляров В.М. Использование листериозных бактериофагов при диагностике и индикации листерий. В сб. Листериоз на рубеже тысячелетий. Покров, 1999: 64-67.
3. Станиславский Е.С., Жванецкая М.И. Использование методов дезинтеграции в научных исследованиях и производстве бактерийных препаратов. /Дезинтеграция микроогранизмов, Пущино-на-Оке, 1972
Инфекционные и паразитарные заболевания
Общее описание
Листериоз — это острая инфекционная патология, проявляющаяся полиморфизмом симптомов, лихорадкой и интоксикацией. Возбудитель — грамположительные кокковидные палочки, относящиеся к семейству коринебактерий, резистентные к условиям внешней среды.
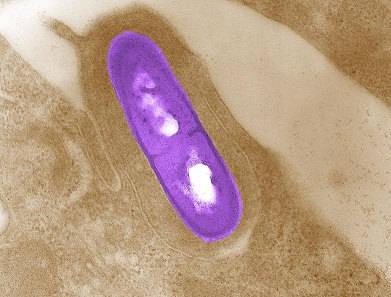
Резервуаром служат грызуны, птицы, домашние животные и насекомые, выделяющие в окружающую среду вместе с фекалиями листерии. Человек заражается, употребляя зараженную пищу: молочные и мясные продукты, салаты из свежей зелени, квашеной капусты и овощей. Вероятны воздушно-капельный и контактный пути передачи.
Выделяют врожденный и приобретенный листериоз. При приобретенном листериозе патологические изменения локализуются в местах внедрения возбудителя. Входными воротами инфекции могут быть желудочно-кишечный тракт, конъюнктива, глотка, респираторные органы и поврежденный кожный покров, где возникают воспалительные очаги. С участка инвазии листерии проникают в лимфоузлы и затем разносятся током крови по всему организму с появлением специфических гранулем в печени, легких, почках, ЦНС и эндокринных железах.
Симптомы листериоза
Инкубация возбудителя может продолжаться от 3 дней до полутора месяцев. Рассматривают ангинозную, глазо-железистую, тифоидную, а также нервную формы болезни.
Ангинозная форма возникает внезапно с повышения температуры, общей слабости, головной боли, боли при глотании. Типичный симптом — появление на слизистой зева изменений по типу катаральной, пленчатой или язвенно-некротической ангины. Одновременно увеличиваются регионарные лимфатические узлы, развивается гепатолиенальный синдром, появляется полиморфная сыпь.
При глазо-железистой форме вместе с умеренно повышенной температурой и интоксикацией, развивается конъюнктивит на стороне поражения. На гиперемированной отечной конъюнктиве в области переходной складки определяются яркие фолликулы, являющие собой узелки-гранулемы. Роговица в воспаление не вовлекается. Увеличиваются в размерах и становятся болезненными на ощупь околоушные, подчелюстные, шейные и затылочные лимфоузлы.
Тифоидная форма характеризуется продолжительной лихорадкой, повреждением печени и селезенки, кожными высыпаниями. Зачастую развивается гепатит с желтухой, на 5–6 день после начала болезни возникает розеолезная или пятнисто-папулезная сыпь без четкой локализации. Могут возникать полисерозиты с перикардитом и плевритом.
Наиболее тяжелое течение свойственно нервной форме, которая проявляется менингитом, энцефалитом или менингоэнцефалитом. Врожденный листериоз характеризуется клиническими проявлениями неонатального сепсиса. Наиболее типичными изменениями являются пневмония, тяжелый респираторный дистресс-синдром, рефрактерный к лечению. В случае поражения ЦНС с развития менингита и менингоэнцефалита возможен летальный исход.
Диагностика листериоза
Диагноз приобретенного листериоза (кроме ангинозной и глазо-железистой форм) труден для постановки в связи с разнообразной симптоматикой. В периферической крови при листериозе наблюдаются на 1-й неделе болезни лимфоцитоз и моноцитоз.
Обязательно учитываются эпидемические данные, бактериологическое выделение возбудителя, ПЦР, выделение специфических антител с помощью серологических методов исследования (ИФА, РПГА, РСК, РА).
Дифференциальный диагноз приобретенного листериоза проводится с дифтерией, туляремией, брюшным тифом, сепсисом, псевдотуберкулезом и серозным менингитом. Врожденный листериоз дифференцируют с врожденной цитомегалией, токсоплазмозом, сепсисом и гемолитической болезнью новорожденных.
Лечение листериоза
Имеются противопоказания. Необходима консультация специалиста.


- Левомицетин (антибиотик широкого спектра действия). Режим дозирования: внутрь за полчаса до еды или во время приема пищи от 0,25 г до 0,75 г (в среднем — 0,5 г) на прием 3-4 раза в сутки в течение всего лихорадочного периода плюс 3–5 дней сверх того, а в тяжелых случаях до 2-3 нед. с момента нормализации температуры тела.
- Амоксиклав (антибиотик широкого спектра действия). Режим дозирования: внутрь, в случае легкого и среднетяжелого течения инфекции по 1 табл. 250 + 125 мг каждые 8 ч или 1 табл. 500 + 125 мг каждые 12 ч, в случае тяжелого течения инфекции и инфекций дыхательных путей — 1 табл. 500 + 125 мг каждые 8 ч или 1 табл. 875 + 125 мг каждые 12 ч. в течение всего лихорадочного периода плюс 3-5 дней сверх того.
- Цефтриаксон (антибиотик широкого спектра действия). Режим дозирования: в/м, в/в. Взрослым и детям старше 12 лет средняя суточная доза составляет 1-2 г цефтриаксона 1 раз в сутки или 0,5–1 г каждые 12 ч. в течение всего лихорадочного периода плюс 3-5 дней сверх того.
Рекомендации при листериозе
Рекомендуется консультация инфекциониста.
Заболеваемость (на 100 000 человек)
| Мужчины | Женщины | |||||||||||||
| Возраст, лет | 0-1 | 1-3 | 3-14 | 14-25 | 25-40 | 40-60 | 60 + | 0-1 | 1-3 | 3-14 | 14-25 | 25-40 | 40-60 | 60 + |
| Кол-во заболевших | 0.3 | 10.8 | 10.8 | 10.8 | 10.8 | 10.8 | 10.8 | 0.3 | 10.8 | 10.8 | 10.8 | 10.8 | 10.8 | 10.8 |
Что нужно пройти при подозрении на листериоз
Положительный результат ПЦР-диагностики на наличие возбудителя листериоза с большой степенью точности указывает на наличие этой инфекции.
Если концентрация антител к возбудителям листериоза очень высока или нарастает со временем, это свидетельствует о заражении данной инфекцией.
Симптомы
| Вcтречаемость (насколько часто симптом проявляется при данном заболевании) | |
|---|---|
| Общее повышение температуры тела (высокая температура, повышенная температура) | 80% |
| Боль в горле | 79% |
| Приступы судорог с потерей сознания или без (судороги, судорожные припадки, судорожный синдром, конвульсия) | 50% |
Москва, Большой Староданиловский пер, 5 ст3
Москва, Можайское шоссе, 10
Москва, Грузинский пер., 3а
Москва, Большая Спасская, 10 к1
Москва, Ореховый бульвар, 28
Москва, Последний пер, 28
Москва, Полтавская, 2
Москва, Хорошёвское шоссе, 25
Москва, Пырьева, 11а
Москва, Тверская, 6 ст6
Москва, Алтуфьевское шоссе, 28 к1
Москва, Новокосинская, 24 к1
Москва, Лобачевского, 108
Москва, Шарикоподшипниковская, 40
Москва, Велозаводская, 13 ст2
Москва, Спиридоньевский пер, 5 ст1
Москва, Брестская 1-я, 2/14
Москва, Арбат, 28
Москва, Хорошёвское шоссе, 90
Москва, Москворечье, 1
1 Утверждаю Главный врач ФГУЗ "Федеральный центр гигиены и эпидемиологии", Председатель Лабораторного совета Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека А.И.ВЕРЕЩАГИН 8 декабря 2006 года ОПРЕДЕЛЕНИЕ БАКТЕРИЙ РОДА LISTERIA МЕТОДОМ ТВЕРДОФАЗНОГО ИММУНОФЕРМЕНТНОГО АНАЛИЗА МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ N Разработаны: ФГУЗ ФЦГиЭ Роспотребнадзора, при участии ООО "Стай-лаб". 2. Рекомендованы к утверждению Лабораторным советом Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (от 29 сентября 2006 г.). 3. Утверждены и введены в действие Председателем Лабораторного совета, Главным врачом ФГУЗ ФЦГиЭ Роспотребнадзора Верещагиным А.И Введены впервые. 1. Область применения Методические рекомендации предназначены для применения в лабораториях организаций, независимо от форм собственности, осуществляющих производственный контроль, а также в лабораториях иных организаций, аккредитованных на право проведения испытаний, исследований. Методические рекомендации могут быть использованы для целей определения бактерий рода Listeria при скрининговых исследованиях пищевых продуктов и смывов. 2. Общие положения
2 Бактерии рода Listeria относятся к группе грамположительных подвижных бактерий, широко распространенных в окружающей среде и размножающихся в почве, воде, на растениях, в пищевых продуктах. Известны семь видов листерий: Listeria monocytogenes, Listeria innocua, Listeria ivanovii, Listeria grayi, Listeria murrayi, Listeria seeligeri и Listeria welshimeri. Эпидемиологическое значение имеют Listeria monocytogenes, Listeria innocua и Listeria ivanovii в связи с наиболее частой контаминацией этими представителями рода Listeria пищевых продуктов. Поэтому чрезвычайно важна организация скрининга с использованием высокоспецифичных и простых методов определения бактерий рода Listeria. Хотя патогенной для человека является только Listeria monocytogenes, присутствие в пробах любых других листерий может свидетельствовать о контаминации патогенными бактериями. 3. Принцип метода твердофазного варианта ИФА К иммунохимическому определению бактерий рода Listeria в пищевых продуктах, смывах относится твердофазный иммуноферментный анализ на полистироловых планшетах, покрытых моноклональными антителами к антигену бактерий рода Listeria. Результатом проведения ИФА служит образование комплекса антиген-антитело при исследовании тестируемых образцов в сравнении с негативными и позитивными контролями. Использование твердой фазы позволяет надежно разделять компоненты реакции за счет иммобилизации одного из компонентов, не участвующих в реакции. Для осуществления реакции данного типа используется тест-система LOCATE(R) Listeria с высокоспецифичными моноклональными антителами к антигенам бактерий рода Listeria. Тестсистема LOCATE(R) Listeria спроектирована в формате стрипованного 96-луночного ИФА-планшета, что позволяет выполнять исследования от 1 до 94 образцов одновременно как с визуальной, так и с автоматической оценкой результата (с помощью ридера). 4. Аппаратура, материалы, питательные среды и тест-системы T Термостат электрический с диапазоном измерения от ТУ до 65 С с допустимой погрешностью регулирования температуры +/- 1 С
3 Стерилизатор паровой медицинский ГОСТ Шкаф сушильно-стерилизационный, обеспечивающий поддержание заданного температурного режима в диапазоне от 50 до 200 С с погрешностью +/- 2 С Гомогенизатор бактериологический перистальтического типа Masticator (или Stomacher) со стерильными полиэтиленовыми пакетами Облучатель бактерицидный настенный ОБН-150 ТУ Весы лабораторные с наибольшим пределом взвешивания ГОСТ г и допустимой погрешностью +/- 2 мг Холодильник бытовой электрический ГОСТ Пипетки градуированные исполнения 1, 2 классов точности ГОСТ вместимостью 1 куб. см, 10 куб. см Пробирки бактериологические вместимостью не менее ГОСТ
5 куб. см Посуда широкогорлая ГОСТ Питательные среды: Половинный бульон Фразера для обогащения листерий Бульон Фразера Оксфордагар PALCAMагар T Компоненты набора тест-системы LOCATE(R) Listeria: Микротитровальный стрипованный планшет на 96 лунок, 1 покрытых моноклональными антителами на листерии Конъюгат, в рабочем разведении 1 Положительный контроль (термически дезактивированные 1 бактерии рода Listeria), 2 мл Отрицательный контроль (термически дезактивированные 1 бактерии), 2 мл Концентрирующий моющий буфер, 25-кратный, 20 мл 2 Субстрат, ТМБ, 15 мл 1
7 Стоп-реагент, содержит 2% раствор серной кислоты, 15 мл 1 Схема планировки планшета 1 L Отбор и подготовка проб к анализу 5.1. Отбор и подготовку проб продукции производят в соответствии с ГОСТ "Методы отбора проб для микробиологических анализов", ГОСТ "Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов", МУК "Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов", ГОСТ Р (ИСО ), ГОСТ Р "Продукты пищевые. Методы выявления и определения бактерий Listeria monocytogenes", МУК "Организация контроля и методы выявления бактерий Listeria monocytogenes в пищевых продуктах", а также в соответствии с действующими ГОСТ и НД на конкретные виды продуктов Масса или объем отбираемых проб должны быть достаточными для проведения исследования и превышать аналитический образец не менее чем в два раза От продукции в мелкой фасовке пробы отбирают в количестве одной или нескольких единиц в зависимости от массы или объема потребительской тары так, чтобы количество было достаточным для проведения анализа От продукции в транспортной и потребительской таре больших размеров или без упаковки пробы отбирают из разных точек: с поверхности и с различной глубины Пробы для микробиологических анализов отбирают стерильным инструментом в стерильную посуду до взятия проб на физико-химические и органолептические исследования Замороженные продукты предварительно размораживают до температуры внутри продукта 0 - (-1) С (не менее 1 ч в термостате при температуре 37 С); продукты, содержащие жиры (сливочное масло, мороженое), нагревают до температуры С и перемешивают Отобранные образцы перемешивают и измельчают или доводят до однородной консистенции по ГОСТ , из измельченной суспензии составляют навеску массой 25 +/- 0,1 г ( г или куб. см - для продуктов детского, лечебного и специализированного питания) Смывы отбирают с помощью стерильных увлажненных тампонов, сделанных из марли или ваты, с поверхности оборудования и инвентаря площадью 100 кв. см, используя трафарет. Трафарет фламбируют перед каждым употреблением. 6. Определение бактерий рода Listeria в пищевых продуктах методом твердофазного иммуноферментного анализа
8 6.1. Предобогащение: внести 25 г подготовленной пробы в 225 мл бульона предобогащения. Перемешать образец в стомахере, блендере или с помощью другой техники, обеспечивающей достаточно хорошее перемешивание. Инкубировать в течение 24 ч при 30 С После инкубации перенести по 0,1 мл предобогащенной пробы в 10 мл бульона Фразера. Инкубировать бульоны в течение 24 ч при 30 С После инкубации перенести по 1 мл в две стеклянные пробирки, одну пробирку проавтоклавировать при 100 С (допускается использовать водяную баню 80 С в течение 20 мин. для инактивации живых бактерий). Другую пробирку с бульоном (не термообработанную) поместить в холодильник до конца исследования Охладить пробу до комнатной температуры. Тщательно перемешать бульон после охлаждения и использовать для ИФА. 7. Подготовка реагентов для ИФА 7.1. Для анализа используется тест-система иммуноферментная LOCATE(R) Listeria производства R-Biopharm Rhone Ltd Приготовление рабочих разведений растворов, входящих в комплект тест-системы: Подготовить моющий буфер в рабочем разведении: разбавить концентрат моющего буфера в 25 раз дистиллированной водой (смешать 40 мл буфера и 960 мл дистиллированной воды). Отметить дату приготовления на флаконе с буфером. Хранить буфер в холодильнике Рабочий раствор конъюгата: конъюгат поставляется в рабочем разведении Субстрат (ТМБ) поставляется в рабочем разведении Стоп-реагент поставляется в рабочем разведении Положительные и отрицательные контроли поставляются в рабочем разведении. 8. Проведение иммуноферментного анализа 8.1. Извлечь из пакета необходимое количество стрипов, разделить на необходимое количество лунок (по одной лунке на каждую пробу) и 2 лунки для контрольных растворов. Поместить лунки в планшетную рамку и зафиксировать. Немедленно упаковать оставшиеся лунки в пакет вместе с силикагелем Внести по 100 мкл растворов положительного и отрицательного контроля в соответствующие лунки. Внести по 100 мкл исследуемых термообработанных бульонов в соответствующие лунки. Обозначить положение каждой лунки на прилагаемой диаграмме. Инкубировать планшет в темноте при температуре 37 С 30 мин.
9 8.3. После инкубации с помощью автоматического вошера или многоканальной автоматической пипетки с переменным объемом внести в каждую лунку по 250 мкл моющего буфера. Повторить процедуру промывания еще 3 раза, после чего промыть лунки 1 раз дистиллированной водой. Перевернуть рамку и тщательно выбить капли дистиллированной воды путем постукивания рамки по столу, накрытой фильтровальной бумагой Внести по 100 мкл конъюгата в каждую лунку (при необходимости использования большого количества лунок использовать 8-канальную автоматическую пипетку). Инкубировать планшет при температуре 37 С 30 мин По окончании инкубации промыть лунки планшета, как описано в п Внести по 100 мкл субстрата в каждую лунку (при необходимости исследования большого количества образцов использовать ванночку для реагентов и 8-канальную пипетку). Чтобы снять излишки субстрата с верхнего края лунок, необходимо промокнуть лунки фильтровальной бумагой. Немедленно поставить планшет в темноту, инкубировать его при комнатной температуре 30 мин Учет результатов: - При визуальной интерпретации результатов: считывание результатов проводится сразу после инкубации. Стоп-реагент не добавляется. - При автоматизированном учете результатов: по окончании инкубации добавить в каждую лунку по 100 мкл стоп-реагента. В течение 5-ти минут (не более) после добавления стоп-реагента измерить оптическую плотность в каждой лунке, используя фотометр планшетный (ридер) с длиной волны 450 им. 9. Интерпретация результатов 9.1. Интерпретации результатов, полученных с помощью ридера: При значении оптической плотности 0,3 и менее результат расценивается как отрицательный - в исследуемой пробе пищевого продукта бактерии рода Listeria не обнаружены При значении оптической плотности более 0,3 проба пищевого продукта расценивается как положительная, и требуется подтверждение наличия в пробе жизнеспособных бактерий рода Listeria Интерпретация результатов при визуальном учете: При окраске содержимого лунки в синий цвет результат расценивается как положительный, и требуется подтверждение наличия в пробе жизнеспособных бактерий рода Listeria При окраске содержимого лунки в прозрачный или бледно-голубой цвет результат расценивается как отрицательный, то есть проба пищевого продукта не содержит бактерий рода Listeria. 10. Подтверждение положительных результатов
10 10.1. Из бульона Фразера, не подвергавшегося термообработке, провести высев на плотные питательные среды (не менее 2). Инкубировать при температуре 30 С в течение часов. При наличии подозрительных колоний провести биохимическое и серологическое типирование При положительном результате биохимического и серологического типирования проба пищевого продукта считается положительной и расценивается как содержащая жизнеспособные бактерии рода Listeria. 11. Способы отбора смывов В ходе производственного контроля пищевых предприятий, вырабатывающих и реализующих пищевые продукты, широко используется метод смывов с целью контроля эффективности санитарной обработки инвентаря, оборудования, посуды, санитарной одежды и рук персонала. Метод смывов дает возможность оценить санитарно-эпидемиологическое состояние обследуемых объектов Отбор смывов производится с помощью стерильных увлажненных ватных тампонов. Стерильные ватные тампоны на стеклянных, металлических или деревянных палочках, вмонтированных в пробки для пробирок, заготавливают заранее в лаборатории. В день взятия смывов в каждую пробирку с тампоном наливается (в асептических условиях) по 5 мл бульона предобогащения (половинный бульон Фразера) таким образом, чтобы тампон не касался жидкости Непосредственно перед отбором смыва с поверхности тампон опускают в жидкость При проведении отбора смывов необходимо использовать трафарет в соответствии с установленным порядком контроля объектов. После отбора смывов пробирки со средой обогащения вместе с тампоном необходимо поместить в термостат на 24 ч, инкубировать при 30 С Далее исследование проводится в соответствии с п. п Требования к помещениям и технике безопасности Работа по определению бактерий рода Listeria методом твердофазного иммуноферментного анализа должна осуществляться в соответствии с требованиями СП "Безопасность работы с микроорганизмами III - IV групп патогенности и гельминтами", ГОСТ Р "Микробиология. Продукты пищевые. Общие правила микробиологических исследований". 13. Чувствительность метода Чувствительность метода составляет: 1 КОЕ бактерий рода Listeria на 25 г пробы пищевого продукта до этапа предобогащения (по данным инструкции производителя тест-системы).
11 Чувствительность метода перед детекцией в ИФА - от 100 до жизнеспособных бактерий рода Listeria в 1 мл культуральной жидкости.
Читайте также:
- Расшифровка анализа на золотистый стафилококк у ребенка
- Стафилококк эпидермальный в мочеполовой системе у женщин
- Экстренная профилактика сыпного тифа
- У меня нашли трихомонады что делать
- Лабораторная диагностика лямблиоза у детей


