Лецитиназная активность стафилококков выявляется на агаре
1. Изучение мазков из чистой культуры стафилококка, окрашенных по Граму (зарисовать)
В препарате из чистой культуры видны грамположительные кокки, располагающиеся скоплениями в виде “виноградных гроздьев”. Могут встречаться единичные кокки или маленькие кучки.
2. Изучение мазков из гноя, окрашенных по Граму (зарисовать)
В мазке, на фоне клеточного детрита, окрашенного в розовый цвет, видны лейкоциты и грамположительные кокки, расположенные одиночно или небольшими кучками, не образующие капсул. Расположение кокков позволяет предположить длительность заболевания. Если заболевание свежее, то микробы располагаются внеклеточно, в более поздние сроки болезни можно наблюдать кокки, фагоцитированные лейкоцитами.
3. Изучение характера роста стафилококков на кровяном агаре (зарисовать)
Посев на кровяном агаре позволяет определить тип гемолизина, выделяемого стафилококками. Гемолитическая активность является одним из признаков патогенности стафилококков. Для приготовления кровяного агара, к 1,8 % МПА расплавленного и остуженного до 45–50 градусов добавляют 5% дефибринированной или свежевзятой крови животного (кролика, барана, крупного рогатого скота) или человека. После тщательного перемешивания агар разливают по чашкам. Гемолизин стафилококков вызывает растворение стромы эритроцитов, поэтому вокруг колоний стафилококков, обладающих гемолитической активностью, образуются светлые зоны гемолиза. Штаммы, образующие альфа-гемолизин, вызывают гемолиз кроличьих и бараньих эритроцитов, бета-гемолизин вызывает тепло-холодовой гемолиз только бараньих эритроцитов. Вокруг колоний стафилококков без гемолитической активности кровяной агар не изменен.
4. Изучение характера роста стафилококков на желточно-солевом агаре (ЖСА) (зарисовать)
Посев на желточно-солевом агаре проводят для определения лецитовителлазы (лецитиназы). Для приготовления ЖСА к 10% солевому агару, расплавленному и остуженному до 60 градусов, добавляют 10% желточной взвеси (1 желток асептично взбалтывают в 200 мл физиологического раствора), агар тщательно смешивают и разливают в чашки.
St.aureus образует на желточно-солевом агаре непрозрачные круглые, слегка выпуклые колонии золотистого или желтого цвета. Среда вокруг колоний мутнеет за счет расщепления липовителлина (комплекс жира и белка), содержащегося в желтке ферментом лецитиназой. В результате действия фермента от липовителлина отрываются жирные кислоты, степень дисперсности белка уменьшается, происходит преципитация его, что приводит к помутнению среды. Освобождение жирных кислот сопровождается образованием “радужного” ореола вокруг колоний (лецитиназоположительные стафилококки).
St.epidermidis на желточно-солевом агаре образует колонии белого цвета или лимонно-желтые с ровным краем, среднего размера. Среда вокруг колоний не изменена (лецитиназоотрицательные стафилококки).
5. Изучение характера роста стафилококков на молочно-солевом агаре (зарисовать)
Молочно-солевой агар используют для выделения стафилококков из материала, обильно обсемененного микробами, а также для определения пигмента образуемого стафилококками. Для приготовления молочно-солевого агара к 6,5% солевому агару, расплавленному и остуженному до 50 градусов, добавляют 10% стерильного обезжиренного молока. Агар тщательно перемешивают с молоком и разливают в чашки. Для лучшего выявления пигмента посевы инкубируют 18-20 часов при 37 градусах, а затем до 2 суток при комнатной температуре в рассеянном свете.
St.aureus образует колонии золотистого цвета средних размеров, блестящие, выпуклые. St.epidermidis образует подобные колонии белого цвета. St. citreus (только как образующий пигмент) образует подобные колонии лимонно-желтого цвета.
6. Изучение лабораторной диагностики стафилококковых инфекций по схеме (зарисовать)
Основные методы микробиологического исследования:
Микроскопический метод. Метод основан на обнаружении стафилококков при микроскопическом исследовании мазков из материала, которые окрашивают по Граму. Под микроскопом изучают гной, отделяемое ран, слизь и налеты с миндалин и другой материал, содержащий большое количество микробов. Микроскопическое исследование крови не производят, так как кокки в мазках обнаружить не удается. Жидкий материал наносят на предметное стекло пипеткой или петлей. Густой материал растирают на стекле в капле воды, материал с тампона размазывают по стерильному предметному стеклу. В мазках обнаруживают грамположительные кокки среди лейкоцитов или внутри них. Отмечают степень обсемененности. Определить вид кокков в мазке не всегда удается, поэтому микроскопическое исследование носит ориентировочный характер. Но даже обнаружение в материале типичных по морфологии стафилококков не позволяет поставить диагноз инфекции, потому что присутствие стафилококков в исследуемом материале не всегда является доказательством его этиологической роли, по морфологии невозможно отдифференцировать патогенные стафилококки от непатогенных. Поэтому наряду с микроскопическим исследованием обязательно проводят бактериологическое исследование.
Бактериологический метод. Бактериологический диагноз основан на выделении чистой культуры стафилококка путем посева и определения его патогенных свойств. Этот метод используется также для установления источника инфекции факторов передачи инфекции, определения схемы антибактериальной терапии, ее эффективности, контроля за лечением и эпидемическим режимом в лечебных учреждениях. Важным условием бактериологической диагностики является определение качественных и количественных критериев содержания патогенного стафилококка.
Исследование гноя (слизи из носа или зева, налета)
Для посева материала выбирают необходимые питательные среды. Стафилококки к питательным средам неприхотливы и способны расти на МПА. Но для повышения высеваемости и возможности провести количественный учет и надежно отличить патогенные стафилококки от непатогенных используют элективные питательные среды. В качестве элективных сред используют молочно-солевой, желточно-солевой агар или молочно-желточно-солевой агар. Элективность этих сред обеспечивается высоким содержанием хлорида натрия (6,5–10%), добавленное молоко позволяет определить цвет образуемого пигмента, а яичный желток – выявить лецитовителлазную (лецитиназную) активность, которая является одним из факторов патогенности стафилококков.
Для посева материала используют также кровяной агар, который дает возможность определить наличие пигмента и гемолитическую активность. Однако нужно помнить, что результат исследования (наличие гемолитической активности) зависит от вида крови, ее концентрации, густоты крови, присутствия и характера сопутствующей флоры. Поэтому использование кровяного агара рекомендуется для первичного посева материала, не содержащего другой микрофлоры.
Для оценки обсемененности производят количественный посев материала, готовя из него разведения, и высевают по 0,1 мл из разведений десять во второй, десять в четвертой и десять в шестой степенях. С тампона засевают цельный материал. Посевы на ЖСА инкубируют в течение 2 суток, а на кровяном агаре – 18–20 часов.
Так как ЖСА является элективной средой, то на нем вырастают только колонии стафилококков. Обращают внимание на наличие лецитиназоположительных колоний, подсчитывают их, отбирают 2-3 колонии для дальнейшего исследования. Если на ЖСА вырастают только лецитиназоотрицательные стафилококки, то из посева тоже отбирают не менее 2 колоний. И лецитиназоположительные и лецитиназоотрицательные стафилококки отсевают на скошенный мясопептонный агар. После суточного инкубирования выделенную культуру изучают в мазках, окрашенных по Граму, определяя морфологию микробов и чистоту культуры. При наличии в мазке грамположительных кокков, расположенных характерными гроздьями, проводят исследование для идентификации стафилококков. Согласно генотипической классификации род Staphylococcus относится к семейству Staphylococcасеае, класс Bacilli, в которое входят также роды: Jeotgalicoccus, Macrococcocus, Nosocomiicoccus, Salinicoccus. Общими признаками для представителей этого семейства является то, что все они грамположительные кокки. Для установления принадлежности к роду Staphylococcus проводится первичная идентификация по наличию каталазы и способности ферментировать глюкозу в анаэробных условиях.
Стафилококки ферментируют маннит в анаэробных условиях (табл.10). Микрококки не ферментируют глюкозу в анаэробных условиях, так как они облигатные аэробы.
Не нашли то, что искали? Воспользуйтесь поиском:
а) Желточно-солевой агар. Среда предназначена для выделения стафилококков и выявления пигмента.
Для приготовления используют мясопептонный агар (pH 7,3±0,1) с добавлением 10% натрия хлорида. После розлива во флаконы по 100,0-200,0 мл агар стерилизуют в автоклаве в течение 20 мин при температуре 121°С.
Перед употреблением среду расплавляют, охлаждают до 45-50°С и добавляют 20% (по объему) стерильной желточной взвеси (1 желток куриного яйца на 150,0-200,0 мл стерильного изотонического раствора натрия хлорида). Среду быстро перемешивают, разливают в чашки, которые продолжительное время могут оставаться в холодильнике в полиэтиленовых пакетах. Готовая среда полупрозрачна, имеет беловатый цвет с легким кремовым оттенком.
Учет результатов производят через 36-48 ч инкубации в термостате при 35-37°С. На этой среде хорошо выявляются пигментные свойства микроорганизма, обусловленные липохромным пигментом. Вокруг колоний можно видеть радужный венчик за счет образования лецитовителлазы. Добавление к среде 10% стерильного снятого молока усиливает пигментообразование.
б) Желточная среда по Г.Н.Чистовичу. Среда предназначена для определения лецитиназной активности стафилококков.
К мясопептонному питательному агару, приготовленному по общепринятой прописи, добавляют 20% желточной взвеси (1 желток куриного яйца на 150,0-200,0 мл стерильного изотонического раствора натрия хлорида).
При определении лецитиназной активности по методу Чистовича исследуемую культуру стафилококка засевают на среду отдельными штрихами или бляшками. Посевы помещают в термостат при 36-37°С. Вокруг колоний стафилококка, продуцирующих лецигиназу, образуются четко выраженные зоны помутнения с радужным венчиком по периферии.
в) Среда Casman E.R. в модификации Ф.С.Флуера для получения стафилококкового энтеротоксина.
Состав:
Ферментативный гидролизат казеина
Цитрат железа — 0,25 г
KH2PO4 - 1,0 г
К2HPO4*3H2O - 1,0 г
MgSO4*7H2O - 0,2 г
L-цистин — 0,025 г
L-триптофан — 0,075 г
Ацетат натрия — 7,0 г
Кальция пантетонат — 0,0005 г
Тиамин гидрохлорид — 0,00004 г
Никотиновая кислота — 0,0012 г
Дистиллированная вода — до 1000,0 мл
Навески ингредиентов (кроме четырех — см. ниже) вносят в колбу с ферментативным гидролизатом казеина; объем ферментативного гидролизата вносится из расчета конечного содержания аминного азота в среде — 2,0 г/л. Затем вносят L-триптофан, предварительно растворенный в 3 мл 1N раствора НО. Общий объем воды доводят до 1 л дистиллированной водой, тщательно перемешивают. Подогревают (при частом перемешивании) и кипятят 1 мин для полного растворения. Устанавливают pH среды 7,3. Стерилизуют автоклавированием при 121°С в течение 15 мин.
Кальций пантетонат, тиамин гидрохлорид и никотиновую кислоту стерилизуют отдельно через миллипоровские фильтры и добавляют асептически в среду перед посевом.
Подготовка раствора кальция пантегоната: берут навеску 500,0 мкг, растворяют в 10,0 мл дистиллированной воды, стерилизуют пропусканием через миллипоровский фильтр и 1,0 мл стерильного пангентоната кальция асептически перед посевом добавляют к 1,0 л питательной среды перед посевом.
Подготовка раствора тиамина гидрохлорида: берут навеску 40,0 мкг, растворяют в 10,0 мл дистиллированной воды, стерилизуют пропусканием через миллипоровский фильтр и 1,0 мл стерильного раствора тиамин гидрохлорида асептически добавляют к 1,0 л питательной среды перед посевом.
Подготовка раствора никотиновой кислоты: берут навеску 12,0 мкг никотиновой кислоты, растворяют в 10,0 мл дистиллированной воды, стерилизуют пропусканием через миллипоровский фильтр и 1,0 мл стерильной никотиновой кислоты асептически добавляют к 1,0 л питательной среды перед посевом.
г) Бульон для энтеротоксигенных стафилококков HiMedia, Casein Hydrolysate Broth. Бульон используют для культивирования стафилококков с целью получения энтеротоксина, используемого в пробе на котятах и в серологических исследованиях.
Состав, г/л:
Гидролизат казеина кислотный — 20,0
Железа цитрат — 0,025
Калия дигидроортофосфат — 2,0
Магния сульфат — 0,20
L-цистин — 0,025
Натрия ацетат — 7,0
L-триптофан — 0,075
Кальция пантотенат — 0,0005
Тиамин — 0,00004
Никотиновая кислота — 0,0012
pH 7,3±0,2
Навеску среды 29,33 г вносят в 1000,0 мл дистиллированной воды. Тщательно размешивают. Подогревают (при частом помешивании) и кипятят 1 мин для полного растворения. Устанавливают pH. Разливают в соответствующие емкости. Стерилизуют при 121°С в течение 15 мин.
Испытуемые на энтеротоксигенность стафилококки засевают на этот бульон, выращивают в течение 18-24 ч при 35°С в атмосфере, содержащей 30% углекислоты. Полученную культуру из каждой пробирки в количестве 3,0 мл засевают в два флакона со 100,0 мл той же среды и инкубируют в тех же условиях 3 дня. Бульонные культуры затем центрифугируют и надосадочную жидкость пропускают через мембранный фильтр для стерилизации.
Полученные фильтраты тестируют на присутствие α- и β-гемолизинов. В случае положительного результата токсин денатурируют прогреванием или нейтрализуют иммунной сывороткой. После денатурации фильтраты можно вводить котятам и наблюдать за появлением рвоты.
Этот бульон можно использовать для приготовления плотной среды, если добавить в его состав агар. Культуры, выращенные на таком агаре, можно применять и для заражения других животных, и для исследования в системе антиген-антитело методом диффузии.
Готовая среда янтарной окраски, прозрачна или опалесцирует.
д) Бульон для получения и очистки токсина синдрома токсического шока (ТСТШ).
Состав:
Бактопентон Difco — 6,0 г
Никотиновая кислота — 1,0 мг
Солянокислый тиамин — 5,0 мг
Бактопептон Difco растворяют в 100,0 мл дистиллированной воды, устанавливают pH6,5 и проводят стерилизацию в течение 15 мин при 121°С. Никотиновую кислоту и солянокислый тиамин добавляют асептически в среду перед посевом. Предварительно берут 10,0 мг никотиновой кислоты, растворяют в 10,0 мл дистиллированной воды, стерилизуют пропусканием через миллипоровский фильтр и 1,0 мл добавляют к 100,0 мл среды перед посевом.
Раствор солянокислого тиамина готовят следующим образом: берут 50,0 мг солянокислого тиамина, растворяют в 10,0 мл дистиллированной воды, затем стерилизуют пропусканием через миллипоровский фильтр и асептически добавляют 1,0 мл к 100,0 мл основной среды.
е) Солевой бульон для обогащения материала, исследуемого на энтеротоксигенные стафилококки. К 100,0 мл мясопептонного бульона (МПБ) с pH 7,3 добавляют 6,5 г хлористого натрия и разливают в пробирки по 10,0 мл, стерилизуют в автоклаве при 121°С в течение 20 мин.
ж) Среда Фогель-Джонсона, плотная среда для выделения энтеротоксигенных стафилококков.
Состав:
Триптиказа — 1,0 г
Дрожжевой экстракт — 0,5 г
Глицин — 1,0 г
Маннит — 1,0 г
Хлористый литий — 0,5 г
Двузамещенный фосфат катия K2HPO4*3H2O — 0,5 г
Теллурит калия (1% раствор) — 2,0 мл
Феноловый красный — 0,0025 г
Агар — 1,6 г
Дистиллированная вода — 100,0 мл
Навески триптиказы, дрожжевого экстракта, глицина, маннита, хлористого лития, двузамещенного фосфата калия, фенолового красного и агара растворяют в 100,0 мл дистиллированной воды.
Устанавливают pH 7,2 и стерилизуют в автоклаве при 121°С 20 мин. Теллурит калия добавляют асептически в остуженную среду до 45°С перед посевом. Среду разливают в чашки Петри.
з) Теллурит-полимиксин-желточный агар (г/100 мл) для выделения энтеротоксигенных стафилококков.
Состав:
Триптон — 1,1 г
Дрожжевой экстракт — 0,55 г
Маннит — 0,55 г
Хлорид натрия NaCl — 2,2 г
Теллурит калия (1%-ный раствор) — 1,0 мл
Желток яйца (в 50 мл физиологического раствора) — 10,0 мл
Полимиксинсульфат (1%-ный раствор) — 0,04 мл
Агар — 2,0 г
Навески триптона, дрожжевого экстракта, маннита, хлористого натрия и агар добавляют в колбу с 100,0 мл дистиллированной воды, доводят до кипения.
Устанавливают pH среды 7,2 и стерилизуют в автоклаве при 121°С в течение 15 мин. В остуженную до 45°С среду асептически вносят раствор теллурита калия, взвесь желтка куриного яйца и полимиксин, после чего среду разливают в чашки Петри по 25,0 мл. Выросшие колонии стафилококка имеют черный цвет.
з) Среда Baird-Parker (г/100,0 мл) для выделения энтеротоксигенных стафилококков.
Состав:
Триптон — 1,0 г
Мясной экстракт — 0,5 г
Дрожжевой экстракт — 0,1 г
Глицин — 1,2 г
Пируват натрия — 1,0 г
Хлористый литий — 0,5 г
Теллурит калия (2,0%-ный раствор) — 0,5 мл
Желток яйца — 5,0 мл
Агар — 2,0
Вода дистиллированная — 100,0 мл
Все навески (кроме раствора теллурита и желтка) размешивают в 100,0 мл дистиллированной воды. Смесь нагревают при перемешивании и кипятят в течение 1 мин до полного расплавления ингредиентов. Устанавливают pH 7,1 и стерилизуют при 121°С в течение 15 мин. Основа среды может храниться в холодильнике в течение 1 мес. Перед употреблением в расплавленную и охлажденную до 45°С основу, соблюдая правила асептики, прибавляют из расчета на 100,0 мл среды 0,5 мл 2%-ного раствора теллурита калия и 0,5 мл эмульсии яичного желтка.
Среду тщательно перемешивают и разливают в чашки Петри в объеме не менее 20,0 мл на чашку. Чашки со средой могут быть использованы в течение 24-28 ч. Перед посевом чашки со средой подсушивают в термостате общепринятым способом.
Выросшие колонии S. aureus имеют черный цвет (за счет восстановления теллура) с зонами просветления и опалесценции (за счет лецитиназы).
и) Основа дифференцирующего агара (с плазмой) для стафилококков HiMedia, Coagulase Mannitol Agar Base. Среду с добавкой плазмы используют для выделения и дифференциации Staphylococcus spp. из патологического материала и для идентификации чистых культур S.aureus по способности коагулировать плазму и ферментировать маннит.
Состав, г/л:
Настой мозга и сердца — 5,0
Гидролизат казеина ферментативный — 10,5
Перевар соевой муки папаиновый — 3,5
Натрия хлорид — 3,5
Маннит — 10,0
Бромкрезоловый пурпурный — 0,02
Агар — 14,5
pH 7,4±0,2
Размешивают 47,0 г среды в 1000,0 мл дистиллированной воды. Кипятят до полного растворения частиц. Стерилизуют при 121°С в течение 15 мин. Охлаждают до 45-50°С и асептически добавляют до 7-15% (об.) стерильную предварительно проверенную плазму. Тщательно перемешивают и разливают в стерильные чашки Петри.
В случае ферментации маннита среда вокруг колонии закисляется, и индикатор бромкрезоловый пурпурный окрашивается в желтый цвет. Если микроорганизмы коагулируют плазму, вокруг их колоний образуется непрозрачная зона. Коагулазоотрицательными видами стафилококка маннит может ферментироваться с образованием желтой зоны, но она не будет мутной.
Готовая среда имеет лиловую окраску, слегка опалесцирует.
к) Среда для выявления термостабильной дезоксирибонуклеазы (ДНКазы) у энтеротоксигенных стафилококков. ДНКаза определяется по методу, основанному на метахроматических свойствах толуидина голубого.
К 1000,0 мл 0,05 М трис-буфера (оксиметиламинометан), pH 9,0, добавляют 0,3 г ДНК, затем 10,0 г агара Difco, 1 мл 0,01 М раствора CaCl2, 10,0 г хлористого натрия, 3,0 мл 0,1 М раствора толуидина голубого. Среду разливают в пробирки по 12-15 мл, закрывают резиновыми пробками и хранят в холодильнике до 3-5 мес.
Перед постановкой реакции среду растапливают и разливают в чашки Петри, подсушивают при 37°С в течение 1 ч, стерильно вырезают лунки диаметром 3 мм, отсасывают пипеткой агар и вносят в лунки пастеровской пипеткой взвеси испытуемых культур.
Для этого пробирки с суточным ростом испытуемых культур стафилококков на полужидком питательном агаре прогревают в кипящей водяной бане 15 мин и вносят в лунки в агаровой пластинке, содержащей ДНК и толлуидин голубой инкубируют при 37°С. В результате гидролиза ДНК, находящейся в среде, термостабильной ДНКазой стафилококков, образуются зоны просветления с розовым окрашиванием. Появление через 1-2 ч зон, окрашенных в розовый цвет, расценивается как положительная реакция на наличие термостабильной ДНКазы.
л) Молочно-солевой агар С.Л. Петрович (для определения каротиноидного пигмента стафилококков). К расплавленному мясопептонному агару с pH 7,2±0,2, содержащему 5-7,5% натрия хлорида, добавляют ex tempore 10% стерильного теплого молока, хорошо обезжиренного, тщательно перемешивают и разливают в стерильные чашки Петри.
Редактор: Искандер Милевски. Дата публикации: 25.2.2020
Глава 14. Стафилококки
Впервые стафилококки были обнаружены Л. Пастером в 1897 г. Подробно они были изучены А. Огстоном (1882) и Ф. Розенбахом (1884).
Морфология. Стафилококки (от греч. staphyle - виноградная гроздь) имеют вид круглых шаров диаметром 0,5-1,5 мкм. Размножаясь, образуют скопления в виде грозди винограда. Такая форма является результатом деления микробов в различных плоскостях. Однако в гное встречаются единичные и парные кокки. Стафилококки неподвижны, не имеют спор, при специальных условиях культивирования образуют микрокапсулу, грамположительны.
Культивирование. Стафилококки - факультативные анаэробы, однако лучше растут в присутствии кислорода. Растут и размножаются на обычных питательных средах, хорошо растут на средах с кровью, оптимальные условия - температура 37° С, рН 7,2-7,4.
Элективными средами являются желточно-солевой агар и солевой агар. На МПА колонии стафилококка выпуклые, круглые, непрозрачные, блестящие, размером 2-4 мм с ровными краями. При росте стафилококки образуют пигмент: золотистый, лимонно-желтый или белый. Лучше всего пигмент образуется на молочной среде при комнатной температуре и рассеянном свете. Стафилококковый пигмент не растворяется в воде, растворяется в ацетоне, эфире, спирте и т. д. При росте некоторых штаммов стафилококка на агаре с кровью вокруг колонии образуется зона гемолиза. Рост на бульоне характеризуется равномерным помутнением и осадком на дне.
Ферментативные свойства. Стафилококки вырабатывают сахаролитические и протеолитические ферменты. Сахаролитические ферменты расщепляют ряд сахаров: лактозу, глюкозу, сахарозу, мальтозу, глицерин и другие с образованием кислоты.
Протеолитические свойства стафилококка выражаются в способности растворять казеин, разжижать желатин (медленно), расщеплять другие белковые субстраты.
Стафилококки продуцируют ферменты патогенности: 1) коагулазу (сворачивает плазму крови); 2) гиалуронидазу (фактор распространения); 3) лецитиназу (растворяет лецитин оболочки клеток); 4) фибринолизин (лизирует фибрин); 5) ДНКазу (деполимеризует ДНК); 6) фосфатазу и др.
Наличие плазмокоагулазы позволяет дифференцировать золотистый стафилококк от стафилококков других видов. Многие стафилококки вырабатывают пенициллиназу, разрушающую пенициллин.
Токсинообразование. Стафилококки вырабатывают экзотоксины. К их числу относятся гемолизины четырех типов, из которых наибольшее значение имеет α-токсин. Он обладает следующими свойствами: гемолитическим - вызывает гемолиз эритроцитов, дермонекротическим - при внутрикожном введении вызывает некроз, летальным - при внутривенном введении приводит к гибели чувствительных к нему животных.
Кроме гемолизинов стафилококки образуют лейкоцидин, убивающий лейкоциты, энтеротоксины шести типов, вызывающие пищевые отравления, эксфолиатины двух типов, приводящие к отслаиванию эпидермиса у новорожденных детей.
Антигенная структура. Стафилококки имеют протеиновый антиген А, общий для всех золотистых стафилококков, и полисахаридные антигены: А, Б, С.
Стафилококки выделяют бактериоцины (стафилоцины), которые обладают антагонистическим действием по отношению к микроорганизмам данного рода.
Среди золотистых (реже эпидермальных) стафилокков различают около 40 фаговаров. Определение чувствительности выделенных из различных объектов стафилококковых культур к типовым фагам имеет важное эпидемиологическое значение (при установлении источника и путей передачи возбудителя).
Классификация. В настоящее время стафилококки, выделенные от человека, делят на 3 вида (табл. 23): S. aureus, S. epidermidis, S. saprophyticus.

Таблица 23. Дифференциация видов стафилококков, выделенных от человека
Примечание. + наличие ферментации, устойчивости, - отсутствие ферментации, устойчивости.
Устойчивость к факторам окружающей среды. Стафилококки довольно устойчивы, поэтому они обнаруживаются в воздухе, почве, воде, на предметах обихода. При температуре 100° С они погибают моментально, при температуре 70° С - через 10-15 мин. Они хорошо переносят низкие температуры. При замораживании сохраняют жизнеспособность в течение нескольких лет. Хорошо переносят высушивание. Прямой солнечный свет убивает их только через несколько часов. Обычные растворы дезинфицирующих веществ (например, сулема в разведении 1:1000) убивают их через 15-20 мин. При обезвреживании выделений, содержащих гной, белок, мокроту, не следует применять фенол. Это дезинфицирующее вещество вызывает коагуляцию белков, что предохраняет микроорганизмы от гибели. Стафилококки чувствительны к бриллиантовому зеленому.
Восприимчивость животных. К стафилококку чувствительны крупный и мелкий рогатый скот, лошади, свиньи, куры. Из экспериментальных животных - кролики, белые мыши и котята.
Источники инфекции. Больной человек и бактерионоситель.
Пути передачи. Контактно-бытовой, воздушно-капельный, воздушно-пылевой, пищевой.
Заболевания у человека. Пиодермия, фурункулы, карбункулы, панариции, абсцессы; воспалительные процессы различных органов и тканей; ангины, циститы, остеомиелиты, холециститы, маститы; сепсис и септикопиемия; пищевые токсикоинфекции и многие другие. Описано около 120 нозологических форм стафилококковой этиологии.
Патогенез. Стафилококки проникают через кожу и слизистые оболочки.
Преимущественное значение при стафилококковых заболеваниях имеет золотистый стафилококк (S. aureus). Менее выражена роль в патологии человека S. epidermidis и S. saprophyticus. Патогенез обусловливается свойствами возбудителя - ферментами, экзотоксинами, веществами бактериальной клетки и состоянием иммунной системы макроорганизма.
Чаще поражается кожа и подкожная клетчатка - возникают пиодермиты, фурункулы, панариции. Нередко стафилококки обусловливают вторичные заболевания, например пневмонию при гриппе. Они также вызывают раневые инфекции. Особенно велика роль стафилококков в акушерской практике, так как новорожденные очень чувствительны к ним. В течении стафилококковых заболеваний имеет значение развитие аллергии, поэтому заболевание характеризуется рецидивами.
Особое место среди стафилококковых заболеваний занимают пищевые интоксикации. Клинически они протекают как токсикозы, сопровождаются рвотой, поносом, головной болью и другими явлениями.
Иммунитет. У человека имеется естественная резистентность, связанная с механическими факторами, фагоцитозом и наличием антител. Воспалительный процесс, возникающий в месте внедрения возбудителя, обусловливает задержку стафилококков и затрудняет их распространение по организму. В образовавшемся очаге стафилококки подвергаются фагоцитозу.
Образующийся в процессе заболевания антитоксин является важным фактором в общем комплексе иммунитета. Однако приобретенный иммунитет нестойкий, поэтому наблюдаются рецидивы.
Профилактика. Сводится к улучшению санитарно-гигиенических условий, активному выявлению больных и бактерионосителей, правильному режиму работы больничных учреждений.
Специфическая профилактика. Стафилококковый анатоксин и антистафилококковый иммуноглобулин.
Лечение. Антибактериальные препараты, поливалентный стафилококковый бактериофаг, антистафилококковая плазма и иммуноглобулин. В некоторых случаях при хроническом течении стафилококковых инфекций применяют аутовакцину.
1. По какому признаку кокки объединены в одну группу?
2. Какие ферменты и факторы патогенности продуцируют стафилококки?
3. Какие заболевания вызывают стафилококки?
4. Какие виды стафилококков Вы знаете?
Цель исследования: выделение и идентификация стафилококков.
1. Гной (фурункулы, карбункулы, абсцессы).
2. Слизь из зева (ангина).
3. Мокрота (пневмония).
4. Моча (пиелиты и циститы).
5. Дуоденальное содержимое (холецистит).
6. Кровь (подозрение на сепсис).
7. Рвотные массы, промывные воды желудка, пищевые продукты (пищевые отравления).
8. Слизь из носа (обследование на бактерионосительство).

Способы сбора материала

Первый день исследования
Все посевы ставят в термостат на сутки.
Обнаружение стафилококков при микроскопии гноя из закрытого абсцесса и осадка мочи, взятой катетером, позволяет дать предварительный положительный ответ: обнаружен стафилококк.
Посевы на плотных и жидких питательных средах вынимают из термостата и изучают. Подозрительные в отношении стафилококка колонии, выросшие на желточно-солевом агаре, отсевают на скошенный агар для получения и дальнейшего изучения чистой культуры. При этом учитывают наличие лецитиназы, которое проявляется в образовании радужного венчика вокруг колонии. Чашки с оставшимися колониями оставляют на 2-3 дня при комнатной температуре для выявления пигмента. Просматривают посевы на чашках с агаром, содержащим кровь. Колонии с четкой зоной гемолиза (просветление) вокруг них выделяют на скошенный агар. Посев крови в сахарном бульоне инкубируют 10 сут, производя через 2-3 дня высевы на агар с кровью и желточно-солевую среду.
При отсутствии роста на плотных питательных средах делают высев из бульона с глюкозой на агар с кровью. Посевы ставят в термостат на сутки.
Вынимают посевы из термостата. Из выделенных на скошенный агар культур делают мазки, окрашивают по Граму и микроскопируют. При наличии грамположительных стафилококков проводят дальнейшее изучение выделенной культуры:
а) ставят реакцию плазмокоагуляции;
б) изучают гемолитические свойства;
в) определяют продукцию ДНКазы;
г) определяют ферментацию маннита в анаэробных условиях;
д) определяют устойчивость к новобиоцину.
Реакция плазмокоагуляции. Цитратную плазму, полученную из крови кролика, разводят изотоническим раствором натрия хлорида в соотношении 1:4 и наливают в две преципитационные пробирки по 0,3-0,5 мл. В одну пробирку вносят петлю исследуемой культуры, другая пробирка служит контролем. Обе пробирки ставят в термостат при температуре 37° С. Учет реакции производят через 2-3 ч. При отсутствии свертывания плазмы посевы оставляют при комнатной температуре на 24 ч, после чего учитывают реакцию. При наличии фермента коагулазы плазма свертывается (не выливается из перевернутой пробирки). В контрольной пробирке консистенция плазмы не изменяется.
Ускоренный метод определения коагулазы. В стерильной капле воды на предметном стекле суспендируют выделенную культуру, к ней прибавляют одну каплю неразведенной плазмы. При положительной реакции из микробных клеток в течение 20-60 с образуются крупные хлопья. Этот метод используют при массовых обследованиях.
Определение гемолитических свойств. Производят посев на агар с 5% крови (штаммы, продуцирующие α-гемолизин, дают зоны просветления среды и на кроличьей и на бараньей крови, продуцирующие β-гемолизин лизируют только эритроциты барана).
Определение ДНКазы. Исследуемую культуру засевают на среду, содержащую ДНК. Посевы инкубируют. Через 18-20 ч на чашку с выросшими колониями стафилококка добавляют 5-7 мл раствора хлороводородной кислоты. ДНК реагирует с кислотой и среда становится мутной. Если выделенная культура продуцирует фермент ДНКазу, он деполимеризует ДНК и помутнение не образуется.
Расщепление маннита в анаэробных условиях. Исследуемую культуру засевают уколом на полужидкий агар с маннитом. Поверхность среды заливают вазелиновым маслом. Инкубируют 18-24 ч при 37° С. Положительная реакция характеризуется изменением цвета среды (в среде имеется индикатор).
Производят учет результатов (табл. 24).
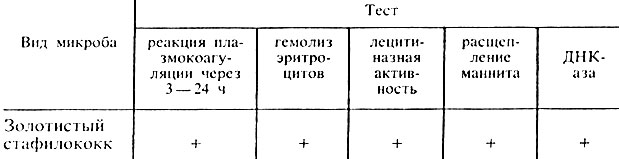
Таблица 24. Свойства золотистого стафилококка
Примечание. + положительная реакция.
Наличие перечисленных признаков позволяет отдифференцировать золотистые стафилококки от стафилококков других видов и дать окончательный ответ: выделен S. aureus (рис. 37).
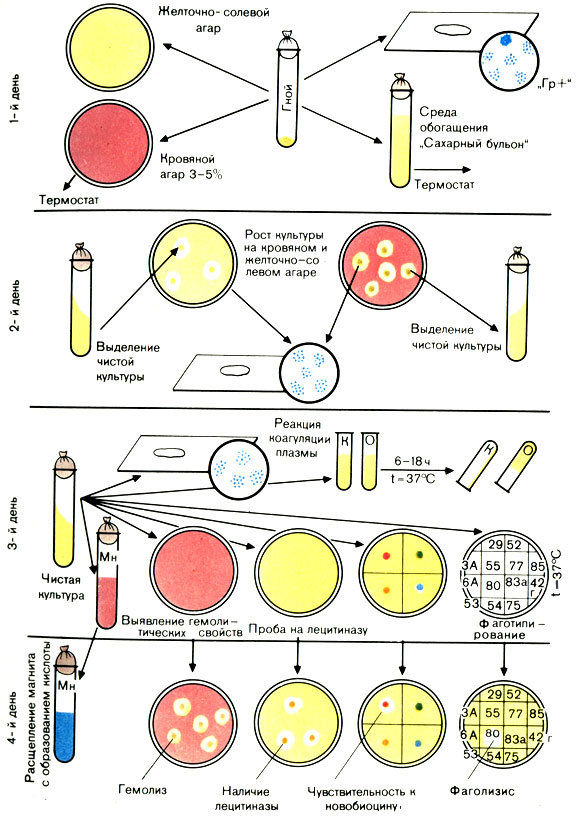
Рис. 37. Схема выделения и идентификации стафилококка
Для установления эпидемиологической цепочки выделенную культуру фаготипируют. Фаготипирование может подтвердить идентичность стафилококков, выделенных от разных больных и из объектов внешней среды.
Для фаготипирования используют критические тест-разведения фагов. Критическим тест-разведением называют то максимальное разведение фагов, при котором происходит полусливной лизис соответствующего штамма стафилококка.
Методика фаготипирования. В чашку Петри наливают 20 мл 1,5% МПА, дают ему застыть и подсушивают в термостате в течение 30-40 мин. На поверхность агара наносят 1 мл 4-6-часовой культуры выделенного стафилококка, распределяют по поверхности всей чашки, избыток жидкости отсасывают или дают ей испариться в термостате в открытой чашке. Предварительно дно чашки делят на секторы или квадраты. Число квадратов или секторов должно соответствовать количеству используемых фагов. Затем на каждый квадрат или сектор наносят один фаг.
Чашки ставят в термостат при температуре 37° С. Результаты определяют через 6-7 ч. Если чашки оставляют при комнатной температуре, то учет фаголизиса производят через 18-24 ч.
Биологические пробы. Проба на определение летальных свойств культуры. Для выявления летального действия токсина кролику вводят внутривенно (или внутрибрюшинно) фильтрат бульонной культуры стафилококка из расчета 0,1-0,2 мл фильтрата на 1 кг массы кролика. Гибель кролика через 3-4 дня свидетельствует о наличии летального действия токсина.
Дермонекротическая проба. Пробу ставят на кролике (наиболее чувствительному к этому токсину животному). Предварительно на боку или на спине животного выщипывают шерсть и вводят внутрикожно 0,2 мл двухмиллиардной взвеси стафилококковой культуры в изотоническом растворе натрия хлорида. При наличии в выделенной культуре некротических свойств в месте введения образуется инфильтрат, сопровождающийся некрозом.
Реакцию учитывают через 24-18 ч.
Полученную культуру стафилококка проверяют на чувствительность к антибиотикам методом бумажных дисков (см. главу 9).
1. Какой материал исследуют при заболеваниях, вызываемых стафилококками?
2. Каковы основные методы лабораторного исследования для выявления стафилококков?
3. Какова методика постановки реакции плазмокоагуляции?
4. На какой среде выявляют гемолитические свойства стафилококков?
5. С какой целью проводят фаготипирование?
Проверьте, к какому антибиотику чувствительна выделенная культура стафилококка.
Желточно-солевой агар Чистовича. Готовят желточную смесь (1 желток куриного яйца на 150 мл стерильного изотонического раствора натрия хлорида). К мясопептонному солевому агару (8-10% натрия хлорида), растопленному и остуженному до 45° С, добавляют 20% желточной взвеси (соблюдают стерильность) и разливают в чашки.
Агар с кровью. См. главу 7.
Солевой бульон, солевой агар. Готовят как обычные среды - МПБ и МПА, только натрия хлорид вносят в большем количестве (8-10%). Бульон разливают в колбы, пробирки, агар - в чашки.
Читайте также:


