Методы микробиологической диагностики брюшного тифа и паратифов а и
• Микробиологическая диагностика брюшного тифа и паратифов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: исходя из особенностей патогенеза брюшного тифа, на 1-й неделе заболевания, в период бактериемии, возбудителей выделяют из крови (получение гемокультуры), со 2-й недели заболевания — из испражнений (получение копрокультуры), мочи или желчи.
Бактериологическое исследование(схема 13.2.1).
Получение гемокультуры. В 1-й день из локтевой вены больного берут 5—10 мл крови и засевают в колбу с 50—100 мл селективной среды Раппопорт, содержащей желчный бульон (для подавления роста других бактерий), глюкозу, индикатор Андреде и поплавок для обнаружения газа. Указанные соотношения крови и среды необходимы для подавления бактерицидного действия белков крови. Посевы инкубируют при 37 "С в течение 18—20 ч. На 2-й день при росте сальмонелл наблюдается помутнение и изменение цвета среды. При росте паратифозных бактерий (биовары paratyphi А, Си schottmuelleri) наряду с указанными изменениями появляются пузырьки газа в поплавке. Для ускорения ответа из среды Раппопорт делают мазки и препараты "висячая" капля. При наличии чистой культуры грамотрицательных подвижных палочек и изменении цвета среды (или наличии газа) дают первый предварительный ответ. Затем культуру из среды Раппопорт пересевают в пробирку со средой Ресселя, полагая при этом, что из крови выделена чистая культура и можно сразу приступить к ее идентификации. Одновременно со среды Раппопорт делают посевы на среду Эндо для получения изолированных колоний с целью проверки чистоты выделенной культуры.
На 3-й день отмечают ферментацию глюкозы на среде Ресселя и ставят ориентировочную реакцию агглютинации на стекле. На основании полученных данных дают второй предварительный ответ. Для дальнейшего исследования отбирают несколько бесцветных колоний со среды Эндо и пересевают их в среду Ресселя или скошенный питательный агар (для контроля полученных результатов). Чистую культуру пересевают на среды "пестрого" ряда и серотипируют в реакции агглютинации на стекле со смесью групповых сывороток, а затем с

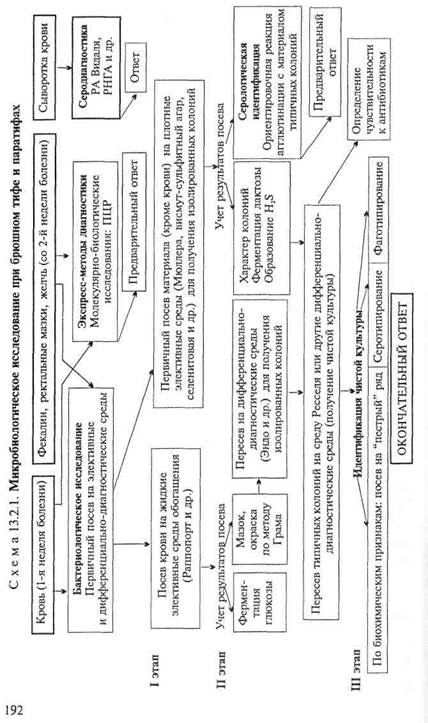 |
адсорбированными монорецепторными О- и Н-сальмонеллез-ными сыворотками. Окончательный диагноз устанавливают на основании биохимических (табл. 13.2.1) и антигенных свойств.
Таблица 13.2.1. Биохимические свойства сальмонелл — возбудителей брюшного тифа и паратифов
| Биовар S.enterica | Ферментация | Образование | |||||
| лактозы | глюкозы | мальтозы | сахарозы | ман-нита | H2S | NH3 | индола |
Paratyphi А - КГ КГ - КГ - -
Schottmuelleri — КГ КГ - КГ + +
Условные обозначения: К — образование кислоты; КГ — образование кислоты и газа; (+) — обнаружение признака; (—) — отсутствие признака.
Биохимические признаки (развернутый "пестрый" ряд) позволяют дифференцировать сальмонеллы от схожих сними энтеробактерий: Citrobacter, Hafnia (табл. 13.2.2).
Таблица 13.2.2. Дифференциация сальмонелл и других энтеробакте рий по биохимическим признакам
| Род | Лизин- декар- бокси- лаза | Ферментация углеводов | р- Галак-този-даза | ||
| дуль-цита | сорбита | ксилозы | рам-нозы | салицина | 4% лактозы |
Salmonella ± К(-) К К К - - -
Citrobacter - К(-) К К К К(±) К(±) К
Hafnia + - - К К К(+) - К
Условные обозначения: (+) — положительная реакция; (—) — отрицательная реакция; ± — вариабельная реакция; К — образование кислоты; К(—) — образование кислоты (редко); К(±) — образование кислоты (вариабельно).
Выделенную чистую культуру бактерий используют для определения чувствительности к антимикробным препаратам.
Фаготипирование. С помощью набора стандартных Vi-фагов определяют до 78 фаготипов S.enterica биовара typhi. При этом необходимым условием является наличие в культуре FZ-антигена. Культуры S.enterica биовара paratyphi В (schottmuelleri) дифференцируются на11 фаготипов и подтипов.
Получение копрокультуры. Испражнения засевают на одну из дифференциально-диагностических сред (Эндо или Левина) или элективные среды обогащения (Мюллера, селени-

товая или висмут-сульфит агар). Для посева петлю фекалий вносят в пробирку с изотоническим раствором хлорида натрия и готовят суспензию. После оседания крупных комочков суспензию петлей наносят на поверхность агаровой среды — на одну половину чашки. Материал тщательно растирают шпателем по одной, а затем по другой половине чашки для получения изолированных колоний. Посевы инкубируют при 37 °С в течение 18—20 ч. На 2-й день изучают характер колоний, выросших на чашках (рис. 13.2.1; на вклейке), пересевают 2—3 бесцветные колонии (со среды Эндо или Левина) или колонии черного цвета (висмут-сульфит агар) на среду Ресселя и в пробирки со скошенным питательным агаром. При отсутствии подозрительных колоний на чашках делают высевы из среды Мюллера или селенитовой среды на чашки со средой Эндо для получения изолированных колоний. Для ускорения ответа ставят ориентировочную реакцию агглютинации на стекле с материалом, взятым из бесцветной колонии. Далее поступают так же, как и при идентификации гемокультуры.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Влабораторной практике широко применяют развернутую реакцию агглютинации Видаля, основанную на обнаружении в сыворотке крови людей антител — агглютининов, которые появляются в конце 1-й — начале 2-й недели заболевания. Реакцию ставят одновременно с четырьмя антигенами: О- и Н-брюшнотифозными, А- и В-паратифозными диагностикумами. Брюшнотифозные монодиагностикумы применяют для установления стадии болезни, так как содержание О- и Н-антител в разные ее периоды неодинаково. О-антитела появляются на 1-й неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н-антитела появляются в разгар заболевания, накапливаются к концу заболевания и сохраняются у переболевших в течение длительного времени. У людей, вакцинированных против брюшного тифа и парати-фов, также наблюдается положительная реакция Видаля, причем в довольно высоком титре, поэтому "инфекционный Ви-даль" удается отличить от "прививочного" только по нарастанию титра агглютининов у больных в процессе заболевания. Реакцию Видаля ставят в четырех рядах пробирок по 7 пробирок в каждом ряду, из которых 5 опытных и 2 контрольные. Для контроля каждого диагностикума в пробирки вносят по 1 мл изотонического раствора хлорида натрия, в который добавляют 2 капли диагностикума. В контрольной пробирке с
1 мл сыворотки (без диагностикума) не должно быть хлопьев. При спонтанной агглютинации реакция не учитывается. Диагностический титр реакции Видаля равен 1:200. Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию непрямой И-гемаг-глютинации, с помощью которой в сыворотке крови людей определяют присутствие антител к К/-антигену. В качестве антигена используют эритроцитарный Р?-диагностикум, представляющий собой взвесь эритроцитов человека 1(0) группы, обработанных формалином и сенсибилизированных Fz'-антиге-ном S.enterica биовара typhi. Готовят разведения испытуемой сыворотки от 1:10 до 1:1280. При положительной реакции эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательной реакции, так же как и в контроле, эритроциты осаждаются на дно пробирки и имеют виддиска с ровными краями ("пуговки"). Диагностическое значение имеет титр пассивной Й-гемагглютинации, начиная с 1:40 и выше. Всех лиц, сыворотка крови у которых дает положительный результат в РНГА с эритроцитарным F/f-диагностикумом, рассматривают как подозрительных на носительство S.enterica биовара typhi и подвергают многократному бактериологическому обследованию.
• Микробиологическая диагностика сальмонеллезов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь.
МЕТОДЫ ДИАГНОСТИКИ: микробиологическая диагностика сальмонеллезов принципиально не отличается от диагностики брюшного тифа и паратифов. Серодиагностика не применяется по причине большого числа сероваров возбудителей.
• Микробиологическая диагностика кишечного иерсиниоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь, моча, спинномозговая жидкость.
МЕТОДЫДИАГНОСТИКИ:
Бактериологическое исследование.Посев материала на дифференциально-диагностические (среда Эндо, Мак-Конки, СБТС-агар с желчью и бромтимоловым синим) и селективные (CIN-arap с антибиотиками цефсулодином и новобиоцином) плотные среды или жидкие среды обогащения (буферно-казе-иново-дрожжевой бульон, 1 %, пептонная вода с рН 7,6—7,8). Посевы инкубируют при 25 "С в течение 24—48 ч. Идентификация чистой культуры осуществляется на основании морфологии, подвижности, тинкториальных свойств (грамотрица-

тельные палочки с закругленными концами и характерным биполярным окрашиванием, неспорообразующие, перитрихи), культуральных, биохимических признаков.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР.В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика.Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителей наиболее распространенных серотипов (03, 04, 05, 06, 08, 09) в РА. Положительной считается РА в титре не менее 1:160. Разработаны также ИФА-тесты.
• Микробиологическая диагностика кишечного дисбактериоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии. МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование.Имеет ориентировочное значение. При резко выраженном дисбактериозе в мазках преобладают микроорганизмы определенных видов (например, дрожжеподобные грибы, стафилококки и др.) на фоне существенного уменьшения грамотрицательной микрофлоры.
Бактериологическое исследование.Проводится количественное исследование состава микрофлоры кишечника. Для этого из исследуемого материала готовят разведения Ю -2 , 10 -4 , Ю -6 и т.д. Первичные посевы по 0,1 мл каждого разведения производят параллельно на несколько питательных сред (Эндо, кровяной агар, ЖСА, агар Сабуро и др.) и инкубируют при 37 °С. Подсчитывают число выросших колоний и определяют число КОЕ в 1 г материала. Проводят отсев 2—3 колоний каждого вида для выделения и идентификации чистых культур микроорганизмов.
Дляобнаружения анаэробных Bifidobacterium spp. делают мерные посевы материала в разведениях 10" 7 и выше в пробирки с 13—15 мл модифицированной среды Блаурокка, в состав которой входит печеночный бульон, пептон — 1 %, лактоза — 1 %, хлорид натрия — 0,5 %, цистин — 0,01 %, агар-агар — 0,75%, твин-80 — 0,1 %. При росте Bifidobacterium spp. через 24—48 ч происходит помутнение всей среды с образованием тяжей или отдельных колоний. Готовят мазки и окрашивают по методу Грама. Выделение чистых культур Bifidobacterium spp. является весьма трудоемким и практически необязательным. При необходимости идентификацию представителей рода осуществляют по биохимическим свойствам.
Для оценки результатов бактериологического исследования
сопоставляют полученные данные с количественным содержанием микроорганизмов в норме. Ориентировочные критерии нормальной микрофлоры толстой кишки представлены в табл. 13.2.3.
Таблица 13.2.3. Критерии нормы кишечной флоры
| Норма |
Патогенные микробы сем. Enterobacteriaceae О
Общее количество E.coli, млн/г 300—400
E.coli со слабовыраженными ферментативными
свойствами, % До 10
E.coli с гемолитическими свойствами, % Нет
Энтеробактерии (лактозоотрицательные и лактозополо
жительные): Hafnia, Aerobacter, Citrobacter, Klebsiella,
Serratia, % До 5
Кокковые формы, % До 25
Гемолитический стафилококк по отношению ко
всем кокковым формам, % Нет
Bifidobacterium spp. (рост при посеве разведения) 10 и выше
Бактерии рода Proteus Нет
Грибы рода Candida Нет
При кишечном дисбактериозе происходит значительное снижение облигатной анаэробной микрофлоры, и в первую очередь Bifidobacterium spp., а также увеличение аэробных видов, в частности E.coli, содержание которых может превышать 10 11 микробных клеток в 1 г испражнений. Увеличивается частота обнаружения штаммов E.coli со слабой ферментацией лактозы и имеющих гемолитические свойства (до 30—40 %), гемолитических и негемолитических стафилококков, бактерий рода Proteus, грибов рода Candida (до 15—16 %). У лиц с дис-бактериозами более часто обнаруживают лактозоотрицательные и лактозоположительные энтеробактерии, относящиеся к родам Hafnia, Aerobacter, Citrobacter. Для микроорганизмов, в норме отсутствующих в испражнениях или имеющихся в небольшом количестве, показателем дисбактериоза будет содержание их 10 5 —10 6 и выше КОЕ в 1 г материала (Proteus spp., Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Candida spp.). Для окончательного заключения о кишечном дисбактериозе важное значение имеет повторное его выявление в динамике обследования больного.
• Диагностические, профилактические и лечебные препараты
Не нашли то, что искали? Воспользуйтесь поиском:
Реакция Видаля. Со второй недели заболевания в крови больных накапливаются антитела против возбудителя инфекции. Для их выявления исследуют сыворотку крови больного в реакции агглютинации. В качестве антигена используют убитые культуры сальмонелл - диагностикумы.
Для постановки реакции Видаля используют сыворотку больного, набор диагностикумов, изотонический раствор натрия хлорида.
Кровь (2-3 мл) из мякоти пальца или локтевой вены собирают в стерильную пробирку и доставляют в лабораторию. В лаборатории пробирку ставят в термостат на 20-30 мин для образования сгустка, затем пастеровской пипеткой обводят сгусток, чтобы отделить от стенки пробирки, и ставят на 30-40 мин на холод. Отделившуюся сыворотку отсасывают и используют для постановки реакции агглютинации с диагностикумами из сальмонелл тифа и паратифов. Для получения сыворотки кровь можно отцентрифугировать.
При возникновении инфекционного процесса - брюшного тифа или паратифов - в организме вырабатываются О- и Н-антитела к одноименным антигенам возбудителя.
О-антитела появляются первыми и исчезают довольно быстро. Н-антитела сохраняются долго. То же самое происходит и при вакцинации, поэтому положительная реакция Видаля с О- и Н-антигенами свидетельствует о наличии заболевания, а реакция только с Н-антигенами может быть и у переболевших (анамнестическая реакция), и у привитых (прививочная). Исходя из этого, реакцию Видаля ставят раздельно с О- и Н-антигенами (диагностикумы).
Так как клинически брюшной тиф и паратифы А и В сходны, то для выявления природы заболевания сыворотку больного испытывают одновременно с диагностикумами из сальмонелл тифа и паратифа А и В.
Реакцию Видаля широко используют, так как она проста и не требует специальных условий.
Поставить реакцию можно двумя способами: капельным и объемным (см. главу 12). В практике чаще используют объемный метод. При постановке линейной реакции агглютинации количество рядов должно соответствовать количеству антигенов (диагностикумы). Возбудителем заболевания считают микроорганизм, диагностикум из которого агглютинировался сывороткой больного. Иногда отмечают групповую агглютинацию, так как возбудители тифа и паратифов обладают общими групповыми антигенами. В этом случае положительным считают результат реакции в ряду, в котором агглютинацию отмечают в большем разведении сыворотки (табл. 36).

Таблица 36. Возможный результат реакции агглютинации
Примечание. В практике реакцию Видаля ставят с четырьмя диагностикумами: брюшного тифа "О" и "Н", а паратифов А и В - с диагностикумами "ОН".
Если агглютинация возникает только в небольших разведениях сыворотки - 1:100, 1:200, то для отличия реакции при заболевании от прививочной или анамнестической прибегают к повторной постановке реакции агглютинации через 5-7 дней. У больного титр антител повышается, а у привитого или переболевшего не изменяется. Таким образом, нарастание титра антител в сыворотке крови служит показателем заболевания.
В ответ на внедрение в организм возбудителей брюшного тифа, обладающих Vi-антигеном, в крови больного появляются Vi-агглютинины. Их определяют со 2-й недели болезни, но титр их обычно не превышает 1:10. Обнаружение Vi-антител связывают с наличием в организме возбудителей брюшного тифа, поэтому определение этих антител имеет большое эпидемиологическое значение, так как позволяет выявить бактерионосителей.
Реакция Vi-гемагглютинации. Это наиболее чувствительная реакция для выявления антител.
Принцип реакции заключается в том, что эритроциты человека (I группы) или барана после специальной обработки могут адсорбировать на своей поверхности Vi-антиген и приобретают при этом способность агглютиниповаться соответствующими Vi-антителами.
Эритроциты с адсорбированными на поверхности антигенами называют эритроцитарными диагностикумами.
Для постановки реакции Vi-гемагглютинации берут:
1) сыворотку крови больного (1-2 мл); 2) эритроцитарный сальмонеллезный Vi-диагностикум; З) Vi-сыворотку; 4) О-сыворотку; 5) изотонический раствор натрия хлорида.
Реакцию ставят в агглютинационных пробирках или в пластмассовых пластинах с лунками.
Кровь у больного берут так же, как для реакции Видаля. Получают сыворотку. Из сыворотки готовят двукратные серийные разведения, начиная с 1:10 до 1:160.
По 0,5 мл каждого разведения вносят в лунку и прибавляют по 0,25 мл эритроцитарного диагностикума. Реакцию ставят в объеме 0,75 мл.
Контролем служат: 1) стандартная агглютинирующая монорецепторная сыворотка + диагностикум - реакция должна быть положительной до титра сыворотки; 2) диагностикум в изотоническом растворе натрия хлорида (контроль) - реакция должна быть отрицательной.
Содержимое лунок тщательно перемешивают, ставят в термостат на 2 ч и оставляют при комнатной температуре до следующего дня (на 18-24 ч).
Учет начинают с контроля. Реакцию оценивают в зависимости от степени агглютинации диагностикума.
Результаты учитывают по четырехкрестной системе:
++++ эритроциты полностью агглютинированы - осадок на дне лунки в виде "зонтика";
+++ "зонтик" меньше, не все эритроциты агглютинировались;
++ "зонтик" маленький, на дне лунки имеется осадок из неагглютинированных эритроцитов;
- реакция отрицательная; эритроциты не агглютинировались и осели на дно лунки в виде пуговки.
1. В какой период заболевания ставят реакцию Видаля?
2. Какие ингредиенты необходимы для постановки реакции Видаля?
3. С какими диагностикумами ставят реакцию Видаля?
4. Какая из серологических реакций является самой чувствительной при диагностике тифопаратифозных инфекций?
5. Каким диагностикумом пользуются при постановке реакции Vi-гемагглютинации?
6. Какой сывороткой определяют наличие Vi-антигена у исследуемой культуры?
7. Какое значение имеет определение Vi-фаготипа?
Возьмите у преподавателя О- и Н-диагностикумы из сальмонелл тифа, паратифа А и паратифа В и сыворотку больного. Поставьте реакцию Видаля.
Питательные среды
Среды ЭМС, Плоскирева, висмут-сульфитный агар выпускаются медицинской промышленностью в виде сухого порошка. Их готовят согласно указаниям на этикетке: отвешивают определенное количество порошка, наливают соответствующее количество воды, кипятят и разливают в стерильные чашки Петри.
Среда Рассела. В 950 мл дистиллированной воды добавляют 40 г сухой питательной среды и прибавляют 5 г питательного агара. Нагревают до кипения и растворения порошков. В 50 мл дистиллированной воды растворяют 1 г х. ч. глюкозы и добавляют к приготовленной смеси. Среду разливают в стерильные пробирки по 5-7 мл, стерилизуют текучим паром (2 дня по 2 мин) и скашивают так, чтобы оставался столбик. Среду Рассела с маннитом и сахарозой готовят так же.
Среда Олькеницкого из сухого агара. 2,5 г сухого питательного агара расплавляют в 100 мл дистиллированной воды. В остуженный до 50° С агар прибавляют все ингредиенты, указанные в рецептуре (этикетке). Среду, разлитую в пробирки, стерилизуют текучим паром (3 дня по 20 мин) и затем скашивают. Готовая среда должна быть бледно-розового цвета.
Лабораторная диагностика. Самым ранним и основным методом диагностики брюшного тифа и паратифов является бактериологический — получение гемокультуры или миелокультуры. С этой целью исследуют кровь или пунктат костного мозга. Кровь лучше засевать на среду Рапопорт (желчный бульон с добавлением глюкозы, индикатора и стеклянного поплавка) в соотношении 1: 10 (на 10 мл среды 1 мл крови). Посев следует инкубировать при температуре 37 С С не менее 8 дней, а с учетом возможного наличия L-форм — до 3—4 нед.
Для идентификации выделенной культуры сальмонелл используют (с учетом их биохимических свойств) диагностические адсорбированные сыворотки, содержащие антитела к антигенам 02 (S. paratyphi А), 04 (S. paratyphi В) и 09 (S. typhi). Если выделенная культура S. typhi не агглютинируется 09-сывороткой, ее необходимо проверить с Vi-сывороткой.
Бактериологическое исследование испражнений, мочи и желчи проводят для подтверждения диагностики, контроля бактериологического выздоровления при выписке реконвалесцентов и для диагностики бактерионосительства. В этом случае материал предварительно засевают на среды обогащения (среды, содержащие химические вещества, например селенит, которые угнетают рост Е. coli и других представителей микрофлоры кишечника, но не угнетают роста сальмонелл), а затем со среды обогащения — на дифференциально-диагностические среды (Эндо, висмут-сульфит-агар) с целью выделения изолированных колоний и получения из них чистых культур, идентифицируемых по указанной выше схеме. Для обнаружения О- и Vi- антигенов в сыворотке крови и испражнениях больных могут быть использованы РСК, РПГА с антительным диагностикумом, реакции коагглютинации, агрегат-гем- агглютинации, ИФМ. Для ускоренной идентификации S. typhi перспективно применение в качестве зонда фрагмента ДНК, несущего ген Vi-антигена (3—4 ч).
Наиболее надежной и специфической является последняя реакция (Vi-гемагглютинации).
Обнаружены 3 необычных мутанта S. typhi: Vi-I — R-форма, клетки лишены Н- и О-антигенов. но стойко сохраняют Vi-антиген; 0-901 - лишен Н- и Vi-антигенов; Н-901 — содержит О- и Н-антигены, но лишен Vi-антигена, Все три антигена: О-, Н- и Vi— имеют выраженные иммуногенные свойства. Наличие Vi-антигенов позволяет подвергать культуры S. typhi фаготипированию. Чувствительность их к соответствующим фагам является стабильным признаком, поэтому фаготипирование имеет важное эпидемиологическое значение.
Разработаны также схемы фаготипирования S. paratyphi А и S. paratyphi В, по которым они разделяются на десятки фаготипов. Существенно, что фаготипы сальмонелл могут ни по каким другим признакам не отличаться друг от друга.
Серологический метод обнаружения 0- и Н- антител в РПГА.
8. Бактерионосительство при брюшном тифе и методы ого выявлении. Особенности антигенного строении возбудители брюшного тифа и его фаготипирование.
Примерно 5 % переболевших становятся хроническими носителями сальмонелл тифа или паратифов. Известное значение в формировании носительства играют местные воспалительные процессы в желчевыводящих (иногда в мочевыводящих) путях, которые часто возникают в связи с тифо-паратифозными инфекциями или обостряются в результате этих инфекций. Однако не менее важную роль в формировании длительного носительства сальмонелл брюшного тифа и паратифов А и В играет L-трансформация их. L-формы сальмонелл утрачивают Н-, частично 0- и Vi-антигены, располагаются, как правило, внутриклеточно (внутри макрофагов костного мозга), поэтому становятся не доступными ни для химиопрепаратов, ни для антител и могут длительно персистировать в организме переболевшего человека. Возвращаясь в исходные формы и полностью восстанавливая свою антигенную структуру, сальмонеллы вновь становятся вирулентными, вновь проникают в желчные ходы, вызывают обострение процесса бактерионосительства, выделяются с испражнениями, а такой носитель становится источником заражения для окружающих. Не исключено также, что формирование бактерионосительства зависит от какого-то дефицита иммунной системы.
Антигенное строение. Сальмонеллы имеют О- и Н-антигены, По О-антигенам они разделяются на большое количество серогрупп, а по Н-антигенам — на серотипы. S. typhi, S. paratyphi А и S. paratyphi В отличаются друг от друга как по О-антигенам (относятся к разным серогруппам), так и по Н-антигенам..
S. typhi помимо О- и Н-антигенов имеет еще один поверхностный антиген, который они назвали антигеном вирулентности (Vi-антигеном). По химической природе Vi-антиген отличается от О- и Н-антигенов, он состоит из трех различных фракций, но его основу составляет сложный полимер N-ацетилгалактозаминоуроновая кислота с м, м. 10 МД.
Обнаружены 3 необычных мутанта S. typhi: Vi-I — R-форма, клетки лишены Н- и О-антигенов. но стойко сохраняют Vi-антиген; 0-901 - лишен Н- и Vi-антигенов; Н-901 — содержит О- и Н-антигены, но лишен Vi-антигена, Все три антигена: О-, Н- и Vi— имеют выраженные иммуногенные свойства. Наличие Vi-антигенов позволяет подвергать культуры S. typhi фаготипированию. Чувствительность их к соответствующим фагам является стабильным признаком, поэтому фаготипирование имеет важное эпидемиологическое значение.
Разработаны также схемы фаготипирования S. paratyphi А и S. paratyphi В, по которым они разделяются на десятки фаготипов. Существенно, что фаготипы сальмонелл могут ни по каким другим признакам не отличаться друг от друга.
9. Микроорганизмы - возбудители пищевых отравлений. Пищевые отравлении, обусловленные стафилококками. Типы энтеротоксинов, их свойства, способы выявления.
Пища нередко является причиной отравлений, природа которых может быть самой различной.
Наиболее простая классификация пищевых отравлений такова: различают пищевые отравления немикробного и микробного происхождения.
Пищевые отравления микробного происхождения подразделяют на 2 группы: пищевые интоксикации и пищевые токсикоинфекции.
Пищевые интоксикации — отравления, обусловленные исключительно токсинами микроорганизмов. Они могут возникать и в тех случаях, когда живые возбудители в пищевом продукте, подвергнутом термической обработке, отсутствуют.
Пищевые токсикоинфекции возникают только в связи с употреблением в пищу продуктов, обильно зараженных бактериями.
Токсикоинфекции являются следствием массивного обсеменения пищевого продукта живыми возбудителями. Для пищевых токсикоинфекций существует только один путь передачи — через пищу.
Пищевые токсикоинфекции могут вызывать представители по крайней мере пяти семейств бактерий:
Enterobacteriaceae (роды - Escherichia, Salmonella, Shigella, Proteus, Serratia, Hafnia, Enterobacter, Citrobacter и др.),
Vibrionaceae (V. parahaemolyti- cus),
Streptococcaceae (протеолитические варианты стрептококков серогруппы D),
Bacillaceae — роды Bacillus (В. cereus),
Clostridium (С. perfringens, cepo- типы A, D, F; C. botulinum, серотипы А, В, С, E, F).
Инфицирование стафилококками пищевых продуктов — частая причина пищевых отравлений.
Основным методом диагностики пищевых токсикоинфекций является бактериологический. Он применяется с учетом биологии возможного возбудителя (грамотрицательные и грамположительные палочки, стрептококки, бациллы, клостридии). Материалом для исследований служат испражнения, рвотные массы, промывные воды желудка, кровь, продукты, послужившие причиной отравления. Обращают внимание на обнаружение большого количества бактерий в продукте, таких же бактерий в выделениях из кишечника и желудка, в том числе от нескольких человек при групповом отравлении.
Подтверждением диагноза является обнаружение в сыворотке крови переболевших людей (через 1—2 нед.) антител к возбудителю.
10. Сальмонеллы - возбудители острых гастроэнтеритов. Классификация сальмонелл. Методы лабораторной диагностики сальмомеллезов.
Сальмонеллы являются не только основными возбудителями пищевых токсикоинфекций, но и часто причиной своеобразных диарей — сальмонеллезов.
Ключевые признаки рода Salmonella следующие: короткие грамотрицательные палочки с закругленными концами, длиной 1,5—4,0 мкм, в большинстве случаев подвижные (перитрихи), спор и капсул не имеют, образуют при ферментации глюкозы кислоту и газ (за исключением S. typhi и некоторых других серотипов), имеют лизин- и орнитиндекарбоксилазы, не имеют фенилаланиндезаминазы, образуют H2S.
Классификация. Род Salmonella включает единственный вид S. enteritica с семью основными подвидами: S. choleraesuis, S. salamae, S. arizonae, S. diarizonae, S. houtenae, S. bongori, S. indica, которые различаются по ряду биохимических признаков
Серологическая классификация сальмонелл по Уайту и Кауффманну.
У сальмонелл имеются О-, Н- и К-антигены. Обнаружено 65 различных О-антигенов. Они обозначаются арабскими цифрами от 1 до 67. По О-антигену сальмонеллы разделены на 50 серологических групп (A—Z, 51—65).
У сальмонелл различают два типа Н-антигенов: I фаза и II фаза. Обнаружено более 80 вариантов Н-антигенов I фазы. По Н-антигенам серогруппы разделяют на серотины.
Основной метод диагностики сальмонеллезной инфекции — бактериологический. Материалом для исследования служат испражнения, рвотные массы, кровь, промывные воды желудка, моча, послужившие причиной отравления продукты. Особенности бактериологической диагностики сальмонеллезов:
использование сред обогащения (селенитовой, магниевой), в особенности при исследовании испражнений;
для обнаружения сальмонелл пробы следует брать из последней, более жидкой, части испражнений (верхнего отдела тонкого кишечника);
соблюдать соотношение 1: 5 (одна часть испражнений на 5 частей среды);
в связи с тем, что S. arizonae и S. diarizonae ферментируют лактозу, использовать в качестве дифференциально-диагностической не только среду Эндо, но и висмут-сульфит-агар, на котором колонии сальмонелл приобретают черный (некоторые — зеленоватый) цвет;
для посева крови использовать среду Рапопорт;
использование для предварительной идентификации колоний 01-сальмонеллезного фага.
для окончательной идентификации выделенных культур вначале используют поливалентные адсорбированные О- и Н-сыворотки, а затем — соответствующие моновалентные О- и Н-сыворотки.
Для быстрого обнаружения сальмонелл могут быть использованы поливалентные иммунофлуоресцентные сыворотки. Для выявления антител в сыворотке крови больных и переболевших используется РПГА с применением поливалентных эритроцитар- ных диагностикумов, содержащих полисахаридные антигены серогрупп А, В, С, D и Е.
Читайте также:


