Миастенический синдром при ботулизме

Миастенические синдромы встречается относительно редко в популяции. Диагностика и назначение эффективной терапии на ранних этапах развития заболеваний представляют некоторые сложности. Это связано с рядом причин: трудности в дифференциальной диагностике между миастенией и синдромами, низкая встречаемость. Диагноз устанавливают окончательно, когда пациент уже испытывает значительные трудности в социальной адаптации и трудовой деятельности или в период новорожденности, что обуславливает неблагоприятный прогноз. Сложности возникают и с получением хорошего ответа от медикаментозной терапии, потому что лекарственные препараты в большинстве случаев неэффективны. Миастенические синдромы — это заболевания, которые проявляются слабостью и быстрой утомляемостью скелетных мышц вследствие нарушения нервно-мышечной передачи.
Механизм развития
Проведение сигнала от нерва к мышце осуществляется с помощью синапсов. Синапс – это структурно-функциональное образование между окончанием аксона двигательного нейрона (нервная клетка) и мышечным волокном. Аксон на конце образует утолщение (бляшку), которая покрыта пресинаптической мембраной. В утолщении аксона синтезируется и накапливается медиатор ацетилхолин. Клетки миоциты, образующие мышечное волокно, покрыты постсинаптической мембраной. На постсинаптической мембране находятся рецепторы к ацетилхолину. Между этими мембранами располагается синаптическая щель, где работает фермент ацетилхолинэстераза, которая расщепляет ацетилхолин. Передача сигнала осуществляется с помощью ацетилхолина, который высвобождается из утолщения аксона и связывается с рецепторами на постсинаптической мембране. Избыток ацетилхолина расщепляется в синаптической щели под действием ацетилхолинэстеразы. Если у больных с миастенией антителами блокируются постсинаптические рецепторы, то при миастенических синдромах имеются дефекты пресинаптической и постсинаптической мембран.
- Нарушение синтеза и выделения ацетилхолина.
- Уменьшение синаптических везикул, содержащих ацетилхолин.
- Дефицит фермента ацетилхолинэстеразы.
- Врожденная недостаточность синаптических щелей.
- Недостаточность ацетилхолиновых рецепторов.
- Аномальное строение рецепторов без снижения их числа.
Синдромы
Данный синдром встречается крайне редко в популяции. Выделяют два предрасполагающих фактора в развитии заболевания:
- Особенный иммунный статус человека, так называемый HLA-статус, при котором образуются антитела к пресинаптической мембране.
- Паранеопластический синдром, развивающийся при плоскоклеточном раке легких, раке молочной железы, аденокарциноме предстательной железы и других злокачественных процессах. У онкологических больных образуются антитела, которые начинают атаковать пресинаптическую мембрану. Реже синдром развивается на фоне аутоиммунных заболеваний организма.
В лечении используют антихолинэстеразные препараты (пиридостигмин, неостигмин), кортикостероиды, цитостатики (азатиоприн), плазмаферез.
Проявляется сразу после рождения. Возникают трудности при кормлении ребенка. Часто такие дети находятся на искусственной вентиляции легких (ИВЛ), потому что доминирует поражение бульбарных мышц и дыхательные расстройства. Поражение бульбарных мышц проявляется нарушением глотания (дисфагия), гнусавым оттенком голоса или плача. Постепенно присоединяется поражение глазных мышц, которое проявляется опущением верхних век (птоз). Генерализованная слабость мышц также характерна для данного синдрома. Она проявляется малой двигательной активностью ребенка, быстрым уставанием. По мере роста ребенка симптомы исчезают. Однако, в течение жизни у человека могут повторяться приступы остановки дыхания (апноэ). В лечении данного заболевания применяются ингибиторы холинэстеразы (калимин) на протяжении всего детства. Удаление вилочковой железы и применение иммуносупрессоров не эффективно.
Диагноз ставится на основе клинических и лабораторно-инструментальных данных в первые дни жизни ребенка.
Некоторые авторы рекомендуют отнести врожденную миастению к миастеническим синдромам, потому что при данном заболевании неэффективны иммуносупрессоры.
Это единственный синдром, при котором поражаются в первую очередь глазодвигательные мышцы (офтальмоплегия). Мальчики болеют в 2 раза чаще, чем девочки. Наследуется данное заболевание по аутосомно-рецессивному типу. В первые недели жизни ребенка родители обращают внимание на опущение век и нарушение движения глазных яблок вплоть до отсутствия движений (неподвижность глаз).
В большинстве случаев лечение не помогает в устранении офтальмоплегии.
В основе болезни лежит нарушение работы ионных каналов в ацетилхолиновых рецепторах.
Дебют заболевания приходится на грудной возраст детей. Наследуется по аутосомно-доминантному типу. Первые симптомы связаны с нарушением функции шейных и лопаточных мышц, постепенно вовлекаются глазодвигательные мышцы, скелетная мускулатура верхних конечностей. Ребенка беспокоит слабость в руках, трудности в удержании рук выше горизонтального уровня. Развитие заболевания медленное, лечение не разработано.
Заболевание развивается вследствие недоразвития синапсов. Очень редкий синдром, который проявляется выраженной мышечной слабостью. При данной патологии имеются аномалии развития скелета, асимметрия тела и лица, недоразвитие у девочек молочных желез. Лечения нет.
Данный синдром описывался в большинстве случаев у пациентов, принимавших D-пеницилламин для лечения ревматоидного артрита. В рандомизированных исследованиях была доказана его роль в запуске аутоиммунных процессов в организме и синтезе антител к ацетилхолиновым рецепторам, которые по строению очень схожи с антителами при миастении. Миастеноподобный синдром при приеме данного препарата проявляется слабостью бульбарных мышц (поперхивания при глотании, гнусавый оттенок голоса, нарушение артикуляции речи) и слабостью мышц конечностей.
При отмене препарата регресс симптомов наступает в течение нескольких месяцев.
Некоторые антибиотики у ряда лиц могут вызвать нарушение нервно-мышечной передачи. К таким препаратам относят аминогликозиды (неомицин, гентамицин, канамицин), стрептомицин, колистин, полимиксин. Чаще всего данное воздействие на синапсы начинается при применении токсических доз антибактериальных средств. Чаще в клинике происходит усиление уже имеющихся симптомов миастении или миастенического синдрома. Больных беспокоит слабость в руках, ногах, иногда нарушение глотания, может появиться птоз.
Диагностика
На сегодня миастенические синдромы изучены в недостаточной степени, чтобы разработать эффективное лечение и меры профилактики.
Что такое ботулизм? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 12 лет.

Определение болезни. Причины заболевания
Ботулизм — острое инфекционное заболевание, вызываемое токсином Clostridium botulini, который поражает нервную систему организма, нарушая нервно-мышечную передачу. Клинически характеризуется синдромом общей инфекционной интоксикации, синдромом поражения желудочно-кишечного тракта (гастрит, энтерит), неврологическими синдромами. При отсутствии адекватного лечения может привести к смерти (летальность до 10%).
возбудитель — Clostridium botulinum (ботулотоксин)
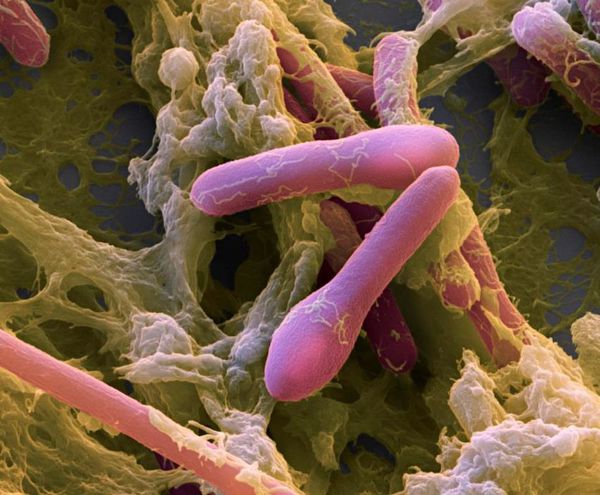
Возбудитель был выявлен в 1895 году Эмилем ван Эрменгемом. В природе — грамположительная палочка, имеет вид ракетки для тенниса, в теле человека — грамотрицательная. Анаэроб (развивается только при отсутствии кислорода), подвижна — является перитрихом (жгутиковой бактерией).
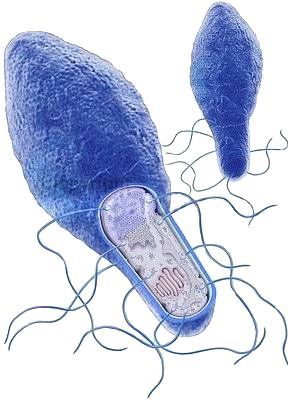
Вегетативные формы микроба малоустойчивы в окружающей природной среде. Капсулы нет, формирует споры и выделяет сильнодействующий экзотоксин — ботулотоксин. Он является ферментом белковой природы, достаточно устойчив к факторам окружающей среды, сохраняется в консервах в течение ряда лет, его токсичность резко повышается под влиянием трипсина в желудке. Может вырабатывать газ, определяемый в закрытых банках в виде бомбажа (вздутия консервов). Сахаролитические свойства возбудителя: разлагает лактозу, глюкозу, мальтозу и глицерин с появлением кислоты и газа. Протеолитические свойства: растопляет фрагменты печени, разлагает белок яйца, образует сероводород и аммиак.
В составе имеется общий О-соматический антиген и Н-антигены — подразделение по типам. Все серотипы возбудителей ботулизма выделяют токсин — наиболее сильный из многообразия ядов природного происхождения (всего лишь в 1 мкг ботулинического токсина достаточно для получения 100 миллионов смертельных доз для белой мыши). Типы ботулотоксина: А, B, E, F (патогенные для человека). Из подопытных животных более восприимчивы морские свинки, кролики, белые мыши. При введении данным животным ботулотоксина появляется мышечная слабость, одышка, слабость конечностей. Смерть наступает в течении 1-3 дней.
Зооантропоноз. Clostridium botulinum являются распространённым микроорганизмом природной среды. Источник инфекции и основной накопительный фактор — различные дикие и одомашненные животные, представители пернатых и рыбы (в их пищеварительной системе могут собираться вегетативные формы возбудителя), а также трупы. При попадании в землю бактерии длительно сохраняются в виде спор, загрязняя воду, фрукты и многое другое.
Таким образом, ботулизм может развиться при попадании в организм человека только ботулотоксина, ботулотоксина и бактерии ботулизма или только спор.
От человека к человеку болезнь не передаётся. Иммунитет к заболеванию не развивается.
Механизмы передачи: фекально-оральный (пищевой, водный и контактно-бытовой пути), воздушно-капельный (пылевой путь — биотерроризм), контактный (раневой, у наркоманов). [1] [2]
Симптомы ботулизма
Инкубационный период — до 36 часов при заражении через рот, до 14 суток при раневом ботулизме.
Начало внезапное. Характерны синдромы:
- общей инфекционной интоксикации;
- поражения желудочно-кишечного тракта (гастрит, редко энтерит, парез);
- неврологических нарушений (псевдобульбарный — лицо и глотка, офтальмоплегический — нарушения зрения, псевдоспинальный — периферические парезы и параличи).
Первые проявления — симптомы кишечного расстройства (гастроэнтерит) и интоксикация: возникают диффузные головные боли, слабость, адинамия, иногда возникает умеренное повышение температуры тела, боли в животе (преимущественно в проекции желудка), тошнотворное состояние, повторная рвота. Стул до 5 раз в сутки, жидкий, без явных патологических примесей. Внезапно всё быстро прекращается (к концу первых суток), и на первый план выходят неврологические расстройства.
Основной период заболевания характеризуется парезом глазодвигательных мышц (офтальмоплегия) и нарушением зрения. Человек видит туман, сетку, мелькание мушек перед глазами. Контуры вещей расплываются (расслабляется ресничная мышца, возникает парез аккомодации — адаптации), двоится в глазах (диплопия), расширяются зрачки (мидриаз), реакция на свет значительно снижается.
Объективно обращает на себя внимание прогрессирующая вялость, адинамичность, невнятная речь, маскообразное лицо, косоглазие (страбизм), нистагм неконтролируемые колебательные движения глаз (нистагм), неравномерные зрачки (анизокория), опущение верхних век (птоз), ограничение диапазона движения глазных яблок (парез взора). Высунуть язык становится сложной задачей.
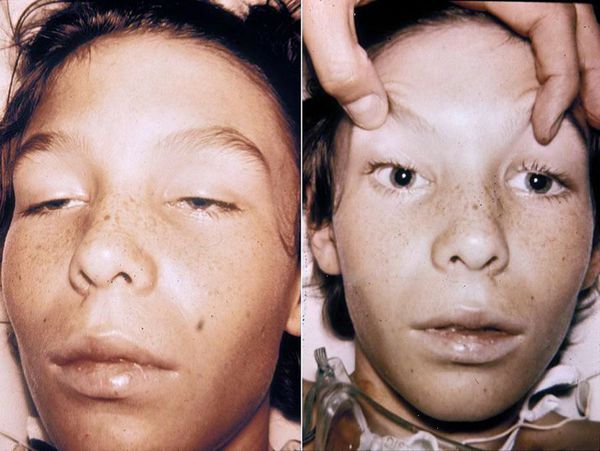
Со стороны сердечно-сосудистой системы также наблюдаются изменения: повышается частота сердечных сокращений, снижается артериальное давление, тоны сердца резко ослабевают. Дыхание становится поверхностным, шумы вдоха и выдоха ослаблены, кашля нет (может быть попёрхивание слизью). Живот вздут, перистальтические звуки резко ослаблены. Слизистая оболочка ротоглотки высохшая, ярко-красного цвета. В надгортанном пространстве накоплена тягучая вязкая слизь, голосовая щель расширена, что в совокупности с нарушением процесса отхождения мокроты приводит в асфиксии (удушью).
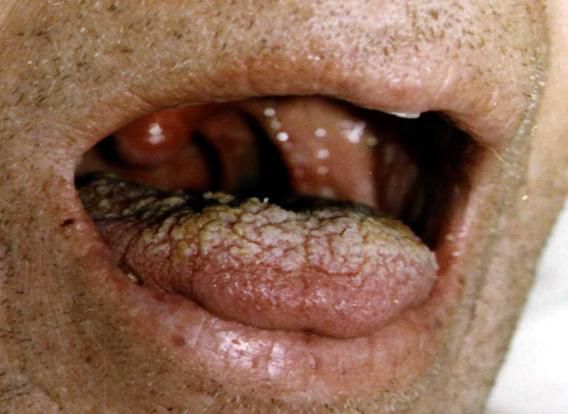
При благоприятном течении процесса (лечении) медленно улучшается слюноотделение, снижается выраженность неврологических проявлений. Глазные феномены и парезы регрессируют достаточно медленно, общий восстановительный период растягивается на несколько месяцев.
Детский ботулизм встречается преимущественно у детей до шести месяцев, которые проглатывают споры, из которых впоследствии произрастают вегетативные формы бактерий, колонизирующие неокрепший кишечник и выделяющие токсин. Наиболее часто источником инфекции является мёд. Клиническая картина напоминает общую при процессе развития болезни у взрослых, включая изменение характера плача, нарушение удержания головки. [1] [3] [4]
Патогенез ботулизма
Входные ворота инфекции — слизистая выстилка желудочно-кишечного тракта (ЖКТ) и кожа с нарушениями защитной структуры.
Главенствующая роль в патогенезе принадлежит ботулотоксину. При алиментарном заражении (через пищу) ботулотоксин совместно с активной формой бактерии попадает в макроорганизм человека. Ботулотоксин активно всасывается через слизистую оболочку ЖКТ, начало идёт со слизистой полости рта. После поступлении его из желудка и тонкой кишки он проникает в лимфатическую и кровеносную систему и далее с током лимфы и крови попадает во все органы и ткани.

Ботулотоксин обладает способностью крепко объединяться с рецепторами нервных клеток, блокируя освобождение ацетилхолина (нейромедиатора нервной системы) в щель синапса (места соединения с нейроном), тем самым нарушая нервно-мышечную передачу в холинергических нервных волокнах (возникают парезы и параличи).

Угнетается иннервация мышц глазодвигательного аппарата, ротоглотки и гортани, блокируется работа дыхательных мышц, находящихся в состоянии постоянной активности: парезы и параличи межрёберных мышц и диафрагмы → вентиляционная дыхательная недостаточность → гипоксия (нехватка кислорода) → респираторный алкалоз). Дезорганизации вентиляции содействует парез мышц глотки и гортани, накопление вязкой слизи в над- и подсвязочном пространстве, аспирация (вдыхание) рвотных масс, пищи и воды. Влияние ботулотоксина обратимо (нет органической патологии), и со временем (при устранении токсина — лечении) двигательная активность полностью восстанавливается.
Посредством функционального нарушения вегетативной иннервации происходит угнетение секреции пищеварительных желез (выделение слюны и желудочного сока), развитие выраженного пареза желудочно-кишечной системы, на фоне гипосаливации воспаляется слизистая оболочка полости рта (гнойный паротит). Вегетативные (активные) формы бактерии ботулизма, поступившие в организм человека с едой, продолжают вырабатывать токсин — его постоянное поступление в кровь усугубляет токсический эффект.
Совместно с бактерией ботулизма в пищеварительный тракт иногда попадают другие кишечные патогены, что обуславливает симптомы гастроэнтерита в начальном периоде у некоторых больных.
Признаки, позволяющие исключить ботулизм:
- развитие менингеального синдрома (раздражение оболочек мозга);
- патологические изменения ликвора при люмбальной (спинномозговой) пункции;
- центральные (спастические) параличи;
- любые нарушения чувствительности;
- явная болевая симптоматика;
- развитие судорожного синдрома;
- любые нарушения сознания;
- психические отклонения;
- синдром общей инфекционной интоксикации при развёрнутой картине неврологических расстройств.
Дифференциальный диагноз:
- миастенический бульбарный паралич (болезнь Эрба — Гольдфлама) — отличить помогает отсутствие пищевого анамнеза, в большинстве случаев возникает неоднократно, положительная проба с прозерином (антихолинэстеразный препарат);
- полиомиелит (+ паралич мышц конечностей и туловища и наличие препаралитического периода);
- отравление атропином (соответствующий анамнез, психомоторное возбуждение, галлюцинации, гиперемия кожи, сердцебиение, аритмия);
- дифтерийные полиневриты (анемнез и характерная картина заболевания);
- пищевая токсикоинфекция (выраженный синдром общей инфекционной интоксикации и гастроэнтерита). [1][4]
Классификация и стадии развития ботулизма
По клинической картине выделяют пять форм ботулизма:
- типичная;
- раневая;
- наркоманов;
- ботулизм у младенцев;
- неуточнённый ботулизм.
По течению ботулизм бывает:
- лёгким (расстройства аккомодации, изменения тембра голоса, гипосаливация — пониженное слюноотделение);
- среднетяжёлым (все симптомы налицо, но жизнеугрожающих расстройств нет);
- тяжёлым (появление жизнеугрожающих расстройств). [1][3]
Осложнения ботулизма
- острая вентиляционная дыхательная недостаточность (нарастающий цианоз, частое поверхностное дыхание, нет одышки и психомоторного возбуждения);
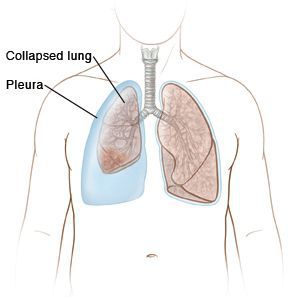
- ателектазы (спадение доли лёгкого);
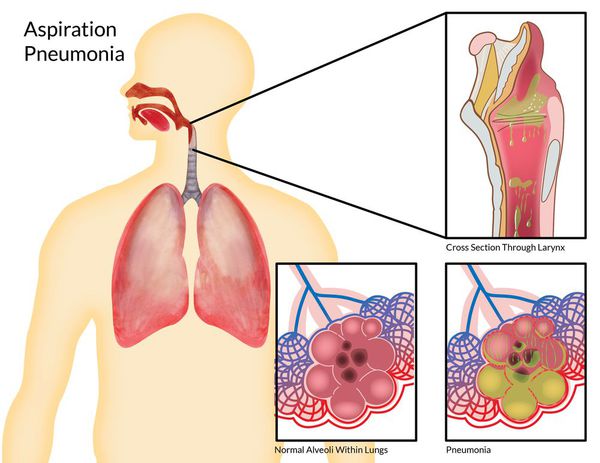
- гнойный паротит;
- ботулинический миозит (боли в мышцах на 2-3 неделе заболевания, чаще икроножных);
- сывороточная болезнь (при применении сыворотки);
- миокардит, сепсис. [1][2]
Диагностика ботулизма
- газовый состав крови (гипоксемия, гиперкапния, ацидоз);
- обнаружение ботулотоксина в сыворотке крови больного (с помощью биопробы на белых мышах с реакцией нейтрализации антитоксическими сыворотками);
- бактериальный посев содержимого желудка, рвотных масс, испражнений, раневого отделяемого, продуктов на анаэробные питательные среды (Китта-Тароцци, бульон Хоттингера, казеиново-грибная);
- серологические реакции (РНГА);
- общий анализ мочи и клинический анализ крови неинформативны (изменения только при осложнениях). [1][3]
Лечение ботулизма
Место проведения лечения — инфекционное отделение больницы, ОРИТ.
Во всех случаях заболевания ботулизмом необходимо неотложное лечение и постоянное непрерывное наблюдение с готовностью к немедленной дыхательной реанимации.
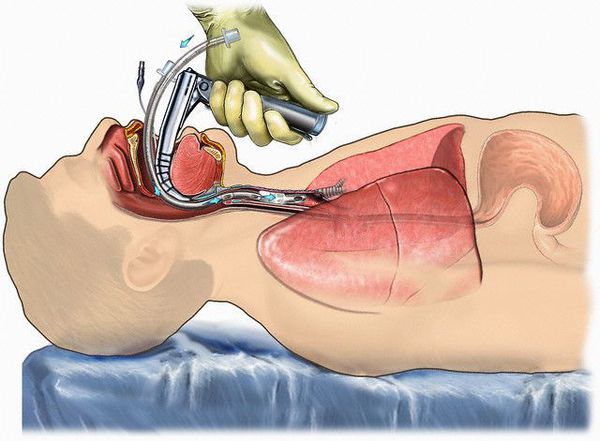
Режим палатный, постельный.
Диета определяется тяжестью расстройств глотания и желудочно-кишечного тракта.
Всем больным уже на догоспитальном этапе следует осуществлять промывание желудка, необходимо назначение слабительных, очистительных клизм и сорбентов — это уменьшает количество возбудителя и токсина.
Основным мероприятием является введение специфической антитоксической противоботулинической сыворотки, которая осуществляет нейтрализацию ботулотоксина.
Показано назначение антибактериальной терапии для ускорения элиминации (устранения) возбудителя, нормализация кишечной микрофлоры.
Выписка реконвалесцентов (пациентов, идущих на поправку) производится после полного клинического выздоровления (исключая астенический синдром). [1] [3]
Прогноз. Профилактика
Прогноз при своевременном лечении ботулизма благоприятный.
Основа профилактики — соблюдение гигиены питания и контроль за соблюдением технологии приготовления пищевых продуктов (особенно консервирования) и условиями их хранения. Не следует покупать мясные и рыбные изделия у частных лиц, лучше брать эти продукты только в магазинах, желательно заводского производства. [1] [4]
РФ, г. Архангельск
РФ, г. Архангельск
РФ, г. Архангельск

Аннотация. В данной статье проводится дифференциальная диагностика ботулизма и миастении на основании клинического случая, научных работ и различных исследованиях.
Цель: провести анализ научных статей, посвященных дифференциальной диагностике ботулизма и миастении и описать клинический случай пациента с подозрением на ботулизм, в ходе обследования которого установлен диагноз миастения.
Случаи ботулизма встречаются крайне редко, поэтому дифференциальная диагностика составляет большой научный интерес, что делает нашу статью актуальной.
По данным всемирной организации здравоохранения (ВОЗ) пищевой ботулизм является тяжелой, потенциально смертельной, но относительно редкой болезнью [1].
Существуют три формы заболевания – пищевой ботулизм, ботулизм новорожденных и раневой ботулизм. Пищевой ботулизм, составляющий более 99% всех случаев ботулизма, вызывается токсином, содержащимся в употребляемых пищевых продуктах, в то время как при раневом ботулизме токсин продуцируется микроорганизмом в инфицированных тканях, а при ботулизме новорожденных – в желудочно-кишечном тракте. [2]
Ботулизм вызывается токсином анаэробного спорообразующего микроба Clostridium botulinum.
По морфологии возбудители ботулизма - небольшие палочки длиной 4-9 мкм и шириной 0,6-0,9 мкм с закругленными концами. Палочки образуют субтерминальные или терминальные споры и имеют вид теннисной ракетки. Эти микробы легко окрашиваются различными анилиновыми красками. Молодые клетки окрашиваются по Граму положительно. Через 4-5 суток роста палочки окрашиваются грамотрицательно. Микробы подвижны, имеют от 4 до 35 жгутиков, капсулы не образуют. Токсин ботулизма представляет собой протеин, состоящий из Н- и L-цепей, связанных дисульфидными мостиками, что обеспечивает необычную устойчивость токсина во внешней среде и длительное сохранение активности. Н-цепи обеспечивают избирательную рецепцию к мембранам нервных окончаний и эндоцитоз токсинов. L-цепи, влияя на белки-мишени, обеспечивающие экзоцитоз синаптических везикул, блокируют выделение ацетилхолина в область нервно-мышечных синапсов и как следствие индуцируют развитие вялых параличей. [3, 4]
В настоящее время известно 7 типов возбудителя ботулизма (A, B, C, D, E, F, G) соответственно вырабатывающих 7 токсинов, в свою очередь палочка типа С вырабатывает два различных токсина, что позволяет говорить о существовании не 7, а 8 ботулинических токсинов. Все они отличаются между собой по антигенным свойствам вырабатываемых ими токсинов и некоторыми другими признаками. Каждый серовар характеризуется специфической иммуногенностью. Имеется О-антиген, который является общим для всех сероваров [4].
Источником заболевания может служить только больной человек или больное животное. Механизм передачи преимущественно фекально-оральный [4].
Ботулотоксины попадают в организм при потреблении продуктов, не прошедших надлежащую обработку, в которых бактерии или споры выживают и вырабатывают токсины [1].
Клиника ботулизма человека весьма специфична и складывается из нескольких основных синдромов: паралитического, гастроинтестинального и интоксикационного. Следует отметить, что действие токсина распространяется на все органы и системы, однако, на фоне бросающегося в глаза поражения нервной системы (как центральной, так и периферической) нарушениям со стороны других органов часто не уделяется должного внимания [2].
Заболевание начинается через 2-24 часа, реже 2-10 дней после употребления в пищу продуктов, в которых были созданы благоприятные, анаэробные условия для развития вегетативных форм клостридии.
Своевременной диагностике болезни, помогает понимание патофизиологии развития ботулизма, для которой характерна различная степень выраженности одновременно возникающих мионеврологических симптомов, которые указывают на повреждение многих органов и систем:
- офтальмоплегический синдром в виде мидриаза, анизокории, диплопии, птоза обусловлен поражением внутренних и наружных мышечных групп глазного яблока;
- бульбарный синдром проявляется дисфагией, вследствие нарушения функции надгортанника, мягкого неба, языка, голосовых связок и наружных мышц гортани;
- синдром дыхательных расстройств обусловлен не только расслаблением дыхательной мускулатуры, но и параличем диафрагмы, и проявляется частым поверхностным дыханием, нарастающим цианозом;
- расстройства функции ЖКТ в виде тошноты, рвоты, метеоризма, запоров связаны с нарушением функции нервно-секреторного и нервно-мышечного аппарата, с развитием пареза кишечника [6].
Клиническое сходство симптомов отравления ботулотоксином и миастении может приводить к ошибкам диагностики, особенно в дебюте заболевания [7].
А.И. Смолин определяет миастению как тяжелое аутоиммунное нервно-мышечное заболевание с прогрессирующим течением, главной клинической чертой которого является патологическая утомляемость мышц, приводящая к парезам и параличам. Частота миастении в настоящее время составляет 20 случаев на 100 000 населения. По сравнению с данными 70-х годов прошлого столетия (3-7 человек на 100 000 населения), отмечается тенденция к увеличению заболеваемости миастенией [8].
Заболеваемость составляет 1:10000. Миастения обычно возникает в возрасте 20-30 лет у женщин и в возрасте 50-70 лет у мужчин [9].
Среди всех аутоиммунных заболеваний миастения занимает особое место в связи с тем, что механизмы ее развития тесно связаны с патологическими изменениями тимуса. Органом-мишенью при миастении являются структуры синапса и непосредственно мышечная ткань. Механизм нарушения нервно-мышечной проводимости при миастении связан с выработкой антител к никотиновым ацетилхолиновым рецепторам постсинаптической мембраны мышц. Большую роль в патогенезе миастении играет патология как клеточного, так и гуморального иммунитета. На ранних этапах болезни происходит образование тримолекулярного комплекса, состоящего из антигенпредставляющей клетки холинорецептора и молекул главного комплекса гистосовместимости II класса. Клинические проявления миастении на данном этапе заболевания, как правило, отсутствуют, хотя при целенаправленном опросе можно выявить жалобы на общую слабость, быструю утомляемость при физической нагрузке, лучшее самочувствие в утренние часы. Затем происходит активация Т-лимфоцитов, стимулирующих выработку антител к холинорецепторам в крови и в ткани тимуса при миастении. Клинически эти иммунологические изменения в организме больных сопровождаются локальной мышечной слабостью (парез глазодвигательных или фарингеальных мышц), либо генерализованной слабостью [8]. В сыворотках крови 80-90% больных миастенией с тимомой обнаружены антитела к титину (IgG1 и IgG4, обладающие способностью активировать белки системы комплемента). Титин - это гигантский мышечный белок, который управляет расположением саркомера и обеспечивает его эластичность [10].
Типичными клиническими проявлениями миастении являются различной степени выраженности нарушения функции поперечнополосатой мускулатуры, приводящие к затруднению или невозможности выполнения определённых движений. Для миастении типично хроническое течение с периодическими обострениями и ремиссиями и возможным развитием тяжёлых состояний, называемых кризами. Ведущий клинический симптом при всех формах миастении - слабость и патологическая мышечная утомляемость, усиливающаяся на фоне физических нагрузок и уменьшающаяся после отдыха или приёма антихолинэстеразных препаратов. Для миастении с ранним началом характерно частое вовлечение экстраокулярной (80 %), мимической (92 %) и бульбарной (65 %) мускулатуры, относительно редкое поражение жевательных (40 %) и дыхательных (20 %) мышц, а также мышц шеи (30 % случаев). У большинства больных выявляют слабость мышц туловища и конечностей, причём снижение силы в трёхглавой мышце выражено в большей степени (60 %), чем в дельтовидной (35 % случаев). У больных миастенией, сочетающейся с тимомой, и больных с поздним началом болезни без тимомы существенно чаще поражаются бульбарная и жевательная мускулатура (80 %), мышцы шеи (65 %) и дельтовидная мышца (75 % случаев). Для серонегативной миастении характерно относительно редкое вовлечение экстраокулярных (10 %) и туловищных (35 %) мышц, а также более частое поражение бульбарной (90 %) и дыхательной (65 % случаев) мускулатуры. Внезапные нарушения витальных функций, называемые кризами, наблюдают у 10-15 % больных [10].
Кризы при миастении бывают миастенические, холинергические и смешанные. Миастенические кризы возникают при недостаточном лечении антихолинэстеразные препараты (АХЭП). Для миастенического криза характерно быстрое развитие (в течение часов или минут), мидриаз, сухость кожи, повышение АД и тахикардия, задержка мочеиспускания, парез кишечника, отсутствие фасцикулярных подергиваний в мышцах, нарушение дыхания [10].
Холинергический криз развивается при передозировке АХЭП. Он характеризуется медленным развитием (сутки и более), миозом, гипергидрозом, снижением АД и брадикардией, учащенным мочеиспусканием, усилением перистальтики кишечника и диареей, в мышцах наблюдаются фасцикулярные подергивания, больной страдает от нарушения дыхания. Нарушение дыхания проявляется лабильностью ритма, цианозом, включением в процесс дыхания вспомогательной мускулатуры, возбуждением, изменением сознания.
При сборе анамнеза заболевания обращает на себя внимание наличие в прошлом кратковременных эпизодов слабости и утомляемости, полностью или частично регрессировавших самопроизвольно или на фоне неспецифического лечения. Также имеет значение семейный анамнез (наличие у родственников нервно-мышечных, аутоиммунных и онкологических заболеваний).
Для оценки степени выраженности двигательных расстройств используется шкала силы мышц конечностей, предложенная A. Szobor (1976), при этом сила мышцы может варьировать от 0 (выраженный парез) до 5 баллов (норма). Для объективной оценки тяжести клинических проявлений миастении используют количественную шкалу QMGS (quantitative myasthenia gravis score), предложенную R.J. Barohn и соавт. Она предусматривает оценку выраженности (0, 1, 2, 3) вовлечения в патологический процесс различных мышц (глазодвигательных, бульбарных, мимических, дыхательных, проксимальных и дистальных мышц конечностей, а также мышц шеи) [10].
Приводим клиническое наблюдение, отражающее трудности диагностики ботулизма.
Больной С., 46 лет, заболела остро 07.11.18 Заболевание началось с тошноты, однократной рвоты, нечеткости зрения, двоения в глазах, сухости во рту, кашицеобразного стула, вялости, снижения аппетита. Больной обратился к участковому врачу. Поставлен диагноз: Ботулизм. Больной была направлен на госпитализацию в инфекционную больницу г. Архангельска. При поступлении 08.11.18 общее состояние больной было расценено средней степени тяжести. Кожные покровы бледные. Подчелюстные и шейные лимфатические узлы пальпировались множественные до 0,5 см, мягко-эластические, безболезненные, не спаянные с окружающей тканью. При аускультации легких отмечалось везикулярное дыхание. Тоны сердца приглушены АД 150/100 мм. рт. ст. В зеве изменений не наблюдали. Печень и селезенка были не увеличены. Край печени при пальпации был плотный, безболезненный. Со стороны нервной системы определялось незначительное содружественное расходящиеся косоглазие, горизонтальный нистагм. Незначительный парез небной занавески.
Из эпидемиологического анамнеза было установлено, что пациент за три дня до заболевания употреблял в пищу маринованые грибы собственного изготовления, которые употреблял один. На основании вышеизложенного был поставлен предварительный диагноз: Ботулизм?
Назначена стандартная дезинтоксикационная терапия и антибактериальная, введена противобутулиническая сыворотка терапия. Однако, эффекта от лечения не наступало развились нисходящие вялые парезы мышц шеи и плечевого пояса.
При обследовании были выявлены изменения в общем анализе крови. в виде лейкоцитоза и нейтрофилеза. При дальнейшем обследовании в общем анализе крови были выявлены нарастающий лейкоцитоз (10,6х10*6) и нейтрофилез Биохимический анализ крови выявил незначительное повышение уровня АЛТ и АСТ с преимущественным повышением АСТ, общий анализ мочи в норме. В Бактериологический анализ кала на кишечную группу – отрицательный. При УЗИ органов брюшной полости наблюдали эхо–признаки диффузных изменений поджелудочной железы и печени.
При проведении реакции нейтрализации на мышах данных за ботулизм не обнаружено. За время нахождения в стационаре, больному проводили, дезинтоксикационную, гормональную терапию, назначался курс витаминов. На фоне лечения положительная динамика: не отмечалась, проведен консилиум с участием неврологов. При обследовании выявлены незначительные расстройства чувствительности в верхних конечностях, у пациента была заподозрена нейропатия на фоне ранее перенесенной вирусной инфекции. Он был переведен в неврологическое отделение.
Анализ клинического случая показал сложность дифференциальной диагностики ботулизма и миастения до стадии нарушения чувствительности при наличии отягощенного эпидемического анамнеза.
Читайте также:


