Плазмокоагулаза у эпидермального стафилококка
Методы микробиологической диагностики стафилококковых заболеваний отражены в схеме 1. Выполняется следующий комплекс методов исследования.
Бактериоскопический метод – микроскопия мазков из материала от больного, окрашенных по Граму. Выявление в мазках кокков, располагающихся небольшими группами по 2-3 бактерии; типичное расположение в виде гроздьев винограда характерно для чистых культур стафилококка (рис. 1 – цветная вкладка).
Бактериологический метод.Исследуемыйматериал засевают на чашки с желточно-солевым (ЖСА) и кровяным МПА, инкубируют при 37 0 С сутки. На 2 день учитывают характер
роста колоний на обеих средах. На желточно-солевом агаре колонии стафилококка имеют ровные края, гладкую поверхность, вокруг колонии образуется радужный венчик в результате расщепления лецитина яичного желтка ферментом лецитовителлазой; цвет пигмента колоний варьирует от золотистого до белого. На кровяном МПА вокруг колоний образуются зоны
гемолиза. Из типичных для стафилококка колоний делают мазок, окрашивают его по Граму, микроскопируют. Оставшуюся часть колонии пересевают на скошенный МПА для получения чистой культуры. На 3 день проводят идентификацию выделенной культуры стафилококка с дифференциацией основных видов в соответствии с таблицей 2, определяют чувствительность к антибиотикам методом бумажных дисков и фаговар (набор для фаготипирования состоит из фагов 21 типа, разделенных на 4 группы; при внутрибольничных инфекциях наиболее часто встречаются фаговары 77 и 80).
Таблица 1.Этиология бактериальных раневых и гнойно-воспалительных инфекций
| Аэробы | Анаэробы |
| Грамположительные бактерии Enterococcus faecalis, Staphylococcus aureus, Staphylococcus hyicus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Staphylococcus haemolyticus, Staphylococcus hominis, Streptococcus pyogenes, Streptococcus agalactiae, Erysipelotrix rhusiopathiae Грамотрицательные бактерии Burkholderia cepacia, Citrobacter koseri, Edwardsiella tarda, Eikenella corrodens, Enterobacter spp, Escherichia coli, Haemophylus influence, Klebsiella spp, Listeria monocytogenes, Moraxella catarrhalis, Proteus spp, Pseudomonas spp, Salmonella enterica, Serratia spp, Spirillum minus, Streptobacillus moniliformis, Vibrio vulnificus | Неспорообразующие грамположительные бактерии Bacteroides spp, Prevotella spp, Porphiromonas spp, Fusobacterium spp, Veilonella spp Неспорообразующие грамотрицательные бактерии Peptostreptococcus spp, Propionibacterium spp Cпорообразующие грамположительные бактерии Clostridium perfringens, Clostridium novy, Clostridium oedematiens, Clostridium septicum, Clostridium sordelli, Clostridium histolyticum, Clostridium sporogenes, Clostridium ramosum |
| Схема 1. Микробиологическая диагностика стафилококковых инфекций | |
| Материал: гной, раневое отделяемое, пунктаты из полостей и абсцессов, кровь, мокрота, моча, ликвор, рвотные массы, испражнения, остатки пищи. | |
| Микроскопический метод Выявление грамположительных кокков (группами по 2-3 клетки) в мазках из материала от больного, окрашенных по Граму Серологический метод РНГА или РН для определения α-антитоксина в сыворотке крови больных хроническими стафилококковыми инфекциями. ИФА для определения антител к стафилококку. Имеет вспомогательное значение Бактериологический метод 1 день. Посев материала на чашки с желточно-солевым (ЖСА), кровяным МПА, сахарным МПБ. 2 день -учет характера роста колоний. На ЖСА колонии стафилококка с ровными краями, гладкой поверхностью, радужным венчиком вокруг, цвет - от золотистого до белого. | На кровяном МПА - зоны гемолиза, в МПБ –равномерное помутнение. В мазке из колоний в окраске по Граму – кокки в виде гроздьев винограда. Пересев оставшейся части колонии на скошенный МПА для получения чистой культуры, а с сахарного МПБ на кровяной МПА и ЖСА для получения изолированных колоний. 3 день - идентификация выделенной культуры стафилококка, дифференциация видов по биохимическим свойствам, определение чувствительности к антибиотикам и фаговара. Выделение чистой культуры с ЖСА и кровяного МПА. 4 день.Заключение о виде стафилококка. Идентификация культуры, выделенной из сахарного МПБ 5 день.Заключение о виде стафилококка, выделенного из сахарного МПБ. |
Таблица 2. Дифференциация основных видов стафилококка
| Признаки | Виды стафилококков | ||
| S. aureus | S. epidermidis | S. saprophyticus | |
| Плазмокоагулаза | + | - | - |
| Лецитиназа | + | - | - |
| Альфа-токсин | + | - | - |
| Анаэробная ферментация глюкозы | + | + | - |
| Анаэробная ферментация маннита | + | - | - |
| Чувствительность к новобиоцину | S | S | R |
Обозначения: (+) – наличие признака; (-) – отсутствие признака; S - чувствительный; R – резистентный.
Для выявления плазмокоагулазы цитратную плазму крови кролика разводят в 2 раза, разливают по 0,4 мл в пробирки, куда вносят петлей культуру стафилококков. Результаты регистрируют через 2, 4, 24 часа. При наличии плазмокоагулазы образуется сгусток.
В некоторых случаях у выделенных чистых культур стафилококка определяют наличие ДНК-азы, каталазы, лизоцимной активности, фибринолизина, гиалуронидазы.
Лизоцимную активность выявляют по зонам просветления вокруг колоний стафилококка при его посеве на МПА в чашках Петри с культурой Micrococcus luteus.
Определение ДНК-азы. Суточную агаровую культуру стафилококка засевают на МПА в чашке Петри, содержащий ДНК. После инкубации посевов при температуре 37 0 С в течение 18-24 часов поверхность МПА заливают 1 N раствором соляной кислоты. Наличие ДНК-азы характеризуется появлением зоны просветления вокруг колоний.
Каталазный тест. Чистую культуру стафилококка вносят в каплю 3%-10%-го раствора перекиси водорода на стекле и растирают круговыми движениями. При наличии каталазы перекись водорода разлагается с образованием пузырьков кислорода.
Cерологический методв диагностике стафилококковых инфекций имеет вспомогательное значение, используясь, в основном, для диагностики хронических процессов (остеомиелит, септикопиемия и др.). Для определения антител к токсину стафилококка применяют РНГА с эритроцитарным диагностикумом, нагруженным α-токсином стафилококка или РН (реакция нейтрализации гемолитической активности стафилококкового токсина антитоксинами сыворотки крови больного в присутствии эритроцитов кролика). У здоровых лиц титр стафилококкового антитоксина составляет 0,5-4 АЕ. Разработан также ИФА.
| Клинически значимые виды стафилококка Коагулазоположительные: S. aureus, S. hyicus Коагулазоотрицательные: S. epidermidis, S. saprophyticus, S. haemolyticus, S.hominis |
Не нашли то, что искали? Воспользуйтесь поиском:
Плазмокоагулаза вызывает свертывание плазмы крови. Стафилококки, продуцирующие этот фермент, покрываются фибриновым чехлом, защищающим их от фагоцитоза. Большие концентрации коагу-лазы, циркулирующие в организме больного, приводят к понижению свертываемости крови, нарушению гемодинамики, прогрессирующему кислородному голоданию тканей.
Плазмокоагулазу выявляют путем внесения выделенной культуры в пробирку с цитратной плазмы кролика. У кролика из сердца берут 8 мл крови, вносят в пробирку с 2 мл 5% лимонно-кислого натрия и ставят в холодильник. После полной осадки форменных элементов плазму отсасывают в стерильную пробирку. Она может храниться в холодильнике 8-10 дней. Перед использованием ее разводят 1:5 (1 мл плазмы и 4 мл изотонического раствора хлорида натрия) и разливают в аглютинацийни стерильные пробирки по 0,5 мл. Полную петлю культуры стафилококков эмульгируют в плазме и помещают в термостат на 3 часа, затем оставляют при комнатной температуре на 18-20 часов. Предварительный учет свертывания плазмы проводят через 3 ч, окончательный - на второй день. Очень удобно пользоваться стандартной сухой цитратной плазмы кролика. Перед употреблением в ампулу добавляют 1 мл изотонического раствора хлорида натрия и после полного растворения ее разводят 1:5. Плазма человека малопригодна для постановки реакции плазмокоагуляции, поскольку в ней могут быть консерванты, лекарственные вещества, антитела, которые могут подавлять образование плазмокоагулаза.
Если выделена культура вызывает гемолиз, коагулирует плазму и дает положительную лецитовителазну реакцию, уже на третий день можно выдать результат на наличие S. aureus. Если культура обладает только плазмокоагулаза или только вителазну активность, для окончательного установления вида стафилококка необходимо определить дополнительные критерии патогенности: ферментацию маннита в анаэробных условиях, ДНК-азную активность, продукцию лизоцима, фосфатазы, а также определить чувствительность к новобиоцин.
57) методы определения чувствительности к антибиотикам( скажу честно, это инет-батюшка) ( я еще у Малышевой спрошу)
• Методы определения минимальных ингибирующих и бактерицидных концентраций, т. е. минимального уровня антибиотика, который позволяет предотвратить видимый рост микробов в питательной среде или пол ностью ее стерилизует. Это количественные методы, которые позволяют рассчитать дозу препарата, так как концентрация антибиотика в крови должна быть значительно выше минимальной ингибирующей концентрации для возбудителя инфекции. Введение адекватных доз препарата необходимо для эффективного лечения и профилактики формирования устойчивых микробов.
Для получения достоверных результатов необходимо применять стандартные диски и питательные среды, для контроля которых используются эталонные штаммы, соответствующих микроорганизмов. Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундирующим в агар полипептидным антибиотикам (например, полимиксин, ристомицин). Если эти антибиотики предполагается использовать для лечения, рекомендуется определять чувствительность микроорганизмов методом серийных разведений.
Определение чувствительности бактерий к антибиотикам методом серийных разведений. Данным методом определяют минимальную концентрацию антибиотика, ингибирующую рост исследуемой культуры бактерий. Вначале готовят основной раствор, содержащий определенную концентрацию антибиотика (мкг/мл или ЕД/мл) в специальном растворителе или буферном растворе. Из него готовят все последующие разведения в бульоне (в объеме 1 мл), после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащей 106-107 бактериальных клеток в 1 мл. В последнюю пробирку вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры). Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта по помутнению питательной среды, сравнивая с контролем культуры. Последняя пробирка с прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий, под влиянием содержащейся в ней минимальной ингибирующей концентрации (МИК) антибиотика.
Последнее изменение этой страницы: 2017-01-19; Нарушение авторского права страницы
Роды: Staphylococcys (типовой),
Род Staphylococcys включает около 30 видов. Доминируют 3 вида:
Морфология и биологические свойства
Staphyle— виноградная гроздь. Шарообразной формы, диаметр 0,6-1 мкм, неподвижный, спор не имеет, капсула формируется лишь в условиях организма (индуцибельный фактор). Хорошо окрашиваются анилиновыми красителями, грамположительны.
Хемоорганотроф, по типу дыхания — факультативный анаэроб, не прихотлив к питательным средам и условиям культивирования. Растет на простых питательных средах: МПБ — диффузное помутнение, МПА — колонии диаметром 2-4 мм, пигментированные (золотистого, лимонно-желтого или белого цвета). Пигмент — каротиноид, не растворим в воде, растворим в спирту, бензине, хлороформе. Синтезируется лучше на свету, при комнатной температуре, дополнительной аэрации на плотных питательных средах с молоком, картофелем или глицерином.
Пигментообразование: у S. aureus пигмент золотистый, у S. saprophyticus — лимонно-желтый, S. epidermidis — лимонно-желтый или белый.
Температурный диапазон роста 6-46° С, оптимальная 35-37°С, рН 4,2-9,3, оптимум 7,2.
Галотолерантный(устойчив к высоким концентрациям солей), большинство штаммов растет в присутствии 15% NaCl, сахарозы — до 40%, желчных кислот — до 40%.
Питательные среды для культивирования стафилококков:
2. Кровяной МПА с 5% бараньих или кроличьих эритроцитов — альфа-гемолиз;
3. Солевой МПБ — накопительная среда ( МПБ+ 7-10 % NaCl);
4. Желточно-солевой агар (ЖСА) — дополнительно содержит суспензию желтка куриного яйца (для определения лецитовителазы).
Семейство Micrococcaceae оксидаза(-), каталаза(+) — признак дифференциации от семейства Streptococcaceae; последнее оксидаза(-), каталаза(-).
Сахаролитические гидролазы: лактоза, глюкоза, маннит, мальтоза, сахароза — ферментация до кислоты без газа.
Примечание: стафилококк глюкозу и маннит ферментирует как в аэробных, так и в анаэробных условиях (отличие от стрептококка); NH3+, H2S-, индол +, восстанавливает нитраты в нитриты, разжижает желатин воронкообразно.
Липолитические ферменты: фосфотаза, лецитовителаза.
Факторы вирулентности стафилококков
1. Структурные компоненты: микрокапсула, компоненты клеточной стенки — протеин А, тейхоевые кислоты, пептидогликан.
2. Ферменты агрессии: плазмокоагулаза, лецитиназа, гиалуронидаза, муромидаза, фибринолизин и др.
3. Токсины: гемолизины, лейкоцидин, эксфолиативный токсин, токсин синдрома токсического шока, энтеротоксин.
Возникновение пищевых отравлений стафилококковой природы связано с действием термостабильных энтеротоксинов (100°С — 30 мин.), продуцируемых золотистыми стафилококками.
Экология и распространение
Стафилококки являются представителями микрофлоры кожи, слизистых полости рта, носоглотки, кишечника. Они постоянно выделяются из организма человека и могут быть обнаружены на предметах обихода, в воде, воздухе, почве. Особую опасность представляет S. aureus как потенциально патогенный для человека микроорганизм.
Источник стафилококковой инфекции: больной человек, носитель.
Механизмы и пути передачи: воздушно-капельный, контактный, алиментарный, инъекционный.
Стафилококки способны поражать практически все ткани организма и вызывать гнойно-воспалительные процессы различной локализации, раневую инфекцию, пищевые интоксикации.
При генерализации местных процессов возникает сепсис, септицемия (септикопиемия).
S. aureus может быть возбудителем внутрибольничных инфекций.
Исследуемый материал: гной, слизь, мокрота, кровь, моча, ликвор и др.
I. Бактериоскопический метод.
Микроскопия мазков, окрашенных по Граму — грамположительные кокки, в виде виноградных гроздей.
II. Бактериологический метод.
1. Посев на солевой бульон (среда накопления).
2. Посев на кровяной МПА — золотистые колонии с зоной α-гемолиза; ЖСА — колонии с радужным ореолом (положительная проба на лецитовиттеллазу).
3. Откол подозрительных колоний на косячок МПА с целью выделения чистой культуры.
4. Проверка чистоты выделенной культуры — микроскопия мазков, окрашенных по Граму (однородная популяция грамположительных гроздевидных кокков).
5. Постановка диагностических тестов: оксидаза (-), каталаза (+) — семейство Micrococcaceae; аэробное и анаэробное сбраживание глюкозы — род Staphylococcus; реакция на плазмокоагулазу (+/-), лецитовиттеллазу (+) — только у S. aureus.
6. Дифференцировка видов
Дифференцировка видов стафилоккоков
| Признак | виды | ||
| S. aureus | S. epidermidis | S. saprophyticus | |
| Плазмокоагулаза | + | - | - |
| Анаэробное сбраживание маннита | + | - | - |
| Окисление маннита | + | - | + |
| Чувствительность к новобиоцину | чувств. | нет | нет |
7. Внутривидовая дифференцировка. Определение антибиотикограммы и фаготипирование.
Иммунитет.Антимикробный, антитоксический, ненапряженный, непродолжительный, связан как с клеточными, так и гуморальными факторами.
Специфическая профилактика и терапия.Профилактика стафилоккоковых инфекций направлена на выявление микробоносителей золотистых стафилоккоков, главным образом, среди персонала хирургических отделений больниц и родовспомогательных учреждений и их санации. Для профилактики стафилоккоковых осложнений проводят активную иммунизацию стафилоккоковым анатоксином больных, накануне плановых хирургических операций, или беременных в конце беременности.
Для специфической терапии септических инфекци используют донорский антистафилоккоковый иммуноглобулин или антистафилоккоковую плазму.
При хронических инфекциях применяют стафилоккоковый анатоксин и/или стафилоккоковую аутовакцину с целью создания антитоксического и антимикробного иммунета.
Антибиотикотерапия стафилоккоковых инфекций проводится под контролем антибиотикограммы.
| | | следующая лекция ==> | |
| ОСНОВНЫЕ ВОЗБУДИТЕЛИ ГСИ | | | СТРЕПТОКОККИ |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
| Материал | Метод исследования | Результаты |
| Гной, эксудат, некроти-ческие массы | 1. Микроскопический 2. Бактериологический Посев на ЖСА, МСА А. Микроскопия мазков из колоний Б. Выделение чистой культуры Установление принадлежности культуры к роду Staphylococcus А. Микроскопический Б. Культуральное определение ферментации глюкозы в анаэробных условиях Видовая идентификация I. Коагулаза Определение признаков патогенности 1. Плазмокоагуляция 2. Лецитиназа 3. Гемолизин 4. Гиалуронидаза 5. ДНК-аза | Гр+кокки Рост пигментированных кокков Гр+кокки Гроздекокки Пигментообразование. Ферментация с образо-ванием кислоты Коагулазоположительные |
Идентификация стафилококков
Целью первичной идентификации является установление принадлежности выделенной культуры к семейству Micrococcaceae и роду Staphylococcus. Для установления принадлежности культур к семейству микрококков используют тест на каталазу.
Отмечают способность представителей семейства микрококков, имеющих фермент каталазу, расщеплять перекись водорода, образуя воду и газообразный кислород.
В отличие от микрококков представители родственного семейства стрептококков каталазы не имеют.
Видовая идентификация стафилококков
Последним этапом исследования является дифференциация S. aureus от представителей двух коагулазоотрицательных видов стафилококков. Если установлено, что штамм относится к виду S. aureus, проводят его идентификацию.
Идентификация S. aureus
Ориентировочные данные о принадлежности культуры к Staphylococcus можно получить при изучении характера колоний, выросших после посева исходного материала на элективную среду (для стафилококков – молочно-желточный солевой агар).
Определение лецитоветиллазы (лецитиназы)
Хлористый натрий является элективным фактором, так как подавляет рост большинства представителей микрофлоры, главным образом, грамотрицательной. Из компонентов яичного желтка – лецитоветиллаза является субстратом для фермента лецитоветиллазы. При расщеплении лецитоветиллина вокруг лецитиназоположительной колонии на поверхности среды образуется радужный венчик. Добавление в среду молока путем сложных химических процессов стимулирует образование стафилококками золотистого или лимонно-желтого пигмента, относящегося к группе каротиноидов.
Как правило, штаммы S. aureus обладают лецитиназой и пигментом, а культуры двух других видов лишены их. Возможны, однако, исключения: некоторые штаммы S. aureus не имеют пигмента или лецитиназы, а ряд штаммов S. epidermidis обладают лецитиназной активностью.
Реакция плазмокоагуляции
Принцип. Под действием фермента плазмокоагулазы активизируется естественная система свертывания крови (плазминогенротромбин).
Приготовление свежей плазмы. Стерильно взятую из сердца кровь кролика в количестве 3 мл вносят в пробирку с 2 мл стерильного 5 % раствора лимоннокислого натрия, смешивают и центрифугируют для осаждения форменных элементов крови в течение 10 минут при 1500 об/мин.
Плазму отсасывают, разводят в 5 раз стерильным физиологическим раствором и разливают в стерильные пробирки по 0,5 мл.
Ход исследования. В пробирку вносят 1 петлю суточной агаровой культуры исследуемого штамма, которую суспензируют в плазме. Штатив с пробиркой помещают в термостат при 37 °С и регистрируют результаты через 1, 2, 4 и 18 часов инкубации.
Оценка результатов. Появление на дне пробирки студнеобразного сгустка любого размера считается положительным результатом реакции. Отсутствие свертывания плазмы в течение 18 часов расценивается как отрицательный результат. В качестве контроля рекомендуется ставить реакцию с заведомо коагулирующим и некоагулирующим штаммами, а также оставлять одну пробирку с плазмой незасеянной.
Окончательная идентификация S. aureus требует постановки еще двух тестов. На первом этапе определяют наличие у штаммов плазмокоагулазы. Если после этого штамм идентифицировать не удается, дополнительно определяют один из двух следующих признаков: наличие ДНК-азы (что предпочтительнее) или способность ферментировать маннит в анаэробных условиях.
При наличии положительного результата в реакции плазмокоагуляции и хотя бы в одном из двух предварительных тестов (пигмент лецитиназа) исследуемый штамм может быть отнесен к виду S. aureus (варианты 2-3).
Отсутствие плазмокоагулазы и хотя бы одного из двух первых признаков дает основание считать, что штамм не принадлежит к S. aureus (варианты 5-7).
Расхождения между результатами реакции плазмокоагуляции, с одной стороны, и двух предварительных тестов – с другой (варианты 4 и 8), требует постановки одного из двух дополнительных тестов (ДНК-азы или ферментации маннита в анаэробных условиях). В случае совпадения результатов дополнительного теста с результатами реакции плазмокоагуляции штамм считается либо относящимся к виду S. aureus при положительных результатах (варианты 4а и 4в), либо не относящимся к нему (при отрицательных, варианты 8б и 8г), или отрицательных (принадлежность к другим видам, варианты 4б и 4г) результатов.
Проводить идентификацию S. aureus лишь на основании результата одного теста не рекомендуется.
Определение ДНК-азы
Принцип. Под действием ДНК-азы (дезоксирибонуклеазы) добавленная в плотную среду высокополимерная ДНК распадается на низкополимерные фрагменты. При этом мутная, среда становится прозрачной.
Определение ферментации маннита в анаэробных условиях
Определение ферментации глюкозы в анаэробных условиях. Определение проводят аналогичным путем, в качестве субстрата используют 1% раствор маннита.
Идентификация S. epidermidis и S. saprophyticus
Те штаммы, которые после исследований, описанных выше, признаны не относящимися к S. aureus, подвергаются дальнейшей идентификации для установления их видовой принадлежности.
Дифференциацию S. epidermidis; и S. saprophyticus рекомендуется проводить в трех тестах:
1) определение устойчивости к новобиоцину;
2) наличие фосфатазы;
3) способность окислять маннит.
Для штаммов S. epidermidis характерны: чувствительность к новобиоцину, наличие фосфатазы, неспособность окислять маннит; для штаммов S. saprophyticus – противоположные свойства. Поскольку не все стафилококки по своим характеристикам укладываются в указанную схему, такие штаммы следует обозначать Staphylococcus Spp.
Вопросы для обсуждения
1. Общая характеристика патогенных кокков.
2. Морфология, тинкториальные и культуральные свойства стафилококков.
3. Токсины и ферменты "агрессии".
4. Классификация стафилококков.
5. Способы обнаружения токсинов и ферментов "агрессии".
6. Лабораторная диагностика.
7. Препараты, применяемые для специфического лечения и профилактики стафилококковых заболеваний.
Идеи о восприятии организма человека или животных как биоценоза давно бередили мое воображение — еще со времен работы в Детской больнице имени Филатова. В кишечнике, в носовой полости, во влагалище, на коже здоровых людей обитает множество микроорганизмов, среди которых преобладают вполне безвредные. Но есть и условно патогенные и патогенные, способные при определенных условиях вызывать тяжелые заболевания. То есть организм человека или животных можно рассматривать как биоценоз, в котором обитают потенциальные хищники и жертвы. Иногда они меняются ролями. Например, в ответ на внедрение бактерий организм отвечает мощной реакцией (иммунитет!), которая разрушает хищника еще до того, как он проникнет во внутреннюю среду человека или животных. Бывает и другая ситуация. Организм чем-то ослаблен. Не в силах предотвратить проникновение микробов в свои внутренние (в норме стерильные) среды: кровь, почки, легкие, мозг, сердце и др. И вот тут начинается борьба между микробами и клетками организма за контроль внутренней среды. Особенно агрессивны те микробы, у которых имеются ферменты, способные разрушать вещества, входящие в состав тканей организма. Золотистые стафилококки особенно богаты разнообразными ферментами, для которых многие органические соединения клеток человека и животных являются питательными субстратами. Например, лецитиназа способна разрушать клеточные стенки эритроцитов. Желатиназа — некоторые белки. Гиалуронидаза — гиалуроновую кислоту, входящую в состав пупочного канатика новорожденного. Дезоксирибонуклеаза — разрушает ДНК. Мое особое внимание привлекла плазмокоагулаза, фермент, который приводит к свертыванию крови. Есть такое выражение: кровь застыла в жилах. То есть, при определенных условиях кровь свертывается в сосудах, что приводит к гибели человека или животного. Такая страшная картина может наблюдаться, когда Staphylococcus aureus проникает внутрь кровеносной системы, вызывая сепсис (заражение крови). Стафилококковый сепсис приводит к тяжелейшему состоянию, которое называется: тромбогеморрагический синдром или синдром диссеминированного внутрисосудистого свертывания крови. Субстратом для стафилококковой плазмокоагулазы служит фибриноген крови человека или животных. Наличие плазмокоагулазы у золотистого стафилококка — один из ведущих признаков этого вида бактерий. Во всех микробиологических лабораториях до сих пор самым первым тестом, по которому определяют: патогенный ли это стафилококк (Staphylococcus aureus) или безвредный обитатель кожи (Staphylococcus epidermidis), является реакция свертывания плазмы кролика.
Меня интересовало, можно ли подавить продукцию плазмокоагулазы производными акридина, как это наблюдалось в отношении фермента бета-лактамазы (пенициллиназы), разрушающего пенициллин. В этом случае предлагаемая мной схема антистафилококковой химиотерапии была бы еще более обоснованной. Всякое продвижение вперед в науке и искусстве связано с разработкой новых медодов или использованием старых, никогда не применявшихся в этой области человеческого творчества. Качественный метод, который десятилетиями использовался для выявления плазмокоагулазы, совершенно не годился. Совместно с Н. Б. Гришиной, научной сотрудницей Первого Московского медицинского института имени Сеченова, мы стали применять нефелометрический и тромбоэластографический количественные методы измерения динамики активности плазмокоагулазы. Появление мелких хлопьев (фибринового полимера) повышало светопреломление смеси веществ, участвующих в реакции, и регистрировалось с помощью оптического прибора — нефелометра. Применение тромбоэластографического метода, основанного на измерении скорости образования кровяного сгустка, позволило получать графически документированную количественную оценку процесса образования сгустка в контроле и в присутствии производных акридина. Все эти исследования были проведены в 1976–1978 годах. Для того, чтобы показать возможность эффекта акридинов на плазмокоагулазу устойчивых и чувствительных к пенициллинам и акридинам культур стафилококка, использовали в экспериментах штаммы золотистого стафилококка 209 Р (пенициллиназаоотрицательный) и 8325–1 (пенициллиназоположительный), а также спонтанные мутанты штамма 209 Р, устойчивые к акридинам. В результате этих экспериментов удалось показать, что в присутствии 3,6-диаминоакридинов снижается продукция плазмокоагулазы. Эти соединения подавляли не самый фермент (его взаимодействие с субстратом), а выработку плазмокоагулазы клетками золотистых стафилококков. Из наших наблюдений следовал очень важный для тактики антистафилококковой химиотерапии вывод: акридины блокировали синтез плазмокоагулазы, подобно тому, как это наблюдалось нами на модели пенициллиназы.
Глава 14. Стафилококки
Впервые стафилококки были обнаружены Л. Пастером в 1897 г. Подробно они были изучены А. Огстоном (1882) и Ф. Розенбахом (1884).
Морфология. Стафилококки (от греч. staphyle - виноградная гроздь) имеют вид круглых шаров диаметром 0,5-1,5 мкм. Размножаясь, образуют скопления в виде грозди винограда. Такая форма является результатом деления микробов в различных плоскостях. Однако в гное встречаются единичные и парные кокки. Стафилококки неподвижны, не имеют спор, при специальных условиях культивирования образуют микрокапсулу, грамположительны.
Культивирование. Стафилококки - факультативные анаэробы, однако лучше растут в присутствии кислорода. Растут и размножаются на обычных питательных средах, хорошо растут на средах с кровью, оптимальные условия - температура 37° С, рН 7,2-7,4.
Элективными средами являются желточно-солевой агар и солевой агар. На МПА колонии стафилококка выпуклые, круглые, непрозрачные, блестящие, размером 2-4 мм с ровными краями. При росте стафилококки образуют пигмент: золотистый, лимонно-желтый или белый. Лучше всего пигмент образуется на молочной среде при комнатной температуре и рассеянном свете. Стафилококковый пигмент не растворяется в воде, растворяется в ацетоне, эфире, спирте и т. д. При росте некоторых штаммов стафилококка на агаре с кровью вокруг колонии образуется зона гемолиза. Рост на бульоне характеризуется равномерным помутнением и осадком на дне.
Ферментативные свойства. Стафилококки вырабатывают сахаролитические и протеолитические ферменты. Сахаролитические ферменты расщепляют ряд сахаров: лактозу, глюкозу, сахарозу, мальтозу, глицерин и другие с образованием кислоты.
Протеолитические свойства стафилококка выражаются в способности растворять казеин, разжижать желатин (медленно), расщеплять другие белковые субстраты.
Стафилококки продуцируют ферменты патогенности: 1) коагулазу (сворачивает плазму крови); 2) гиалуронидазу (фактор распространения); 3) лецитиназу (растворяет лецитин оболочки клеток); 4) фибринолизин (лизирует фибрин); 5) ДНКазу (деполимеризует ДНК); 6) фосфатазу и др.
Наличие плазмокоагулазы позволяет дифференцировать золотистый стафилококк от стафилококков других видов. Многие стафилококки вырабатывают пенициллиназу, разрушающую пенициллин.
Токсинообразование. Стафилококки вырабатывают экзотоксины. К их числу относятся гемолизины четырех типов, из которых наибольшее значение имеет α-токсин. Он обладает следующими свойствами: гемолитическим - вызывает гемолиз эритроцитов, дермонекротическим - при внутрикожном введении вызывает некроз, летальным - при внутривенном введении приводит к гибели чувствительных к нему животных.
Кроме гемолизинов стафилококки образуют лейкоцидин, убивающий лейкоциты, энтеротоксины шести типов, вызывающие пищевые отравления, эксфолиатины двух типов, приводящие к отслаиванию эпидермиса у новорожденных детей.
Антигенная структура. Стафилококки имеют протеиновый антиген А, общий для всех золотистых стафилококков, и полисахаридные антигены: А, Б, С.
Стафилококки выделяют бактериоцины (стафилоцины), которые обладают антагонистическим действием по отношению к микроорганизмам данного рода.
Среди золотистых (реже эпидермальных) стафилокков различают около 40 фаговаров. Определение чувствительности выделенных из различных объектов стафилококковых культур к типовым фагам имеет важное эпидемиологическое значение (при установлении источника и путей передачи возбудителя).
Классификация. В настоящее время стафилококки, выделенные от человека, делят на 3 вида (табл. 23): S. aureus, S. epidermidis, S. saprophyticus.

Таблица 23. Дифференциация видов стафилококков, выделенных от человека
Примечание. + наличие ферментации, устойчивости, - отсутствие ферментации, устойчивости.
Устойчивость к факторам окружающей среды. Стафилококки довольно устойчивы, поэтому они обнаруживаются в воздухе, почве, воде, на предметах обихода. При температуре 100° С они погибают моментально, при температуре 70° С - через 10-15 мин. Они хорошо переносят низкие температуры. При замораживании сохраняют жизнеспособность в течение нескольких лет. Хорошо переносят высушивание. Прямой солнечный свет убивает их только через несколько часов. Обычные растворы дезинфицирующих веществ (например, сулема в разведении 1:1000) убивают их через 15-20 мин. При обезвреживании выделений, содержащих гной, белок, мокроту, не следует применять фенол. Это дезинфицирующее вещество вызывает коагуляцию белков, что предохраняет микроорганизмы от гибели. Стафилококки чувствительны к бриллиантовому зеленому.
Восприимчивость животных. К стафилококку чувствительны крупный и мелкий рогатый скот, лошади, свиньи, куры. Из экспериментальных животных - кролики, белые мыши и котята.
Источники инфекции. Больной человек и бактерионоситель.
Пути передачи. Контактно-бытовой, воздушно-капельный, воздушно-пылевой, пищевой.
Заболевания у человека. Пиодермия, фурункулы, карбункулы, панариции, абсцессы; воспалительные процессы различных органов и тканей; ангины, циститы, остеомиелиты, холециститы, маститы; сепсис и септикопиемия; пищевые токсикоинфекции и многие другие. Описано около 120 нозологических форм стафилококковой этиологии.
Патогенез. Стафилококки проникают через кожу и слизистые оболочки.
Преимущественное значение при стафилококковых заболеваниях имеет золотистый стафилококк (S. aureus). Менее выражена роль в патологии человека S. epidermidis и S. saprophyticus. Патогенез обусловливается свойствами возбудителя - ферментами, экзотоксинами, веществами бактериальной клетки и состоянием иммунной системы макроорганизма.
Чаще поражается кожа и подкожная клетчатка - возникают пиодермиты, фурункулы, панариции. Нередко стафилококки обусловливают вторичные заболевания, например пневмонию при гриппе. Они также вызывают раневые инфекции. Особенно велика роль стафилококков в акушерской практике, так как новорожденные очень чувствительны к ним. В течении стафилококковых заболеваний имеет значение развитие аллергии, поэтому заболевание характеризуется рецидивами.
Особое место среди стафилококковых заболеваний занимают пищевые интоксикации. Клинически они протекают как токсикозы, сопровождаются рвотой, поносом, головной болью и другими явлениями.
Иммунитет. У человека имеется естественная резистентность, связанная с механическими факторами, фагоцитозом и наличием антител. Воспалительный процесс, возникающий в месте внедрения возбудителя, обусловливает задержку стафилококков и затрудняет их распространение по организму. В образовавшемся очаге стафилококки подвергаются фагоцитозу.
Образующийся в процессе заболевания антитоксин является важным фактором в общем комплексе иммунитета. Однако приобретенный иммунитет нестойкий, поэтому наблюдаются рецидивы.
Профилактика. Сводится к улучшению санитарно-гигиенических условий, активному выявлению больных и бактерионосителей, правильному режиму работы больничных учреждений.
Специфическая профилактика. Стафилококковый анатоксин и антистафилококковый иммуноглобулин.
Лечение. Антибактериальные препараты, поливалентный стафилококковый бактериофаг, антистафилококковая плазма и иммуноглобулин. В некоторых случаях при хроническом течении стафилококковых инфекций применяют аутовакцину.
1. По какому признаку кокки объединены в одну группу?
2. Какие ферменты и факторы патогенности продуцируют стафилококки?
3. Какие заболевания вызывают стафилококки?
4. Какие виды стафилококков Вы знаете?
Цель исследования: выделение и идентификация стафилококков.
1. Гной (фурункулы, карбункулы, абсцессы).
2. Слизь из зева (ангина).
3. Мокрота (пневмония).
4. Моча (пиелиты и циститы).
5. Дуоденальное содержимое (холецистит).
6. Кровь (подозрение на сепсис).
7. Рвотные массы, промывные воды желудка, пищевые продукты (пищевые отравления).
8. Слизь из носа (обследование на бактерионосительство).

Способы сбора материала

Первый день исследования
Все посевы ставят в термостат на сутки.
Обнаружение стафилококков при микроскопии гноя из закрытого абсцесса и осадка мочи, взятой катетером, позволяет дать предварительный положительный ответ: обнаружен стафилококк.
Посевы на плотных и жидких питательных средах вынимают из термостата и изучают. Подозрительные в отношении стафилококка колонии, выросшие на желточно-солевом агаре, отсевают на скошенный агар для получения и дальнейшего изучения чистой культуры. При этом учитывают наличие лецитиназы, которое проявляется в образовании радужного венчика вокруг колонии. Чашки с оставшимися колониями оставляют на 2-3 дня при комнатной температуре для выявления пигмента. Просматривают посевы на чашках с агаром, содержащим кровь. Колонии с четкой зоной гемолиза (просветление) вокруг них выделяют на скошенный агар. Посев крови в сахарном бульоне инкубируют 10 сут, производя через 2-3 дня высевы на агар с кровью и желточно-солевую среду.
При отсутствии роста на плотных питательных средах делают высев из бульона с глюкозой на агар с кровью. Посевы ставят в термостат на сутки.
Вынимают посевы из термостата. Из выделенных на скошенный агар культур делают мазки, окрашивают по Граму и микроскопируют. При наличии грамположительных стафилококков проводят дальнейшее изучение выделенной культуры:
а) ставят реакцию плазмокоагуляции;
б) изучают гемолитические свойства;
в) определяют продукцию ДНКазы;
г) определяют ферментацию маннита в анаэробных условиях;
д) определяют устойчивость к новобиоцину.
Реакция плазмокоагуляции. Цитратную плазму, полученную из крови кролика, разводят изотоническим раствором натрия хлорида в соотношении 1:4 и наливают в две преципитационные пробирки по 0,3-0,5 мл. В одну пробирку вносят петлю исследуемой культуры, другая пробирка служит контролем. Обе пробирки ставят в термостат при температуре 37° С. Учет реакции производят через 2-3 ч. При отсутствии свертывания плазмы посевы оставляют при комнатной температуре на 24 ч, после чего учитывают реакцию. При наличии фермента коагулазы плазма свертывается (не выливается из перевернутой пробирки). В контрольной пробирке консистенция плазмы не изменяется.
Ускоренный метод определения коагулазы. В стерильной капле воды на предметном стекле суспендируют выделенную культуру, к ней прибавляют одну каплю неразведенной плазмы. При положительной реакции из микробных клеток в течение 20-60 с образуются крупные хлопья. Этот метод используют при массовых обследованиях.
Определение гемолитических свойств. Производят посев на агар с 5% крови (штаммы, продуцирующие α-гемолизин, дают зоны просветления среды и на кроличьей и на бараньей крови, продуцирующие β-гемолизин лизируют только эритроциты барана).
Определение ДНКазы. Исследуемую культуру засевают на среду, содержащую ДНК. Посевы инкубируют. Через 18-20 ч на чашку с выросшими колониями стафилококка добавляют 5-7 мл раствора хлороводородной кислоты. ДНК реагирует с кислотой и среда становится мутной. Если выделенная культура продуцирует фермент ДНКазу, он деполимеризует ДНК и помутнение не образуется.
Расщепление маннита в анаэробных условиях. Исследуемую культуру засевают уколом на полужидкий агар с маннитом. Поверхность среды заливают вазелиновым маслом. Инкубируют 18-24 ч при 37° С. Положительная реакция характеризуется изменением цвета среды (в среде имеется индикатор).
Производят учет результатов (табл. 24).
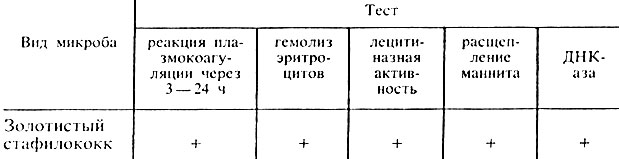
Таблица 24. Свойства золотистого стафилококка
Примечание. + положительная реакция.
Наличие перечисленных признаков позволяет отдифференцировать золотистые стафилококки от стафилококков других видов и дать окончательный ответ: выделен S. aureus (рис. 37).
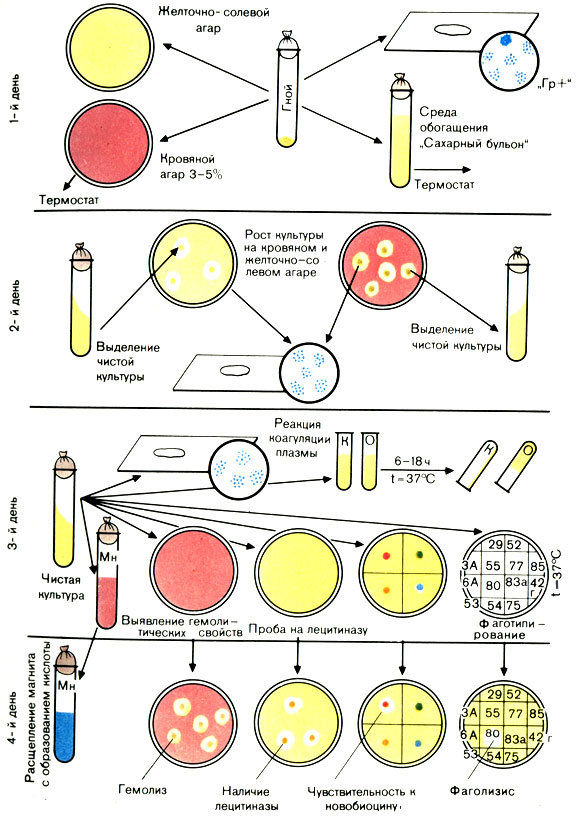
Рис. 37. Схема выделения и идентификации стафилококка
Для установления эпидемиологической цепочки выделенную культуру фаготипируют. Фаготипирование может подтвердить идентичность стафилококков, выделенных от разных больных и из объектов внешней среды.
Для фаготипирования используют критические тест-разведения фагов. Критическим тест-разведением называют то максимальное разведение фагов, при котором происходит полусливной лизис соответствующего штамма стафилококка.
Методика фаготипирования. В чашку Петри наливают 20 мл 1,5% МПА, дают ему застыть и подсушивают в термостате в течение 30-40 мин. На поверхность агара наносят 1 мл 4-6-часовой культуры выделенного стафилококка, распределяют по поверхности всей чашки, избыток жидкости отсасывают или дают ей испариться в термостате в открытой чашке. Предварительно дно чашки делят на секторы или квадраты. Число квадратов или секторов должно соответствовать количеству используемых фагов. Затем на каждый квадрат или сектор наносят один фаг.
Чашки ставят в термостат при температуре 37° С. Результаты определяют через 6-7 ч. Если чашки оставляют при комнатной температуре, то учет фаголизиса производят через 18-24 ч.
Биологические пробы. Проба на определение летальных свойств культуры. Для выявления летального действия токсина кролику вводят внутривенно (или внутрибрюшинно) фильтрат бульонной культуры стафилококка из расчета 0,1-0,2 мл фильтрата на 1 кг массы кролика. Гибель кролика через 3-4 дня свидетельствует о наличии летального действия токсина.
Дермонекротическая проба. Пробу ставят на кролике (наиболее чувствительному к этому токсину животному). Предварительно на боку или на спине животного выщипывают шерсть и вводят внутрикожно 0,2 мл двухмиллиардной взвеси стафилококковой культуры в изотоническом растворе натрия хлорида. При наличии в выделенной культуре некротических свойств в месте введения образуется инфильтрат, сопровождающийся некрозом.
Реакцию учитывают через 24-18 ч.
Полученную культуру стафилококка проверяют на чувствительность к антибиотикам методом бумажных дисков (см. главу 9).
1. Какой материал исследуют при заболеваниях, вызываемых стафилококками?
2. Каковы основные методы лабораторного исследования для выявления стафилококков?
3. Какова методика постановки реакции плазмокоагуляции?
4. На какой среде выявляют гемолитические свойства стафилококков?
5. С какой целью проводят фаготипирование?
Проверьте, к какому антибиотику чувствительна выделенная культура стафилококка.
Желточно-солевой агар Чистовича. Готовят желточную смесь (1 желток куриного яйца на 150 мл стерильного изотонического раствора натрия хлорида). К мясопептонному солевому агару (8-10% натрия хлорида), растопленному и остуженному до 45° С, добавляют 20% желточной взвеси (соблюдают стерильность) и разливают в чашки.
Агар с кровью. См. главу 7.
Солевой бульон, солевой агар. Готовят как обычные среды - МПБ и МПА, только натрия хлорид вносят в большем количестве (8-10%). Бульон разливают в колбы, пробирки, агар - в чашки.
Читайте также:


