Журнал регистрации на тиф паратифную группу микроорганизмов
Противоэпидемические мероприятия в очаге брюшного тифа
Согласно Санитарно-эпидемиологическим правилам "Профилактика брюшного тифа и паратифов. СП 3.1.1.2137-06"
Мероприятия в отношении источника брюшного тифа
1.Все больные брюшным тифом и паратифами подлежат обязательной госпитализации. Госпитализацию больных осуществляют в течение первых трех часов, в сельской местности - в течение 6 часов после получения экстренного извещения.
2.На территориях с эндемичной заболеваемостью тифопаратифами провизорной госпитализации подлежат лица с лихорадочным состоянием невыясненного происхождения, продолжающимся более трех дней, с обязательным исследованием крови на гемокультуру.
3. Учет и регистрация больных (носителей) осуществляется в установленном порядке. Информация о выявленном случае (подозрении) направляется из ЛПУ в учреждения, осуществляющие госсанэпиднадзор (по телефону в течение 2 ч с момента установления диагноза). В течение 12 ч передается экстренное извещение. Каждый случай болезни (носительства) фиксируется в журнале регистрации инфекционных заболеваний.
4. Выписка больного из стационара проводится после исчезновения клинических симптомов и отрицательного трехкратного исследования кала и мочи. Первое исследование проводят спустя 5 дней после установления нормальной температуры, последующие - с пятидневным интервалом.
Реконвалесцентов, получавших антибиотики, выписывают из стационара не ранее 21 дня, а лиц, не получавших антибиотики, - не ранее 14 дня после установления нормальной температуры
Противоэпидемические мероприятия в очаге в отношении контактных с больными или носителями
1.В квартирных очагах медицинскому наблюдению подлежат все лица, контактировавшие с больными тифопаратифами.
2.С целью раннего выявления новых заболеваний за всеми контактными устанавливается медицинское наблюдение (осмотр, опрос, термометрия) на протяжении 3 недель при брюшном тифе и 2 недель при паратифах.
3.Исследованию крови на гемокультуру подлежат все лица с лихорадочным состоянием невыясненного происхождения, наблюдающимся в течение 5 и более дней.
4. В первую очередь в очагах обследуются работники отдельных профессий, производств и организаций, представляющие собой наибольшую потенциальную эпидемическую опасность. Проводится однократное бактериологическое исследование фекалий и мочи, а также однократное серологическое исследование крови с постановкой РПГА с Ви-антигеном (для выявления состояния хронического брюшно-тифозного бактерионосительства)
5. Всем контактным в очаге проводится фагопрофилактика. Фагопрофилактика брюшного тифа осуществляется брюшно-тифозным бактериофагом, паратифов - бактериофагом сальмонеллезным групп ABCDE. Противопоказаний к применению бактериофагов не имеется. В очагах брюшного тифа и паратифов бактериофаг назначают трехкратно с интервалом в 3 - 4 дня.
6. Заключительную дезинфекцию в городах проводится не позже шести часов, в сельской местности - 12 часов после госпитализации больного.
7. Результаты медицинского наблюдения отражаются в амбулаторных картах, в историях развития ребенка (в специальных листах наблюдения за контактными в очаге)
Противоэпидемические мероприятия в очаге вирусного гепатита В
согласно Санитарно-эпидемиологическим правилам СП 3.1.1.2341-08
Мероприятия в отношении источника
1.Больные с установленным диагнозом ОГВ, микст-гепатитами, а также больные ХГВ в период обострения подлежат госпитализации в инфекционные отделения.
2.Лица, перенесшие ОГВ, должны находиться под диспансерным наблюдением в течение 6 месяцев. Клинический осмотр, биохимические, иммунологические и вирусологические тесты проводят через 1, 3, 6 месяцев после выписки из стационара. При сохранении клинико-лабораторных признаков заболевания наблюдение за пациентом должно быть продолжено.
Противоэпидемические мероприятия в очаге вирусного гепатита А
Согласно Санитарно-эпидемиологическим правилам СП 3.1.2825-10 "Профилактика вирусного гепатита А"
Первичный осмотр и клинико-лабораторное обследование проводит медицинский работник (врач-инфекционист, врач-терапевт, фельдшер) лечебно-профилактической организации по месту проживания контактных лиц или месту работы (обучения, воспитания) в первые 5 дней после выявления больного и до введения вакцины против ОГА.
4.При выявлении больного ОГА медицинский работник лечебно-профилактической организации (врач, фельдшер, средний медицинский работник) организует проведение комплекса противоэпидемических мероприятий, включая текущую и заключительную дезинфекцию, направленных на предупреждение заражения окружающих.
Для заключительной и текущей дезинфекции в очагах ОГА используют зарегистрированные в установленном порядке дезинфицирующие средства, эффективные в отношении ВГА.
4.Все меры, направленные на ликвидацию очага, отражаются в карте эпидемиологического обследования и листе наблюдения за контактными лицами, последний вклеивается в амбулаторную карту больного ОГА. В этих же документах фиксируется окончание мероприятий в очаге и результаты наблюдения за контактными лицами.
4.При отсутствии клинических признаков заболевания, контактных лиц, ранее не привитых против гепатита А и не болевших этой инфекцией, вакцинируют по эпидемическим показаниям не позднее 5 дня с момента выявления больного ОГА.
Специфическая профилактика. Вакцинацию населения против ОГА проводят в соответствии с действующим календарем профилактических прививок по эпидемическим показаниям.В России зарегистрированы следyющие вакцины: хаврикс 1440(Глаксо Смит Кляйн, Бельгия); хаврикс 720 (детская доза) (ГлаксоСмит Кляйн, Бельгия); вакта (Мерк Шарп Доум, CIIIA); аваксим(Авентис Пастер, Франция).
Вакцинацию рекомендуется начинать с 12-месячного возраста.
После введения первой дозы вторую дозу вводят через 6-12 месяцев
В нашей стране разрешена к применению отечечественная вакцина против гепатита А - культуральная инактивированная очищенная
схеме 0-l-6 месяцев с последующей ревакцинацией каждые 5 лет.
Эпидемическим показаниям
Сведения о выполненной прививке (дата введения, название препарата, доза, номер серии, контрольный номер, срок годности, характер реакции на прививку) вносят в установленные учетные формы медицинских документов и сертификат профилактических прививок.
Выписка больного дифтерией осуществляется после полного клинического выздоровления и 2-кратного бактериологического обследования на наличие возбудителя дифтерии с отрицательным результатом. Больного обследуют не ранее 3 дней после отмены антибиотиков с интервалом 1-2 дня.
За лицами, общавшимися с больным дифтерией, с подозрением на это заболевание, носителем токсигенных коринебактерии дифтерии устанавливается ежедневное медицинское наблюдение с осмотром ротоглотки, носа, кожи и термометрией в течение 7 дней от момента изоляции источника инфекции с регистрацией данных наблюдения в медицинской документации.
2.В течение первых 3 дней с момента изоляции больного организуется осмотр контактных лиц врачом-отоларингологом.
3.В течение 48 часов с момента установления диагноза дифтерии (или подозрения на это заболевание, или носительства токсигенных коринебактерии дифтерии) проводится бактериологическое обследование лиц, бывших с ними в контакте. В случае выявления токсигенных коринебактерии дифтерии у контактных лиц, бактериологическое обследование повторяют до прекращения выявления возбудителя дифтерии в этом очаге.
4.Текущая дезинфекция организуется медицинским работником и проводится в очаге инфекционного заболевания на дому членами семьи:
- до госпитализации больного,
- при лечении на дому до выздоровления,
- у бактерионосителей до полной санации.
Заключительная дезинфекция проводится после госпитализации больного или носителя из очага.
5. В очаге дифтерии необходимо проведение профилактических прививок. Профилактическим прививкам подлежат:
- не привитые против дифтерии лица;
- дети и подростки, у которых наступил срок очередной вакцинации или ревакцинации;
- взрослые лица, у которых согласно медицинской документации с момента последней прививки прошло 10 и более лет;
- лица, у которых при серологическом обследовании не обнаружены защитные титры дифтерийных антител (1:20 и более).
Специфическая профилактика дифтерии проводится в соответствии с национальным календарем профилактических прививок и инструкциями по применению медицинских иммунобиологических препаратов.
Противоэпидемические мероприятия в очаге брюшного тифа
Согласно Санитарно-эпидемиологическим правилам "Профилактика брюшного тифа и паратифов. СП 3.1.1.2137-06"

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
• Микробиологическая диагностика брюшного тифа и паратифов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: исходя из особенностей патогенеза брюшного тифа, на 1-й неделе заболевания, в период бактериемии, возбудителей выделяют из крови (получение гемокультуры), со 2-й недели заболевания — из испражнений (получение копрокультуры), мочи или желчи.
Бактериологическое исследование(схема 13.2.1).
Получение гемокультуры. В 1-й день из локтевой вены больного берут 5—10 мл крови и засевают в колбу с 50—100 мл селективной среды Раппопорт, содержащей желчный бульон (для подавления роста других бактерий), глюкозу, индикатор Андреде и поплавок для обнаружения газа. Указанные соотношения крови и среды необходимы для подавления бактерицидного действия белков крови. Посевы инкубируют при 37 "С в течение 18—20 ч. На 2-й день при росте сальмонелл наблюдается помутнение и изменение цвета среды. При росте паратифозных бактерий (биовары paratyphi А, Си schottmuelleri) наряду с указанными изменениями появляются пузырьки газа в поплавке. Для ускорения ответа из среды Раппопорт делают мазки и препараты "висячая" капля. При наличии чистой культуры грамотрицательных подвижных палочек и изменении цвета среды (или наличии газа) дают первый предварительный ответ. Затем культуру из среды Раппопорт пересевают в пробирку со средой Ресселя, полагая при этом, что из крови выделена чистая культура и можно сразу приступить к ее идентификации. Одновременно со среды Раппопорт делают посевы на среду Эндо для получения изолированных колоний с целью проверки чистоты выделенной культуры.
На 3-й день отмечают ферментацию глюкозы на среде Ресселя и ставят ориентировочную реакцию агглютинации на стекле. На основании полученных данных дают второй предварительный ответ. Для дальнейшего исследования отбирают несколько бесцветных колоний со среды Эндо и пересевают их в среду Ресселя или скошенный питательный агар (для контроля полученных результатов). Чистую культуру пересевают на среды "пестрого" ряда и серотипируют в реакции агглютинации на стекле со смесью групповых сывороток, а затем с

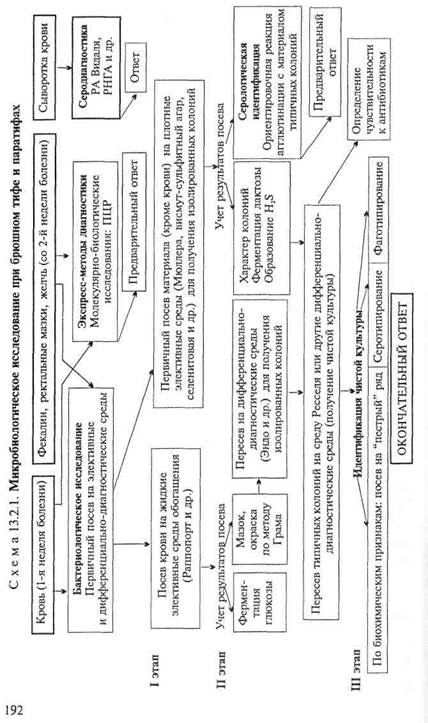 |
адсорбированными монорецепторными О- и Н-сальмонеллез-ными сыворотками. Окончательный диагноз устанавливают на основании биохимических (табл. 13.2.1) и антигенных свойств.
Таблица 13.2.1. Биохимические свойства сальмонелл — возбудителей брюшного тифа и паратифов
| Биовар S.enterica | Ферментация | Образование | |||||
| лактозы | глюкозы | мальтозы | сахарозы | ман-нита | H2S | NH3 | индола |
Paratyphi А - КГ КГ - КГ - -
Schottmuelleri — КГ КГ - КГ + +
Условные обозначения: К — образование кислоты; КГ — образование кислоты и газа; (+) — обнаружение признака; (—) — отсутствие признака.
Биохимические признаки (развернутый "пестрый" ряд) позволяют дифференцировать сальмонеллы от схожих сними энтеробактерий: Citrobacter, Hafnia (табл. 13.2.2).
Таблица 13.2.2. Дифференциация сальмонелл и других энтеробакте рий по биохимическим признакам
| Род | Лизин- декар- бокси- лаза | Ферментация углеводов | р- Галак-този-даза | ||
| дуль-цита | сорбита | ксилозы | рам-нозы | салицина | 4% лактозы |
Salmonella ± К(-) К К К - - -
Citrobacter - К(-) К К К К(±) К(±) К
Hafnia + - - К К К(+) - К
Условные обозначения: (+) — положительная реакция; (—) — отрицательная реакция; ± — вариабельная реакция; К — образование кислоты; К(—) — образование кислоты (редко); К(±) — образование кислоты (вариабельно).
Выделенную чистую культуру бактерий используют для определения чувствительности к антимикробным препаратам.
Фаготипирование. С помощью набора стандартных Vi-фагов определяют до 78 фаготипов S.enterica биовара typhi. При этом необходимым условием является наличие в культуре FZ-антигена. Культуры S.enterica биовара paratyphi В (schottmuelleri) дифференцируются на11 фаготипов и подтипов.
Получение копрокультуры. Испражнения засевают на одну из дифференциально-диагностических сред (Эндо или Левина) или элективные среды обогащения (Мюллера, селени-

товая или висмут-сульфит агар). Для посева петлю фекалий вносят в пробирку с изотоническим раствором хлорида натрия и готовят суспензию. После оседания крупных комочков суспензию петлей наносят на поверхность агаровой среды — на одну половину чашки. Материал тщательно растирают шпателем по одной, а затем по другой половине чашки для получения изолированных колоний. Посевы инкубируют при 37 °С в течение 18—20 ч. На 2-й день изучают характер колоний, выросших на чашках (рис. 13.2.1; на вклейке), пересевают 2—3 бесцветные колонии (со среды Эндо или Левина) или колонии черного цвета (висмут-сульфит агар) на среду Ресселя и в пробирки со скошенным питательным агаром. При отсутствии подозрительных колоний на чашках делают высевы из среды Мюллера или селенитовой среды на чашки со средой Эндо для получения изолированных колоний. Для ускорения ответа ставят ориентировочную реакцию агглютинации на стекле с материалом, взятым из бесцветной колонии. Далее поступают так же, как и при идентификации гемокультуры.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Влабораторной практике широко применяют развернутую реакцию агглютинации Видаля, основанную на обнаружении в сыворотке крови людей антител — агглютининов, которые появляются в конце 1-й — начале 2-й недели заболевания. Реакцию ставят одновременно с четырьмя антигенами: О- и Н-брюшнотифозными, А- и В-паратифозными диагностикумами. Брюшнотифозные монодиагностикумы применяют для установления стадии болезни, так как содержание О- и Н-антител в разные ее периоды неодинаково. О-антитела появляются на 1-й неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н-антитела появляются в разгар заболевания, накапливаются к концу заболевания и сохраняются у переболевших в течение длительного времени. У людей, вакцинированных против брюшного тифа и парати-фов, также наблюдается положительная реакция Видаля, причем в довольно высоком титре, поэтому "инфекционный Ви-даль" удается отличить от "прививочного" только по нарастанию титра агглютининов у больных в процессе заболевания. Реакцию Видаля ставят в четырех рядах пробирок по 7 пробирок в каждом ряду, из которых 5 опытных и 2 контрольные. Для контроля каждого диагностикума в пробирки вносят по 1 мл изотонического раствора хлорида натрия, в который добавляют 2 капли диагностикума. В контрольной пробирке с
1 мл сыворотки (без диагностикума) не должно быть хлопьев. При спонтанной агглютинации реакция не учитывается. Диагностический титр реакции Видаля равен 1:200. Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию непрямой И-гемаг-глютинации, с помощью которой в сыворотке крови людей определяют присутствие антител к К/-антигену. В качестве антигена используют эритроцитарный Р?-диагностикум, представляющий собой взвесь эритроцитов человека 1(0) группы, обработанных формалином и сенсибилизированных Fz'-антиге-ном S.enterica биовара typhi. Готовят разведения испытуемой сыворотки от 1:10 до 1:1280. При положительной реакции эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательной реакции, так же как и в контроле, эритроциты осаждаются на дно пробирки и имеют виддиска с ровными краями ("пуговки"). Диагностическое значение имеет титр пассивной Й-гемагглютинации, начиная с 1:40 и выше. Всех лиц, сыворотка крови у которых дает положительный результат в РНГА с эритроцитарным F/f-диагностикумом, рассматривают как подозрительных на носительство S.enterica биовара typhi и подвергают многократному бактериологическому обследованию.
• Микробиологическая диагностика сальмонеллезов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь.
МЕТОДЫ ДИАГНОСТИКИ: микробиологическая диагностика сальмонеллезов принципиально не отличается от диагностики брюшного тифа и паратифов. Серодиагностика не применяется по причине большого числа сероваров возбудителей.
• Микробиологическая диагностика кишечного иерсиниоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь, моча, спинномозговая жидкость.
МЕТОДЫДИАГНОСТИКИ:
Бактериологическое исследование.Посев материала на дифференциально-диагностические (среда Эндо, Мак-Конки, СБТС-агар с желчью и бромтимоловым синим) и селективные (CIN-arap с антибиотиками цефсулодином и новобиоцином) плотные среды или жидкие среды обогащения (буферно-казе-иново-дрожжевой бульон, 1 %, пептонная вода с рН 7,6—7,8). Посевы инкубируют при 25 "С в течение 24—48 ч. Идентификация чистой культуры осуществляется на основании морфологии, подвижности, тинкториальных свойств (грамотрица-

тельные палочки с закругленными концами и характерным биполярным окрашиванием, неспорообразующие, перитрихи), культуральных, биохимических признаков.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР.В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика.Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителей наиболее распространенных серотипов (03, 04, 05, 06, 08, 09) в РА. Положительной считается РА в титре не менее 1:160. Разработаны также ИФА-тесты.
• Микробиологическая диагностика кишечного дисбактериоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии. МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование.Имеет ориентировочное значение. При резко выраженном дисбактериозе в мазках преобладают микроорганизмы определенных видов (например, дрожжеподобные грибы, стафилококки и др.) на фоне существенного уменьшения грамотрицательной микрофлоры.
Бактериологическое исследование.Проводится количественное исследование состава микрофлоры кишечника. Для этого из исследуемого материала готовят разведения Ю -2 , 10 -4 , Ю -6 и т.д. Первичные посевы по 0,1 мл каждого разведения производят параллельно на несколько питательных сред (Эндо, кровяной агар, ЖСА, агар Сабуро и др.) и инкубируют при 37 °С. Подсчитывают число выросших колоний и определяют число КОЕ в 1 г материала. Проводят отсев 2—3 колоний каждого вида для выделения и идентификации чистых культур микроорганизмов.
Дляобнаружения анаэробных Bifidobacterium spp. делают мерные посевы материала в разведениях 10" 7 и выше в пробирки с 13—15 мл модифицированной среды Блаурокка, в состав которой входит печеночный бульон, пептон — 1 %, лактоза — 1 %, хлорид натрия — 0,5 %, цистин — 0,01 %, агар-агар — 0,75%, твин-80 — 0,1 %. При росте Bifidobacterium spp. через 24—48 ч происходит помутнение всей среды с образованием тяжей или отдельных колоний. Готовят мазки и окрашивают по методу Грама. Выделение чистых культур Bifidobacterium spp. является весьма трудоемким и практически необязательным. При необходимости идентификацию представителей рода осуществляют по биохимическим свойствам.
Для оценки результатов бактериологического исследования
сопоставляют полученные данные с количественным содержанием микроорганизмов в норме. Ориентировочные критерии нормальной микрофлоры толстой кишки представлены в табл. 13.2.3.
Таблица 13.2.3. Критерии нормы кишечной флоры
| Норма |
Патогенные микробы сем. Enterobacteriaceae О
Общее количество E.coli, млн/г 300—400
E.coli со слабовыраженными ферментативными
свойствами, % До 10
E.coli с гемолитическими свойствами, % Нет
Энтеробактерии (лактозоотрицательные и лактозополо
жительные): Hafnia, Aerobacter, Citrobacter, Klebsiella,
Serratia, % До 5
Кокковые формы, % До 25
Гемолитический стафилококк по отношению ко
всем кокковым формам, % Нет
Bifidobacterium spp. (рост при посеве разведения) 10 и выше
Бактерии рода Proteus Нет
Грибы рода Candida Нет
При кишечном дисбактериозе происходит значительное снижение облигатной анаэробной микрофлоры, и в первую очередь Bifidobacterium spp., а также увеличение аэробных видов, в частности E.coli, содержание которых может превышать 10 11 микробных клеток в 1 г испражнений. Увеличивается частота обнаружения штаммов E.coli со слабой ферментацией лактозы и имеющих гемолитические свойства (до 30—40 %), гемолитических и негемолитических стафилококков, бактерий рода Proteus, грибов рода Candida (до 15—16 %). У лиц с дис-бактериозами более часто обнаруживают лактозоотрицательные и лактозоположительные энтеробактерии, относящиеся к родам Hafnia, Aerobacter, Citrobacter. Для микроорганизмов, в норме отсутствующих в испражнениях или имеющихся в небольшом количестве, показателем дисбактериоза будет содержание их 10 5 —10 6 и выше КОЕ в 1 г материала (Proteus spp., Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Candida spp.). Для окончательного заключения о кишечном дисбактериозе важное значение имеет повторное его выявление в динамике обследования больного.
• Диагностические, профилактические и лечебные препараты
Не нашли то, что искали? Воспользуйтесь поиском:
Задание 1
Цель. Провести бактериологический и серологический методы диагностики дизентерии. Оценить их диагностическую ценность. Ознакомиться с ИБМП для лабораторной диагностики дизентерии.
Бактериологический метод диагностики: выделение и идентификация чистой культуры.
1-й этап. Посев нативного материала. Или взятого с помощью петли из прямой кишки. Материал засевают на среду Плокирева или Левина или висмут-сульфит агар и помещается в термостат при температуре 37°С и инкубируется в течение 24-48 часов, петлю заливаем средой накопления ( селенитовый или желчный бульоны).
2-й этап. Выделение чистой культуры. Через 24 часа инкубации в термостате с помощью петли отвить типичную для дизентерийных бактерий бесцветную колонию на скошенный МПА или среду Олькеницкого для выделения чистой культуры и поместить в термостат на сутки. Из сред накопления произвести высев на среды Плоскирева, Левина или висмут-сульфит агар.
3-й этап. Идентификация выделенной культуры: а) морфология; б) биохимические свойства; в) антигенная структура;
4-й этап: учесть чувствительность выделенной культуры к антибиотикам и бактериофагу.
Серологический метод диагностики.
Для серологического исследования при постановке РПГА берется: а) сыворотка больного; б) эритроцитарный диагностикум; в) физиологический раствор.
| Исследуемый материал | Среда для посева | Характеристика колоний по цвету | Идентификация цистой культуры | |
| Морфология | Биохимические свойства | агглютинации | Чувствительность к антибиотикам и бактериофагу | |
| лактоза | глюкоза | маннит | С сывороткой Флекснера | С сывороткой зонне и ньюкастл |
| Срок исследования | Разведение сыворотки больного | ||
| 1/100 | 1/200 | 1/400 | Контроль |
| 3-й день 6-й день |
Задание 3
Цель. Изучить специфические препараты для диагностики дизентерии.
| Название препарата | Состав | К какой группе диагностических препаратов относится | Практическое использование (метод диагностики) |
Бактериофаг дизентерийный поливалентный жидкий или в таблетках – стерильный фильтрат фаголизатов возбудителей бактериальной дизентерии: шигелл Флекснера 1,2,3,4,6- типов и шигелл Зонне
Интести-бактериофаг жидки – смесь стерильных фильтратов фаголизатов шигелл Флекснера 1,2,3,4,6-го серовариантов, шигелл Зоне; сальмонелл паратифа А, паратифа В, тифимуриум, инфантис, холерасуис, ораниенбург, энтеритидис; наиболее распространенных серовариантов кишечной палочки, протеус вульгарис и мирабилис, энтерококков, стафилококков, псевдомонас аеругиноза. Применяется для лечения кишечных инфекций.
Адсорбированные агглютинирующие сыворотки для идентификации шигелл. Получены из крови животных, иммунизированных определенными видами шигелл. Используются в бактериологическом методе для идентификации чистых культур.
Дизентерийный диагностикум. Состоит из взвеси убитых бактерий Флекснера и Зоне. Используется в серологическом методе.
Дизентерийный эритроцитарный диагностикум состоит из взвеси эритроцитов, нагруженных антигенами Флекснера, Зоне и др. используются для постановки РПГА в серологическом методе.
Лабораторное занятие №6
Цель. Изучить этиологию, эпидемиологию и патогенез брюшного тифа, паратифов и ПТИ. Овладеть основными методами лабораторной диагностики брюшного тифа, паратифов, и оценки результатов исследований. Научиться практически решать вопросы по специфической профилактике брюшного тифа.
По последней классификации отмечают два вида сальмонелл: 1)Salmonella bogori содержит 10 очень редких сероваров; 2)Salmonella choleraesuis включает 2500 сероваров. Диагностическим лабораториям рекомендовано внутри рода Salmonella использовать названия сероваров, например: Salmonella typhi или Salmonella typhimurium. Природный резервуар сальмонелл – человек, животные и птицы. Основной путь передачи – водный и пищевой. Сальмонеллы высокоустойчивы в окружающей среде: в питьевой воде – до 120 суток, в комнатной пыли – до 560 суток, в замороженном мясе – до 13 месяцев. Сальмонеллы имеют сложную антигеннюую структуру: в соответствии с содержанием тех или иных О-АГ сальмонеллы разделяют на серологические группы, обозначаемые арабскими цифрами. По Н-АГ микроорганизмы делят на серовары, Vi-АГ – фактор вирулентности. При идентификации сальмонелл принимают во внимание 3 антигена: О, Н и Vi. Этот принцип положен в основу диагностической антигенной схемы Кауфмана-Уайта. Типичную клиническую картину брюшного тифа и характерные патологоанатомические изменения вызывают как брюшнотифозные бактерии, так и бактерии паратифа А и В. Остальные сальмонеллы вызывают заболевания с синдромом гастроэнтероколита.
Для лабораторной диагностики сальмонеллезов используют оба принципа:
1) обнаружение возбудителя – метод бактериологический;
2) обнаружение специфических изменений – метод серологический;
Самостоятельная практическая работа
Цель. Провести бактериологический и серологический методы диагностики брюшного тифа, паратифов.
Задача. В инфекционную больницу поступила женщина на 6-й день болезни. для подтверждения диагноза был сделан посев крови, мочи, испражнений больной для выделения чистой культуры. Поставлена серологическая реакция с сывороткой больной. Учтите результаты исследований, оформите протокол.
Бактериологический метод диагностики
Выделение и идентификация чистой культуры.
1-й этап. Посев материала. Материал для исследования в зависимости от условий задачи может быть различным: кровь, испражнения, моча. Кровь больного берется на первой неделе болезни в количестве 5-10 мл стерильно из локтевой вены и засевается у постели больного во флаконы с 50-100 мл 10-20% желчного бульона. Испражнения и мочу засевают на среду Плоскирева, висмут-сульфит агар и залить средами обогащения: магниевую среду и селенитовый бульон.
2-й этап. Выделение чистой культуры. Через сутки делается посев петлей с желчного бульона на среды Плоскирева и висмут-сульфит агар для выделения чистой культуры. Из чашки со средой Плоскирева петлей откалывают типичную для сальмонеллезных палочек бесцветную колонию на трехсахарный (Олькеницкого, Клиглера) агар. Посевы помещают в термостат при температуре 37°С на сутки.
3-й этап идентификация чистой культуры:
а) морфологические свойства;
в) биохимические свойства;
г) антигенная структура;
Положительная реакция агглютинации с одной из О-сывороток позволит определить групповую принадлежность выделенной культуры сальмонелл по таблице Кауфмана, после чего с соответствующими данной группе Н-монорецепторными сыворотками определяется серовар культуры.
Исследование выделенной культуры заканчивается определением фаготипа микроорганизмов. С этой целью выделенную культуру сеют на питательную среду и наносят петлей на засеянную поверхность брюшнотифозные фаги различных типов. Лизис культуры вызывается определенным фагом, что соответствует фаготипу культуры.
Серологический метод диагностики брюшного тифа. РНГА.
Ставиться по стандартной схеме в плашках или пробирках.
Выделение чистой культуры и её идентификация
| Исследуемый материал | Среда для посева | Характеристика колоний по цвету | Идентификация чистой культуры | |
| Морфология | Подвижность | Биохимические свойства | Антигенные свойства | Вид культуры и фаготип |
| Лактоза | Глюкоза | Сероводород | О-сыворотки | Н-сыворотки |
| Диагностикум | Разведение сыворотки | |||
| 1/100 | 1/200 | 1/400 | 1/800 | К |
| Брюшнотифозный Паратифозный А S.typhimirium |
Цель. Провести исследования для диагностики брюшнотифозного бактерионосительства.
Задача. Больной перенес брюшной тиф. Перед выпиской из стационара он был обследован для выявления бактерионосительства: возбудитель обнаружен в испражнениях, из мочи и желчи микроорганизмы не выделены. Проведен серологический метод диагностики: поставлена реакция Vi-гемагглютинации. Учтите результат. Оформите протокол.
Для серологического метода использованы ингредиенты: сыворотка больного, эритроцитарный Vi-диагностикум, физиологический раствор.
| Диагностикум | Разведение сыворотки | ||
| 1/20 | 1/40 | 1/80 | К |
| Vi-эритроци тарный |
Цель. Изучить специфические препараты для диагностики сальмонеллезных инфекций.
| Название препарата | Состав | К какой группе диагностических препаратов относится | Практическое использование | Максимальное и минимальное разведение сывороток |
Вакцина брюшнотифозная спиртовая, обогащенная Vi-антигеном.
Вакцина брюшнотифозная Vi-полисахаридная.
Интести бактериофаг жидкий.
Люминисцирующаю брюшнотифозная сыворотка.
Адсорбированные агглютинирующие сыворотки.
Эритроцитарный сальмонеллезный диагностикум
Лабораторное занятие №6
Тема:Микробиологическая диагностика пищевых токсикоинфекций.
Цель. Изучить этиологию, эпидемиологию и патогенез пищевых токсикоинфекций (далее ПТИ). Овладеть основными методами лабораторной диагностики ПТИ и оценки результатов исследований.
Теоретическая справка. К пищевым отравлениям микробной природы относятся острые системные заболевания, возникающие в результате употребления пищевых продуктов, массивно обсемененных некоторыми микроорганизмами или зараженных микробными экзотоксинами. Это определение позволило подразделить все пищевые отравления, связанные с микроорганизмами, на пищевые токсикоинфекции и интоксикации. Первые вызывают преимущественно грамотрицательные бактерии, среди которых энтеробактерии занимают первое место. При этом название токсикоинфекции определяется поступлением в кровь бактериального эндотоксина (ЛПС), освобождающегося в большом количестве после массивного разрушения бактерий. Пищевые продукты, содержащие экзотоксины бактерий, вызывают пищевые интоксикации, а токсины грибов микотоксикозы.
Наиболее распространенными возбудителями пищевых токсикоинфекций являются сальмонеллы, реже E.coli, P.vulgaris, P.morganii, Bacillus cereus.
Патогенез и клиническая картина ПТИ определяются проникновением в желудочно-кишечный тракт большого количества соответствующих бактерий с зараженными пищевыми продуктами (мясо, рыба), подвергшимися недостаточной термической обработке. При этом сохранившие жизнеспособность бактериальные клетки быстро размножаются в благоприятных условиях. Одновременное проникновение в кишечник человека массивной дозы возбудителя, его последующее размножение и разрушение бактериальных клеток приводит к освобождению большого количества эндотоксина, оказывающего воздействие на интрамуральный нейрорецепторный аппарат тонкой кишки, периферические сосуды брюшной полости. Это сопровождается нейродистрофическими изменениями в стенке тонкой кишки и поражением клеток других органов. При ПТИ освобождение желудочно-кишечного тракта от возбудителей во многих случаях происходит достаточно быстро, иногда через несколько часов после начала заболевания. Бактериемия при этих заболеваниях как правило не наступает..
Лабораторная диагностика проводится бактериологическим методом, Материалом для исследования являются испражнения, рвотные массы, промывные воды желудка больных людей и остатки пищи и продуктов, из которых лона была приготовлена.
Пищевые интоксикации бактериальной природы возникают также при попадании с пищей в желудочно-кишечный тракт бактериальных токсинов, из которых наибольшую опасность представляют энтеротоксины Staphylococcus aureus, Clostridium perfringens и особенно ботулонейротоксин C. Botulinum. Для возникновения пищевой интоксикации не обязательно присутствие в продукте живых возбудителей.
Микробиологическая диагностика пищевых отравлений проводится методом выявления токсинов, а также выделения чистых культур возбудителя – продуцентов токсинов в остатках пищи и в материале, взятом от больного.
Бактериологическая диагностика токсикоинфекций, вызванных сальмонеллами, эшерихиями и протеем.
Материалом для исследования являются испражнения, рвотные массы, промывные воды желудка, остатки пищевых продуктов – возможные факторы передачи инфекции.
1этап Производится посев материала на дифференциально-диагностические среды (Эндо, Плоскирева, Левина, висмут-сульфит агар) для выделения чистой культуры сальмонелл или эшерихий, а также в конденсационную воду в пробирке со скошенным агаром.
На условно-патогенную микрофлоруфлору
3 этап Производят пересев на трехсахарный агар (Клиглера, Олькеницкого) и выделяют чистую культуру протея,
4 этап определяют биохимические и другие признаки и устанавливают вид: P. vulgaris, P. mirabilis.
Оценка роли условно-патогенных микроорганизмов в этиологии пищевых токсикоинфекций должна быть строго аргументирована:
а) бактериологическим, серологическим, эпидемиологическим и клиническим исключением сальмонеллезов, дизентерии, холеры;
б) выделением идентичных штаммов условно-патогенных бактерий из рвотных масс, промывных вод желудка, испражнений, продуктов;
в) нарастанием титров реакции агглютинации с аутоштаммами возбудителей в динамике заболевания.
Лабораторная диагностика пищевых интоксикаций бактериальной природы
1. Материалом для определения стафилококкового энтеротоксина являются рвотные массы, промывные воды желудка больных, остатки пищи (чаще кремы, сметана, мороженое, а также мясные продукты, в которых хорошо размножаются стафилококки).
С целью выделения чистой культуры стафилококка исследуемые материалы, которые могут содержать жизнеспособные бактерии, засевают в чашки с ЖСА.
Для эпидемиологического анализа массовых стафилококковых интоксикаций проводят фаготипирование выделенных культур с помощью набора стафилококковых фагов.
2. Материалом для выявления энтеротоксина клостридий С. perfringens являются мясные, рыбные консервы и другие продукты, из которых экстрагируют токсин изотоническим раствором хлорида натрия. Экстракт центрифугируют и надосадочную жидкость вводят внутрибрюшинно белым мышам или внутрикожном морским свинкам. Гибель животных в течение первых 3-4 дней появление некроза на месте внутрикожных инъекций свидетельствует о наличии токсина. Для его идентификации ставят реакцию нейтрализации с антитоксическими сыворотками С. perfringens.
Выделение чистой культуры С. perfringens и С. botulinum производят, используя методы выделения анаэробных бактерий.
3. Материалом для выявления ботулотоксина служат сыворотка крови, моча, испражнения, промывные воды желудка больного, остатки пищи или подозреваемые продукты (колбасы, мясные, рыбные, фруктовые, овощные консервы и др.). Для обнаружения ботулотоксина в сыворотке крови больного ставят реакцию нейтрализации таксина антитоскической сывороткой в биопробе на белых мышах. (с , моновалентными антитоксическими противоботулиническими сыворотками типов А, В, Е. F,C В качестве контроля берут нормальную сыворотку крови. При нейтрализации токсина гомологичной антитоксической сывороткой мыши остаются живыми.
| | | следующая лекция ==> | |
| Тема:Микробиологическая диагностика дизентерии | | | Механизм питания |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Читайте также:


