Бас и болезнь паркинсона
Нейроны и контроль над качеством митохондрий

Поврежденная и здоровая митохондрии. (Фото: National Institute on Aging)
Ученые из Медицинской школы Гарвардского университета связали этот путь, уже ассоциируемый с болезнью Паркинсона, с белками, мутирующими при боковом амиотрофическом склерозе – поражении моторных нейронов, известном также как болезнь Лу Герига. Результаты их исследования опубликованы в журнале Molecular Cell (Heo et al., The PINK1-PARKIN Mitochondrial Ubiquitylation Pathway Drives a Program of OPTN/NDP52 Recruitment and TBK1 Activation to Promote Mitophagy).
Белки, связанные с болезнью Паркинсона
Повреждение митохондрий является триггером активации двух белков,– PARKIN и PINK1, – маркирующих их поверхность цепочками убиквитина, молекулы, сигнализирующей клетке о необходимости избавиться от этих дефектных органелл. То, что эти белки являются виновниками развития семейной формы болезни Паркинсона с ранним началом, известно уже более десятилетия, но их роль в осуществлении контроля над качеством митохондрий выяснена лишь недавно. А как клетки распознают сигналы о необходимости утилизации и какие белки после распознавания принимают участие в этом процессе, ученые изучают и совсем недолго.
Первые ключевые идеи об этих нижележащих механизмах были представлены несколько лет назад, когда было открыто, что рецепторный белок аутофагии OPTN совместно с протеинкиназой TBK1 участвует в удалении из клеток посредством аутофагии патогенных бактерий. Интересно, что оба эти белка – OPTN и TBK1 – мутируют и при боковом амиотрофическом склерозе (БАС), но какой вклад они вносят в развитие этого нейродегенеративного заболевания, оставалось неясным.
Группа ученых во главе с Вэйдом Харпером (Wade Harper) механистически связала эти два набора белков и описала многоступенчатый путь контроля над качеством митохондрий. Стоящие у истока каскада реакций белки PARKIN и PINK1 функционируют в начале процесса утилизации митохондрий, связывая убиквитиновые цепочки с дефектными митохондриями, в то время как действующие позднее белки OPTN и TBK1 связываются с этими убиквитиновыми цепочками, делая поврежденные митохондрии мишенями механизма аутофагии.
Важно отметить, что связывание комплекса OPTN-TBK1 с убиквитиновыми цепочками стимулирует активацию TBK1 и последующую активацию убиквитин-связывающей функции OPTN, создавая самоусиливающийся механизм, имеющий важнейшее значение для конечной доставки митохондрий в аутофагосому.
Связь с БАС
С помощью самой современной количественной масс-спектрометрии, редактирования генома и визуализации американские ученые получили детальную картину того, как происходит взаимодействие этих двух молекулярных путей, и смогли составить представление о том, каким образом они могут связывать эти два нейродегенеративных заболевания.

Схема из статьи в Molecular Cell
Постдокторант его лаборатории Альбан Ордюро (Alban Ordureau), соавтор статьи, и раньше изучал биохимическое взаимодействие PARKIN и PINK1 в процессе специфической маркировки поврежденных митохондрий убиквитином.
Ведущий автор статьи Цзинь-Ми Хэо (Jin-Mi Heo), также постдокторант лаборатории Харпера, открыл, что белок TBK1 активируется при повреждении митохондрий связыванием убиквитиновой цепочки белком OPTN.
Стресс и чувствительность
При болезни Паркинсона повреждаются нейроны, вырабатывающие нейромедиатор дофамин, а при БАС нарушена функция моторных нейронов.
Одна из идей состоит в том, что разные типы нейронов проявляют к токсичным белкам или токсичным органеллам – таким как дефектные митохондрии – разную чувствительность. Моторные нейроны, например, гораздо длиннее, чем большинство нейронов головного мозга; поэтому они могут быть более чувствительны к накоплению определенных типов токсичных белков или органелл, чем другие типы нейронов, продолжает Харпер. Мутации при определенных заболеваниях могут отражать чувствительность к различным типам грузов аутофагосом. Результатом будет поражение моторных нейронов при БАС и дофаминергических нейронов при болезни Паркинсона.
Может оказаться, что это общий механизм, используемый клетками для того, чтобы избавляться от самого различного поврежденного материала в разных типах нейронов.
"Мой супруг — офицер, человек очень уравновешенный. Он всю жизнь работал, ни на что не жаловался, я никогда не слышала от него про усталость. Но приблизительно шесть лет назад он стал слишком тихим, мало разговаривал — просто сидел и смотрел в одну точку. Мне даже в голову не пришло, что он болен. Наоборот, ругала, что раньше времени постарел. Примерно тогда же к нам приехала двоюродная сестра из Англии — она работает в больнице — и сразу сказала, что у Рафика все очень плохо, нужно завтра же вести его к врачу. Так мы узнали о болезни Паркинсона", — вспоминает Седа из Еревана.
Что такое болезнь Паркинсона
Паркинсон — одна из самых страшных фамилий, что можно услышать в кабинете у невролога. Ее носил английский врач, который в 1817 году подробно описал шесть случаев загадочной болезни. День рождения Джеймса Паркинсона, 11 апреля, и выбран памятной датой Всемирной организацией здравоохранения. Из-за основных симптомов Паркинсон называл недуг дрожательным параличом: движения больных замедляются, становятся скованными, мышцы сильно напрягаются, а руки, ноги, подбородок или все тело бесконтрольно трясутся. Впрочем, в четверти случаев дрожания — самого известного признака болезни — нет.
Все это напоминает обыкновенную старость. Двигательные симптомы — собирательно их называют паркинсонизмом — встречаются у многих здоровых стариков. Но болезнь Паркинсона этим не исчерпывается. На поздних стадиях человек легко теряет равновесие, то и дело застывает на месте во время ходьбы, ему трудно говорить, глотать, спать, появляются тревога, депрессия и апатия, мучают запоры, падает кровяное давление, слабеет память, а под конец часто развивается слабоумие. Самое печальное — вылечить болезнь Паркинсона пока невозможно.
В начале XX века российский невропатолог Константин Третьяков выяснил, что при болезни Паркинсона гибнут клетки черной субстанции, области мозга, которая частично отвечает за движения, мотивацию, обучение. Что вызывает смерть нейронов, неизвестно. Возможно, дело в сбоях внутри клеток, но еще замечено, что внутри них скапливается вредный белок. Оба процесса наверняка как-то связаны, но ученые не знают, как именно.
В 2013 году физиолог Сьюзан Гринфилд из Оксфордского университета представила новую модель развития нейродегенеративных заболеваний, в том числе болезней Паркинсона и Альцгеймера. Гринфилд предположила, что при повреждении мозга, например, от сильного удара выделяется особое вещество. У маленьких детей из-за него растут новые клетки, а на взрослых оно, судя всему, действует противоположным образом, дальше повреждая клетки. После этого следует еще больший выброс вещества, и цепная реакция постепенно разрушает мозг. По злой иронии взрослые впадают в младенчество из-за фермента, необходимого младенцам.

Впрочем, догадка Гринфилд объясняет не все. Болезнь Паркинсона связана с наследственностью: близкий родственник с таким же диагнозом или тремором другой природы — главный фактор риска. На втором месте — запоры: иногда их вызывают изменения в мозге, когда еще не появились двигательные симптомы. Также риск растет, если человек никогда не курил, живет за городом, пьет колодезную воду, но при этом сталкивался с пестицидами, а снижается — у любителей кофе, алкоголя и гипертоников. В чем тут секрет, непонятно, как непонятно, почему болезнь Паркинсона обычно начинается в старости: если на пятом десятке лет болеет примерно один из 2500 человек, то на девятом — уже один из 53.
Новую зацепку дала свежая работа ученых из Университета Томаса Джефферсона: возможно, болезнь Паркинсона связана с иммунной системой. Исследователи взяли мышей с мутантным геном, который часто встречается у больных, и ввели им безвредные остатки бактерий. Из-за этого у зверьков началось воспаление, затронувшее и мозг, причем иммунных клеток было в 3–5 раз больше, чем у обычных мышей. Из-за этого в мозге мутантов начались процессы, губительные для нейронов черной субстанции. Как и в модели Гринфилд, процессы эти оказались циклическими: воспаление в мозге может остаться даже после того, как тело справилось с инфекцией. Впрочем, сами авторы исследования признаются, что в этом механизме еще многое не ясно.
Каково живется больным и их близким
В России болезнь Паркинсона есть примерно у 210–220 тыс. человек. Но эти данные рассчитаны по косвенным показателям, а единого реестра не существует. Анастасия Обухова, кандидат медицинских наук с кафедры нервных болезней Сеченовского университета и специалист по болезни Паркинсона, считает эту статистику заниженной. "Многие больные впервые приходят уже на развернутых стадиях болезни. При расспросе удается выяснить, что признаки появились еще несколько лет назад. У большинства наших людей действует принцип "Пока гром не грянет, мужик не перекрестится": они читают в интернете, спрашивают соседок, а к врачу не обращаются. Это в Москве, а в маленьких городках и поселках к врачу идут только если совсем помирают", — объясняет Обухова.
Вдобавок попасть на прием не так-то просто. Для этого сначала нужно сходить к терапевту, чтобы тот направил к неврологу. Но и тогда нет гарантии, что человеку поставят правильный диагноз и назначат нужное лечение. "Врач в поликлинике не может разбираться во всем, поэтому должен послать больного к узкому специалисту. А окружных паркинсонологов, по-моему, убрали. Во всяком случае, пациенты на это жаловались", — рассказывает Обухова. Правда, если больной все-таки попал к нужному доктору, лечить его будут на мировом уровне. Оттого в Россию с болезнью Паркинсона прилетают даже из других стран.
Одиссею по кабинетам приходится часто повторять, потому что болезнь прогрессирует — терапию нужно подстраивать. Лечение обходится дорого: месячный запас некоторых лекарств стоит по 3–5 тыс. рублей, а на поздних стадиях назначают сразу несколько препаратов. "В районных поликлиниках лекарства иногда дают бесплатно, но только дешевые дженерики. Комментировать их качество не буду. Иногда нужных лекарств нет. Тогда их заменяют чем-то другим. Пациентам от этого плохо", — объясняет Обухова.
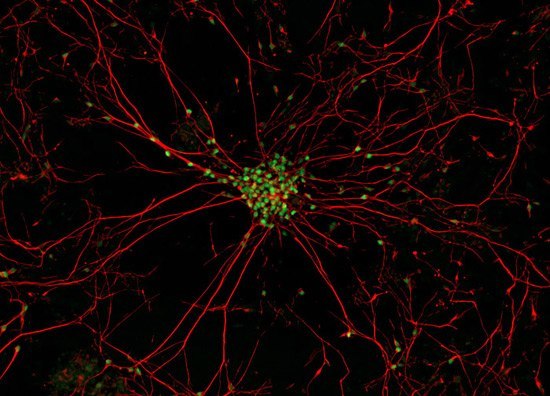
Настоящее фото мотонейрона (двигательного нейрона в передних рогах спинного мозга) - закупорка межсинаптических щелей (зелёные точки) - блокада передачи импульсов через медиаторы (вещества для передачи импульсов) в синапсы (места соединения) отростков нервных клеток.
В центре - тело мотонейрона.
Красные линии -длинные отростки мотонейрона - аксоны и короткие -дендриты.
Причина появления блокады передачи импульсов в межсинаптических щелях учёными мира не найдена. Предположительно - мутация гена,кодирующего фермент передачи этих импульсов через нейромедиаторы - супероксиддисмутазы. (СОД).
Предрасположенность к мутациям гена может иметь наследственный характер по аутосомно-рецессивному типу.
Эндемические (массовые вспышки) случаи этого заболевания зафиксированы у групп военных, живущих в островах на тихом океане. Чаще болеют мужчины от 40 до 60 лет.Следовательно не исключается инфекционная причина развития заболевания.
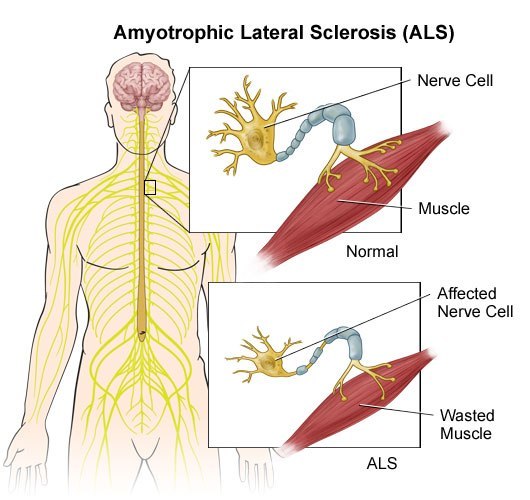
Боковой амиотрофический склероз. (БАС)..
Показано истончение нервных волокон в случае БАС и нарушение иннервации (передачи нервных импульсов) к мышцам. Как следствие - уменьшение работы мышцы и её последующая атрофия. (уменьшение размеров, обратное развитие.)
Блокада передачи нервных импульсов к мышцам (как к поперечно-полосатым которыми мы управляем сами своей волей так и к к гладким, работающим, независимо от нашего сознания, усилий и воли) пищеварительной и дыхательной системы ведёт к смерти из-за невозможности совершать эти жизненно важные моменты работы мускулатуры.
Две статьи из медицинских источников:
1) Теория аксостаза бокового амиотрофического склероза. Аксональная теория бокового амиотрофического склероза
Теория аксостаза основана на анализе патологических процессов, происходящих в аксональном транспорте мотонейронов [Chou S., 1992]. Наибольшими нейронами организма являются двигательные мотонейроны передних рогов спинного мозга и пирамвды Беца. Они должны поддерживать интеграцию дендритов, часто протяженностью более 1 см, и аксон, достигающий 100 см. В аксоне имеются непрерывные потоки, через которые клеточное тело направляет структурные и функциональные белки на периферию и получает обратные сигналы. Ортоградный транспорт бывает 2 видов: а) быстрый — 400 мм в день, идущий в обоих направлениях и транспортирующий связанные с мембраной белки и гликопротеиды, б) медленный — несколько миллиметров в день, транспортирующий сети микрофиламентов, микротрубочек, нейрофиламентов, как компонент "а" (0,1—2 мм в день), а также большой комплекс растворимых белков, как компонент "б" (2—4 мм в день). Ретроградный аксональный транспорт несет эндогенные (аминокислоты, фактор роста нервов) и экзогенные (токсин столбняка, вирус полиомиелита, простого герпеса, бешенства, лектин пероксидазы хрена и др.) субстанции от терминальных аксонов к клеточному телу со скоростью свыше 75 мм в день. Морфологические исследования аксонального транспорта в биоптатах двигательных веточек периферических нервов больных боковым амиотрофическим склерозом выявили уменьшение скорости ретроградного аксонального транспорта и, следовательно, связи терминального аксона с перикарионом [Bieuer A. et al., 1987]. В межреберных нервах больных АБС еще до развития признаков нейрональной дегенерации появляются изменения белков микротрубочек [Binet S. et al., 1988].
Улыраструктурные исследования проксимального аксона и аксонального бугорка мотонейронов переднего рога спинного мозга больных, умерших от бокового амиотрофического склероза [Sasaki S. et al., 1996], показали нарушение быстрого аксонального транспорта. Гладкий эндо-плазматический ретикулум теряет структуру: происходит скопление митохондрий, лизосом, Леви-подобных телец, эозино-фильных и гиалиновых включений, липофусциновых гранул, особенно в аксональном бугорке. Присутствие этих необычных структур является отражением дисфункции аксонального транспорта. Применительно к возможной этиологии АБС еще ранее выдвинута концепция "аксостаза" [Chou S., 1992]. Ней-ротоксические факторы путем ретроградного транспорта избирательно поражают нейрон, создавая феномен "суицидцального транспорта". Ухудшение медленного транспорта в аксоне сопровождается скоплением нейрофиламентов, набуханием проксимального аксона и последующей дистальнои аксональной атрофией, а также вторичной демиелинизацией, характерной для центральной дистальнои аксонопатии или "ретроградного умирания" — "dying back". Определенную значимость в развитии ранних морфологических изменений мотонейронов при АБС имеет теория аутоиммунитета [Smith R. et al., 1996], основанная на появлении антител к зарядам входа кальциевых каналов. Пассивный перенос фракций, содержащих иммуноглобулин, мышам вызывает изменения нервно-мышечных соединений, сходные с таковыми при спорадическом АБС. У животных эти изменения отражают расстройства внутриклеточного Са2+ гомеостаза, и раннее повреждение пластинчатого комплекса в мотонейронах в форме набухания и фрагментации. Иммуноглобулины от больных спорадическим боковым амиотрофическим склерозом вызывают зависимый от Са2+ апоптоз клеток вследствие оксидативных повреждений. Апоптоз, обусловленный иммуноглобулином от указанных больных, регулируется присутствием связанных белков, которые могут модулировать избирательную ранимость нейронов при спорадическом АБС.
2) Боковой амиотрофический склероз
Несмотря на более чем 100-летнее изучение, боковой амиотрофический склероз (БАС) остается фатальным заболеванием центральной нервной системы. Заболевание характеризуется неуклонно прогрессирующим течением с избирательным поражением верхнего и нижнего мотонейронов, что приводит к развитию амиотрофий, параличей и спастичности. До настоящего времени вопросы этиологии и патогенеза остаются невыясненными, в связи с чем не разработаны специфические методы диагностики и лечения этого заболевания. Рядом авторов отмечено повышение частоты встречаемости заболевания среди лиц молодого возраста (до 40 лет).
МКБ-10 G12.2 Болезнь двигательного неврона
ЭПИДЕМИОЛОГИЯ
Боковой амиотрофический склероз дебютирует в возрасте 40 – 60 лет. Средний возраст начала заболевания 56 лет. БАС - болезнь взрослых, и не наблюдается у лиц моложе 16 лет. Несколько чаще заболевают мужчины (отношение мужчины-женщины 1,6-3.0: 1).
БАС является спорадическим заболеванием и встречается с частотой 1,5 – 5 случая на 100 000 населения.
В 90% случаев БАС носит спорадический, а в 10% - семейный или наследственный характер как с аутосомно-доминантным (преимущественно), так и с аутосомно-рецессивным типами наследования. Клинические и патоморфологические характеристики семейного и спорадического БАС практически идентичны.
В настоящее время возраст является основным фактором риска при БАС, что подтверждается нарастанием заболеваемости после 55 лет, и в этой возрастной группе уже не наблюдается различий между мужчинами и женщинами. Несмотря на достоверную связь БАС с возрастом, старение является только одним из предрасполагающих факторов развития патологического процесса. Вариабельность заболевания как в различных возрастных группах, так и среди лиц одного возраста предполагает существование определённых факторов риска: дефицит, или наоборот, наличие определённых нейропротективных факторов, к которым в настоящее время относят: нейростероиды или половые гормоны; нейротрофические факторы; антиоксиданты.
Некоторые исследователи отмечают особо благоприятное течение заболевания у молодых женщин, что подтверждает несомненную роль половых гормонов, в особенности эстрадиола и прогестина, в патогенезе бокового амиотрофического склероза. Подтверждением этому являются: большая частота встречаемости БАС у мужчин до 55 лет (при этом у них отмечается более раннее начало и быстрое прогрессирование заболевания по сравнению с женщинами); с наступлением менопаузы женщины болеют также часто, как и мужчины; единичные случаи заболевания боковым амиотрофическим склерозом во время беременности. К настоящему времени существуют единичные работы по изучению гормонального статуса больных с боковым амиотрофическим склерозом, и ни одной, посвящённой определению концентраций гормонов у молодых пациентов.
Этиология заболевания не ясна. Обсуждается роль вирусов, иммунологических и метаболических нарушений.
В развитии семейной формы БАС показана роль мутации в гене супероксиддисмутазы-1 (Cu/Zn-супероксиддисмутазу, SOD1), 21q22-1 хромосома, выявлен также БАС, связанный с 2q33-q35 хромосомой.
Синдромы, клинически не отличимые от классического БАС, могут возникать в результате:
•опухоли большого затылочного отверстия
•спондилез шейного отдела позвоночника
•артериовенозная аномалия спинного мозга
•бактериальные - столбняк, болезнь Лайма
•вирусные - полиомиелит, опоясывающий лишай
Интоксикации, физические агенты:
•токсины - свинец, алюминий, другие металлы.
Заболевание наследуется по Х-сцепленному рецессивному типу, болеют только мужчины.
Морфологические изменения у больных с Х-сцепленной дистонией-паркинсонизмом включают, главным образом, гибель нейронов и мозаичный астроцитарный глиоз в области хвостатого ядра и скорлупы; иногда дегенеративный процесс носит более распространенный характер.
Заболевание начинается обычно на 2—4-ом десятилетии жизни. У больных развиваются фокальные дистонические гиперкинезы лица, оромандибулярной мускулатуры, шеи, туловища, конечностей. На протяжении нескольких лет возникает генерализованная форма дистонии. По мере прогрессирования болезни постепенно присоединяется синдром паркинсонизма, не чувствительный к препаратам леводопы. Реже паркинсонизм может быть первым или единственным проявлением заболевания. Другие неврологические симптомы не характерны.
Течение медленно прогрессирующее. Положительный эффект на выраженность дистонии и паркинсонизма могут оказать холинолитики, баклофен, клоназепам.
Заболевание является спорадическим. В этиологии данного синдрома предполагается определенная роль хронической алюминиевой интоксикации, связанной с региональными особенностями почвы и питьевой воды, богатой алюминием и относительно бедной кальциевыми солями, что характерно для вышеуказанных территорий. Обсуждается также нейротоксическое действие семян сагового растения Cycas circinalis, использовавшихся туземцами для приготовления муки. Отдельные описания семейного накопления случаев комплекса БАС-паркинсонизм-деменция могут быть обусловлены не столько наследственными факторами, сколько одинаковыми условиями жизни.

Однако убедительных данных в пользу токсической природы данного заболевания до настоящего времени не получено, и механизмы его развития (включая его взаимосвязь с различными формами БАС, деменции и спастического парапареза) нуждаются в дальнейшем исследовании.
В последние годы высказывается прионная гипотеза происхождения синдрома БАС-паркинсонизм-деменция, предполагающая, что данное заболевание может быть своеобразным клиническим вариантом спонгиоформных энцефалопатии, в первую очередь — болезни Крейтцфельдта—Якоба.
Морфологической основой синдрома БАС-паркинсонизм-деменция является мультисистемное поражение ЦНС, при этом дегенеративные изменения затрагивают в первую очередь ядра передних рогов спинного мозга и черепных нервов, черную субстанцию, моторную кору, пирамидные пути. Характерно наличие нейрофибриллярных клубочков в дегенерирующих нейронах.
Психические изменения характеризуются эмоциональной индифферентностью, замедленностью, персеверациями, снижением спонтанной речевой продукции, моторной афазии. Течение заболевания неуклонно прогрессирующее. На поздней стадии развивается глубокая деменция с распадом личности. Смерть наступает от дыхательных нарушений или инфекционных осложнений через несколько лет от момента появления первых симптомов.
Синдром паркинсонизма может наблюдаться при ряде наследственных (преимущественно аутосомно-рецессивных) метаболических заболеваний, таких как гепатолентикулярная дегенерация, GM1 и СМ2-ганглиозидозы, нейрональные цероид-липофусцинозы, наследственный гемохроматоз, болезнь Ниманна—Пика, церебро-тендинальный ксантоматоз, нейроакантоцитоз, митохондриальные энцефаломиопатии и др.
Болезнь Паркинсона — одно из самых грозных и загадочных заболеваний нервной системы. У современной медицины до сих пор нет ответа на вопрос, почему развивается болезнь Паркинсона и можно ли разработать эффективную систему профилактики. Все, что касается причин паркинсонизма, для ученых пока является загадкой, однако течение болезни изучено хорошо и в настоящее время ведется активная работа по поиску лекарств, а также средств, способных продлить больным жизнь и улучшить ее качество.
Болезнь Паркинсона: что означает диагноз
Речь идет о заболевании нервной системы, при котором постепенно разрушаются нейроны, вырабатывающие один из важнейших нейромедиаторов — дофамин. Чаще всего болезнь Паркинсона поражает людей в возрасте — в 55–65 лет. Однако известны случаи, когда болезнь диагностировалась у молодых людей в возрасте 30–40 лет. Существует и так называемая ювенильная форма, при которой заболевание поражает подростков в возрасте до 20 лет.
Стоит сказать, что мужчины страдают от болезни Паркинсона чаще, чем женщины, хотя объективных причин этого факта наука еще не выявила.
По статистике сегодня во всем мире болезнью Паркинсона страдает около 4 миллионов человек.
Как уже было сказано, причины болезни Паркинсона неясны. Все, что есть у науки, — это догадки и теории. К причинам развития этого заболевания относят в первую очередь генетику. Если у вас в семье были случаи паркинсонизма, особенно среди близких родственников, то ваши шансы заболеть несколько выше. Примерно у 15% всех больных есть родня, которая также страдала болезнью Паркинсона.
Играет свою роль и экологическая обстановка — известно, что некоторые гербициды, пестициды и соли тяжелых металлов могут усугубить симптомы болезни Паркинсона или спровоцировать ее развитие.
Болезнь Паркинсона — второе по распространенности нейродегенеративное заболевание. Первое место занимает болезнь Альцгеймера.
В 80% случаев болезнь Паркинсона развивается без каких-либо предпосылок, но в оставшихся 20% паркинсонизм является осложнением других заболеваний, таких как энцефалит, опухоли мозга, инсульт, черепно-мозговые травмы и некоторые другие. Иногда к паркинсонизму приводит отравление некоторыми токсичными веществами (угарным газом, этанолом), а также прием наркотических веществ и некоторых медикаментов, в частности нейролептиков.
Одним из первых признаков болезни Паркинсона является тремор одной руки в состоянии покоя. По мере развития заболевания дрожать начинают обе руки и голова. Если человек взволнован или обеспокоен, тремор усиливается, но при сознательных действиях, например при завязывании шнурков или работе с клавиатурой компьютера, он уменьшается. Иногда, на поздних стадиях болезни, к тремору рук и головы добавляется дрожание век или нижней челюсти и языка.
Еще один симптом болезни Паркинсона — мышечная ригидность, или повышение тонуса мышц. Постоянное напряжение побуждает человека принимать определенную позу — руки сгибаются в локтях, появляется сутулость, голова наклонена вперед, ноги слегка согнуты.
На поздних стадиях болезни развивается так называемая постуральная неустойчивость. Человеку трудно начать двигаться, а потом очень трудно остановиться. Больной постепенно теряет контроль над своим телом, ему становится сложно удерживать равновесие.
Двигательные нарушения — не единственный признак болезни Паркинсона. Параллельно, а порой и до проявления тремора, наблюдаются нарушения в работе вегетативной нервной системы. Кожа становится жирной, наблюдается обильное слюноотделение и потливость, которая никак не зависит от окружающей температуры и физических усилий. Обоняние может снизиться до полного исчезновения. Больные жалуются на запоры и проблемы с мочеиспусканием.
Болезнь Паркинсона редко затрагивает интеллектуальную сферу — большинство больных на ранних и средних стадиях развития заболевания сохраняют остроту ума. Однако болезнь Паркинсона часто сопровождается замедлением всех мыслительных процессов, ухудшением памяти и проблемой с формулированием мыслей, равнодушием к миру и к себе, пониженным настроением и депрессией.
Обычно для постановки диагноза достаточно визуального осмотра, сбора анамнеза и проверки симптомов. При подозрении на болезнь Паркинсона используют такие методы обследования, как ультразвуковое исследование черной субстанции, КТ или МРТ головного мозга.
На сегодняшний день врачи выделяют три формы болезни Паркинсона, которые различаются проявлением той или иной симптоматики:
- акинетико-ригидная. При этой форме наиболее ярко проявляется повышение тонуса мышц, движения больного замедляются, возможна полная обездвиженность;
- дрожательная. Эта форма проявляется дрожью рук, языка, нижней челюсти;
- смешанная. Обычно эта форма проявляется дрожью рук, но позднее к ней присоединяется и скованность движений.
Существует 5 стадий болезни Паркинсона. Эта классификация была разработана в 1960 годах и используется до сих пор:
0 стадия — отсутствие двигательных нарушений;
I стадия — двигательные нарушения с одной стороны тела;
II стадия — двусторонние двигательные нарушения, при которых пациент ходит без ограничений, поддерживает равновесие;
III стадия — появляется умеренная постуральная неустойчивость, но пациент еще не нуждается в посторонней помощи;
IV стадия — существенные нарушения в двигательной активности, больной не может совершать сложных движений, но не нуждается в поддержке для того, чтобы стоять и ходить;
V стадия — больной не может передвигаться без посторонней помощи.
Несмотря на то, что болезнь Паркинсона нельзя полностью вылечить, можно свести к минимуму проявления ее симптомов. Это поможет облегчить жизнь пациента, а возможно, и продлить ее. Как и при любых заболеваниях, поддерживающую терапию лучше начинать на самых ранних стадиях. К ней относится не только регулярный прием лекарств, но и профессиональный уход, предоставить который могут современные гериатрические центры.
Никто не хочет рисковать здоровьем и комфортом близкого человека. Именно поэтому при выборе гериатрического центра стоит отдавать предпочтение проверенным организациям, которые существуют на рынке не первый год и имеют хорошие рекомендации. К таким учреждениям, например, относятся гериатрические центры Senior Group. Подробнее об их работе нам рассказал заместитель генерального директора по медицинской части Senior Group Мария Литвинова:
«Наша организация уже 11 лет работает с пожилыми людьми, страдающими болезнью Паркинсона, а также болезнью Альцгеймера и деменцией. Консалтингом в Senior Group занимаются ведущие израильские специалисты в сфере гериатрии. Для каждого пациента составляется индивидуальная программа ухода в зависимости от состояния его здоровья. Помимо лекарственной терапии и комфортных номеров со специальной ортопедической мебелью, в Senior Group оборудован специальный спортзал с современными тренажерами, где пациенты под чутким контролем наших сотрудников могут заниматься лечебной физкультурой. Меню для постояльцев также составляется индивидуально — в зависимости от предпочтений и медицинских показаний.
В штате Senior Group трудится междисциплинарная команда врачей: реабилитологи, гериатры, психиатры, нейропсихологи и другие специалисты. Не менее важно для нас и эмоциональное состояние пациентов, поэтому сотрудники центра всеми силами поддерживают в учреждении непринужденную атмосферу, в которой постояльцы могут свободно общаться друг с другом и своими родными.
P. S. На сайте Senior Group есть рекомендации по уходу за больными, страдающими болезнью Паркинсона.
Лицензия на осуществление медицинской деятельности № ЛО-50-01-009757 выдана в соответствии с Приказом Министерства здравоохранения Московской области от 5 июня 2018 года № 818.
Читайте также:


