Белки вируса клещевого энцефалита



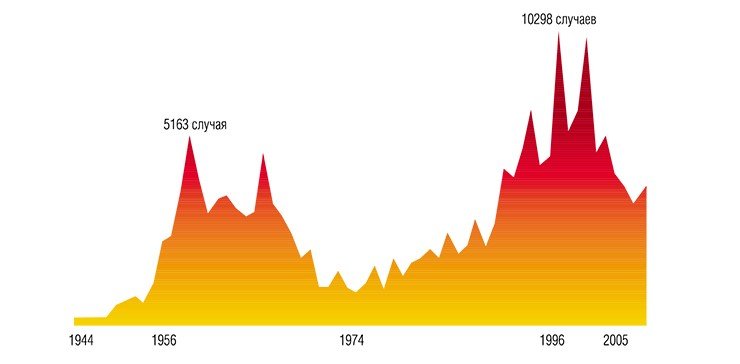
По данным ВОЗ, в мире ежегодно в мире фиксируется 10 - 12 тысяч случаев заражения клещевым энцефалитом. В России эта цифра ниже – около 2 - 3 тысяч человек. Вроде не много, однако, болезнь эта очень опасная, смертность от нее составляет 20 - 25%, а у 10 - 20% заболевших на всю оставшуюся жизнь остаются серьезные неврологические проблемы.
Заразиться клещевым энцефалитом может абсолютно любой человек, независимо от пола и возраста. Болезнь передают человеку иксодовые клещи – они живут в траве, на лугах и лесах. Считается, что из 100 клещей 6 – носители заразы. Однако в России есть регионы, где их особенно много.
В Центральном округе:
- Ивановская область;
- Костромская область;
- Московская область (Дмитровский и Талдомский районы);
- Тверская область;
- Ярославская область.
В Северо-Западном округе:
- Архангельская область;
- Вологодская область;
- Калининградская область;
- Карелия;
- Коми;
- Ленинградская область;
- Новгородская область;
- Псковская область;
- Санкт-Петербург.
В Южном округе:
- Крым.
В Приволжском округе:
- Кировская область;
- Нижегородская область;
- Оренбургская область;
- Пермский край;
- Башкортостан;
- Марий-Эл;
- Татарстан;
- Самарская область;
- Удмуртия;
- Ульяновская область.
В Уральском округе:
- Курганская область;
- Свердловская область;
- Тюменская область;
- Ханты-Мансийский АО;
- Челябинская область.
В Сибирском округе:
- Все регионы.
В Дальневосточном округе:
- Амурская область;
- Еврейская АО;
- Приморский край;
- Сахалинская область;
- Хабаровский край.
Симптомы клещевого энцефалита
После того, как человека укусил клещ, вирус попадает в ткани и там начинает активно размножаться. Затем он переходит в кровь и лимфу. А после проникает в мозг.
Первые признаки болезни появляются не сразу – инкубационный период вируса обычно длится 10 - 14 дней. Но затем болезнь развивается стремительно. Ее симптомы таковы:
- резко повышается температура – до 38 - 39 °С;
- озноб;
- сильные головные боли;
- начинаются тошнота и рвота;
- болят мышцы – в районе шеи, плеч, груди и поясницы, в руках и ногах;
- гиперемия на лице.
Затем добавляются признаки поражения мозга:
- наступает паралич рук и ног;
- появляется косоглазие;
- начинаются судороги;
- больной теряет сознание.
Впрочем, не всегда инкубационный период длится около двух недель, бывают другие варианты развития клещевого энцефалита:
Молниеносное развитие. В данном случае первые симптомы проявляются уже через сутки после того, как укусил клещ. Это очень опасный вариант, если вовремя не обратиться за медицинской помощью, наступает паралич ЦНС, кома и смерть.
Затяжное развитие. При таком варианте инкубация вируса может длиться месяц и даже больше.
Аннотация научной статьи по биологическим наукам, автор научной работы — Хаснатинов Максим Анатольевич, Хавликова С., Таплин Э., Казимирова М., Гунавардане Н.
Похожие темы научных работ по биологическим наукам , автор научной работы — Хаснатинов Максим Анатольевич, Хавликова С., Таплин Э., Казимирова М., Гунавардане Н.
THE ROLE OF THE STRUCTURAL PROTEINS IN THE NON-VIRAEMIC TRANSMISSION OF TICK-BORNE ENCEPHALITIS VIRUS
М.А. Хаснатинов 2, С. Хавликова 5, Э. Таплин 3, М. Казимирова 4, Н. Гунавардане М. Словак 4, Б. Клемпа 5, И.М. Джоунс М. Лабуда 5, Э.А. Гоулд 6, Т.С. Грицун 1
роль Структурных белков вируса клещевого энцефалита в осуществлении невиремической трансмиссии вируса между
1 Школа биологических наук, Редингский Университет (Рединг, Великобритания) 2 Научный центр проблем здоровья семьи и репродукции человека (Иркутск) 3 Школа естественных наук, Уорикский университет (Ковентри, Великобритания)
4 Институт Зоологии (Братислава, Словакия) 5 Институт вирусологии (Братислава, Словакия) 6 Кафедра вирусологии политехнического университета (Марсель, Франция)
Ключевые слова: вирус клещевого энцефалита, трансмиссия, рекомбинантный вирус
THE role of THE structural pRoTEiNs iN THE NoN-viRAEMiC TRANsMissioN
of TiCK-BoRNE encephalitis viRus
M.A. Khasnatinov 2, Sabina Havlikova 5, Andrew Tuplin 3, Maria Kazimirova 4, Niluka Goonavardane Mirco Slovak 4, Boris Klempa 5, Ian M. Jones ', Milan Labuda 5, Ernest A. Gould 6, Tamara S. Gritsun 1
1 School of Biological Sciences, University of Reading, UK 2 Scientific Center of Family Health and Human Reproduction Problems SB RAMS, Irkutsk
3 School of Life Sciences, University of Warwick, Coventry, UK Institute of Zoology, Bratislava, Slovakia 5 Institute of Virology, Bratislava, Slovakia 6 Unit des Virus Emergents, Marseille, France
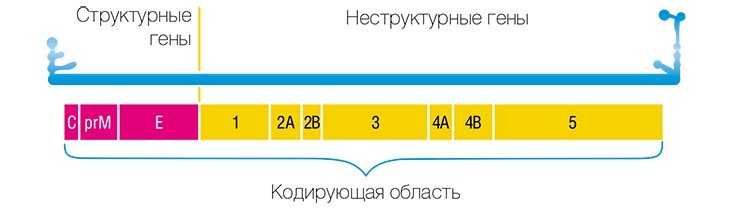
Клещевой энцефалит (КЭ) — это инфекционное заболевание, распространенное в лесной и лесостепной зоне Северной Евразии. Возбудитель КЭ — вирус, который передается человеку при укусе иксодовых клещей. Ежегодно в мире происходит порядка 10000 новых случаев заболеваний КЭ [5]. ВКЭ относится к семейству Flaviviridae род Flavivirus и в настоящее время выделяют 3 субтипа вируса — Дальневосточный, Сибирский
и Западноевропейский. Основным переносчиком первых двух субтипов является таежный клещ Ixodes persulcatus, который распространен в лесной и лесостепной зоне Азии и Восточной Европы, вплоть до Прибалтики. Основной переносчик вирусов Европейского субтипа — клещ Ixodes ricinus, обитающий в лесах Западной и Восточной Европы до Урала [6]. Геном вируса состоит из одной одноцепочечной молекулы РНК длиной
-11000 нуклеотидных оснований (н.о.). Одна открытая рамка считывания кодирует полипротеин, который расщепляется клеточными сигналазами и вирусной протеазой NS3 на 3 структурных и 7 неструктурных белков. На поверхности вириона расположены 2 структурных белка — мембранный (М) и оболочечный (Е), которые вместе с липидной мембраной образуют оболочку вириона [9]. В природе ВКЭ существует в процессе непрерывной передачи (трансмиссии) от зараженных клещей к незараженным. Существует 3 основных вида трансмиссии: невиремическая, при которой вирус передается незараженным клещам во время совместного питания в непосредственной близости с зараженным клещом [7], виремическая, при которой вирус передается клещу с кровью больного животного [1]и трансовариальная, при которой вирус передается от зараженной самки потомству [2]
Недавно было обнаружено, что эффективность невиремической трансмиссии ВКЭ Сибирского субтипа между клещами I. ricinus чрезвычайно низкая — при совместном питании с зараженными самками заражались только от 0 до 5 % нимф, в то время как для ВКЭ Западноевропейского субтипа этот показатель составлял 60 — 100 % (T.S. Gritsun и M. Labuda, неопубл.). В настоящей работе мы попытались определить, какие вирусные белки определяют эффективность невиремической трансмиссии. Для этого мы сконструировали ряд рекомбинантных вирусов, содержащих разные комбинации генов ВКЭ Сибирского и Западноевропейского субтипов, и сравнили их биологические свойства со свойствами соответсвующих типовых штаммов обоих субтипов.
материалы и методы
Для культивации ВКЭ, титрования инфекционного вируса с помощью бляшкообразующих единиц, восстановления рекомбинантных вирусов и оценки эффективности репродукции вирусов в клетках млекопитающих использовали культуру клеток эмбриона свиньи СПЭВ. Все эксперименты проводили с использованием среды RPMI1640 с добавлением 2 — 5 % сыворотки крови эмбрионов коров и антибиотиков.
Концентрацию инфекционного вируса, а также морфологию бляшек определяли с помощью титрования бляшкообразующих единиц (БОЕ\мл) согласно Gould и Clegg, 1985 [3]. Эффективность репликации ВКЭ в культуре клеток млекопитающих оценивали по скорости накопления инфекционного вируса в течение первых 48 часов после
заражения. Монослой клеток заражали из расчета 1 БОЕ на клетку, адсорбировали вирус в течение 1 часа при комнатной температуре, тщательно промывали монослой и заливали среду поддержки. Через 4, 8, 12, 16, 20, 24 и 48 часов отбирали аликвоты надклеточной среды и определяли титр инфекционного вируса.
Клещи I. ricinus были выведены в лабораторной колонии Института Зоологии Академии наук Словакии (Братислава). Эффективность невиремиче-ской трансмиссии для каждого вируса определяли следующим образом. Группу из 10 голодных самок клещей заражали инъекцией 500БОЕ исследуемого вируса на одного клеща. Зараженных клещей инкубировали при 24 ± 4 °C и влажности 85 — 90 % в течение 14 дней. Далее зараженных самок попарно прокармливали на мышах Balb/C одновременно с 15 неинфицированными нимфами I. ricinus, которые были прикреплены в непосредственной близости от самок-доноров. Открепившихся нимф и самок использовали для определения в них концентрации инфекционного вируса. Эффективность трансмиссии определяли как долю зараженных нимф. Эффективность репликации оценивали по средней концентрации инфекционного вируса в единичном зараженном клеще.
Все биологические эксперименты проводили как минимум в 3 независимых повторах. Для оценки вариабельности результатов рассчитывали стандартную ошибку средних значений.
результаты и обсуждение
При оценке эффективности репродукции рекомбинантных ВКЭ и типовых штаммов в клетках млекопитающих выяснилось, что все они способны достигать высоких титров в культуре клеток СПЭВ. Динамика репродукции вирусов оказалась практически идентичной и к 32 часу после момента заражения титры вирусов достоверно не отличались друг от друга (рис. 1).
Во взрослых клещах I. ricinus все вирусы размножались со сходной эффективностью и достигали титров 3,65 — 5,71 1од10БОЕ/мл. Интересно, что типовые штаммы размножались с практически одинаковой эффективностью — 4,56 1од10БОЕ/мл для
Рис. 1. Динамика репродукции рекомбинантных вирусов в культуре клеток млекопитающих (СПЭВ).
Vs Vs | НуprL | VS | Hvpr 1' i'M-L ] VS | Hvpr-S Ir | Hypr
Vs Vs[lKprhJ VS [11> pr PrM-F) VS[1 Ivpr-Slr] ll\pr
Рис. 2. А - репродукция рекомбинантных и исходных вирусов в нимфах I. ricinus; б - эффективность невире-мической трансмиссии рекомбинантных и исходных вирусов от самок к нимфам I. ricinus.
Vs[ns], что согласуется с высокой эффективностью репродукции этого вируса в нимфах (рис. 2Б).
Данная работа выполнена при поддержке грантов BBSRC BBS/B/00697, The Sixth EU Framework grant (VIZIER EU Contract LSHG-CT-2004-511960) и грантом MRC ID 87652. Данный проект вдохновлен идеями покойного проф. Milan Labuda, который сформулировал концепцию невиремической трансмиссии ВКЭ.
2. Danielova V., Holubova J. Transovarial transmission rates of tick-borne encephalitis virus in Ixodes ricinus ticks. In: Dusbabek F,Bukva V, eds. Modern acarology. Vol 2, Prague, Czech Republic: SPB Academic Publishing; 1991. - С. 7-10.
3. Gould E.A., Clegg J.C.S. Growth, titration and purification of togaviruses. // In: B. W. J. Mahy (ed.), Virology: A Practical Approach. — IRL Press, 1985. — P. 43 — 48.
4. Gritsun TS, Gould EA Development and analysis of a tick-borne encephalitis virus infectious clone using a novel and rapid strategy // J. Virol. Methods. — Vol. 76. — P. 109—120.
5. Kunz C., Heinz F.X. Tick-borne encephalitis. — Vaccine, 2003. — Vol. 21. — P. 1—2.
6. Lindquist L., Vapalahti O. Tick-borne encephalitis // Lancet. — 2008. — Vol. 371. — P. 1861 — 1871.
7. Non-viraemic transmission of tick-borne encephalitis virus: a mechanism for arbovirus survival in nature / M. Labuda [et al.] // Experientia. — 1993. — Vol. 49. — P. 802 — 805.
8. Nucleotide and deduced amino acid sequence of the envelope gene of the Vasilchenko strain of TBE virus; comparison with other flaviviruses / T.S. Gritsun [et al.] // Virus Res 27. — 1993. — P. 201 —209.
9. Rice C. Flaviviridae: the viruses and their rep- Virology. — Lippincot-Raven Publishers, Philadelphia lication // In: Fields, B., Knipe, M.D. (Eds.), Fields and New York, 1996.
Сведения об авторах
HavlikovaS. - Institute of Virology, Bratislava
Tuplin A. - лектор School of Life Sciences, University of Warwick
KazimirovaM. - научный сотрудник Institute of Zoology, Slovakia
GoonavardaneN. - научный сотрудник School of Biological Sceinces, University of Reading, UK
SlovakM. - научный сотрудник Institute of Zoology, Slovakia
KlempaB. - руководитель группы экологии вирусов Institute of Virology, Bratislava
JonesI.M. - глава департамента School of Biological Sceinces, University of Reading, UK
LabudaM. - профессор Institute of Virology, Bratislava
Среди переносчиков инфекционных заболеваний человека клещи занимают второе место после комаров: на сегодня выявлено не менее трех вирусных, 22 бактериальные и несколько протозойных инфекций, которые переносятся иксодовыми клещами. Ситуация зачастую осложняется тем, что при укусах клещи способны передавать человеку одновременно разные виды бактерий, вирусов и простейших, вызывая смешанные инфекции, часто протекающие в более тяжелых формах. Дополнительный риск заражения возникает из-за возможной циркуляции патогенов в сельскохозяйственных и домашних животных (например, инфекционные агенты могут сохраняться в молочных продуктах), а также при переливаниях крови и трансплантации органов. Наиболее опасными среди инфекций, переносимых клещами, считаются клещевой энцефалит, иксодовый клещевой боррелиоз, эрлихиоз, риккетсиоз и бабезиоз. Для России наиболее социально значимыми инфекционными агентами являются боррелии и конечно же вирус клещевого энцефалита, о котором пойдет речь ниже.
Таежная инфекция
В 30-х гг. XX в. шло интенсивное освоение Дальнего Востока: строились дороги, вырубались леса, из-за напряженных отношений с Японией в тайге дислоцировались крупные военные части. Врачи, работавшие в то время в Приморском крае, стали регулярно сообщать о неизвестной тяжелой болезни, поражающей как местных жителей, так и военных. Заболевание, считавшееся новой разновидностью тяжелого гриппа, сопровождалось резким повышением температуры и часто приводило к параличам и даже гибели заболевших.
Правильно диагностировать неизвестную болезнь удалось лишь в 1935 г. местному врачу А. Г. Панову. Заболевание оказалось воспалением мозга, т. е. энцефалитом, похожим по симптомам на описанный ранее японский энцефалит. В 1936 г. врачи дальневосточной пастеровской станции пытались выделить возбудителя заболевания, вводя мышам в мозг эмульсию мозга людей, погибших от энцефалита. Но, несмотря на то, что у мышей появлялись признаки заболевания, исследования не увенчались успехом.
В январе 1937 г. военные медики обратились в Наркомздрав СССР, где и было принято решение об организации на Дальний Восток научной экспедиции под руководством Л. А. Зильбера. В тяжелых полевых условиях была развернута настоящая вирусологическая лаборатория. Ученые свою задачу выполнили: патоген, вызывающий тяжелые заболевания центральной нервной системы, был успешно выделен и описан. Кроме того, была четко установлена определяющая роль иксодовых клещей в передаче инфекционного агента. Выяснилось, что источником заражения клещей служили дикие позвоночные животные, на основе чего были разработаны рекомендации по необходимым профилактическим мерам.
К сожалению, это поистине блестящее открытие, ставшее важной вехой в истории вирусологии, не обошлось без жертв среди самих участников научной экспедиции. Так, М. П. Чумаков – будущий академик и создатель Института по изучению полиомиелита – перенес тяжелейшую форму инфекции, перешедшую у него в хроническую пожизненную форму; последствием заболевания у В. Д. Соловьева стала шестимесячная слепота.
Опасный сосед
Что на сегодня известно о вирусе клещевого энцефалита (ВКЭ)? Вирус относится к достаточно старому в эволюционном плане семейству флавивирусов (Flaviviridae), включающему более 70 вирусов животных и человека, в том числе такие опасные, как вирус желтой лихорадки, японского энцефалита, вирус лихорадки Денге и вирус гепатита C.

Лев Александрович ЗИЛЬБЕР (1894—1966) – один из основоположников медицинской науки в СССР. С его именем связаны фундаментальные исследования изменчивости у бактерий и природы иммунитета, организация первых в стране вирусологических центров, создание и экспериментальная разработка вирусо-генетической теории происхождения опухолей, а также совершенно нового направления – иммунологии рака.
За работу по выявлению возбудителя и переносчика весенне-летнего энцефалита в 1937 г. был награжден премией Наркомздрава СССР, но в том же году арестован по ложному обвинению, что экспедиция, которую возглавлял Зильбер, тайно распространяла японский энцефалит на Дальнем Востоке, и освобожден лишь через полтора года. В короткий промежуток времени между освобождением и новым арестом работал над монографией об эпидемических энцефалитах, подготовил несколько статей.
Основным природным резервуаром ВКЭ служат мелкие млекопитающие (полевки, мыши, насекомоядные). Вирус способен заражать животных и размножаться в их организме, однако заболевание протекает у них зачастую без видимого вреда для здоровья. Переносчиками вируса являются клещи, питающиеся кровью лесных зверьков, – европейский лесной клещ, таежный, луговой клещи, а также ряд других, более редко встречающихся видов. ВКЭ может размножаться и в их организме. Точно не известно, был ли вирус первоначально связан только с клещами, или только с позвоночными животными, но в процессе эволюции он приспособился к существованию в организмах как тех, так и других.
В настоящее время вирус клещевого энцефалита встречается в лесных регионах по всей территории Евразии от Атлантического океана до Тихого, причем в целом область его распространения совпадает с ареалами европейского лесного и таежного клещей. В последние десятилетия ареал ВКЭ неуклонно расширяется, что связано с усилением хозяйственной деятельности человека. Так, заброшенные лесные вырубки зарастают мелкими кустарниками и заболачиваются, что создает идеальные условия для обитания мелких млекопитающих и связанных с ними клещей.
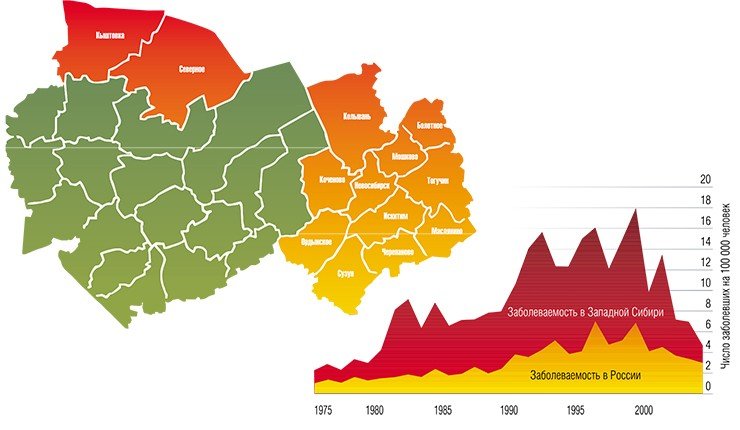
Кроме того, все большее число людей предпочитает проводить свободное время на природе, отдыхая или работая на приусадебных участках. В той же Новосибирской области около 75% населения проживает на территории, условия которой благоприятны для жизни клещей, здесь же сосредоточена и основная масса летних оздоровительных учреждений, зон массового отдыха, садово-дачных участков.
В Институте химической биологии и фундаментальной медицины были исследованы 95 штаммов вируса клещевого энцефалита из коллекции Института систематики и экологии животных СО РАН, выделенных от взрослых особей таежного клеща, собранных с растительности в восточной части Новосибирской области в 1980—2001 гг.
Анализ нуклеотидных последовательностей фрагмента гена Е, кодирующего белок оболочки вируса, показал, что все штаммы соответствуют сибирскому генетическому типу.
С другой стороны, в крови людей, госпитализированных с подозрением на клещевые инфекции, в совместных исследованиях с новосибирскими медиками были обнаружены изоляты ВКЭ, относящиеся к дальневосточному генетическому типу.
Ранее считалось, что этот тип вызывает только тяжелые формы заболевания, тогда как сибирский – преимущественно хронические. Наши исследования, подтвержденные данными других авторов, показали, что вирус дальневосточного генетического типа способен вызывать различные формы клещевого энцефалита, начиная от самых тяжелых и заканчивая стертыми, никак не проявляющимися.
Геном вируса клещевого энцефалита был расшифрован в 1989—1990 гг. практически одновременно в нашей стране (в том числе и в Институте химической биологии и фундаментальной медицины СО РАН (Pletnev et al., 1990)) и за рубежом (Mandl et al., 1989). На сегодня выделено три генетических типа вируса, различающихся по своим свойствам: дальневосточный, сибирский и западноевропейский. Такая привязка генетического типа к географическому местоположению достаточно условна, поскольку в одном регионе могут встречаться штаммы, относящиеся к разным типам.
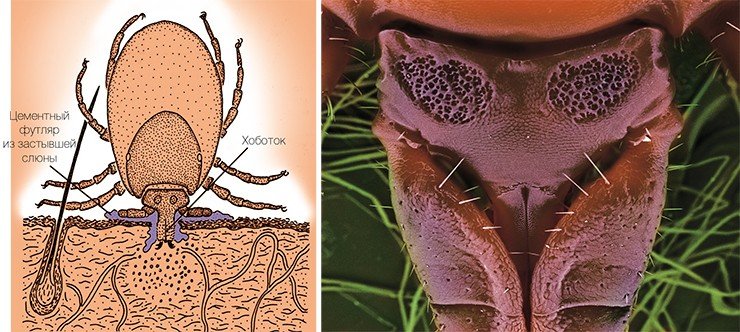
Для вируса клещевого энцефалита, как и для большинства других вирусных инфекций, не существует высокоспецифических методов лечения – в этом заключается его опасность. Лечение всех вирусных заболеваний направлено в основном на стимуляцию иммунитета и устранение внешних симптомов заболевания, а дальше организм должен сам справляться с инфекцией. ВКЭ опасен еще и тем, что способен вызывать хронические формы заболевания, а его последствиями могут быть параличи и инвалидность. Поэтому важнейшим делом в исследовании этого инфекционного агента является разработка методов диагностики и профилактики заболевания.
Диагностика и профилактика
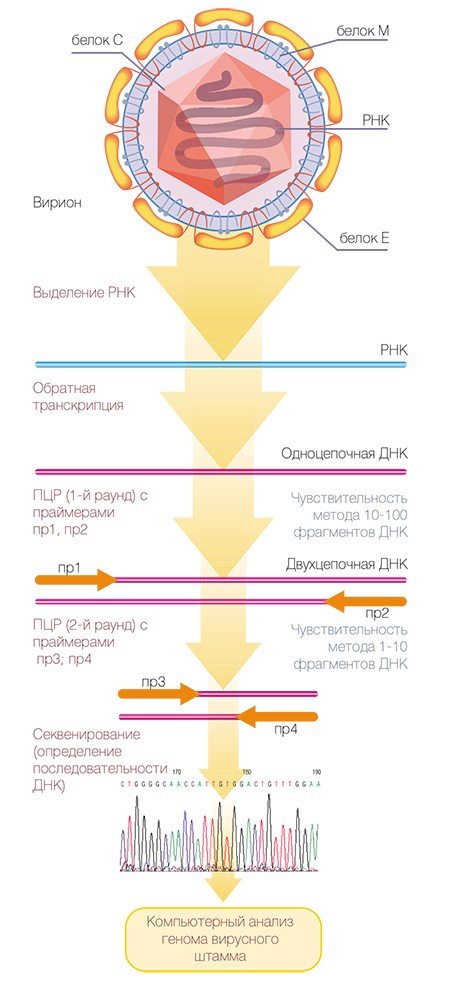
В клинической диагностике вируса клещевого энцефалита наиболее распространены серологические методы, с помощью которых в крови пациента определяют наличие антител, специфических защитных белков, или наличие самого агента. Однако чувствительность этих методов не слишком высока, к тому же существует вероятность ошибки из-за возможных перекрестных реакций с другими патогенами. Кроме того, с их помощью невозможно получить подробную характеристику самого возбудителя (например, определить его генетический тип).
Молекулярно-генетические методы, направленные на специфическое распознавание генетического материала вируса, обладают более высокой чувствительностью. Особенно это относится к методу полимеразной цепной реакции** (ПЦР), благодаря которой можно размножить, а потом идентифицировать ничтожное количество наследственного материала вируса, что позволяет провести диагностику в течение первых дней после заражения. Однако при некоторых обстоятельствах достоинства могут переходить в недостатки: генодиагностика ВКЭ молекулярно-генетическими методами благодаря высокой чувствительности может также приводить к ошибкам, обусловленным многочисленными новыми мутациями вирусных геномов, а кроме того, предъявляет высокие требования к чистоте экспериментов.

Живые вакцины
Живые вакцины – способ стимуляции иммунитета введением в организм ослабленных вирусов, открытый еще в 1796 г. английским врачом Э. Дженнером. С тех пор была получена живая вакцина против вируса желтой лихорадки, отличающаяся от высокопатогенных штаммов многочисленными заменами нуклеотидов в геноме; продолжаются поиски ослабленных штаммов флавивирусов Денге, Западного Нила и Лангат для разработки на их основе живых вакцин.
Были предприняты попытки создания живой вакцины и против вируса клещевого энцефалита. В 1957 г. в качестве такой живой вакцины было решено использовать ослабленный штамм флавивируса Лангат, вызывающий в организме выработку антител, подобных антителам к ВКЭ. Однако выяснилось, что при внутримозговом введении этот штамм сам становится патогенным и вызывает энцефалиты и атрофию участков мозга без внешних клинических проявлений. В дальнейшем были обнаружены ослабленные штаммы самого ВКЭ, но, к сожалению, все они оказались генетически нестабильными.
Вот трагический пример использования живых вакцин против ВКЭ. В 1969 г. от больного, у которого после укуса клеща в течение 4 лет не было клинических проявлений заболевания, но в крови сохранялись высокие титры антител, был выделен ослабленный штамм вируса клещевого энцефалита. Лабораторные исследования выявили его низкую нейровирулентность, после чего были проведены клинические испытания на добровольцах, давшие положительные результаты. В конечном счете ослабленным штаммом ВКЭ было иммунизировано около 650 тыс. человек. Однако 35 вакцинированных получили тяжелые осложнения в виде менингитов и менингоэнцефалитов, причем у 22 из них тяжелые последствия заболевания остались на всю жизнь, а один человек умер. Использование этого штамма в качестве живой вакцины было прекращено (Timofeev, Karganova, 2003).
ДНК-копии
С помощью подобных манипуляций были созданы живые химерные вакцины, содержащие, например, часть генов вируса желтой лихорадки и часть генов других флавивирусов. При этом в функционально важные участки их геномов были введены точечные мутации, вызывающие ослабление патогенности (Pletnev et al., 2006).
Тем не менее в настоящее время применение ослабленных живых вакцин, в том числе и против ВКЭ, ограничено, поскольку существует вероятность превращения ослабленных штаммов в высокопатогенные штаммы дикого типа. Это происходит потому, что в клетке-хозяине отсутствуют системы коррекции мутаций, которые могут возникнуть в вирусной РНК. Гарантией безопасности таких вакцин могла бы служить утрата больших фрагментов вирусных геномов, однако это приводит к значительному снижению жизнеспособности самих вирусов-мутантов.
Нужно отметить, что исследования флавивирусов, как и многих других патогенов, осложняются их высокой инфекционностью, следствием которой являются строгие требования безопасности, а также дороговизной самих вирусных препаратов. И в этом смысле использование неинфекционных ДНК-копий генома ВКЭ является очень перспективным направлением.
В ИХБФМ был получен ряд генно-инженерных ДНК, содержащих в том числе и полноразмерную ДНК-копию генома вируса клещевого энцефалита (Dobrikova et al., 1996). Конструирование подобных стабильных ДНК-копий вирусных геномов открывает широкие возможности для исследования хода размножения вируса в клетках, изучения функций отдельных вирусных белков и их комплексов.
Иммунизация генами
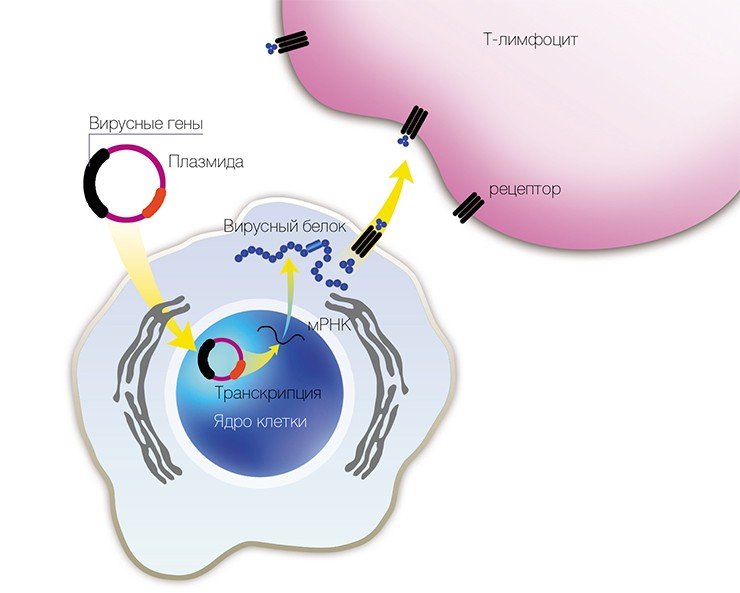
В 1993 г. появился новый подход к профилактике инфекционных заболеваний – генная иммунизация, основанная на прямом введении в организм генно-инженерной ДНК, рекомбинантных плазмид (векторов-переносчиков), содержащих не весь геном, но отдельные гены возбудителя заболевания.
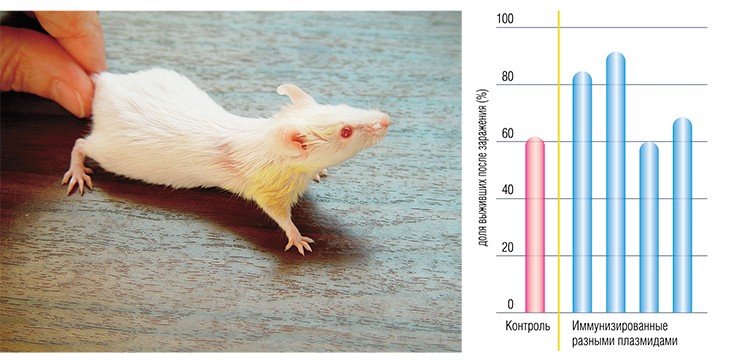
Учеными из ИХБФМ были сконструированы четыре таких плазмиды, содержащие различные гены одного из штаммов вируса клещевого энцефалита. Для оценки эффекта генной иммунизации привитых мышей заражали летальными дозами того же штамма ВКЭ. В результате оказалось, что некоторые плазмиды обладают определенным защитным эффектом.
В качестве вакцин против вирусных заболеваний ученые предполагают использовать генно-инженерные плазмиды, в которые встроены отдельные гены вирусов
Чтобы изучить возможные нежелательные эффекты этих вакцин, плазмиды вводили в различные клеточные культуры. В результате выяснилось, что при увеличении времени культивирования клеток до нескольких месяцев наблюдалась существенная модификация плазмид и встраивание их в хозяйский геном.
Таким образом, несмотря на положительные результаты генной вакцинации, вопрос о применении ДНК-вакцин в настоящее время остается открытым, поскольку препятствием к их использованию также является проблема безопасности. Возможно, преодолеть это препятствие удастся созданием РНК-вакцин с аналогичным принципом действия, для которых не существует риска интеграции в ДНК-геном хозяйской клетки. Но это уже задачи будущих исследований.
Возможно ли полностью избавиться от ВКЭ, например, уничтожив его основных переносчиков, иксодовых клещей? В свое время такая попытка была сделана с использованием печально известного ДДТ, но последствия массовой обработки лесов сильнейшим ядом были поистине ужасающими.
Ø К этой группе вирусов относятся:
· Вирус клещевого энцефалита (TBEV)
· Вирус Омской геморрагической лихорадки (OHFV)
· Вирус Кьясунарской лесной болезни (KFDV)
· Вирус Повассан (PV)
Ø Большинство вирусов этой группы переносится клещами рода Ixodes и вызывает у человека энцефалиты (исключение; OHFV – вызывает геморрагическую лихорадку, основной переносчик - клещ Dermacentorreticulates)
Ø Смертность 1-2%, у 10-20%, заболевших КЭ, остаются последствия в виде поражений нервной системы
Ø Против КЭ разработана эффективнаяинактивированная вакцина
Клещевой энцефалит
TBEV вызывает 2 заболевания: русский весенне-летний энцефалит и центрально-европейский энцефалит
Гепатит С
Ø Пути передачи инфекции: парентеральный (половой, перинатальным – в меньшей степени)
170 млн. человек на Земле заражены HCV
Ø У 60% инфицированных развивается хронический гепатит (намного чаще по сравнению с гепатитом В), из них у 30% развивается цирроз печени, на фоне которого 3-4% случаев возникает рак печени
Ø Географическая вариабельность заболеваемости раком печени: США,
Ø Зап.Европа – 0.5-1%; Ближний Восток, Азия – 20%
Ø Ведущей гипотезой возникновения рака печени, вызываемого HCV, является непрекращающаяся гибель инфицированных вирусом гепатоцитов, компенсаторная замена гибнущих клеток размножающимися гепатоцитами и как результат возникновение мутаций в геноме последних
Ø Уход от иммунного ответа: белок нуклеокапсида вируса (С) ингибирует TNF-α-опосредованный апоптоз
Ø Стресс эндоплазматического ретикулума вызывает изменения в физиологии клетки и предрасполагает клетку к трансформации
Ø Окислительный стресс ведёт к хронической активации звёздчатых клеток (клеток Ито), которые усиливают фиброгенез и пролиферацию гепатоцитов
Средства борьбы с HCV
Создать генно-инженерную вакцину не удалось, т.к. поверхностные белки – гипервариабельны
Некоторые генотипы HCV (генотипы 2 и 3) поддаются терапии интерферонами
Ингибиторы протеазы NS3 и ингибиторы РНК- зависимой РНК-полимеразы NS5B (Ограничение: монотерапия такими ингибиторами быстро приводит к появлению резистентных штаммов HCV)
8. Коронавирусы: классификация, структура вириона, строение генома. Субгеномные РНК. Неструктурные белки, поверхностные гликопротеины.
Ø порядок: Nidovirales
v корона вирусы человека 229, NL63 (HCoV)
v вирус трансмиссивного гастроэнтерита свиней (TGEV)
v коронавирусы человека ОС43, HKU-1 (HCoV)
v вирус гепатита мышеи (MHV)
v вирус атипичной пневмонии (SARS)
v вирус инфекционного бронхита птиц (IBV)
v торовирус человека (HuTV)
v торовирус лошадей (Berne/EqTV)
v торовирус быков (Breda/BoTV)
Ø род Coronavirus: dвириона 120-160 нм, размер линейного (+)РНК-генома
Ø род Torovirus: dвириона 120-140 нм, размер линейного (+)РНК-генома
Ø в отличии от большинства других (+)РНК-вирусов, коронавирусы имеют нуклеокапсид со спиральной симметрией

Ø Геном коронавирусов самый большой среди вирусных РНК-геномов, распространена рекомбинация
Ø Непосредственно с геномной РНК считывает ORF1, все остальные белки транслируются с сгРНК
Ø На 5'-концах всех сгРНК присутствует лидерная РНК- последовательность (65-89 bp), эквивалентная 5’-концу генома. 3’- конец полиаденилирован.
Жизненный цикл коронавирусов


Неструктурные белки

Ø Неструктурные белки образуются путем нарезания 2 полипротеинов, транслирующихся с помощью фреймшифтинга (сдвиг рамки считывания (смотри геном))
Ø Коронавирусы кодируют до 16 неструктурных белков: как минимум 2 протеазы, РНК-полимеразу, хеликазу, ферменты, связанные с процессингом РНК (эндорибонуклеаза, 3'-5'-экзонуклеаза, метилтрансфераза, АДФ-l'-фосфатаза, циклофосфодиэстераза), деубиквитинирующий фермент и белки, блокирующие клеточную защиту против вирусов.
Субгеномные РНК
Ø Коронавирусы кодируют набор кэпированных и полиаденилированных сгРНК, от 5 до 8, с каждой из которых считывается 1-3 белка
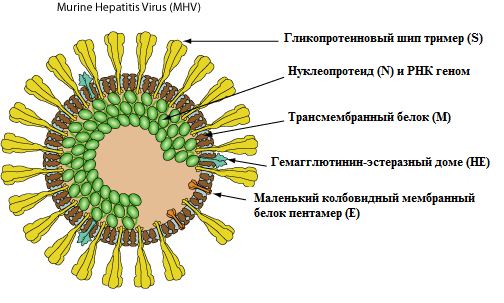
Ø С сгРНК считываются структурные белки S (триммер гликопротеиновый шип), Е(маленький колбовидный мембранный белок пентамер (для модификации клеточной мембраны полученной во время почкования)), М (трансмембранный белок), N (нуклеопротеид (белок капсида)) и ряд вспомогательных белков
Ø Для объяснения образования лидерной РНК предложено 2 модели: согласно первой – на 3 -конце агРНК(-) синтезируется праймер (лидерная РНК) из
60 нуклеотидов, который затем диссоциирует от матрицы и садится на любой сг-промотер (в начале каждого гена есть акцепторная последовательность, на которую этот праймер может сесть), с которого вирусная РНК-полимераза продолжает синтез сгРНК
Ø Нуклеокапсид имеет спиральную симметрию и формируется фосфорилированным белком N в комплексе с оц вгРНК + .
Поверхностные белки
Липопротеиновая оболочка образована из шероховатого эндоплазматического ретикулума или аппарата Гольджи путем почкования.
Ø коронавирусы кодируют 3 белка внешней оболочки: S, М, Е
Ø Белок М – трансмембранный, пересекает липидный бислой 3 раза, размер небольшой (521 амк у SARS)
Ø белок Е – самый маленький из 3-х поверхностных (76 амк у SARS). М и Е важны для морфогенеза вирусных частиц. Белок Е, пентамеры кт способны формировать ионные каналы, содержится в количестве всего неск копий на вирион , но является важным фактором вирулентности.
Ø Некоторые коронавирусы, принадлежащие к группе 2, кодируют 4-ый поверхностный белок – гемагглютинин-эстеразу (НЕ), гомологичную НЕ вируса гриппа С. Не расширяет спектр инфицируемых коронавирусами клеток, связываясь с некоторыми вариантами сиаловых кислот
S- andHE-белки основные эпитопы для нейтрализации. M- andN-белки содержат менее эффективные нейтрализирующие детерминанты. Лучший защитный эффект при иммунизации достигается при использовании S- andN-белков. Антигемагглютинирующие АТ связываются с эпитопами S- andHE-белков. Детерминанты клеточного иммунного ответа находятся в составе N-белка.
Заражение происходи капельно-воздушным или фекально-оральным путем. Клетки-мишени – эпителиальные клетки (респираторный тракт и ЖКТ(также обнаруживаетсяи в других органах(например: в печени и почках))) и МФ, имеющие поверхностные рецепторы, с кт связывается S-белок вируса: ACE2 (HCoVNL63, SARS-CoV), APN (CD13) (AlphaCov1, HCoV 229E). CEACAM1 (MCoV), или полисахариды, α2-3-терминированные остатки О-ацетилированных сиаловых кислот (ACoV, PhCoV, BetaCoV1).
Дата добавления: 2018-06-01 ; просмотров: 655 ;
Читайте также:


