Клетки митохондрии в нервных клетках
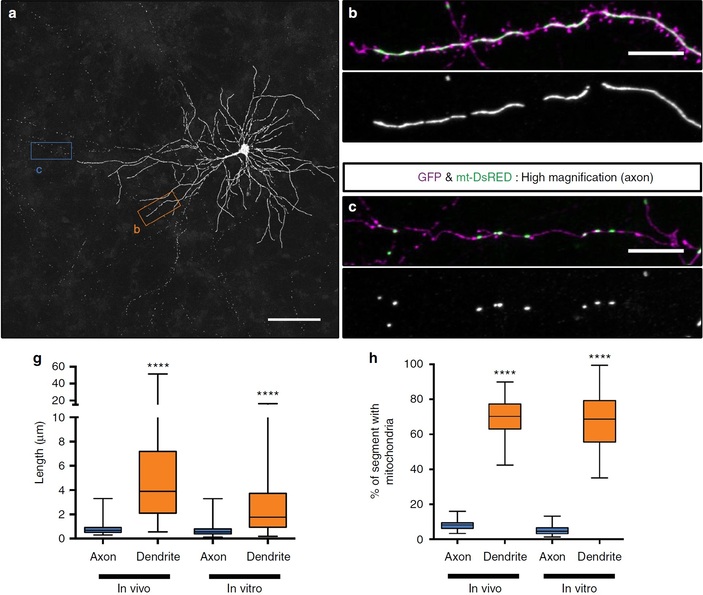

Рис. 1. Пирамидальный нейрон (a) и митохондрии, подсвеченные зеленым в его дендритах (b) и аксонах (с). На графиках показаны линейные размеры митохондрий в аксонах и дендритах (g) и доля длины аксонов и дендритов, которая занята митохондриями (h). In vivo — это данные, полученные на зафиксированных срезах коры головного мозга мышей, в которые предварительно были введены плазмиды белков, избирательно окрашивающих матрикс и митохондрии. In vitro — данные, полученные аналогичным образом в культуре нейронов. Фотография отображает инвертированные цвета, поэтому зеленый флуоресцирующий белок (GFP) здесь выглядит пурпурным, а красный флуоресцирующий белок, окрашивающий митохондрии (mt-DsRED) — зеленым. Рисунок из обсуждаемой статьи в Nature Communications
Нейроны — это клетки, составляющие основные функциональные элементы нервной системы. Структурными элементами нейрона являются тело клетки, в котором располагается ядро с генетическим материалом, и два типа отростков: дендриты (обычно их много, они тонкие и обильно ветвящиеся) и аксон (более толстый отросток, который, однако, обычно тоже ветвится на некотором расстоянии от тела клетки; он всегда один). Оба типа отростков могут формировать множественные контакты с другими клетками, однако функция у них разная: дендриты принимают возбуждающие или тормозящие сигналы от других нейронов и передают их к телу нейрона, а аксон обеспечивает передачу сигналов к следующим нейронам (либо к клеткам мышц).
Передача сигналов от одного нейрона к другому осуществляется через особые образования — синапсы, в которых мембраны передающей и принимающей клеток формируют выпячивания и тесно сближаются друг с другом. Нейроны млекопитающих (таких, как мышь или человек) общаются при помощи химических синапсов. Это значит, что передающий нейрон выделяет через пресинаптическую мембрану сигнальные молекулы — нейромедиаторы, а принимающая клетка улавливает эти молекулы при помощи специальных рецепторов, встроенных в постсинаптическую мембрану. Связывание рецептора с нейромедиатором и вызывает в принимающей клетке те или иные реакции.
Но затем избыток кальция откачивается из цитоплазмы. И тогда активаторный сигнал прекращается до индукции нового потенциала действия.
Работа нейронов очень энергозатратна. Неудивительно поэтому, что митохондрии чрезвычайно важны для их функционирования. Пирамидальные нейроны коры головного мозга содержат огромное количество митохондрий, причем форма этих митохондрий различается в разных частях клетки. В дендритах митохондрии имеют сильно удлиненную форму, напоминая под микроскопом макаронины. В теле клетки такие же удлиненные митохондрии сливаются между собой, формируя густую сеть. Но в аксонах митохондрии выглядят иначе: они гораздо более короткие, многие — практически шарообразной формы. Эти митохондрии без конца снуют туда и обратно, используя в качестве рельсов цитоскелетные элементы — микротрубочки, протянутые вдоль аксона. Эта динамика хорошо видна на видео, снятом в ходе прошлогодней работы польской группы исследователей (T. M. Stępkowski et al., 2017. mitoLUHMES: An Engineered Neuronal Cell Line for the Analysis of the Motility of Mitochondria):
Группа ученых из США, решила продвинуться дальше и разобраться в механизме формирования особенных аксональных митохондрий и в том, есть ли какой-то специфический функциональный смысл в этой их особенности. Их статья на прошлой неделе была опубликована в журнале Nature Communications.
Ученые предположили, что размеры митохондрий могут зависеть от контроля их деления. На сегодняшний день главные молекулярные игроки, задействованные в этом процессе известны (K. Basu et al., 2017. Molecular mechanism of DRP1 assembly studied in vitro by cryo-electron microscopy). Один из этих игроков — белок Mff. Этот белок встраивается в наружную мембрану митохондрий и служит рецептором для моторного белка Drp1. Drp1 формирует кольцо, перетягивающее митохондрию пополам (будто ремнем) и таким образом разделяет ее на две отдельные митохондрии меньшего размера. На рис. 2 показаны и другие молекулы, участвующие в этом процессе. С другой стороны, митохондрии могут и увеличиваться в размере за счет слияния друг с другом, зависящего от другого комплекта белков-регуляторов. В итоге размер и морфология митохондрии определяется, по-видимому, соотношением частоты слияний и разделений.


Рис. 2. Механизм разделения митохондрий при участии Drp1 и MFF рецептора. Рисунок из статьи K. Basu et al., 2017. Molecular mechanism of DRP1 assembly studied in vitro by cryo-electron microscopy
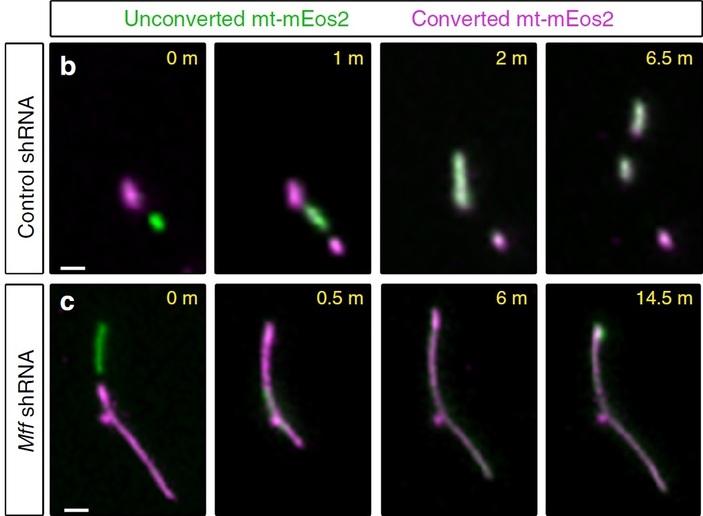

Рис. 3. Слияние и деление митохондрий внутри аксона. Здесь показана серия фотографий, зафиксировавших динамику митохондрий на протяжении нескольких минут (время от начала съемки в минутах показано в правом верхнем углу каждого фотоснимка). В клетки ввели плазмиду с геном белка mt-mEos2, который метит митохондрии, встраиваясь в их мембраны. Облучая небольшую зону аксона светом определенной волны, получали фотоконверсию, из-за которой меняется спектр флуоресценции репортерного белка. На данных фото митохондрии без фотоконверсии выглядят зелеными, а с фотоконверсией — пурпурными. Спустя время некоторые митохондрии сливаются и в результате смешения цветов выглядят белесоватыми. Верхняя серия фотографий демонстрирует нормальный процесс слияния-деления митохондрий в аксоне контрольных клеток. Несмотря на наличие обоих процессов, митохондрии остаются короткими. Нижняя серия показывает результаты аналогичного исследования для нейронов с подавленным Mff (при помощи коротких шпилечных РНК — Mff shRNA). Здесь преобладает слияние, и митохондрии со временем удлиняются. Рисунок из обсуждаемой статьи в Nature Communications
Быть может размер митохондрий отрицательно сказывается на их мобильности внутри аксона или на возможности захвата митохондрий в пресинаптическую область? Ученые измерили соответствующие показатели в клетках с нормальным и подавленным Mff, сравнили результаты — это предположение не подтвердилось.
Далее измерили электрохимический потенциал на мембране митохондрий, окислительно-восстановительный потенциал матрикса, скорость синтеза АТФ длинными и короткими митохондриями в аксонах экспериментальных клеток (кому интересно как именно — рекомендую обратиться к оригинальной статье, но все использованные подходы так или иначе опираются на явление флуоресценции), сравнили, и снова не выявили значимых различий.
Наконец, решили проверить, не влияют ли митохондрии каким-то образом на динамику ионов кальция. Напомню, что именно поступление избыточного кальция в терминали аксона заставляет нейрон высвободить нейромедиатор, отправляя сигналы к принимающей клетке. Куда этот избыточный кальций уходит потом? Частично снова выводится наружу, часть захватывается трубочками эндоплазматической сети, и еще какая-то часть поглощается митохондриями (это было установлено авторами в работе, опубликованной ранее). Может быть именно здесь и кроется ключ к ответу? Эту гипотезу проверяли, замеряя уровни кальция в аксонах пирамидальных нейронов коры головного мозга мышей до, во время и после индукции потенциалов действия. Выяснили следующее:
1) Суммарное количество ионов кальция, удерживаемого внутри длинных митохондрий в состоянии покоя выше, чем в коротких митохондриях. Это и логично, учитывая больший объем матрикса в первых по сравнению со вторыми.
2) Немедленно после индукции потенциала действия кальций, поступивший внутрь терминали аксона, быстрее откачивается близлежащими крупными митохондриями, чем мелкими. В итоге концентрация ионов кальция в цитоплазме внутри терминали оказывается в первом случае более низкой, чем в норме при мелких митохондриях.
3) В присутствии длинных митохондрий в синаптическую щель выделяется меньше нейромедиатора, следовательно, к принимающей клетке приходит ослабленный сигнал по сравнению с тем, что происходит в случае контрольных нейронов с мелкими аксональными митохондриями. Это, собственно, вполне ожидаемое следствие более низкого уровня ионов кальция в цитоплазме.


Общая картина, вырисовавшаяся по итогам этого исследования, отражена на рис. 5.


Итак, обсуждаемая работа выявила еще одну важную функцию митохондрий в качестве регулятора уровня кальция в нейронах. Вместе с тем картина не ясна в полной мере. К примеру, остается вопрос, каким образом обеспечивается формирование морфологически разных митохондрий в дендритах и в аксонах одних и тех же нейронов (между прочим, напоминают авторы, движение митохондрий, располагающихся внутри аксонов и внутри дендритов обеспечивается двумя разными моторными белками: TRAK1 и TRAK2, соответственно — может ответ где-то тут)? И как их функция в качестве депо кальция задействована (если задействована) в дендритах? Что ж, будем ждать продолжения. Авторы представленного исследования наверняка не остановятся на достигнутом.
Источник: Tommy L. Lewis Jr, Seok-Kyu Kwon, Annie Lee, Reuben Shaw & Franck Polleux. MFF-dependent mitochondrial fission regulates presynaptic release and axon branching by limiting axonal mitochondria size // Nature Communications. 2018. DOI: 10.1038/s41467-018-07416-2.
Митохондрии – маленькие труженики или большие начальники?
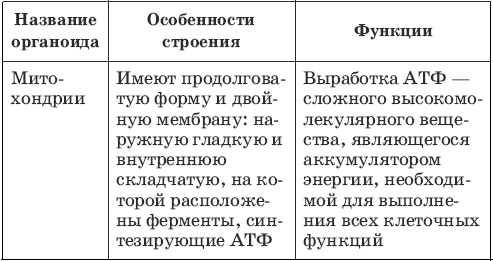
Митохондрии имеют две мембраны (внутреннюю и внешнюю) и собственный наследственный материал в виде ДНК (рис.1). На внутренней мембране митохондрий находится система окислительного фосфорилирования, работа которой обеспечивает окисление энергетических субстратов с образованием АТФ.

Рис. 1. Схематическое строение митохондрии
Больше всего митохондрий находится в тканях с высокими энергетическими потребностями, — мышцы, печень, бурая жировая ткань, мозг. Неудивительно, что и динамика митохондрий в этих тканях изучена лучше.
Итак, если в клетку какой-либо из этих тканей (кроме некоторых нейронов в мозге, об этом потом) поступает большое количество питательных веществ (поступление превышает затраты), то митохондрии находятся в разделенном (фрагментированном) состоянии. Если клетка находится в состоянии голода (поступления меньше затрат), то происходит слияние митохондрий и они находятся в соединенном состоянии. [3,4]. Так поддерживается гомеостаз клетки (рис.2).
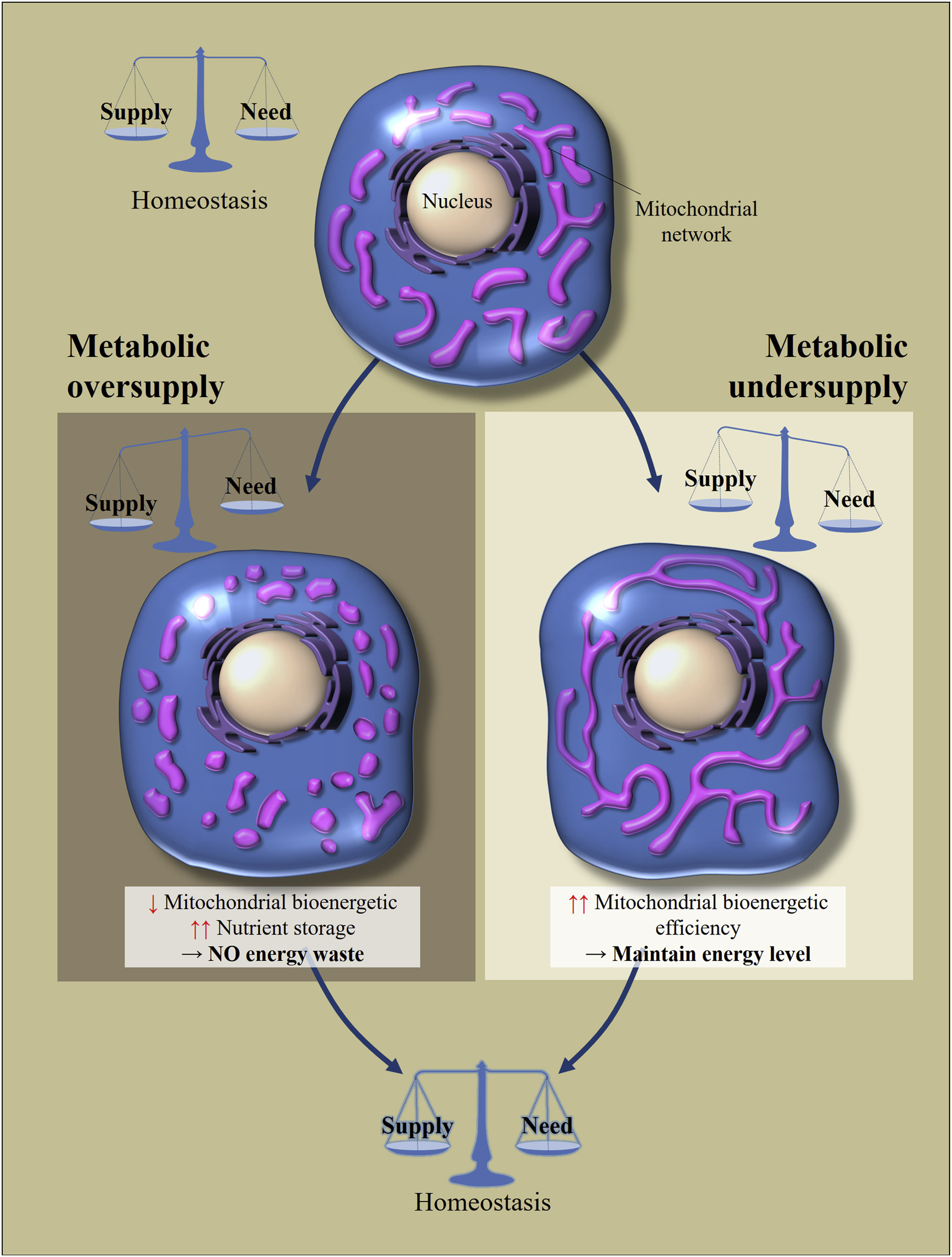
Рис. 2 Регулирование морфологии и биоэнергетической эффективности митохондрий в ответ на избыточное или недостаточное поступление питательных веществ [из 2]
Клеточный метаболический гомеостаз зависит от баланса между потреблением питательных веществ и их расходом. Перемены в поставке питательных веществ приводит к клеточным адаптациям для восстановления баланса. Избыток питания приводит к фрагментации митохондриальной сети, что вызывает снижение биоэнергетической эффективности митохондрий. Это позволит избежать потерь энергии. Напротив, при метаболическом голоде митохондрии удлиняются, чтобы увеличить свою биоэнергетическую эффективность.
Так что, мы ходим на работу, а жизнь митохондрий постоянно протекает в режиме цикла деления и слияния (рис 3).
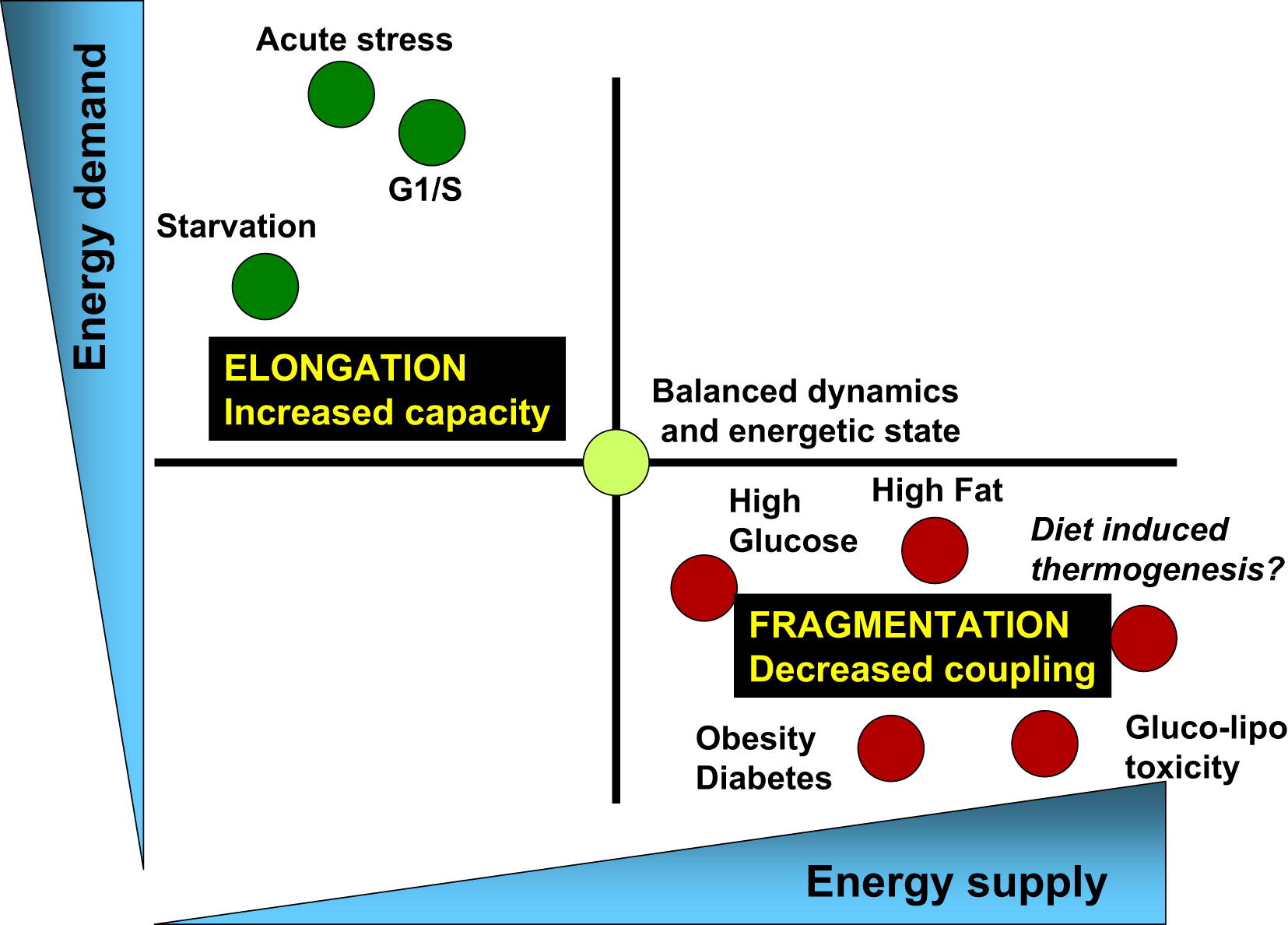
Рис.3 Баланс энергопотребления и энерогообеспечения связан с соответствующими изменениями архитектуры митохондрий и их биоэнергетической эффективностью [из 3]
Физиологические процессы, связанные с увеличением спроса на энергию и снижением энергопоставок, (например, острый стресс, голодание и фаза G1/S) характеризуются удлинением митохондрий и дыханием, связанным с синтезом АТФ. С другой стороны, физиологические процессы, связанные с уменьшением спроса на энергию и увеличением ее поставок (высокий уровень питательных веществ, ожирение и диабет типа 2), связаны с фрагментацией митохондрий, выделением тепла или снижением функции митохондрий.
Нормальный цикл деления митохондрий и их слияния является ключевым звеном контроля их качества. Почему? При делении митохондрий образуется две дочерние, одна из которых имеет более высокий мембранный потенциал и идет дальше в цикл слияния-деления, а другая, с более деполяризованной мембраной, остается отделенной до восстановления мембранного потенциала. Если потенциал восстанавливается, — она воссоединяется с митохондриальной сетью. Если она остается деполяризованной, то она элиминируется в процессе аутофагии, что является залогом качества пула митохондрий (рис.4).
Длительное ингибирование деления митохондрий (при длительном клеточном голодании) приводит к накоплению поврежденных митохондрий, которые не могут быть сегрегированы [3, 4].
С другой стороны, избыток питательных веществ приводит к ингибированию слияния митохондрий, что приводит к нарушению цикла митохондриальной динамики, увеличивает внутриклеточную митохондриальную гетерогенность. Да, при избытке еды фрагментация митохондрий протективна, однако длительная фрагментация, как и длительное слияние, вредна для контроля качества митохондрий. Не происходит селективного удаления, митохондриальная масса будет уменьшаться и состоять из небольших деполяризованных митохондрий.

Рис.4 Жизненный цикл митохондрий и его регулирование доступностью питательных веществ [из 3]
На молекулярном уровне слияние митохондрий является двухстадийным процессом, который требует координированного слияния внешней и внутренней мембран в ходе отдельных последовательных событий. У млекопитающих этот процесс регулируется тремя белками, которые относятся к GTPазам: Mfn1 и Mfn2 необходимы для слияния внешней мембраны, а ОРА1 – для слияния внутренней мембраны. Для деления нужны другие белки, — Fis1 и Drp1.
Роль белков-митофузинов была изучена в loss- and gain-of function studies. Мышки, мутантные по белкам-митофузинам, погибают еще в mid-gestation, потому что у них невозможным становится слияние митохондрий. Митофузины важны для процессов аутофагии и митофагии. Снижение экспрессии Mfn2 в кардиомиоцитах блокирует запуск процесса аутофагии, потому что блокируется слияние аутофагосом с лизосомами. Истощение Mfn2 приводит к снижению потенциала мембран митохондрий, для компенсации происходит снижение работы дыхательной цепи, возрастает поглощение глюкозы и снижается синтез гликогена. Клетка переходит на анаэробный глиоклиз, а это – путь к онкологическому перерождению клетки. Дефицит Mfn2 приводит к нейродегенеративным изменениям. Повышение экспрессии Mfn2 в скелетных мышцах повышает их чувствительность к инсулину.
Динамика митохондрий важна во всех клетках. В бета-клетках поджелудочной железы митохондрии являются сенсорами питательных веществ и генераторами сигналов синтеза инсулина, в мышцах динамика митохондрий важна для регуляции метаболизма глюкозы и т.д. Однако человек не просто совокупность клеток разного типа, каждая из которых принимает самостоятельные решения. Организм – это система, у которой есть центральное регуляторное звено поддержания гомеостаза энергии и глюкозы. Этим главным регулятором является гипоталамус.
Гипоталамус расположен в промежуточном мозге и именно он обеспечивает взаимосвязь нервной и гуморальной систем регуляции. Нейроны гипоталамуса воспринимают, обрабатывают и реагируют на сигналы от жировой ткани (лептин), поджелудочной железы (инсулин), и прочие гормональные стимулы (грелин, холецистокинин, панкреатический полипептид и др.). Гипоталамус управляет деятельностью эндокринной системы человека благодаря тому, что его нейроны способны выделять нейроэндокринные трансмиттеры, стимулирующие или угнетающие выработку гормонов гипофизом. Иными словами, гипоталамус, масса которого не превышает 5 % мозга, является центром регуляции эндокринных функций и поддержания гомеостаза всего организма.
В зависимости от выполняемых функций группы нейронов объединяют в ядра гипоталамуса. Одно из них – аркуатное (дугообразное) ядро является ключевым регулятором пищевого поведения и обмена веществ. В нем могут образовываться орексигенные нейропептиды (стимулируют аппетит) и анорексигенные (подавляют аппетит), относящиеся, соответственно к AgRP и POMC нейронам. Периферические сигналы (инсулин, грелин, лептин и др) влияют на экспрессию пептидов, стимулирующих либо подавляющих аппетит, что обеспечивает слаженность центральной регуляции (рис.5).

Рис. 5. Гипоталамический контроль метмболизма энергии. Мозг интегрирует метаболические сигналы (лептин, инсулин, грелин, PYY3-36) от периферических тканей, таких как поджелудочная железа, жировая ткань, желудок. В мозге специализированные нейронные сети координируют адаптивные изменения в поглощении и расходе пищи [из 5].
Изучение динамики митохондрий в тканях мозга показало, что динамика митохондрий играет существенную роль в способности нейронов гипоталамуса контролировать уровень глюкозы и гомеостаз энергии в организме [6,7,8].
В AgRP нейронах (hunger-promoting AgRP neurons), которые стимулируют аппетит и регулируют набор массы, голодание приводит к делению митохондрий, а high-fat feeding – к слиянию. То есть ответ митохондрий отличается от такового в большинстве других клеток.
Слияние МХ в этих нейронах регулирует электрическую активность в ответ на высокожировую диету, стимулируя выработку орексигенного пептида (AgRP пептида) оно необходимо для набора веса и отложения жира при избытке питательных веществ. Делеции Mfn1 и Mfn2 в этих нейронах приводили к меньшему набору веса у крыс за счет снижения уровня циркулирующего лептина.
РОМС нейроны (подавляют аппетит) имеют противоположную функцию, и динамика митохондрий в ответ на поступление питательных веществ у них иная. Снижение экспрессии митофузинов в этих нейронах приводит к нарушению связи митохондрий с ЭПС, а в результате – гиперфагия, лептинрезистентность и ожирение. При этом возрастало употребление пищи, а энергозатраты снижались.
Таким образом, ответ организма на высокожировую диету зависит от паттернов динамики митохондрий в нейронах гипоталамуса. Ремоделирование митохондрий в нейронах обеспечивает их ответ на поступление в организм питательных веществ, стимулирует выработку нейропептидов, которые будут либо стимулировать либо подавлять аппетит, влияя на метаболизм на уровне организма (Рис.6).
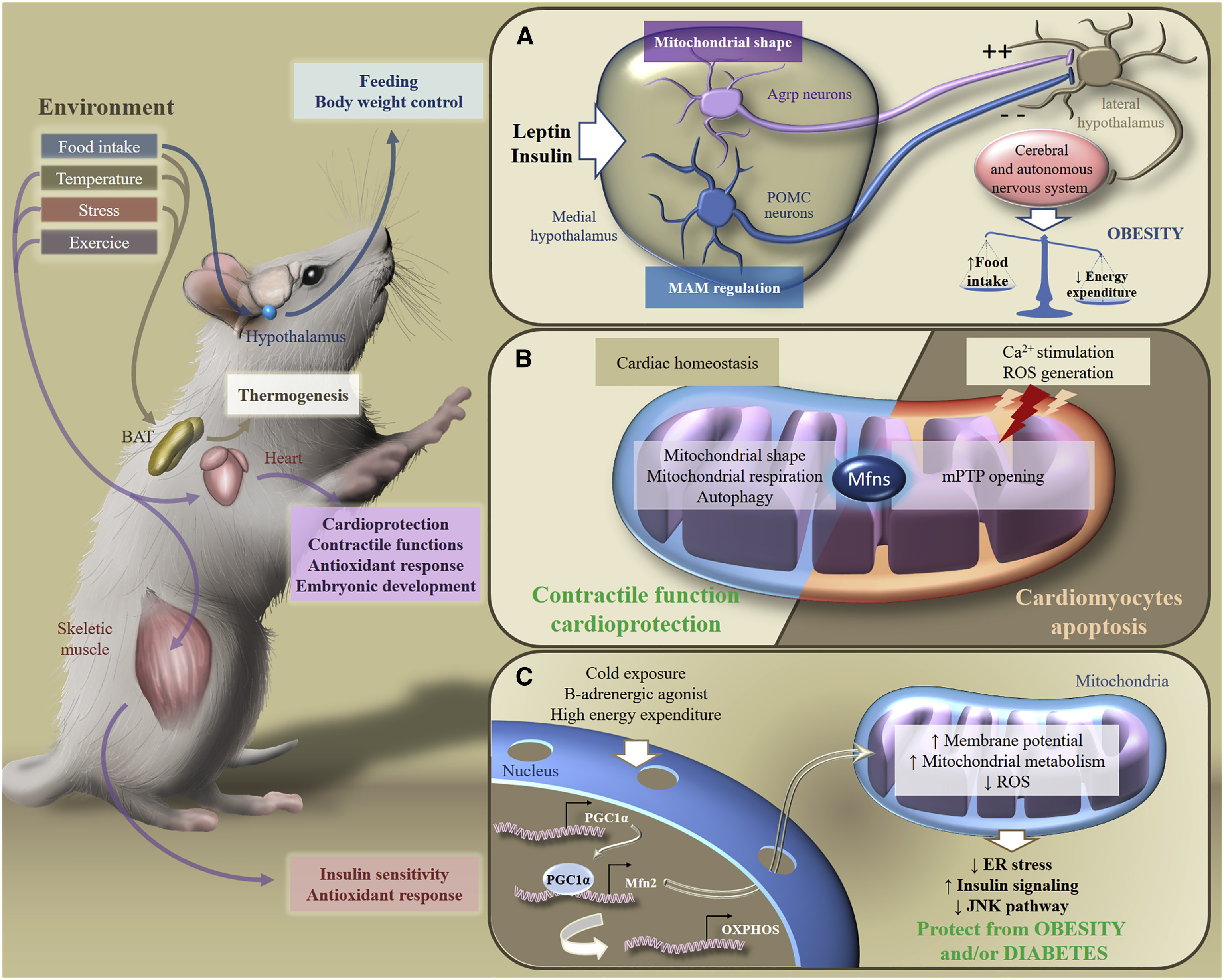
Рис.6. Метаболическая адаптация к стимулам окружающей среды [из 2]
В ответ на экзогенные стимулы Mfns вовлечены в трансдукцию метаболического сигналинга в разных органах, что обеспечивает поддержание гомеостаза энергии всего организма. В частности, в ответ на потребление пищи, изменения температуры, стресс или физические упражнения, бурая жировая ткань, мозг, сердце или скелетные мышцы адаптируют свой метаболизм для контроля питания, веса тела, сократительных функций, антиоксидантного ответа или чувствительности к инсулину.
1. Питание и физические упражнения
Циклы питания Избыток пищи и высокожировая диета (HFD) ингибирует слияние митохондрий в клетках (в некоторых нейронах мозга механизм иной). Незавершенный цикл деления-слияния митохондрий нарушает процессы аутофагии → увеличивается внутриклеточная гетерогенность митохондрий → не происходит селективного удаления митохондрий → накапливаются митохондрии с дисфункцией.
Calorie restriction (fed/fasting cycle) стимулирует биоэнргетическую адаптацию, обеспечивая работу механизмов качества митохондрий.
2. Здоровые мембраны: стеариновая кислота, кардиолипин, фосфатидная кислота
К насыщенным жирным кислотам относится пальмитиновая (С16) и стеариновая (С18). Показано, что употребление стеариновой кислоты (C18:0) стимулирует процесс слияния митохондрий. Действие ее связано с влиянием на митофузины. У мышей диетические добавки стеариновой кислоты могут частично восстанавливать митохондриальную дисфункцию, вызванную мутациями в генах Pink1 или parkin. В нейтрофилах людей, находящихся 2 дня на low-С18:0 диете, митохондрии находятся во фрагментированном состоянии (50% клеток имели фрагментированные МХ, 10 % соединенные МХ). Употребление стеариновой кислоты приводило у них к слиянию митохондрий через 3 часа [8]. Таким образом., стериновая кислота важна для поддержания циклов динамики митохондрий. Больше всего стеариновой кислоты находится в какао-бобах (31-34 %).
Фосфолипиды – основные компоненты мембран органелл. Они также регулируют динамику митохондрий, при этом их влияние различно [9].
Кардиолипин (СL) стимулирует деление митохондрий и слияние внутренних мембран.
Кардиолипин необходим для работы комплекса IV (цитрохром С оксидазы) электронтранспортной цепи. Кардиолипин находится практически исключительно во внутренней мембране митохондрий. С возрастом происходит снижение количества кардиолипина. Есть теория, что потеря функции кардиолипина связана с заменой насыщенных жирных кислот в его молекуле полиненасыщенными жирными кислотами. Для решения этого вопроса необходимо вводить в рацион насыщенные жиры, богатые, в первую очередь, стеариновой жирной кислотой.
Для повышения эффективности доставки насыщенных жирных кислот в мембрану возможно использование переносчиков. Например, – использование насыщенного фосфатидилхолина (дипальмитофосфатидилхолин и дисероилфосфатидилхолин), который, потенциально, сможет доставить насыщенные ЖК прямо в кардиолипин [10]. Холин, как переносчик, легко проходит через цитозоль и поступает в митохондрии.
Фосфатидная кислота (РА) ингибирует митохондриальное деление и стимулирует слияние внешних мембран (рис.7).
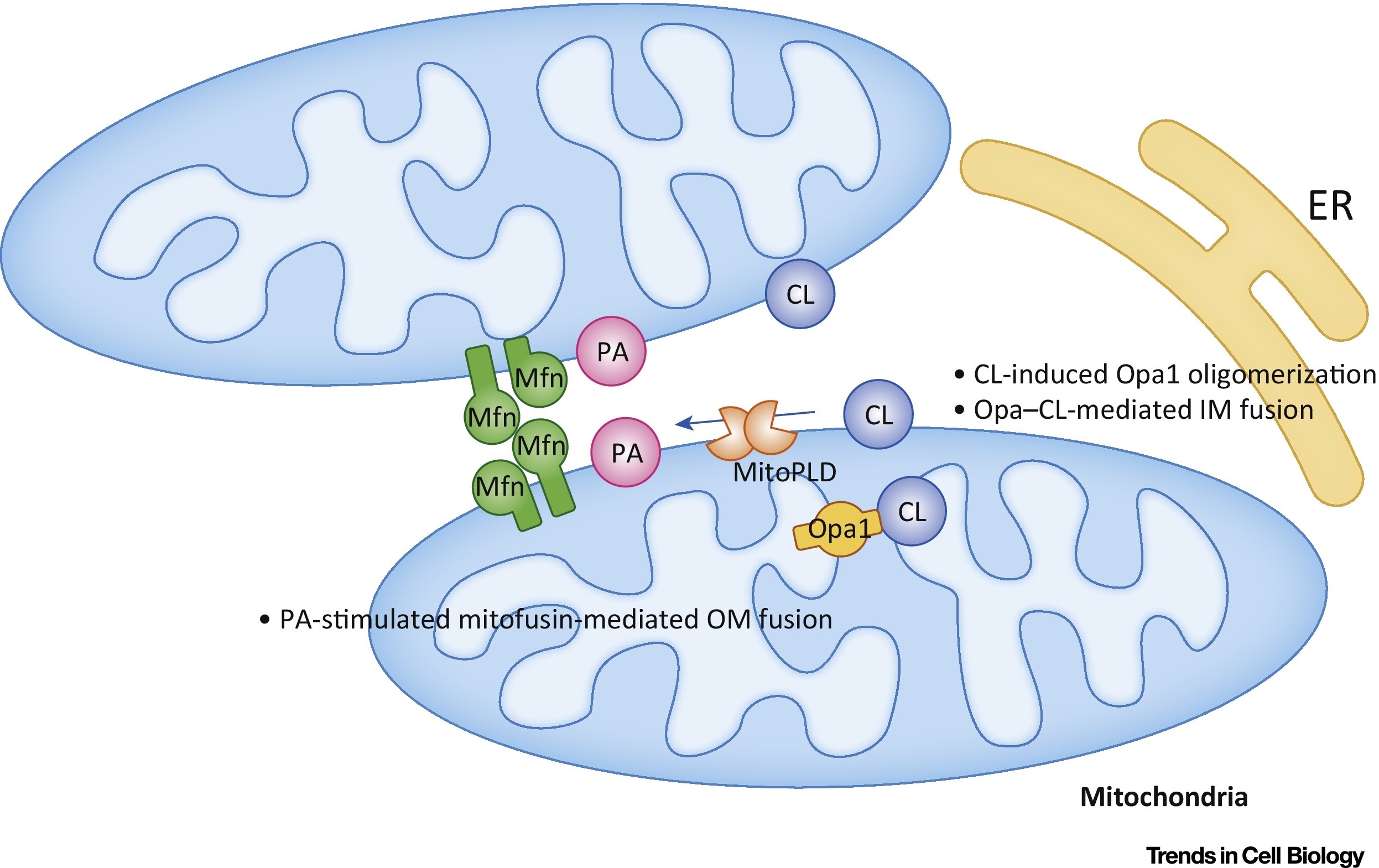
Рис.7 Регулирование слияния митохондрий фосфатидной кислотой (PA) и кардиолипином (CL) [из 9].
Во внешней мембране (ОМ) РА стимулирует митофузин-опосредованное (Mfn) слияние. Во внутренней мембране (IM) CL стимулирует Opa1-опосредованное слияние. Сокращения: ER — эндоплазматический ретикулум; MitoPLD,- митохондрия-локализованная фосфолипаза D.
3. Регуляция экспрессии митофузинов (белков, отвечающих за динамику митохондрий)
Все, о чем мы говорили выше (сalorie restriction, стеариновая кислота, фосфолипиды) действуют, влияя на экспрессию митофузинов.
Помимо этого, есть ряд препаратов, которые опосредованно могут влиять на динамику митохондрий. К ним можно отнести использование метформина.
Наиболее интересным является использование веществ, которые способны напрямую влиять на экспрессию митофузинов. Одним из потенциальных препаратов назван лефлюномид (leflunomide), который был одобрен FDA [5,11]. Он является индуктором экспрессии Mfn1 и Mfn2, а зарегистрирован был как препарат для лечения ревматоидного артрита.
Нарушение динамики митохондрий может быть связано с нарушением экспрессии белков, отвечающих за слияние и деление митохондрий. Помимо этого, нарушение функции этих белков может быть связано (и это и происходит чаще всего) с их мутациями. Тут есть два подхода к рассмотрению причинно-следственных взаимодействий нарушения функции митохондрий.
Ранее считалось, что образ жизни, в том числе переедание, приводит к образованию свободных радикалов, окислительному стрессу, мутациям митохондриального генома и, последовательно, нарушениям функциии митохондрий. Однако, в последнее время есть убедительные доказательства того, что мутации митохондриальной ДНК неизбежны, есть у всех (heteroplasmic DNA point mutations) и связаны с ошибками репликации, а не с оксидативными повреждениями, к которым митохондриальная ДНК довольно устойчива [12]. Уже на этапе оплодотворенной яйцеклетки часть наших митохондрий несут мутации. Со временем они делятся, мутантных митохондрий становится больше, они не могут нормально выполнять свою функцию.
Тут очень кстати можно было бы использовать редактирование генома митохондрий in vivo. Было показано, что для heteroplasmic DNA point mutations у мышей уже был достигнут значительный успех при помощи targeted zinc-finger nucleases (mtZFN) с доставкой при помощи аденовирусного вектора [13].
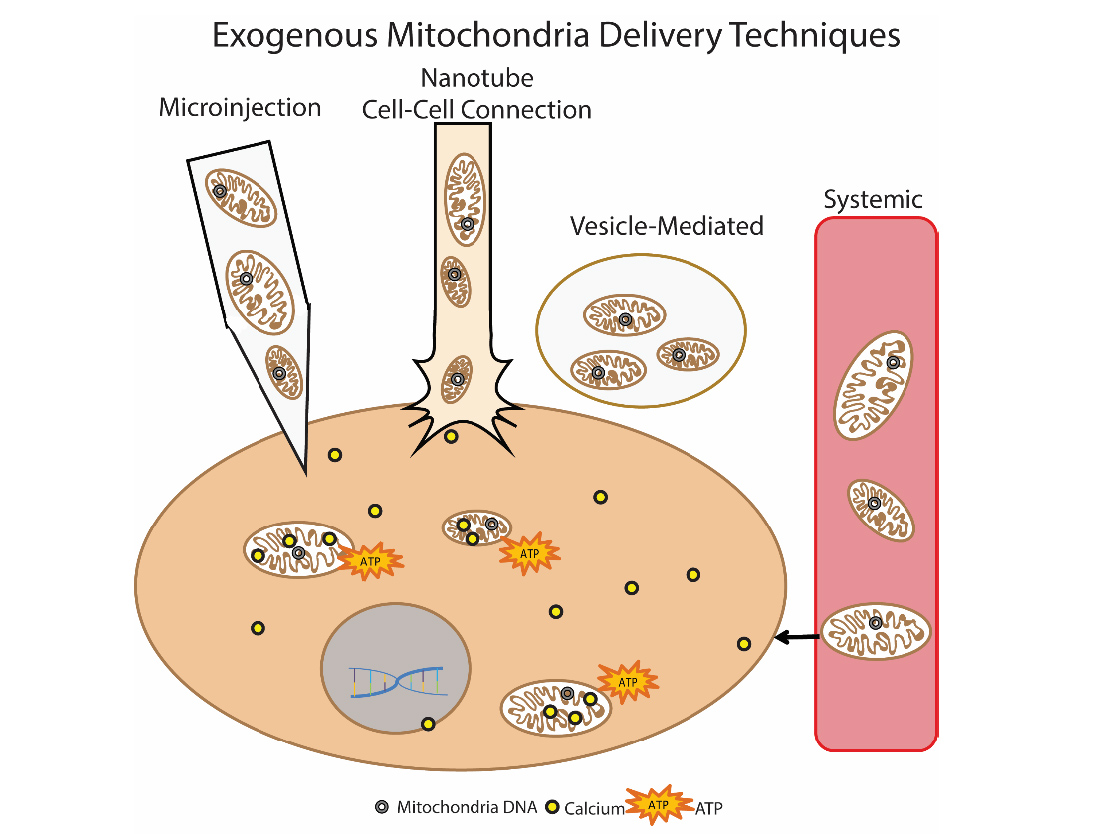
Рис.9 Способы доставки экзогенных митохондрий в клетку
Строение и функции митохондрий представляют собой довольно сложный вопрос. Наличие органеллы характерно почти для всех ядерных организмов – как для автотрофов (растений, способных к фотосинтезу), так и для гетеротрофов, которыми являются почти все животные, некоторые растения и грибы.
Что такое митохондрии
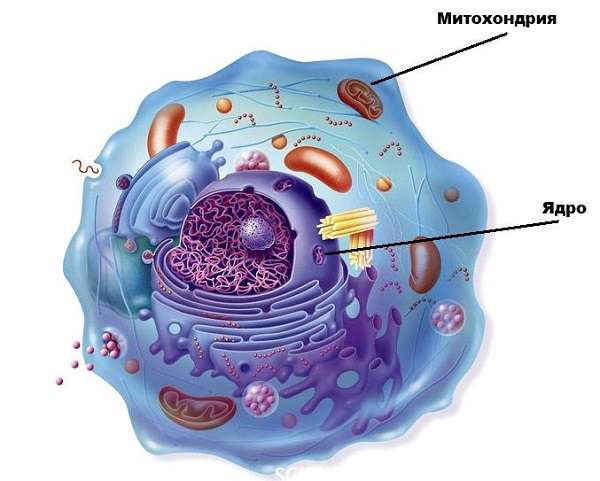
Особый случай – половые клетки. В сперматозоидах присутствует всего лишь одна спиральная органелла, в то время как женских гаметах содержится в сотни тысяч больше митохондрий. В клетке органоиды не зафиксированы в одном месте, а могут передвигаться по цитоплазме, совмещаться друг с другом. Их размер составляет 0,5 мкм, длина может достигать 60 мкм, в то время как минимальный показатель – 7 мкм.
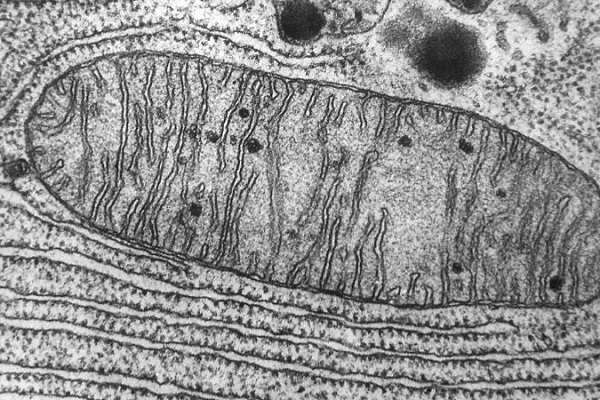
Только объемное изображение позволит выяснить точное клеточное строение и понять, идет речь о 2-5 отдельных органоидах или же об одной, имеющей сложную форму митохондрии.
Особенности строения
Оболочка митохондрии состоит из двух слоев: наружного и внутреннего. Последний включает в себя различные выросты и складки, которые имеют листовидную и трубчатую форму.
Каждая мембрана имеет особенный химический состав, определенное количество тех или иных ферментов и конкретное предназначение. Наружную оболочку от внутренней отделяет межмембранное пространство толщиной 10-20 нм.
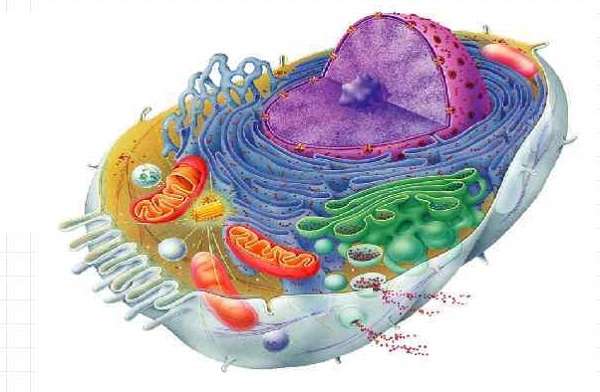
Весьма наглядно выглядит строение органеллы на рисунке с подписями.
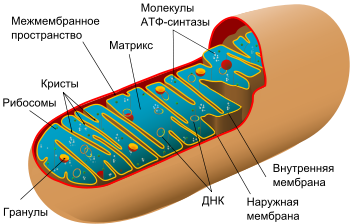
Схема строения митохондрии
Посмотрев на схему строения, можно сделать следующее описание. Вязкое пространство внутри митохондрии называется матриксом. Его состав создает благоприятную среду для протекания в ней необходимых химических процессов. В его составе присутствуют микроскопические гранулы, которые содействуют реакциям и биохимическим процессам (например, накапливают ионы гликогена и других веществ).
В матриксе находятся ДНК, коферменты, рибосомы, т-РНК, неорганические ионы. На поверхности внутреннего слоя оболочки располагаются АТФ-синтаза и цитохромы. Ферменты способствуют таким процессам, как цикл Кребса (ЦТК), окислительное фосфорилирование и т. д.
Таким образом, главная задача органоида выполняется как матриксом, так и внутренней стороной оболочки.
Функции митохондрий
- выработка энергии: в них осуществляются окислительные процессы с последующим выделением молекул АТФ,
- хранение генетической информации,
- участие в синтезе гормонов, аминокислот и других структур.
Процесс окисления и выработки энергии проходят в несколько стадий:
- На первом этапе (подготовительном) сложные органические соединения разделяются на простые. Кратко это можно изобразить на схеме расщепления органических веществ.
![]()
- Вторая стадия, где отсутствует кислород, заключается в окислении углеводов без участия такового (анаэробное окисление, гликолиз). Главным субстратом на данном этапе служит глюкоза. В результате гликолиза происходит неполное ее окисление, что дает всего две молекулы АТФ.
- Следующий этап – кислородный, осуществляется в самих митохондриях: в процессе расщепления молочной кислоты и потребления кислорода выделяется углекислый газ, и синтезируется большое количество энергии.
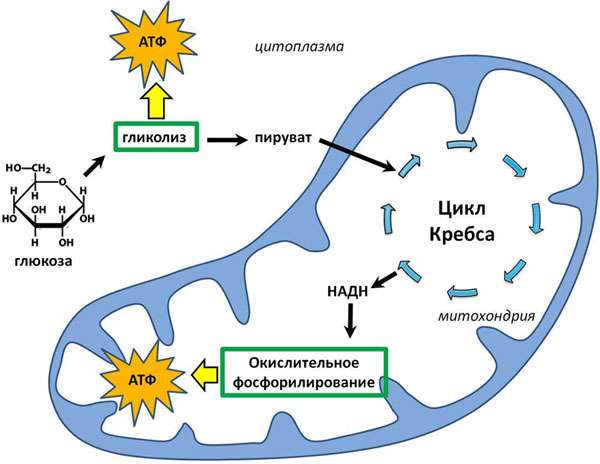
Схематичный рисунок синтеза АТФ
Стоит отметить: в результате цикла Кребса (цикл лимонной кислоты) не образуются молекулы АТФ, происходит окисление молекул и выделение углекислого газа. Это промежуточный этап между гликолизом и электронтранспортной цепью.
От чего зависит число митохондрий в клетке
Превалирующее число органоидов скапливается рядом с теми участками клетки, где возникает необходимость в энергетических ресурсах. В частности, большое количество органелл собирается в зоне нахождения миофибрилл, которые являются частью мышечных клеток, обеспечивающих их сокращение.
В мужских половых клетках структуры локализуются вокруг оси жгутика – предполагается, что потребность в АТФ обусловлена постоянным движением хвоста гаметы. Точно так же выглядит расположение митохондрий у простейших, которые для передвижения используют специальные реснички – органеллы скапливаются под мембраной у их основания.
Что касается нервных клеток, то локализация митохондрий наблюдается вблизи синапсов, через которые передаются сигналы нервной системы. В клетках, синтезирующих белки, органеллы скапливаются в зонах эргастоплазмы – они поставляют энергию, которая обеспечивает данный процесс.
Кто открыл митохондрии
Автором данного события стал ученый из Германии Рихард Альтман. Произошло это в 1890-1894 годах, в это же время немецкий анатом и гистолог составил подробное описание органоида.
Свое название клеточная структура обрела в 1897-1898 годах благодаря К. Бренду. Связь процессов клеточного дыхания с митохондриями сумел доказать Отто Вагбург в 1920 году.
Заключение
Митохондрии являются важнейшей составляющей живой клетки, выступая в роли энергетической станции, которая производит молекулы АТФ, обеспечивая тем самым процессы клеточной жизнедеятельности.
Работа митохондрий основана на окислении органических соединений, в результате чего происходит генерация энергетического потенциала.
Читайте также:



