Нарушение нервно мышечной передачи что это такое

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Нарушение нервно-мышечной передачи происходит вследствие дефектов постсинаптических рецепторов (например, при миастении) или пресинаптического высвобождения ацетилхолина (например, ботулизм), а также распада ацетилхолина в синаптической щели (действие лекарственных или нейротоксических препаратов). Типичны флюктуации степени мышечной слабости и утомляемости.
Код по МКБ-10
Болезни, при которых происходит нарушение нервно-мышечной передачи
Синдром Итона-Ламберта развивается при нарушении высвобождения ацетилхолина из пресинаптических нервных окончаний.
Ботулизм - последствие нарушения высвобождения ацетилхолина пресинаптической терминалью из-за необратимого связывания с нею токсина Clostridium botulinum. Среди симптомов выраженная слабость вплоть до нарушений дыхания и признаки увеличения симпатического тонуса из-за блокирования парасимпатической активности: мидриаз, сухость во рту, запор, задержка мочи, тахикардия, чего не бывает при миастении. На ЭМГ умеренное снижение ответа на низкочастотное (2-3 в 1 секунду) раздражение нерва и рост ответа при увеличении частоты раздражения (50 имп/с) или после кратковременной (10 с) мышечной работы.
Лекарства или токсические вещества могут нарушать функцию нервно-мышечного синапса. Холинергические препараты, фосфорорганические инсектициды и большинство нервнопаралитических газов блокируют нервно-мышечную передачу, деполяризуя постсинаптическую мембрану из-за избыточного действия ацетилхолина на ее рецепторы. Результат: миоз, бронхорея, миастеноподобная слабость. Аминогликозиды и полипептидные антибиотики уменьшают пресинаптическое высвобождение ацетилхолина и чувствительность к нему постсинаптической мембраны. На фоне латентной миастении высокие концентрации этих антибиотиков в сыворотке усугубляют нервно-мышечный блок.
Продолжительное лечение пеницилламином может сопровождаться обратимым синдромом, который клинически и по ЭМГ напоминает миастению. Избыток магния (уровень в крови 8-9 мг/дл) чреват развитием выраженной слабости, что также напоминает миастенический синдром. Лечение включает устранение токсического воздействия, интенсивное наблюдение и при необходимости ИВЛ. Для уменьшения избыточной бронхиальной секреции назначают атропин 0,4-0,6 мг внутрь 3 раза/ день. При отравлении фосфорорганическими инсектицидами или нервно-паралитическим газом могут потребоваться более высокие дозы (2-4 мг в/в за 5 мин).
Синдром ригидного человека - это внезапное появление прогрессирующей ригидности мышц туловища и живота, в меньшей степени - конечностей. Других отклонений, в том числе и на ЭМГ, нет. Этот аутоиммунный синдром развивается как паранеопластический (чаще при раке груди, легких, прямой кишки и при болезни Ходжкина). Аутоантитела против нескольких белков, связанных с ГАМК глициновыми синапсами, воздействуют преимущественно на ингибиторные нейроны передних рогов спинного мозга. Лечение симптоматическое. Диазепам существенно уменьшает мышечную ригидность. Результаты плазмафереза противоречивы.
Синдром Исаакса (синонимы: нейромиотония, синдром броненосца) проявляется, главным образом, жалобами на работу конечностей. Появляются миокимии - мышечные фасцикуляции, выглядящие как конгломерат шевелящихся под кожей червей. Другие жалобы: карпопедальные спазмы, интермиттирующие крампи, повышенное потоотделение и псевдомиотония (нарушение расслабления после сильного мышечного сокращения, но без типичного для истинной миотонии нарастания - убывания на ЭМГ). Первоначально поражает периферический нерв, поскольку кураре снимает жалобы, а под общим наркозом симптомы сохраняются. Причина неизвестна. Карбамазепин или фенитоин уменьшают жалобы.
Нервно-мышечные соединения являются одним из самых уязвимых структур периферического нейромоторного аппарата. Синаптический аппарат мышцы служит местом приложения всех миорелаксантов, применяемых в анестезиологической практике.
Поражение нервно-мышечной передачи служит причиной тяжелых мышечных расстройств при воздействии ядов различных насекомых и змей, интоксикации различными медикаментами, в частности антибиотиками.
Блокада выделения передатчика возбуждения с нерва на мышцу является причиной тяжелых двигательных нарушений при ботулинической интоксикации, некоторых формах карциноматозных нейромиопатий. Патология синаптического аппарата мышц является причиной развития тяжелого нервно-мышечного страдания — миастении.
В течение последних лет изучению физиологии и патофизиологии нервно-мышечной передачи посвящено огромное количество исследований.
Подробно изучены механизмы образования, хранения, выделения передатчика возбуждения — ацетилхолина (АХ). Тончайшими исследованиями установлена природа рецептора ацетилхолина (холинорецептора) постсинаптической мембраны мышц. Уделено большое внимание изучению механизмов патологии нервно-мышечной передачи при различных заболеваниях человека.
Велико также число исследований, посвященных изучению клинической картины нервно-мышечных заболеваний, связанных с нарушениями функционирования нервно-мышечной передачи. Результаты этих исследований приводятся в соответствующих разделах данной главы. Здесь же нам хотелось подчеркнуть, что ни в одной области клинической неврологии внедрение электрофизиологических методов не принесло столь очевидного успеха, как в изучении синаптических болезней мышц.
Благодаря разработке и широкому внедрению новых методов изучения нервно-мышечной передачи удалось выделить, а затем и клинически дифференцировать различные формы заболеваний, ранее относимых к миастении. В настоящее время клиническая диагностика миастении и ряда миастенических синдромов стала рутинным делом, не требующим особой квалификации. Вместе с тем до настоящего времени остается неясным вопрос о нозологическом единстве различных клинических форм миастении.
Есть основание полагать, что миастения — не единая клиническая форма, а группа заболеваний с различным патогенезом. Кроме того, продолжает выделяться все большее число миастенических синдромов, обусловленных нарушениями нервно-мышечной передачи, отягощающих или сопровождающих поражения других уровней нейромоторного аппарата, а иногда сочетающихся с поражениями мозжечковых и пирамидных систем.
Интерес к проблеме синаптических болезней обусловлен и другим обстоятельством: значительная роль в механизме их формирования принадлежит механизму нарушения иммунитета — аутоиммунным и иммуно-аллергическим расстройствам.
Это делает миастению и ряд миастенических синдромов удобной моделью для изучения иммунодефицитных состояний у человека. Кроме того, изучение этого механизма миастении открывает новые успешные пути терапии миастенической болезни и миастенических синдромов с помощью кортикостероидных препаратов и иммунодепрессантов.

Особой формой миастенических расстройств, обусловленных поражением терминальных ветвлений двигательных нервов и грубыми расстройствами нервно-мышечной передачи, является описанная нами в 1979 г. терминальная полиневропатия с миастеническим синдромом. К настоящему времени мы наблюдаем в течение 12 лет 13 больных с этим симптомокомплексом (12 мужчин и 1 женщина). У 2 больных заболевание началось в возрасте старше 30 лет,…
Прежде всего при данном заболевании наблюдаются типичные ЭМГ-ские изменения, свидетельствующие о грубых изменениях нервно-мышечной передачи, снижение амплитуды вызванного ПД мышцы, грубый блок нервно-мышечной передачи при стимуляции редкими частотами (1 и 3 имп/с) и тетанизации мышцы (частотой 50 имп/с). Во всех случаях отмечено изменение резидуальной латенции, свидетельствующее о замедлении скорости проведения возбуждения по самым дистальным претерминальным…

Патологическая утомляемость мышц является нередким симптомом всех форм полимиозита, однако у ряда больных наблюдали сочетание выраженных мышечных расстройств полимиозитического характера с несомненными клиническими и электрофизиологическими признаками, свидетельствующими о вовлечении в процесс синаптических структур, по характеру близкому патологическому процессу, наблюдаемому при миастении. Уже в конце XIX века Е. Wagner (1863, 1887) описал сочетание клиники полимиозита и…
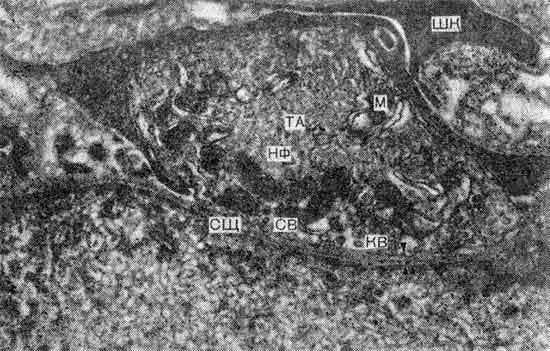
Частично результаты обследования больных данной группы опубликованы в 1974 г. К настоящему времени под нашим наблюдением находятся 12 больных с этим клиническим синдромом. Все больные — девочки. Начало заболевания отмечается в возрасте от 10 до 15 лет. При обследовании больных обращают на себя внимание выраженная мышечная гипотония, снижение, а иногда и выпадение сухожильных рефлексов. Лишь…

В связи с неоднородностью механизмов развития нарушений нервно-мышечной передачи единого лечения миастенических синдромов нет. Воздействия на состояние нервно-мышечной передачи. При большинстве форм миастенических синдромов в определенной степени оказываются эффективными антихолинэстеразные препараты — прозерин, оксазил, калимин и их аналоги (смотрите Лечение миастении). Принципиально иной механизм действия другого препарата — гуанидина хлорида, способствующего выделению ацетилхолина из терминалей…

При обсуждении миастенического синдрома типа Ламберта — Итона следует отметить условность его названия, так как тщательное изучение клиники и механизмов развития данного заболевания позволило считать его неоднородным клиническим синдромом, обусловленным не только, как это предполагалось ранее, специфическим влиянием ракового процесса на нервно-мышечную передачу, но и типом реагирования нервно-мышечного синапса на целый ряд вредностей. Первыми миастенический…

Парестезии рук и ног наблюдаются у 50% больных. Все мужчины с синдромом Ламберта — Итона страдали импотенцией. Иллюстрациями к клинике миастенического синдрома Ламберта — Итона, связанного с бронхогенной мелкоклеточной карциномой, служат следующие наблюдения. Больной С., 43 лет, поступил в октябре 1975 г. с жалобами на слабость и утомляемость в мышцах ног и рук, мышцах туловища,…
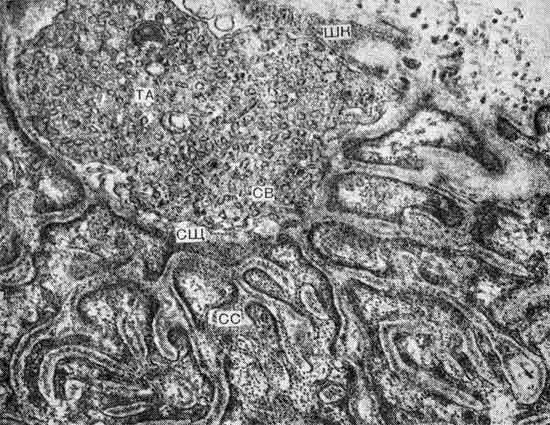
При анализе патогенеза данного клинического синдрома обращает внимание относительная ясность механизмов, обусловливающих двигательные расстройства на синаптическом уровне, и полное отсутствие представления о причинах формирования синаптического дефекта. Существенное место в раскрытии механизмов синаптических нарушений принадлежит изложенным выше результатам ЭМГ-ского исследования и результатам изучения ультраструктуры нервно-мышечных соединений. Электрофизиологическое изучение больных с миастеническим синдромом типа Ламберта — Итона…

Потенциалы действия двигательных единиц и спонтанная активность мышечных волокон. Исследование ПД ДЕ с помощью концентрических игольчатых электродов выявляет снижение их длительности и амплитуды и увеличение числа полифазных потенциалов. Аналогичные данные получены и другими исследователями [Oh S., 1972]. Уменьшение длительности ПД ДЕ отмечено также Е. Lambert и D. Elmqvist (1972), W. Brown и R. Johns (1974).…

Патологическая утомляемость миастенического типа нечасто встречается при полиневропатиях, однако подобные наблюдения описаны в литературе. Большинство из них выявлены при ЭМГ-ском обследовании больных, но в ряде случаев патологическая утомляемость выявлялась и при клиническом обследовании (Гехт Б. М., 1964; Смирнов Ю. К., 1969; Ashby D., Bulmer Е., 1950; Simpson J., Lenman J., 1959). Динамический миастенический компонент заболевания…
1. Пресинаптические нарушения. Рассматриваются только избранные расстройства. Миастенический синдром Итона-Ламберта (Eaton-Lambert), имеющий более скрытые проявления, в настоящем разделе не обсуждается.
Ботулизм вызывается токсином, продуцируемым Clostridium botulinum. Это заболевание часто проявляется слабостью глазных мышц с последующей дизартрией, слабостью дыхательных мышц и мышц конечностей. Этот диагноз может быть подтвержден сведениями о приеме инфицированных пищевых продуктов. Нарастание ответов наблюдается при ритмической стимуляции нервов высокой частотой. Проводимость нервов обычно не изменена. Интоксикация чаще всего развивается у тех младенцев и маленьких детей, чей желудочно-кишечный тракт мог быть колонизирован С. botulinum,
Клещевой паралич является редким заболеванием, вызываемым Dermacentor andersonL Неврологические расстройства начинаются с затруднений ходьбы и нарушений равновесия, затем обнаруживаются восходящий вялый паралич и арефлексия. Могут быть заинтересованы глазные и бульбарные мышцы. ЭМГ выявляет снижение амплитуды мышечных потенциалов действия и нарастание ответов на стимуляцию высокой частоты, особенно в острой стадии. Может наблюдаться некоторое замедление проведения импульсов по двигательным и сенсорным нервам. Рекомендуется тщательный осмотр волосистой части головы и лобковой области для обнаружения возбудителя.

Отравление органическими фосфатами вызывает слабость преимущественно проксимальных отделов мускулатуры ног. Может наблюдаться быстрая утомляемость и слабость экстраокулярных и бульбарных мышц. Часто присутствуют мускари-новые симптомы (миоз, усиление саливации, генерализованные фасцикуляции). ЭМГ обычно нормальная. Ритмическая стимуляция нервов может выявить увеличение ответов при высокой частоте стимуляции.
Медикаментозная миастения. Некоторые медикаменты оказывают побочное действие на нервно-мышечную передачу. Слабость обычно возникает в мускулатуре проксимальных отделов конечностей в большей степени, чем в окулярных или бульбарных мышцах. Медикаментозно-обусловленная миастения может возникать при приеме канамицина, гентамицина, прокаинамида, примидона, гидантоинов.
2. Постсинаптические нарушения: миастения. У взрослых людей миастения с аутоиммунными нарушениями обычно начинается с непостоянной и асимметричной слабости экстраокулярных мышц и мышц век, а затем проявляется слабостью бульбарных мышц и мышц конечностей. Обычно клинические проявления одно- или двусторонние и включают птоз, дизартрию, дисфагию, слабость проксимальных отделов мускулатуры, дисфункцию дыхательных мышц. При повторении движений также наблюдается утомляемость мышц. Мышечный тонус, объем мышц, рефлексы, чувствительная сфера без отклонений. Диагноз основывается на результатах клинического обследования, результатах теста с эдрофонием (тензилоном), ЭМГ одиночных волокон, ритмической стимуляции и определения антител к рецепторам сывороточного ацетилхолина.
1. Полимиозит/дерматомиозит (ПМ/ДМ). Острые воспалительные миопатии обычно начинаются с симметричной слабости в проксимальной мускулатуре, включая мышцы плечевого и бедренного поясов. Тонус и объем мышц, рефлексы мышечного натяжения в норме. Чувствительные расстройства отсутствуют. Полимиозит обычно протекает без болей. Если типичные кожные поражения (эритематозная сыпь в периорбитальных областях, области лба или грудной клетки и особенно эритематозная сыпь над суставами и на разгибательных поверхностях) наблюдаются в сочетании со слабостью, следует рассматривать возможность развития дерматомиозита. Сывороточная креатинкиназа, альдолаза, лактатдегидрогеназа и аспартатаминотрансфераза часто повышены. СОЭ обычно высокая. СПНВ и амплитуды потенциалов нормальные. Игольчатая ЭМГ обнаруживает увеличение количества спонтанных потенциалов, таких как фибрилляции, положительные острые волны, высокочастотные разряды, малые полифазные непродолжительные низкоамплитудные потенциалы моторных единиц. Мышечная биопсия выявляет воспалительные изменения, распространяющиеся на перимизиум и эндомизиум, сочетающиеся с некрозом мышечных волокон и регенерацией мышечных волокон различной степени.
2. Острый инфекционный миозит. Вирусный миозит часто сопровождается миалгией и слабостью. В тяжелых случаях, как правило, наблюдается генерализованная слабость. Паразитарные инвазии и ВИЧ-инфекция могут сопровождаться слабостью проксимальной мускулатуры.
3. Острая токсическая миопатия. Острая алкогольная миопатия проявляется генерализованной симметричной слабостью. Гипермагниемия также вызывает острую генерализованную слабость, особенно у пациентов, страдающих алкоголизмом и получающих избыток магния с пищей. Амиодарон и L-триптофан могут вызывать острую миопатию. L-триптофан может быть причиной миалгии, слабости и эозинофилии.
4. Острый периодический паралич — это группа первичных мышечных заболеваний, которые связаны с нормальным (нормокалиемический вариант), повышенным (гиперкалиемический вариант) или низким уровнем калия (гипокалиемический вариант). Гиперкалиемический периодический паралич часто возникает на фоне напряжения или богатого углеводами питания после интенсивных нагрузок. Гиперкалиемический периодический паралич проявляется генерализованной слабостью при сохранности функций черепных нервов и дыхательных мышц. Во время приступов рефлексы мышечного натяжения отсутствуют. Диагноз можно заподозрить при наличии указаний на перемежающуюся слабость, вызываемую нагрузкой или богатой углеводами диетой, семейный анамнез, и отклонения содержания сывороточного калия в момент приступа. ЭМГ во время приступа нарушений может не выявить. Мышечная биопсия обнаруживает вакуолярную миопатию, особенно при получении препаратов в момент приступа. При подозрительных случаях с нормальным уровнем калия провокационные тесты могут вызывать развитие приступа.
5. Острая стероидная тетраплегическая миопатия часто наблюдается у пациентов, которым при астматическом статусе назначают высокие дозы стероидов и препараты, блокирующие нервно-мышечную передачу. После купирования астматического статуса пациенты испытывают слабость и нуждаются в механической вентиляции легких. ЭМГ обнаруживает признаки нейрогенных и миопатических нарушений. Проведение импульсов по нервным волокнам не страдает. Мышечная биопсия с электронной микроскопией обычно обнаруживает утрату миозиновых филаментов.
Диагноз строится на выявлении мышечной слабости и определении вовлечения верхнего или нижнего мотонейронов. После исключения поражения верхнего мотонейрона необходимо определение уровня поражения нижнего мотонейрона в соответствии с алгоритмом, представленным на рисунке. Часто требуются лабораторные исследования. Наиболее информативным тестом является ЭМГ. Для подтверждения/исключения ПМ/ДМ рекомендуется биопсия мышц. При невропатиях на фоне васкулита показана биопсия нервов.
Пациенты с острой слабостью нервно-мышечного типа нуждаются в госпитализации, особенно при острых параличах и подозрении на синдром Гийена-Барре. При вовлечении бульбарных и дыхательных мышц пациенты нуждаются в переводе в палату интенсивной терапии. Пациенты с другими нервно-мышечными заболеваниями могут обследоваться и лечиться в амбулаторных условиях. В большинстве случаев помощь может быть оказана врачом общей практики, однако для уточнения диагноза требуется консультация невролога.
Л. Г. Энгел (A. G. Engel)
Нарушения нервно-мышечной трансмиссии могут быть генетически унаследованными или приобретенными. Они, как правило, сопровождаются выраженной мышечной слабостью и быстрой утомляемостью при выполнении того или иного мышечного действия. При таких заболеваниях генерация в нервных окончаниях нервных импульсов достаточной амплитуды все же происходит, однако распространяться далее потенциал действия мышечного волокна не может в силу влияния одного или нескольких специфических механизмов.
Миастения
Миастения (myasthenia gravis) - это приобретенное аутоиммунное заболевание, характеризующееся недостаточностью ацетилхолиновых рецепторов (АХР) на моторной концевой пластинке нерва. Число ацетилхолиновых (АХ) квантов, высвобождаемых из нервного терминала при возникновении в нем нервного импульса, и вероятность высвобождения АХ по квантам, по-видимому, не изменены, однако число рецепторов, способных захватить этот АХ, уменьшено, в результате чего снижается амплитуда потенциала на конечной нервной пластинке. Ответная реакция на одиночную кванту АХ, высвобождаемого нервным окончанием в покое, что является как бы миниатюрным потенциалом нервного окончания, также снижена. В одних случаях поражаются только глазодвигательные мышцы, в других - заболевание приобретает генерализованный характер. Выраженность симптомов заболевания уменьшается после отдыха или приема антихолинэстеразных препаратов. Циркулирующие в крови антитела к АХР обнаруживаются у 80-90% больных, а иммунные комплексы (IgG и компоненты комплимента), как правило, откладываются на постсинаптической мембране моторной концевой пластинки.
Заболевание встречается с частотой от 2 до 5 случаев в год на 1 млн населения, а распространенность его - 13-64 случая на 1 млн. Болеют чаще женщины, чем мужчины (соотношение 6:4). Заболевание может начинаться в любом возрасте, однако женщины, как правило, заболевают в 3-м десятилетии жизни, а мужчины - в 6-7-м десятилетиях. Выраженность симптомов может колебаться ежечасно, ежедневно, еженедельно и т. д. Симптоматика ухудшается при физическом усилии, при экстремальных температурах, под влиянием вирусной или иной инфекции, при менструациях, при эмоциональном возбуждении. Поражение глазодвигательных мышц обычно двустороннее, асимметричное и, как правило, сочетается с птозом или диплопией. Вовлеченность в патологический процесс других мышц, иннервируемых черепными нервами, приводит к потере лицевой мимики, выворачиванию губ, превращению улыбки в подобие гримасы, отвисанию нижней челюсти, носовой регургитации жидкостей, возникновению удушья при приеме пищи и жидкостей, к появлению смазанной, скудной и гнусавой речи. Сверхбыстрая утомляемость мышц конечностей приводит к затруднениям при расчесывании волос, повторном подъеме тех или иных предметов, при подъеме по лестнице, ходьбе или беге. В зависимости от выраженности заболевания может присоединяться одышка при умеренной или легчайшей нагрузке или даже в покое. Эту патологическую мышечную утомляемость можно выявить при простых пробах со счетом: просят больного смотреть вверх, не закрывая глаз в течение 1 мин, при этом громко считают от одного до ста; также в течение 1 мин просят поднять руки до уровня плеч и держать их горизонтально или повторно глубоко сгибать ногу в коленном суставе. Глубокие сухожильные рефлексы нормальные даже в ослабленных мышцах. Примерно у 15% больных отмечают атрофию жевательных, височных, лицевых мышц, мышц языка и реже - других мышц.
В течение первого месяца после начала заболевания нарушения лишь со стороны глазодвигательных мышц появляются у 40% заболевших, генерализованные нарушения - у 40%, поражение только конечностей - у 10%, в патологический процесс оказывается вовлеченной только бульбарная мускулатура или бульбарная и глазодвигательная - у 10%. По мере прогрессирования заболевания от более легкого к более тяжелому слабость мышц распространяется от глазодвигательных к лицевым мышцам, к нижним бульбарным мышцам, к мышцам туловища и конечностей (последовательность поражения мышц может быть любой). Проксимальные мышцы конечностей поражаются в большей степени, чем дистальные, а в более далеко зашедших стадиях заболевания мышечная слабость приобретает универсальный характер. К концу первого года глазодвигательная мускулатура поражается практически у всех больных. Симптоматика остается только окулярной не более чем у 16% больных. Почти у 90% больных, у которых заболевание приобретает генерализованный характер, это происходит в течение первого года заболевания. Особенно быстро прогрессирует заболевание в течение первых трех лет, и более половины смертей, связанных с заболеванием, приходится именно на этот период. Могут наблюдаться, конечно, и спонтанные ремиссии, но они длятся от нескольких недель до года; более длительные ремиссии очень редки.
У 60% больных с миастенией отмечают гиперплазию тимуса, а у 10-15% больных развивается тимома. У небольшого числа больных с тимомой возникают также миокардит и/или гигантоклеточный миозит. Примерно у 10% больных миастения сочетается с другими аутоиммунными заболеваниями, такими, как гипертиреоз, полимиозит, системная красная волчанка, синдром Шегрена, ревматоидный артрит, неспецифический язвенный колит, пузырчатка, саркоидоз, пернициозная анемия и миастенический синдром Ламберта - Итона.
Классификация миастений, предложенная Osserman, основана на характере распространения заболевания по телу человека и на степени выраженности симптоматики.
Группа 1 - окулярные симптомы.
Группа 2А - нерезко выраженные генерализованные симптомы.
Группа 2Б - умеренно выраженные генерализованные симптомы.
Группа 3 - острая фульминантная симптоматика.
Группа 4 - поздние резко выраженные симптомы.
Следующая альтернативная классификация соотнесена с тимомой и возрастом, когда началось заболевание:
Тип 1, с тимомой: заболевание обычно резко выражено, титр антител к ацетилхолиновым рецепторам (АХР) в крови высок. Связи с полом или с антигенами системы HLA нет.
Тип 2, без тимомы, начало заболевания в возрасте до 40 лет: титр антител к АХР в крови носит промежуточный характер. Среди больных преобладают женщины, отмечена связь с определенными группами системы HLA-HLA-Al; HLA-B8 и HLA-DRw3 (HLA-B12 - в Японии).
Тип 3, без тимомы, начало заболевания после 40 лет: титр антител к АХР в крови невысок. Среди заболевших преобладают мужчины, повышена связь с группами системы антигенов HLA- HLA-A3, HLA-B7 и HLA-DRw2 (HLA-АЮ - в Японии).
Антитела к поперечно-полосатой мускулатуре обнаруживают в 90,5 и 45% соответственно в типах 1, 2, 3. Связь с другими аутоиммунными заболеваниями наибольшая в типе 3, наименьшая - в типе 1.
Циркулирующие антитела к АХР обнаруживают у большинства новорожденных от матерей, страдающих миастенией, но только у 12% из них развивается болезнь. Признаки болезни проявляются уже в первые несколько часов после рождения. Это затруднения с кормлением ребенка, генерализованная мышечная слабость, расстройства дыхания, слабый крик ребенка, слабость лицевой мускулатуры, птоз. Связи между выраженностью заболевания у матери и у ребенка нет. Заболевание вызвано пассивной передачей АХР-антител или адоптивной (путем пассивного восприятия) передачей иммуноцитов от матери к младенцу или, может быть, в результате повреждения АХР у плода материнскими антителами, вызывающими временную ответную реакцию у новорожденного.
Аутоиммунный характер миастении и патогенетическая роль антител к АХР была установлена целым рядом точных исследований:
1) у животных, иммунизированных АХР, развивался синдром, напоминающий миастению;
2) у большинства больных выявлены циркулирующие АХР-антитела;
3) установлена пассивная передача от человека к мыши с IgG нескольких характерных признаков заболевания;
4) определена локализация иммунных комплексов на постсинаптической мембране;
5) обнаружен благоприятный лечебный эффект плазмафереза.
Антитела, связанные с концевыми пластинками АХР, вызывают АХР-недостаточность двумя основными механизмами - разрушением комплемента и путем модуляции. Фиксация комплемента и активация литической фазы комплементарной реакции приводит к фокальной деструкции складок синапса и к потере АХР в синаптическое пространство. Модуляция состоит из ускоренной интернали-зации и деструкции АХР, перекрестно соединенных с антителами. Число АХР уменьшается тогда, когда синтез и проникновение (погружение) в мембрану новых АХР не успевает за потерей АХР. И далее - лизис синаптических складок с помощью комплемента уменьшает поверхность мембраны, в которую могут погрузиться новые АХР, что еще более в последующем увеличивает дефицит АХР как с помощью модуляции, так и посредством комплемента. Некоторые антитела к АХР могут влиять на их функцию за счет блокады связывания ацетилхолина с АХР. Блокирующие антитела составляют лишь небольшую фракцию ото всех АХР-антител.
Тот факт, что миастении часто сопутствует патология тимуса, а также благоприятный эффект удаления последнего, свидетельствует о его участии в патогенезе миастении. Было высказано предположение, что сенсибилизация лимфоцитов к АХР происходит именно в тимусе и что антигенспецифические Т-хелперные клетки соответственно продуцируются и экспортируются из тимуса в другие антителопродуцирующие зоны организма.
Диагностика основывается на характерном анамнезе, данных физикального обследования, антихолинэстеразных тестах и результатах лабораторных исследований (электромиография, серологические тесты и в отдельных случаях микроэлектродные исследования нервно-мышечной передачи in vitro, а также ультраструктурные и цитохимические исследования концевых пластинок).
При внутривенном введении эдрофониум (Edrophonium) действует через несколько секунд, а его эффект продолжается в течение нескольких минут. Его количество, равное 0,1-0,2 мл (раствора 10 мг/мл), вводят внутривенно в течение 15 с. Если ответной реакции не наступает в течение 30 с, то снова вводят 0,8-0,9 мл лекарственного препарата. Чтобы оценить ответную реакцию, необходимо определить степень птоза, величину движений глазным яблоком, силу хватательного движения кистью. Возможны и побочные эффекты: фасцикуляция, резкая гиперемия лица, слезотечение, схваткообразные боли в животе, тошнота, рвота, понос. Больным с сердечно-сосудистой патологией эдрофониум нужно вводить с осторожностью, так как он может вызвать синусовую брадикардию, атриовентрикулярную блокаду, а иногда и остановку сердца. Купируют эти проявления токсического действия эдрофониума обычно атропином; действие внутримышечно введенного неостигмина (Neostigmine) в дозе 0,5-1 мг начинается через 30 мин и продолжается почти в течение 2 ч, что позволяет неторопливо оценивать изменения, происходящие в организме.
При ЭМГ супрамаксимальная стимуляция моторного нерва с частотой от 2 до 3 Гц вызывает у 10% или более обследованных снижение амплитуды вызванного составного потенциала мышечного действия в направлении от первого к пятому раздражению. Тест бывает положительным практически у всех больных с миастенией при условии, что обследованию подвергаются две или более дистальных и две или более проксимальных мышц. Убывание показателей вызывается естественным уменьшением числа квантов нервной энергии, высвобождаемой из нервных окончаний, и сниженной амплитудой потенциалов концевых пластинок, особенно в начале низкочастотной стимуляции. При миастении амплитуда потенциалов концевых пластинок и без того уже уменьшена, что связано с АХР-недостаточностыо, добавочное же ее снижение во время стимуляции вызывает блокаду нервно-мышечной передачи во все возрастающее число концевых пластинок. Трансмиссионный дефект, правда, уменьшается на несколько секунд после 15-30-секундного периода максимального произвольного сокращения, но снова становится существенным несколькими минутами позже. Этот феномен также отражает нормально функционирующие пресинаптические механизмы, которые увеличивают или уменьшают квантовое содержание потенциалов концевых пластинок и, следовательно, обеспечивают безопасный порог нервно-мышечной трансмиссии. Электромиография одиночного мышечного волокна позволяет сравнивать временные параметры потенциалов действия между парой близлежащих мышечных волокон в одной и той же моторной единице. При миастении низкая амплитуда и замедленное время подъема кривой потенциалов концевых пластинок вызывает патологически затяжные интерпотенциальные интервалы и преходящую блокаду генерации потенциалов действия в некоторых мышечных волокнах.
Тест на АХР-антитела положительный почти у всех больных с умеренно выраженной и остро протекающей миастенией, у 80% больных с мягкой генерализованной формой, у 50% больных при глазной форме миастении и только у 25% больных в стадии ремиссии. Величина титра этих антител довольно свободно коррелирует с тяжестью заболевания, но если у конкретного больного снижение этого титра более чем на 50% удерживается в течение 14 мес и дольше, то это всегда свидетельствует об устойчивом улучшении его состояния. У больных с миастенией периодически выявляют также и антитела к поперечно-полосатой мускулатуре. Роль последних неизвестна, но их связь с тимомой клинически подтверждается.
Методом криостатных срезов на концевых пластинках нервов обнаруживают иммунные комплексы даже в том случае, если циркулирующих АХР-антитела не выявляют. Наиболее удобный и технически легко осуществимый метод подтверждения подозреваемого диагноза - это метод определения локализации С3. До настоящего времени с помощью световой микроскопии не удавалось обнаружить иммунные комплексы на концевых пластинках нервов ни при каких нервно-мышечных заболеваниях, кроме миастении. При электрофизиологических исследованиях in vitro нервно-мышечной трансмиссии можно дифференцировать атипичные случаи миастении, миастенический синдром Ламберта-Итона и некоторые врожденные миастенические синдромы.
В круг дифференциальной диагностики при миастении обычно включают неврастению, окулофарингеальную дистрофию, прогрессирующую экстернальную офтальмоплегию с отсутствием или наличием слабости в других мышцах, иннервируемых черепными нервами или в мышцах конечностей; внутричерепные объемные процессы, сдавливающие краниальные нервы; вызванные лекарственными препаратами миастенические синдромы и другие заболевания, связанные с нарушением нервно-мышечной передачи. Неврастению диагностируют с помощью мышечных тестов и по отсутствию свойственных миастении клинических нарушений и изменений лабораторных показателей. При миопатиях с вовлечением глазодвигательных мышц мышечная слабость обычно стабильная, а не флюктуирующая: диплопия является редким симптомом, а в биоптате мышцы можно выявить четкую морфологическую патологию; при этом фармакологические и лабораторные тесты, подтверждающие миастению, бывают отрицательные. Лекарственные и другие миастенические синдромы рассмотрены в соответствующих разделах.
В настоящее время для лечения больных с миастенией применяют ингибиторы холинэстеразы, преднизон (прием через день), азатиоприн, тимэктомию и плазмаферез.
Ингибиторы холинэстеразы эффективны при всех клинических формах миастении.
Прогрессирующая слабость мышц, несмотря на использование все возрастающих доз ингибиторов холинэстераз, служит сигналом начала миастенического или холинергического криза. Холинергический криз проявляется такими мускариновыми эффектами, как схваткообразные боли в животе, тошнота, рвота, понос, миоз, повышенное слезоотделение, повышенная бронхиальная секреция, диафорез и брадикардия. Криз является в большей степени миастеническим, чем холинергическим, если мускариновые эффекты не столь очевидны и если после внутривенного введения 2 мг эдрофониума мышечная слабость начинает уменьшаться, а не нарастать. На практике, однако, различить эти два типа кризов довольно трудно и чрезмерная лекарственная терапия, направленная на устранение миастенического криза, превращает его в холинергический. Так что больных с нарастающими расстройствами дыхания, кормления, тазовыми расстройствами и не отвечающих на достаточно высокие дозы антихолинэстеразных препаратов необходимо перевести на режим безлекарственного лечения. Им следует произвести трахеальную интубацию или трахеостомию, дыхание поддерживать с помощью респиратора, а питание - внутривенным введением питательных смесей. Через несколько дней рефрактерность к лекарственным препаратам обычно исчезает.
Больных с генерализованной формой заболевания, не отвечающих адекватно на умеренные дозы антихолинэстеразных препаратов, лечить необходимо иначе. Так, тимэктомия увеличивает частоту наступления ремиссий и облегчает симптомы миастении. И хотя не проведено корреляционных клинических исследований влияния тимэктомии на течение миастении в зависимости от возраста, пола и тяжести заболевания, принято считать, что наиболее эффективно удаление вилочковой железы у молодых женщин с гиперплазированной железой и высокими титрами антител в крови. Тимома является абсолютным показанием для тимэктомии, так как эта опухоль локально довольно инвазивна. При рентгенографии грудной клетки в сочетании с послойной томографией можно выявить большинство случаев тимомы. КТ средостения считается высокочувствительным скринирующим тестом в этом отношении, но иногда могут быть получены ложноположительные результаты.
Прием преднизона через день часто позволяет добиться ремиссии или существенно улучшает состояние более чем у 50% больных. Лечение это можно считать довольно безопасным при условии соблюдения предосторожностей, предписываемых всем больным, получающим кортикостероиды. При средней дозе преднизона 70 мг через день состояние больного начинает улучшаться примерно через пять месяцев после начала лечения. После того как состояние больного достигает определенного плато, дозу преднизона нужно снижать в течение нескольких месяцев, чтобы определить величину минимальной поддерживающей дозы. Азатиоприн в дозах 150-200 мг в день также вызывает ремиссии и значительно улучшает состояние более чем у 50% больных, однако некоторые из них одновременно получали преднизон или перенесли тимэктомию. При лечении азатиоприном состояние больных улучшается примерно через 3 мес. Для выявления частоты побочных эффектов такого лечения (панцитопения, лейкопения, тяжелые инфекции, гепатоцеллюлярное повреждение печени) соответствующие наблюдения должны быть продолжены.
Плазмаферез показан при резко выраженных генерализованных или фульминантных формах миастении, рефрактерных к другим видам лечения. Обмен в течение дня двух литров плазмы уже через несколько дней приводит к объективному улучшению состояния больного и снижает в крови титр АХР-антител. Однако плазмаферез сам по себе не вызывает долговременной защиты организма по сравнению с лечением только иммунодепрессантами.
T.P. Harrison. Principles of internal medicine. Перевод д.м.н. А. В. Сучкова, к.м.н. Н. Н. Заваденко, к.м.н. Д. Г. Катковского
Читайте также:


