Наследственная моторная и сенсорная невропатия что это
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Архив - Клинические протоколы МЗ РК - 2010 (Приказ №239)
Общая информация
Протокол "Наследственная моторная и сенсорная невропатия"
Коды по МКБ-10: G 60,0
- Болезнь Шарко-Мари Тута (наследственная мотосенсорная невропатия, тип I)
- Болезнь Дежерина - Сотта (наследственная мотосенсорная невропатия, тип III)
- Наследственная моторная и сенсорная невропатия, типы I-IV
- Гипертрофическая невропатия у детей
- Перонеальная мышечная атрофия (аксональный тип, гипертрофический тип)


Классификация
Клинико-генетическая классификация наследственных мотосенсорных невропатий
Аутосомно-доминантная наследственная мотосенсорная невропатия, тип I:
- обусловленная дупликацией 17 р 11.2;
- обусловленная точковыми мутациями гена миелина РМР-22.
Тип I В: обусловленная точковыми мутациями гена миелина Ро.
Тип I С: с неидентифицированным генетическим дефектом.
Аутосомно-рецессивная наследственная мотосенсорная невропатия, тип I: с неидентифицированным генетическим дефектом.
Аутосомно-доминантная наследственная мотосенсорная невропатия, тип II: с неидентифицированным генетическим дефектом.
Аутосомно-рецессивная наследственная мотосенсорная невропатия, тип II: с неидентифицированным генетическим дефектом.
Наследственная мотосенсорная невропатия, тип III:
- обусловленная дупликацией 17 р 11.2;
- обусловленная точковыми мутациями гена миелина РМР-22;
- обусловленная точковыми мутациями гена миелина Ро.
Х- сцепленная наследственная мотосенсорная невропатия:
- обусловленная точковыми мутациями и делециями коннексина 32;
- с неидентифицированным генетическим дефектом.
Сложные формы наследственных мотосенсорных невропатий:
- с пирамидными симптомами;
- с атрофией зрительных нервов;
- с атрофией зрительных нервов и глухотой;
- с пигментной ретинопатией;
- с кератодермией ладоней и стоп.
Диагностика
Диагностические критерии
В анамнезе: при болезни Шарко-Мари - аутосомно-рецессивный тип наследования, дебют заболевания в первое десятилетие жизни.
При болезни Дежерина-Сотта (наследственной мотосенсорной невропатии, тип III): аутосомно-рецессивный тип наследования, дебют в первые два года жизни, задержка моторного развития, слабость и атрофии дистальных отделов конечностей, по мере прогрессирования - поражение проксимальных отделов, атаксия, быстропрогрессирующее течение.
Для наследственной мотосенсорной невропатии, тип I характерен аутосомно-доминантный тип наследования, дебют заболевания преимущественно в 1-2 десятилетие жизни, медленно-прогрессирующий характер течения.
Для наследственной мотосенсорной невропатии, тип II - характерен аутосомно-доминантный тип наследования, дебют во второй декаде жизни, отсутствие либо незначительно выраженные атрофии дистальных отделов конечностей, относительно доброкачественное течение.
Для наследственной мотосенсорной невропатии, тип II - характерен аутосомно-рецессивный тип наследования, дебют заболевания в раннем возрасте, выраженные атрофии и слабость дистальных отделов конечностей, деформации кистей и стоп, быстропрогрессирующий характер течения.
Лабораторные исследования: общий анализ крови и мочи без патологии.
Инструментальные исследования
ЭМГ различна: для наследственной мотосенсорной невропатии, тип I характерно снижение скорости проведения импульса по моторным и сенсорным волокнам.
Для болезни Шарко-Мари снижение скорости проведения импульса по моторным и сенсорным волокнам.
Для болезни Дежерина-Сотта значительное снижение (менее 12 м/с) скорости проведения импульса по периферическим нервам.
Для наследственной мотосенсорной невропатии, тип II (аутосомно-рецессивная форма) на ЭМГ характерно значительное снижение скорости проведения импульса по периферическим нервам (менее 38 м/с).
Для наследственной мотосенсорной невропатии, тип II (аутосомно-доминантная форма) умеренное снижение скорости проведения импульса по периферическим нервам.
Показания для консультации специалистов:
Минимум обследования при направлении в стационар:
1. Общий анализ крови и мочи.
4. Кал на яйца глист.
Основные диагностические мероприятия:
1. Общий анализ крови.
2. Общий анализ мочи.
Дополнительные диагностические мероприятия:
Дифференциальный диагноз
Дифференциально-диагностические признаки аутосомно-доминантных наследственных мотосенсорных невропатий
Аутосомно-доминантная наследственная мотосенсорная невропатия
Наша команда профессионалов ответит на ваши вопросы
Болезнь Шарко-Мари-Тута (ШМТ), или невральная амиотрофия Шарко-Мари, известная и как наследственная моторно-сенсорная невропатия (НМСН), - обширная группа генетически гетерогенных заболеваний периферических нервов, характеризующаяся симптомами прогрессирующей полинейропатии с преимущественным поражением мышц дистальных отделов конечностей. НМСН являются не только самым частым среди наследственных заболеваний периферической нервной системы, но и одним из самых частых наследственных заболеваний человека. Частота всех форм НМСН варьирует от 10 до 40:100000 в различных популяциях.
Клинико-генетическая гетерогенность невральной амиотрофии Шарко-Мари, явилась основанием для поиска локусов, сцепленных с данными заболеваниями. К настоящему времени картировано более 40 локусов, отвечающих за наследственные моторно-сенсорные нейропатии, идентифицировано более двадцати генов, мутации в которых приводят к развитию клинического фенотипа НМСН. Описаны все типы наследования НМСН: аутосомно-доминантный, аутосомно-рецессивный и Х-сцепленный. Наиболее часто встречается аутосомно-доминантное наследование.
Все моторно-сенсорные нейропатии в настоящее время по электронейромиографическим (ЭНМГ) и морфологическим признакам принято разделять на три основных типа: 1) демиелинизирующий (НМСНI), характеризующийся снижением скорости проведения импульса (СПИ) по срединному нерву, 2) аксональный вариант (НМСНII), характеризующийся нормальной или несколько сниженной СПИ по срединному нерву, 3) промежуточный вариант (intermedia) со СПИ по срединному нерву от 25 до 45 м/с. Величина СПИ, равная 38 м/с, определяемая по двигательной компоненте срединного нерва, считается условной границей между НМСНI (СПИ 38м/с). Таким образом, ЭНМГ исследование приобретает особый смысл для ДНК-диагностики, поскольку позволяет выделить наиболее оптимальный алгоритм генетического обследования для каждой семьи.
Возраст начала заболевания, его тяжесть и прогрессирование зависят от типа нейропатии, но могут сильно варьировать даже в пределах одной семьи. Наиболее часто встречается форма болезни НМСНIА - от 50% до 70 % всех случаев НМСН 1 типа в различных популяциях. В 10% случаев выявляются Х-сцепленные формы НМСН, среди которых преобладает форма с доминантным типом наследования – НМСНIX, составляющая 90% от всех Х-сцепленных полинейропатий. Среди НМСН II типа наиболее часто встречается доминантная форма – НМСНIIA – в 33% всех случаев (табл. 1).
Наследственные моторно-сенсорные нейропатии с аутосомно-рецессивным типом наследования сравнительно редки, но клинически не отличимы от НМСН с аутосомно-доминантным типом наследования. НМСН 4D(Lom), 4С, 4H и 4J являются одними из таких болезней. Примечательно, что в генах NDRG1 и SH3TC2 локализованы частые мутации, характерные для цыган.
Таблица 1. Гены, ответственные за развитие различных форм НМСН. (Синим цветом выделены гены, анализ которых проводится в ООО "Центр Молекулярной Генетики")
Болезнь Шарко-Мари-Тута болезнь Шарко Мари Тута, наследственная моторно-сенсорная невропатия I типа, наследственная нейропатия Шарко-Мари-Тута, ШМТ, невральная амиотрофия
Лечение болезни Шарко-Мари-Тута
Лечение назначается только после подтверждения диагноза врачом-специалистом. Показаны дозированная ЛФК и массаж, ортопедические мероприятия, витаминные препараты, средства нейротрофического действия, улучшающие микроциркуляцию, антихолинэстеразные препараты.
Имеются противопоказания. Необходима консультация специалиста.



- Аденозинтрифосфат натрия (средство, улучшающее метаболизм и энергообеспечение тканей). Режим дозирования: в/м, в первые 2-3 дня вводят 1 раз в день по 1 мл 1%-ного раствора, в последующие дни 2 раза в день или сразу 2 мл 1%-ного раствора 1 раз в день. На курс лечения — 30-40 инъекций.
- Пентоксифиллин (средство, улучшающее микроциркуляцию). Режим дозирования: внутрь, проглатывая целиком, во время или сразу после приема пищи, запивая достаточным количеством воды, в дозе 100 мг 3 раза в сутки с последующим медленным повышением дозы до 200 мг 2-3 раза в сутки.
- Мильгамма (комплекс витаминов группы В). Режим дозирования: терапию начинают с 2 мл внутримышечно 1 р/д на протяжении 5-10 дней. Поддерживающая терапия — 2 мл в/м два или три раза в неделю.
- Метандростенолон (анаболическое стероидное средство). Режим дозирования: внутрь, перед едой в дозе 0,005-0,01 г 1-2 раза в день. Курс лечения у взрослых длится 4-8 недель. Перерывы между курсами 4-8 недель.
- Церебролизин (ноотропное средство). Режим дозирования: применяют парентерально в виде в/м инъекций (до 5 мл) и в/в инъекций (до 10 мл). Препарат в дозе от 10 мл до 50 мл рекомендуется вводить только посредством медленных в/в инфузий после разведения стандартными растворами для инфузий. Продолжительность инфузий составляет от 15 до 60 мин. Вводят парентерально в дозе от 5 мл до 30 мл/сут. Рекомендуемый оптималь-ный курс лечения — ежедневные инъекции в течение 10-20 дней.
- Галантамин (антихолинэстеразное средство). Режим дозирования: внутрь, суточная доза для взрослых составляет 10-40 мг в 2-4 приема.
Формы болезни Шарко-Мари-Тута
Существует много форм болезни Шарко-Мари-Тута, включая CMT1, CMT2, CMT3, CMT4 и CMTX. CMT1, вызванный аномалиями в оболочке миелина, имеет три основных типа. CMT1A является аутосомно-доминантным заболеванием, которое возникает в результате дублирования гена на хромосоме 17, которая несет инструкции по производству периферического белка миелина-22 (PMP-22). Белок PMP-22 является критическим компонентом миелиновой оболочки. Сверхэкспрессия этого гена вызывает ненормальность структуры и функции миелиновой оболочки. Пациенты испытывают слабость и атрофию мышц нижних конечностей, начиная с подросткового возраста; позже они испытывают слабость рук и сенсорную потерю. Интересно, что другая невропатия, отличная от CMT1A, называемая наследственной невропатией с предрасположенностью к параличу давления (HNPP), вызвана удалением одного из генов PMP-22. В этом случае аномально низкие уровни гена PMP-22 приводят к эпизодической рецидивирующей демиелинизирующей нейропатии. CMT1B является аутосомно-доминантным заболеванием, вызванным мутациями в гене, который несет инструкции по изготовлению нуклеотида миелина (P0), который является еще одним критическим компонентом миелиновой оболочки. Большинство из этих мутаций являются точечными мутациями, что означает, что ошибка встречается только в одной букве генетического кода ДНК. На сегодняшний день ученые выявили более 120 различных точечных мутаций в гене P0. В результате аномалий в P0 CMT1B вызывает симптомы, сходные с симптомами, обнаруженными в CMT1A. Менее распространенные CMT1C, CMT1D и CMT1E, которые также имеют симптомы, сходные с симптомами, обнаруженными в CMT1A, вызваны мутациями в генах LITAF, EGR2 и NEFL соответственно.
Болезнь Шарко-Мари-Тута является результатом аномалий в аксоне периферической нервной клетки, а не в оболочке миелина. Он менее распространен, чем CMT1. CMT2A, наиболее распространенная аксоновская форма CMT, вызвана мутациями в Mitofusin 2, белке, связанном с митохондриальным слиянием. CMT2A также был связан с мутациями в гене, который кодирует белок 1B-бета-члена семейства кинезина, но в других случаях он не реплицируется. Кинезины — это белки, которые действуют как двигатели, чтобы помочь обеспечить транспортировку материалов вдоль клетки. Другие менее распространенные формы CMT2 были недавно идентифицированы и связаны с различными генами: CMT2B (связанный с RAB7), CMT2D (GARS). CMT2E (NEFL), CMT2H (HSP27) и CMT2l (HSP22).
CMT3 или Dejerine-Sottas — тяжелая демиелинизирующая невропатия, которая начинается в младенчестве. У младенцев происходит тяжелая атрофия мышц, слабость и сенсорные проблемы. Это редкое расстройство может быть вызвано определенной точечной мутацией в гене P0 или точечной мутацией в гене PMP-22.
CMT4 включает несколько различных подтипов аутосомно-рецессивного демиелинизирующего двигателя и сенсорных невропатий. Каждый подтип невропатии вызван другой генетической мутацией, может влиять на конкретную этническую популяцию и производит различные физиологические или клинические характеристики. Лица с CMT4 обычно развивают симптомы слабости ног в детстве, а в подростковом возрасте они не могут ходить. Несколько генов были идентифицированы как вызывающие CMT4, включая GDAP1 (CMT4A), MTMR13 (CMT4B1), MTMR2 (CMT4B2), SH3TC2 (CMT4C), NDG1 (CMT4D), EGR2 (CMT4E), PRX (CMT4F), FDG4 (CMT4H) и фиг.4 (CMT4J).
CMTX возникает точечной мутацией гена connexin-32 на Х-хромосоме. Коннексин-32-белок экспрессируется в клетках Schwann-клеток, которые обертывают нервные аксоны, составляя один сегмент миелиновой оболочки. Этот белок может участвовать в связи с клеткой Шванна с аксоном. Мужчины, которые наследуют один мутированный ген от своих матерей, проявляют умеренные или тяжелые симптомы заболевания, начиная с позднего детства или подросткового возраста (Y-хромосома, которую самцы наследуют от своих отцов, не имеет ген коннексин-32). Женщины, которые наследуют один мутированный ген от одного родителя и одного нормального гена от другого родителя, могут проявлять мягкие симптомы в подростковом возрасте или позже или вообще не могут развиваться симптомы заболевания.
Возможные осложнения ШМТ
Дыхание может быть затруднено, если болезнь поражает нервы, контролирующую диафрагму. Пациенту может понадобиться бронхолитические лекарственные средства или искусственная вентиляция легких. Избыточный вес или ожирение может затруднять дыхание.
Депрессия может быть результатом психического стресса, тревоги и разочарования жизни с любым прогрессирующим заболеванием. Когнитивная поведенческая терапия помогает пациентам лучше справляться с повседневной жизнью и, при необходимости, с депрессией.
Хотя ШМТ нельзя вылечить, некоторые меры помогут избежать дальнейших проблем. Они включают в себя хороший уход за ногами, так как существует повышенный риск травмы и инфекции, отказ от кофе, алкоголя и курения.
Понравилась новость? Читайте нас в Facebook
Приглашаем подписаться на наш канал в Яндекс Дзен
Как диагностировать ШМТ
Врач спросит о семейном анамнезе, и выявит признаки мышечной слабости — снижение мышечного тонуса, плоскостопие или высокий свод стоп (кавус).
Для исследования нервной проводимости проводится измерение силы и скорости электрических сигналов, которые проходят через нервы (Электромиография). Электроды помещаются на кожу, и вызывают слабые поражения электрическим током, которые стимулируют нервы. Задержанный или слабый ответ предполагает расстройство нервной системы, и, возможно, ШМТ.
При электромиографии (ЭМГ) тонкую иглу вводят в мышцы. Когда пациент расслабляет или сокращает мышцы, измеряется электрическая активность. Тестирование различных мышц покажет, какая из них страдает.
Генетическое тестирование проводится с помощью пробы крови, которая может показать, имеет ли пациент мутации гена.
Симптомы
Клиническая картина болезни имеет общие симптомы независимо от типа, но при этом может проявляться индивидуально. Даже в одной семье, когда заболевание провоцируется одним и тем же геном, у двух близких родственников оно далеко не всегда проявляется одинаково.
Общие симптомы болезни Шарко:
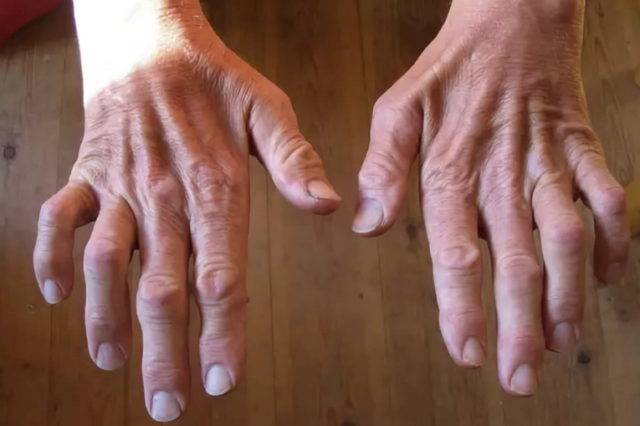
Дополнительные симптомы при 1-м типе болезни:
Особенности 2-го типа заболевания:
- изменения подъема стопы и формы пальцев встречаются реже, чем при 1-м типе;
- не наблюдаются утолщения нервных стволов;
- меньшая степень нарушения чувствительности;
- наблюдается синдром беспокойных ног перед сном;
- реже встречается ослабевание мышц в руках;
- возможно нарушение слуха (когда болезнь передается по женской линии);
- транзисторная энцефалопатия после физической активности на высоте: нарушения речи, шатание при ходьбе, затрудненное глотание, слабость проксимальных (ближних к туловищу) отделах конечностей.
Проявлением данной патологии обоих типов могут стать аутоиммунные реакции, когда вырабатываемые организмом специальные антитела разрушают миелиновые оболочки нервных волокон.
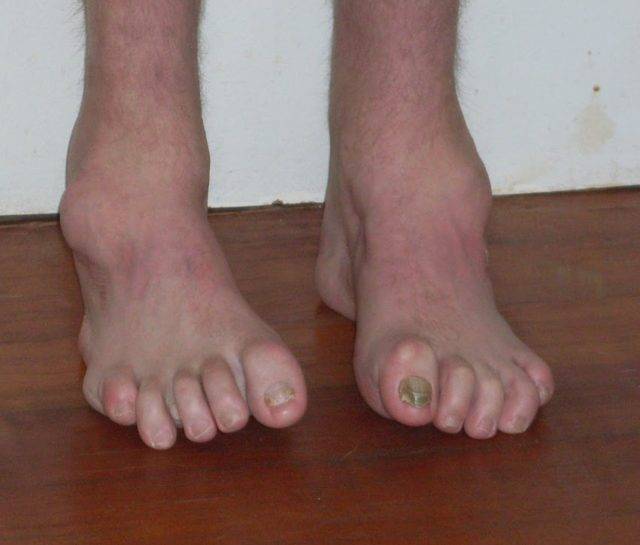
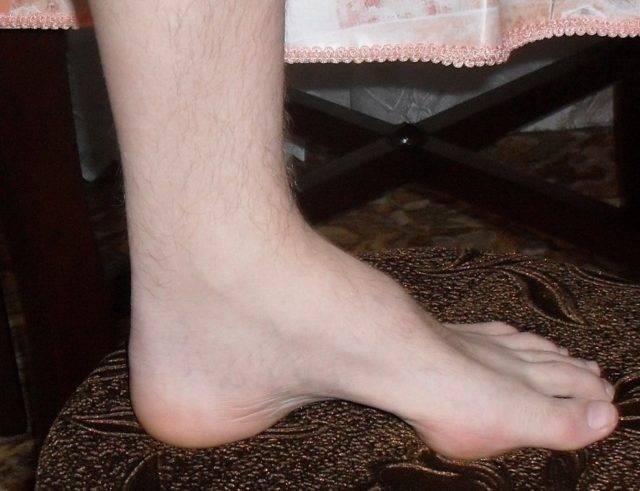
Симптомы болезни Шарко-Мари-Тута
Дебют заболевания отмечается в возрасте 10–20 лет. Первоначально появляются слабость в дистальных отделах ног, утомляемость в мышцах ног при длительном стоянии (постепенно нарастают на протяжении десятков лет). Позже может присоединяться боль в мышцах голени после долгой ходьбы (70%). При ходьбе приходится высоко поднимать ноги. Онемение в стопах отмечается в 80% случаев. Мышечная слабость в руках появляется спустя 10–15 лет после начала заболевания.
| Рис. 1 | Рис. 2 |
Диагностика
Диагностическая процедура включает ряд методов, среди которых:
- подробный личный и семейный анамнез;
- клиническая оценка мышечной силы, чувствительности;
- электрофизиологическое исследование скорости проводимости нервного волокна;
- неврологическое исследование.
Наиболее распространенные формы заболевания могут быть диагностированы путем анализа ДНК из крови пациента.
При диагностике необходимо тесное сотрудничество невролога, генетика, реабилитолога, хирурга-ортопеда и протезиста. В соответствии с выводами обследования, даются рекомендации относительно индивидуального плана реабилитации, при необходимости, назначается ортопедическая операция.
Значительная изменчивость клинических признаков болезни, наряду с отсутствием знаний о ней у многих врачей, часто приводит к неправильной диагностике.
Симптомы ШМТ у взрослых людей
- Слабость в мышцах ног и лодыжек;
- Искривление пальцев ног;
- Трудности подъема стопы из-за слабых мышц голеностопного сустава;
- Онемение в руках и ногах;
- Изменение формы голени, при этом нога становится очень тонкой ниже колена, в то время как бедра сохраняют нормальный объем мышц и форму (нога аиста);
- Со временем руки ослабевают и пациентам трудно выполнять повседневную работу;
- Появляются боли в мышцах и в суставах, человеку тяжело ходить. Нейропатическая боль возникает вследствие поврежденных нервов;
- В тяжелых случаях пациент может нуждаться в коляске, в то время как другие могут использовать специальная обувь или другие ортопедические устройства.
Факторы риска и причины ШMT
ШMT является наследственным заболеванием, так что люди, которые имеют близких родственников с заболеванием, имеют более высокий риск развития болезни.
Заболевание поражает периферические нервы. Периферический нервы состоит из двух основных частей: аксона — внутренняя часть нерва и миелиновой оболочки, которая является защитным слоем вокруг аксона. ШМТ может влиять на аксон и миелиновую оболочку.
При ШMT 1 мутируют гены, которые вызывают распад миелиновой оболочки. В конце концов, повреждается аксон, и мышцы пациента больше не получают четких сообщений от мозга. Это приводит к мышечной слабости и потере чувствительности или онемению.
При ШМТ 2 мутирующий ген влияет непосредственно на аксоны. Сигналы передаются не достаточно сильно, чтобы активизировать мышцы и органы чувств, так что пациенты имеют слабые мышцы, плохую чувствительность или онемение.
ШМТ 3 или болезнь Дежерин-Соттас, редкий тип заболевания. Повреждение миелиновой оболочки приводит к выраженной мышечной слабости и чувствительности. Симптомы могут быть заметны у детей.
ШМТ 4 является редким заболеванием, которое влияет на миелиновую оболочку. Симптомы обычно появляются в детстве, и пациенты часто нуждаются в инвалидном кресле.
ШМТ Х вызывается мутацией Х-хромосомы. Она чаще встречается у мужчин. Женщина с CMT X будет иметь очень слабые симптомы.
Что такое "Наследственные полинейропатии"?
Наследственные полинейропатии – это большая группа клинически разнообразных полинейропатий с возможным вовлечением различных органов и систем, в том числе и центральной нервной системы, которые развиваются в результате мутаций (поломок) в генах человека.
Какие мифы существуют среди населения относительно наследственных заболеваний?
- "Наследственные заболевания развиваются с рождения или в раннем детстве"
Это не так - дебют наследственной болезни возможен и во взрослом возрасте, в том числе и после 50 лет. Более того, зачастую пациенты не могут точно назвать возраст начала заболевания, так как симптомы развиваются незаметно. - "Наследственная патология должна быть и у близких родственников. А если в роду ни у кого нет, значит и у меня тоже нет".
Это не так - наследственные заболевания передаются разными путями: по аутосомно-доминантному, аутосомно-рецессивному, Х-сцепленному типу, также возможен митохондриальный тип наследования и др. Часто в семье есть асимптомные носители мутантного гена без клинических признаков заболевания, а симптомы болезни могут быть только у одного из членов семьи. Поэтому отсутствие отягощенного семейного анамнеза не исключает наследственный генез заболевания.

Какие бывают "Наследственная полинейропатии"?
Наследственных полинейропатий очень много, причиной из развития могут быть мутации более чем в 100 генах. Классифицируют наследственные нейропатии в основном по типу наследования, вовлечению тех или иных нервных волокон и характеру их поражения.
Ниже представлена лишь часть из них, преимущественно тех, которые на практике могут диагностироваться в возрасте старше 20 лет:
- Наследственные моторно-сенсорные нейропатии (НМСН)
- Наследственная нейропатия со склонностью к параличам от сдавления (ННСПС)
- Наследственные сенсорные и автономные нейропатии (НСАН)
- Болезнь Фабри
- Транстиретиновая семейная амилоидная нейропатия (ТТР-САП)

Как часто диагностируются наследственные полинейропатии среди населения?
Частота встречаемости всех форм НМСН варьирует от 10 до 40 случаев на 100 000 населения в различных популяциях. На НМСН 1 типа приходится до 70% всех случаев НМСН. Распространенность ННСПС 2-5 случая на 100 000 населения. Болезнь Фабри - 1 случай на 40 000 - 60 000 мужчин. По примерным подсчетам в США встречаемость ТТР-САП составляет 1 случай на 100 000 человек. Следует отметить, что настороженность относительно дебюта наследственной патологии во взрослом возрасте среди врачей разных специальностей достаточно низкая, поэтому некоторые цифры распространенности могут быть занижены.
Какие симптомы наблюдаются у пациентов с наследственными полинейропатиями?
Наследственные заболевания периферических нервов очень разнообразны по клиническим проявлениям. Ниже представлены данные некоторых из них.
Наследственная моторно-сенсорная нейропатия (НМСН) I типа (болезнь Шарко-Мари-Тута) – наиболее часто диагностируемая (в том числе во взрослом возрасте) наследственная полинейропатия, в основе развития которой лежит дефект гена PMP22, в результате чего повреждается миелиновая оболочка периферических нервов. Заболевание чаще всего имеет аутосомно-доминантный тип наследования. Соотношение мужчин и женщин с НМСН 1 типа примерно равно. Симптомы заболевания появляются на первом десятилетии жизни в 75% случаев, в начале второго десятилетия реже - до 10-25%. Обычно чем позднее манифестирует заболевание, тем более благоприятно оно протекает.
Клиническая картина НМСН 1 типа:
- пациентов беспокоят болезненные спазмы мышц голеней (крампи), слабость и деформация стоп, изменение походки, затруднения при беге или подъеме по лестнице;
- постепенно слабость развивается в кистях, в результате чего появляются затруднения при застегивании пуговиц, открывании двери ключом и т.д. В целом руки вовлекаются не ранее чем через 10 лет после появления первых симптомов болезни;
- в меньшей степени беспокоит онемение кистей и стоп, часто эти изменения игнорируются пациентом.
Особенностью является наличие несоответствия жалоб пациента (они минимальны) и неврологического дефицита (он более выражен), т.к. пациент за длительный период прогрессирования заболевания привыкает к тем или иным нарушениям.
При осмотре обращает внимание наличие деформации стоп, контрактур ахилловых сухожилий.
Клиническая картина других типов НМСН и НСАН вариабельна и определяется генетическим дефектом.
Наследственная нейропатия со склонностью к параличам от сдавления (ННСПС) - также часто диагностируемая во взрослом возрасте наследственная нейропатия (дебютирует, как правило, на 2–3-м десятилетии жизни), обусловленная мутацией в гене PMP22, характеризуется повышенной "чувствительностью" периферических нервов к сдавлению в костно-фиброзных каналах (туннелях), что приводит к повторяющимся эпизодам компрессионных туннельных мононевропатий.
Возможно поражение любого периферического нерва, но чаще всего сдавлению подвергаются:
- лучевой нерв на уровне плеча (спиральный канал), при этом развивается слабость разгибателей кисти, кисть "висит" как плеть, возникает онемение наружного края предплечья и кисти;
- малоберцовый нерв на уровне коленного сустава (фибулярный канал), при этом развивается слабость разгибателей стопы, стопа начинает "шлепать", возникает онемение наружного края голени и стопы;
- локтевой нерв на уровне локтевого сустава (кубитальный канал), при этом развивается слабость межкостных мышц кисти, мышцы - отводящих мизинец и других, возникает онемение 4 и 5 пальцев кисти;
- срединный нерв на уровне запястья (карпальный канал), при этом развивается слабость мышц возвышения большого пальца, возникает онемение 1-3 пальцев кисти, характерен болевой синдром;
- и т.д. с развитием соответствующей клинической картины поражения того или иного нерва.
Степень поражения нерва (защемления в канале) может быть различной - от незначительной, когда беспокоит только онемение и парестезии, до более выраженной, когда помимо чувствительных нарушений развивается и слабость мышц.
Развитию симптомов, как правило, предшествует незначительная травма, нахождение длительное время в неудобной статической поза (на четвереньках, на корточках, облокотившись на локоть и др.), ношение неудобной одежды, непривычная физическая нагрузка и прочее.
Мышечная слабость, как правило, сохраняется в течение нескольких дней или недель, а затем сила мышц постепенно восстанавливается (в течение нескольких недель или месяцев). Эпизоды "защемлений" нервов имеют тенденцию к повторению (всего у пациентов может быть от 1 до 10 таких эпизодов). Следует учитывать, что часто лечащие врачи не задумываются о том, что причиной рецидивирующих (повторяющихся) туннельных невропатий – является наследственная патология, что приводит к поздней диагностике и неоправданным медицинским вмешательствам (операциям по поводу туннельных невропатий).
Болезнь Фабри - редкое генетическое заболевание, обусловленное мутацией гена GLA, картированного на длинном плече хромосомы Хq 22.1 и контролирующего структуру фермента альфа-галактозидазы А. Нередко начало заболевания отмечается в подростковом возрасте. Тип наследования - сцепленное с Х-хромосомой.
Клиническая картина:
- жгучая колющая боль в ладонях и стопах; острые приступы мучительной боли в кистях и стопах (кризы Фабри);
- нарушение потоотделения; непереносимость жары/холода;
- сыпь на коже (ангиокератомы);
- помутнение роговицы в виде завитка, которое не ослабляет зрение;
- шум в ушах, потеря слуха;
- желудочно-кишечные расстройства, диарея;
- кардиологические проявления (включая увеличенное сердце и нарушение ритма);
- нарушение функции почек, которое в конечном итоге приводит к терминальной стадии хронической почечной недостаточности;
- нарушение мозгового кровообращения (чаще ишемический инсульт, но может быть и внутримозговое кровоизлияние, или венозный тромбоз).
Транстиретиновая семейная амилоидная полинейропатия (ТТР-САП) – редкое, прогрессирующее, аутосомно-доминантное заболевание, характеризующееся отложением мутантного амилоидного белка транстиретина (TTR) в тканях сердца, кишечника, стекловидного тела и периферических нервов. Заболевание обусловлено точковой мутацией в гене TTR, который кодирует одноименный белок. Симптоматика и степень выраженности нарушений чрезвычайно полиморфны.
Существуют “красные флаги” заболевания: отягощенный семейный анамнез, автономные нарушения (ортостатическая гипотензия, эректильная дисфункция, нарушение потоотделения), нарушение работы органов пищеварительного тракта (запоры, диарея, тошнота) и мочеиспускания, поражение сердца (рестриктивная кардиомиопатия, аритмии, блокады сердца), синдром карпального канала (идиопатический, часто двусторонний), потеря массы тела, помутнение стекловидного тела, прогрессирующая полинейропатия:
-
при раннем дебюте заболевания (
Читайте также:


