Передача информации в центральной нервной системе
Передача информации в нервной системе
Передача информации в нервной системе
Электрические сигналы, обеспечивающие функционирование нервных клеток, опосредованы потоком ионов через водопроницаемые поры клеточной мембраны. Эти поры, образованные трансмембранными белками, называются ионными каналами. К настоящему времени разработаны высокочувствительные методы, позволяющие зарегистрировать и измерить ионные токи, протекающие через одиночные ионные каналы.
Некоторые ионные каналы избирательно проницаемы только для катионов, тогда как другие проводят только анионы. Катионные каналы могут быть высоко избирательными по отношению к одному иону, например натрию. Ионные каналы совершают переходы между открытым и закрытым состоянием и имеют, как правило, характерное время открытого состояния. Их вклад в ионный ток через клеточную мембрану определяется относительным количеством времени, которое они находятся в открытом состоянии.
Открытие канала регулируется различными механизмами. Некоторые из этих механизмов физические, такие как растяжение мембраны или изменения мембранного потенциала. Другие механизмы химические, включающие связывание активных молекул (лигандов) с активным центром, который располагается либо с внеклеточной, либо с внутриклеточной стороны канала.
Важным свойством каналов, в дополнение к кинетике открытия и закрытия, является способность открытого канала проводить ионный ток. Один из способов, которым ионы могут проникать через открытый канал, является простая диффузия. Другой способ – взаимодействие ионов с внутриканальными центрами связывания и перескакивание внутри водной поры от одного центра к другому. В любом случае движение иона через канал является пассивным и определяется градиентом концентрации и градиентом электрического потенциала на мембране.
Количество тока, проходящего через открытый канал по электрическому градиенту, зависит от проницаемости канала для данного типа ионов. Величина тока также зависит от концентрации ионов в устьях канала. Эти два фактора, проницаемость и концентрация, определяют проводимость канала.
Передача импульса в нервной системе опосредуется изменениями мембранного потенциала. В сенсорных нейронах адекватный стимул, такой как прикосновение, звук, свет, вызывает локальную деполяризацию (делая мембранный потенциал менее негативным) или гиперполяризацию (мембранный потенциал становится более негативным). Подобным же образом нейротрансмиттеры в синапсах вызывают деполяризацию или гиперполяризацию постсинаптической клетки. Потенциалы действия, представляющие собой короткие деполяризационные сигналы большой амплитуды, проводят по отросткам нейрона информацию из одного отдела нервной системы в другой.
Все эти изменения мембранного потенциала вызваны движением ионов через клеточную мембрану. Например, направленное внутрь клетки движение положительно заряженных ионов натрия снижает общий отрицательный заряд мембраны или, другими словами, вызывает деполяризацию. Наоборот, результатом движения положительно заряженных ионов калия из клетки является рост общего отрицательного заряда, то есть гиперполяризация. Гиперполяризация может быть обусловлена также движением внутрь клетки отрицательно заряженных ионов хлора.
Как движутся ионы через клеточную мембрану и чем их движение регулируется? Главным путем для быстрого перемещения ионов внутрь клетки и из нее являются ионные каналы. Ионные каналы представляют собой встроенные в мембрану молекулы белка, которые образуют поры, проницаемые для ионов. Ионные токи регулируются через открытие и закрытие этих ионных каналов. Знание механизмов работы ионных каналов позволяет понять, как генерируются электрические сигналы.
Свойства ионных каналов. Клеточная мембрана нервной клетки
Клеточные мембраны состоят из жидкой фазы липидов и встроенных в липиды белковыхмолекул. Молекулы липидов организованы в двухслойную мембрану (бислой) толщиной около 6 нм. Полярные гидрофильные головки липидов обращены к поверхностям мембраны, а гидрофобные хвосты вытянуты к середине бислоя. Липиды плохо пропускают воду и практически непроницаемы для ионов. Белковые молекулы частично погружены в слой липидов, либо с внеклеточной, либо с цитоплазматической стороны. Некоторые белки целиком пронизывают мембрану. Именно пронизывающие мембрану (трансмембранные) белки образуют ионные каналы. Основные ионы, участвующие в генерации электрических сигналов, такие как калий, натрий, кальций или хлор, движутся через ионные каналы пассивно благодаря градиенту концентраций и электрическому потенциалу мембраны.
Другие трансмембранные белки служат в качестве насосов и переносчиков, обеспечивающих транспорт веществ через клеточную мембрану против электрохимических градиентов. Транспортные механизмы поддерживают ионный состав цитоплазмы, удаляя или возвращая те ионы, которые прошли клеточную мембрану по их электрохимическим градиентам. Они также выполняют важную функцию переноса через клеточные мембраны субстратов метаболических реакций, таких как глюкоза и аминокислоты
Для ионных каналов функционально важными являются переходы между открытым и закрытым состояниями. Эти переходы совершаются практически моментально. С другой стороны, при системном изучении поведения любого ионного канала мы обнаружим, что время открытого состояния варьирует случайным образом. Иногда канал открыт только одну миллисекунду или даже меньше, хотя в следующий раз он может быть открыт на гораздо более продолжительное время. Тем не менее, каждый канал имеет характерное среднее время открытого состояния (т), и все вариации происходят вокруг этого среднего показателя.
Некоторые ионные каналы открываются достаточно часто даже в покое. Иными словами, вероятность нахождения таких каналов в открытом состоянии в неактивированной клетке относительно высока. Большинство таких ионных каналов проницаемо для калия или хлора. Они важны для генерации мембранного потенциала покоя. Остальные ионные каналы при этом закрыты, то есть вероятность нахождения их в открытом состоянии очень низка. Активация этих каналов адекватным стимулом резко увеличивает вероятность открытия. Этот же стимул может деактивировать ионные каналы, бывшие активными в покое. Важно помнить, что активация или деактивация канала означает возрастание или снижение вероятности открытия канала, но не увеличение или уменьшение времени открытого состояния (т) канала.
Помимо активации и деактивации, ионный ток через каналы регулируется двумя другими факторами. Первый фактор заключается в том, что ионный канал переходит в новое конформационное состояние, в котором обычный активирующий стимул не способен вызвать открытие канала. Для ионных каналов, активируемых деполяризацией, такое состояние называется инактивацией. Для каналов, отвечающих на химические стимулы, это состояние известно как десенситнзация. Второй механизм – блок открытого канала. Такое случается, когда, например, крупная молекула (такая как токсин) связывается с ионным каналом и физически закупоривает пору. Другим примером может служить блокирование некоторых катионных каналов ионами магния. В этом случае ионы магния сами не проникают через ионный канал, но связываются с каналом в области его устья и тем самым мешают проникновению других катионов.
Некоторые каналы специфически отвечают на физические изменения в клеточной мембране нейрона. Наиболее яркими представителями этой группы являются потенциал-активируемые каналы. Примером может служить чувствительный к потенциалу натриевый канал, который отвечает за регенеративную деполяризацию, лежащую в основе генерации потенциала действия. К этой группе относятся также механочувствительные ионные каналы, которые отвечают на механическое воздействие на клеточную мембрану. Рецепторы растяжения, содержащие ионные каналы такого рода, найдены в механорецепторах кожи.
Другие ионные каналы открываются тогда, когда химические агенты активируют связывающие центры на молекуле канала. Такие лиганд-активируемые ионные каналы подразделяются на две подгруппы, в зависимости от того, являются ли активные центры внутриклеточными или внеклеточными. Каналом, отвечающим на внеклеточную активацию, является катионный канал постсинаптической мембраны в скелетной мышце. Этот канал активируется нейротрансмиттером ацетилхолином, освобождающимся из двигательного нервного окончания. Открытие ацетилхолин-активируемого ионного канала позволяет ионам натрия войти в клетку, вызывая деполяризацию мышечного волокна.
Лиганд-активируемые каналы, отвечающие на внутриклеточные стимулы, включают каналы, чувствительные к местным изменениям концентрации специфических ионов. Например, кальций-активируемые калиевые каналы активируются локальным повышением концентрации внутриклеточного кальция. Такие каналы играют важную роль в реполяризации клеточной мембраны во время завершения потенциала действия. Помимо ионов кальция, типичными представителями лигандов, активирующих ионные каналы с цитоплазматической стороны мембраны, являются циклические нуклеотиды. Циклический ГМФ, например, отвечает за активацию натриевых каналов в палочках сетчатки. Такой тип канала играет принципиальную роль в работе зрительного анализатора.
Эта классификация не является достаточно строгой. Например, кальций-активируемые калиевые каналы чувствительны также к изменению потенциала, а некоторые потенциал-активируемые ионные каналы чувствительны к внутриклеточным лигандам.
Для измерения ионных токов через одиночные каналы первоначально был предложен непрямой метод анализа мембранного шума. Затем был разработан способ прямой регистрации одиночных ионных каналов с помощью метода, который называется пэтч-кламп (patch-clamp). В совокупности эти подходы дали прямые ответы на вопросы, касающиеся функции ионных каналов, как то: какой заряд проходит через одиночный канал? как долго канал остается открытым? как время нахождения ионного канала в открытом или закрытом состоянии зависит от мембранного потенциала?
Таким образом, пэтч-кламп метод предоставляет новые уникальные возможности для изучения поведения ионных каналов. Во-первых, изоляция маленького участка мембраны позволяет наблюдать активность всего нескольких ионных каналов, а не тысяч, которые активируются в целой клетке. Во-вторых, высокое сопротивление контакта дает возможность регистрировать даже крайне одиночных ионных каналов и можем провести анализ кинетики каналов.
До разработки пэтч-кламп метода свойства ионных каналов в клеточных мембранах исследовались в экспериментах, в которых для измерения мембранного потенциала или мембранного тока использовались стеклянные микроэлектроды. Использование Лингом и Джерардом в 1949 году стеклянных микроэлектродов для внутриклеточной регистрации ионных токов в живых клетках было не менее важным событием, чем введение пэтч-кламп метода три десятилетия спустя. Этот метод обеспечивал точное измерение мембранного потенциала покоя клетки, потенциала действия, а также ответов на синаптическую активацию мышечных волокон и нейронов.
Метод внутриклеточной регистрации. Острая стеклянная микропипетка, диаметр кончика которой не превышает 0,5 мкм, заполненная концентрированным солевым раствором (например, 3 M KC1), служит электродом и присоединяется к вольтметру для записи потенциала. Момент прокалывания пипеткой клеточной мембраны, приводящий к проникновению ее в клеточную цитоплазму, проявляется мгновенным появлением потенциала, соответствующего мембранному потенциалу покоя. При удачном проникновении в клетку мембрана обхватывает внешнюю поверхность пипетки, благодаря чему цитоплазма остается изолированной от внеклеточной жидкости.
Используя известную из физики технику анализа шума, Катц и Миледи смогли получить информацию о среднестатистическом поведении отдельного ионного канала, активируемого АХ. Позднее подобные эксперименты были проведены на том же объекте Anderson и Stevens. В отличие от предшественников, эти исследователи измеряли мембранный ток, вызванный АХ, что позволило установить величину и продолжительность ионных токов через одиночный канал.
Принципы анализа шума достаточно просты: во-первых, если токи одиночного канала являются большими, суммарный шум также будет большим. Во-вторых, ионные каналы, открывающиеся на относительно длительное время, будут продуцировать низкочастотный шум; наоборот, каналы, открывающиеся на короткое время, будут продуцировать высокочастотный шум. Исследование амплитудно-временных характеристик шумов, активированных АХ в нервно-мышечном синапсе, показало, что через одиночный открытый ионный канал проходит около 10 миллионов ионов в секунду. Кроме того, выяснилось, что значение среднего открытого времени ионного канала составляет от 1 до 2 мс.
Несмотря на широкое вытеснение пэтч-кламп методом, анализ шума до сих пор используется для изучения ионных каналов в клетках, которые не поддаются исследованию с помощью пэтч-клампа, например, в некоторых областях центральной нервной системы. Кроме того, анализ шума является сравнительно быстрым методом для получения информации о свойствах большой популяции каналов и используется в комбинации с пэтч-кламп регистрацией от целой клетки для идентификации типов каналов. Тем не менее, надо понимать, что с помощью анализа шума невозможно получить детальную информацию о поведении одиночного канала, особенно в каналах со сложной кинетикой или при наличии нескольких уровней проводимости канала.
Кинетическое поведение канала, то есть время его нахождения в закрытом и открытом состояниях, может предоставить информацию о механизмах открытия и закрытия канала, а также о константах скоростей этих процессов. С другой стороны, величина тока, проходящего через ионный канал, является прямым отражением того, как быстро проникающие ионы движутся через канал. Ток ионов зависит не только от свойств канала, но также от трансмембранного потенциала. На этом рисунке изображен фрагмент мембраны, который содержит один спонтанно активный ионный канал, проницаемый для калия. Растворы, как в пипетке, так и в ванночке для объекта, содержат одинаковую (150 ммоль) концентрацию ионов калия. Ионы калия через открытый канал могут двигаться в обоих направлениях. Однако поскольку концентрации ионов по обе стороны мембраны идентичны, а трансмембранный потенциал отсутствует, то нет никакого движения ионов ни в одном Пэтч-кламп метод имеет достоинство, которое еще не было упомянуто: мы можем менять потенциал на регистрирующей пипетке и варьировать, таким образом, трансмембранную разность потенциалов. Например, при мембранном потенциале +20 Мв каждое открытие калиевого ионного канала сопровождается током, направленным наружу. Это связано с тем, что положительно заряженные ионы калия двигаются через канал по электрическому градиенту между раствором в пипетке и в ванночке. С другой стороны, когда внутри пипетки создан отрицательный потенциал величиной в -20 мВток направлен в обратном направлении (через открытый канал в пипетку).
Зависимость тока является линейной: ток (I), проходящий через канал, пропорционален потенциалу (V): 
Это формула представляет собой преобразованный закон Ома. Константа 7 называется проводимостью канала. При одном и том же потенциале на мембране канал с высокой проводимостью переносит много тока, канал с низкой проводимостью проводит малый ток.
Проводимость измеряется в сименсах (См). В нейронах трансмембранный потенциал обычно выражается в милливольтах (1 мВ = 10 –3 В), токи одиночных ионных каналов в пикоамперах (1 пА = 10 –12 А), проводимость в пикосименсах (1 пСм = 10 –12 См). потенциал +20 мВ продуцировал ток около 2,2 пА, соответственно проводимость канала (I/V) составила 2,2 пА/20 мВ = 110 пСм
Электрические сигналы в нервной системе генерируются движением ионов через мембрану нервной клетки. Эти ионные токи протекают через водные поры трансмембранных белков, известных как ионные каналы.
Каналы различаются по своей избирательности: некоторые катионные каналы пропускают только натрий, калий или кальций, другие являются менее избирательными. Анионные каналы сравнительно не избирательны для малых анионов, но они пропускают в основном ионы хлора, так как хлор является самым распространенным анионом внеклеточной и внутриклеточной жидкостей.
Крутько В.Н., Славин М.Б., Смирнова Т.М. Математические основания геронтологии.
Реутов В.П. и др. Проблема оксида азота в биологии и медицине и принцип цикличности.
Методология биологии: новые идеи (синергетика, семиотика, коэволюция). Ред. Баксанский О.Е.
К рецепторным клеткам подходят нервные волокна — отростки биполярных клеток, тела которых располагаются в ganglion scarpae. Рецепторные клетки формируют синаптическую связь с дендритами биполярных клеток. Аксоны биполярных клеток образуют вторую, вестибулярную, ветвь слухового нерва. Они идут в мозжечок, спинной мозг, продолговатый мозг, мост, вегетативные ганглии. Вестибулярные проекции есть в височной коре, однако точные пути до сих пор не определены. Большинство исследователей полагает, что эти проекции ответственны за головокружение. Активация проекций на более низких уровнях мозга вызывает тошноту и рвоту при “морской болезни” во время движения. Проекции в ядра ствола мозга участвуют в управлении шейными мышцами и контролируют положение головы.
Существуют связи с ядрами черепномозговых нервов (третьим, четвертым, шестым), которые участвуют в управлении мышцами глаз. При движении человека голова покачивается и постоянно меняет свое положение. Мышцы приспосабливают положение глаз относительно изменения положения головы. Это явление называется вестибулоокулярным рефлексом, и именно он обеспечивает стабильность изображения на сетчатке. У людей с поврежденным вестибулярным аппаратом возникают проблемы зрительного восприятия в процессе ходьбы или бега (Carlson, 1992).
Электрическая импульсация в волокнах вестибулярного нерва отмечается и в покое. Но она значительно повышается при поворотах головы или каких-то частей тела, что свидетельствует о синтезе информации, поступающей из различных источников. Вестибулорецепторы могут адаптироваться, поскольку при длительном вращении человека импульсация от них постепенно снижается.
Вкусовое восприятие
.летки, чувствительные к химизму среды, по-видимому, первыми появи-[шсь в процессе эволюции, потому что неосвещенная водная среда, являю-даяся колыбелью жизни, создавала условия, в которых такого рода детек-дия была необходима (Ходгсон, 1974). Однако этот тип восприятия наименее исследован. Уже отмечалось, что не существует четкой физической или Химической шкалы, позволяющей классифицировать воздействия на рецеп-эры вкуса, как это выявлено в отношении света и звука.
Вкусовые стимулы
Ощущение вкуса продукта возникает после растворения его в слюне. Вкусовые ощущения изменяются от вещества к веществу, однако число вариаций меньше, чем диапазон самих веществ. Различают четыре вкуса: сладкий, соленый, горький, кислый. Ощущение естественного вкуса неотделимо от запаха. Приправы как раз и сочетают в себе и вкус, и запах. У людей, не воспринимающих запахи, например из-за насморка, ухудшается и ощущение вкуса.
Большинство позвоночных, как и человек, обладает способностью различать также четыре вкуса (кроме кошек, у которых нет рецепторов для восприятия сладкого). Большая часть исследователей полагает, что у животных рецепторы сладости сигнализируют о съедобности материала, поскольку наиболее сладкие продукты — овощи и фрукты — в основном безопасны для пищи. Рецепторы солености помогают животным определять хлористый натрий в пище и тем самым регулировать его концентрацию.
Значительное число животных избегает кислого и горького. Деятельность гнилостных бактерий приводит к возникновению у продуктов кислого вкуса, поэтому наличие рецепторов, распознающих кислое, увеличивает жизнеспособность животных. Горькость обеспечивается алкалоидами, вырабатываемыми рядом растений для защиты от поедания, поэтому большинство животных не ест горького, что позволяет им избежать многих ядов (Carlson, 1992).
Рецепторы вкуса
Вкусовые рецепторы находятся на многих органах ротовой полости в различной концентрации: на языке, нёбе, миндалине, задней стенке глотки, надгортаннике. В общей сложности их около 10000, и наибольшее количество встречается на кончике, краях и задней части языка. На середине языка и нижней его поверхности вкусовых рецепторов нет.
Рецепторы располагаются на сосочках языка. Каждый сосочек окружен порой, необходимой для сбора и накопления слюны, в которой растворя-
| Рис. 6. IS. Области языка, чувствительные к различным вкусовым ощущениям (Carlson, 1992). |
На языке около 2000 вкусовых почек. К каждой подходит 2-3 эфферентных волокна, оканчивающихся на вкусовых клетках. Передняя часть языка иннервируется волокнами язычного нерва (веткой тройничного нерва), задняя треть — языкогло-точного, небольшая часть надгортанника — вагусом. Раздражение электрическим током этих нервов вызывает ощущение вкуса. Для ощущения едкого, вяжущего и терпкого вкуса дополнительно требуется раздражение обонятельных, болевых, тепловых и тактильных рецепторов полости рта. Для всех нервов, несущих информацию от вкусовых рецепторов, характерна адаптация, т. е. прекращение импульсации при длительном воздействии одного и того же вещества (Бабский и др., 1972).
Вкусовые рецепторы различного типа распределены на поверхности языка неравномерно. Кончик языка наиболее чувствителен к сладкому и соленому, боковые стороны языка сильнее реагируют на кислое, а задняя его часть, мягкое небо и глотка лучше воспринимают горькое (рис. 6.18).
До сих пор точно неизвестно, один или два вида рецепторов имеется у человека для сладкого. Предполагается, что существуют отдельные рецепторы, реагирующие на сахарин и нечувствительные к глюкозе, а также рецепторы, активирующиеся при действии глюкозы (Schiffman e. а., 1986). По-видимому, нет одного типа рецепторов для горького. У людей с наследственной недостаточностью в определении вкуса фенилтиокарбамида одновременно снижена чувствительность к кофеину, но они могут ощущать горький вкус некоторых других веществ (Hall e. а., 1975).
Функциональные структуры клеточной мембраны. Клеточная мембрана (оболочка клетки) представляет собой тонкую липопротеиновую пластинку, содержание липидов – около 40%, белков – 60%. Схематично клеточную мембрану можно представить следующим образом: мембрана состоит из двойного слоя молекул фосфолипидов, покрытого изнутри слоем белковых молекул, а снаружи – слоем молекул сложных углеводов. В клеточной мембране имеются тончайшие канальцы – ионные каналы, обладающие селективностью. Различают каналы, которые пропускают только один ион (натрия, калия, кальция, хлора), либо несколько.
Потенциал покоя и потенциал действия. В состоянии покоя в протоплазме нервной клетки концентрация ионов калия более, чем в 30 раз превышает концентрацию этих ионов в наружном растворе. Мембрана практически непроницаема для натрия, тогда как калий проходит сквозь нее. Диффузия ионов калия из протоплазмы во внешнюю жидкость очень высокая, что и придает наружной мембране положительный заряд, а внутренней – отрицательный. Таким образом, концентрация ионов калия является основным фактором, формирующим и определяющим величину потенциала покоя (ПП).
При действии на клетку раздражения проницаемость мембраны для ионов натрия резко повышается и становится, примерно, в 10 раз больше проницаемости для ионов калия. Поэтому поток положительно заряженных ионов калия из протоплазмы во внешний раствор уменьшается, а возрастает поток положительно заряженных ионов натрия из внешнего раствора в протоплазму клетки. Это приводит к перезарядке мембраны, наружная поверхность становится заряженной электро-отрицательно, а внутренняя - положительно (фаза деполяризации).
Повышение проницаемости мембраны для ионов натрия продолжается очень короткое время. Вслед за этим в клетке возникают восстановительные процессы, приводящие к тому, что проницаемость для ионов натрия снова понижается, а проницаемость ее для ионов калия возрастает. И в итоге этих двух процессов снова наружная мембрана приобретает положительный заряд, а внутренняя – отрицательный (фаза реполяризации).
Мгновенное увеличение проницаемости для ионов натрия и их проникновение в клетку достаточно, чтобы изменить знак мембранного потенциала и возникает потенциал действия (ПД), который распространяется по аксону с довольно большой скоростью, длительность ПД обычно составляет 1-3 мс.
Синаптическая передача информации. Место передачи возбуждения с одного нейрона на другой называется синапсом (в переводе с греческого – контакт). Синапс представляет собой мембраны двух соседних нейронов (пресинаптическая и постсинаптическая мембраны) и пространство между ними, которое называется синаптической щелью.
Различают аксо-соматические синапсы, сформированные мембранами аксона и телом (сомой) другого нейрона, аксо-дендритные, состоящие из мембраны аксона и дендритами другого нейрона, аксо-аксональные, при которых аксон подходит к аксону другого нейрона. Синапс между аксонами и мышечными волокнами называется нейромышечной пластинкой.
Нервный импульс по аксону достигает окончания аксона и вызывает открытие каналов для кальция на пресинаптической мембране. Здесь, на пресинаптической мембране находятся везикулы (пузырьки), которые содержат биологически активные вещества – медиаторы.
Открытие кальцевых каналов приводит к деполяризации на пресинаптической мембране. Кальций входит в связь с белками, образующими оболочку пузырьков, в которых хранится медиатор. Затем пузырьки лопаются и все содержимое поступает в синаптическую щель. Далее молекулы медиатора связываются со специальными белковыми молекулами (рецепторами), которые находятся на мембране другого нейрона – на постсинаптической мембране.
Когда молекулы медиаторов связываются с рецепторами, то на постсинаптической мембране открываются каналы для ионов натрия и калия, вызывая на ней изменение потенциала (деполяризацию). Этот потенциал получил название – постсинаптический потенциал (ПСП). В зависимости от характера открытых ионных каналов возникает возбудительный (ВПСП) или тормозный (ТПСП) постсинаптические потенциалы
Рис. 3.Структура синапса 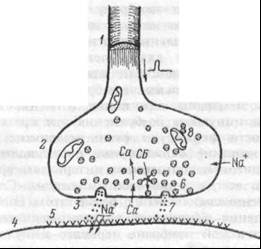 | 1 — аксон, 2 — синаптическая пуговка, 3 — пресинаптическая мембрана, 4 — постсинаптическая мембрана, 5 — рецепторы постсинаптической мембраны, 6 — синаптические пузырьки с медиатором, 7 — кванты медиатора в синаптической щели. |
Таким образом, возбуждение (ПД) нейрона в синапсе превращается из электрического импульса в химический импульс (выброс медиатора из везикул).
Время между началом пресинаптической деполяризации и постсинаптической реакцией составляет 0,5 мс, это – синаптическая задержка.
Основные медиаторы: ацетилхолин, моноамины (серотонин, гистамин), катехоламины (дофамин, норадреналин, адреналин), аминокислоты (глутамат, глицин, аспартат, гамма-аминомаслянная кислота – ГАМК, аланин), пептиды, вазопрессин, окситоцин, аденозин, АТФ и др.
Вопросы для самопроверки
1. Нервная ткань и ее основные функции.
1. Нейрон, функциональные структуры нейрона.
2. Функциональные структуры клеточной мембраны.
3. Потенциал покоя и потенциал действия – ионные механизмы.
4. Синапс и синаптическая передача.
5. Характеристика наиболее известных медиаторов.
Кинетическое поведение канала, то есть время его нахождения в закрытом и открытом состояниях, может предоставить информацию о механизмах открытия и
Передача информации в нервной системе
Другие материалы по предмету
Передача информации в нервной системе
Передача информации в нервной системе
Электрические сигналы, обеспечивающие функционирование нервных клеток, опосредованы потоком ионов через водопроницаемые поры клеточной мембраны. Эти поры, образованные трансмембранными белками, называются ионными каналами. К настоящему времени разработаны высокочувствительные методы, позволяющие зарегистрировать и измерить ионные токи, протекающие через одиночные ионные каналы.
Некоторые ионные каналы избирательно проницаемы только для катионов, тогда как другие проводят только анионы. Катионные каналы могут быть высоко избирательными по отношению к одному иону, например натрию. Ионные каналы совершают переходы между открытым и закрытым состоянием и имеют, как правило, характерное время открытого состояния. Их вклад в ионный ток через клеточную мембрану определяется относительным количеством времени, которое они находятся в открытом состоянии.
Открытие канала регулируется различными механизмами. Некоторые из этих механизмов физические, такие как растяжение мембраны или изменения мембранного потенциала. Другие механизмы химические, включающие связывание активных молекул (лигандов) с активным центром, который располагается либо с внеклеточной, либо с внутриклеточной стороны канала.
Важным свойством каналов, в дополнение к кинетике открытия и закрытия, является способность открытого канала проводить ионный ток. Один из способов, которым ионы могут проникать через открытый канал, является простая диффузия. Другой способ взаимодействие ионов с внутриканальными центрами связывания и перескакивание внутри водной поры от одного центра к другому. В любом случае движение иона через канал является пассивным и определяется градиентом концентрации и градиентом электрического потенциала на мембране.
Количество тока, проходящего через открытый канал по электрическому градиенту, зависит от проницаемости канала для данного типа ионов. Величина тока также зависит от концентрации ионов в устьях канала. Эти два фактора, проницаемость и концентрация, определяют проводимость канала.
Передача импульса в нервной системе опосредуется изменениями мембранного потенциала. В сенсорных нейронах адекватный стимул, такой как прикосновение, звук, свет, вызывает локальную деполяризацию (делая мембранный потенциал менее негативным) или гиперполяризацию (мембранный потенциал становится более негативным). Подобным же образом нейротрансмиттеры в синапсах вызывают деполяризацию или гиперполяризацию постсинаптической клетки. Потенциалы действия, представляющие собой короткие деполяризационные сигналы большой амплитуды, проводят по отросткам нейрона информацию из одного отдела нервной системы в другой.
Все эти изменения мембранного потенциала вызваны движением ионов через клеточную мембрану. Например, направленное внутрь клетки движение положительно заряженных ионов натрия снижает общий отрицательный заряд мембраны или, другими словами, вызывает деполяризацию. Наоборот, результатом движения положительно заряженных ионов калия из клетки является рост общего отрицательного заряда, то есть гиперполяризация. Гиперполяризация может быть обусловлена также движением внутрь клетки отрицательно заряженных ионов хлора.
Как движутся ионы через клеточную мембрану и чем их движение регулируется? Главным путем для быстрого перемещения ионов внутрь клетки и из нее являются ионные каналы. Ионные каналы представляют собой встроенные в мембрану молекулы белка, которые образуют поры, проницаемые для ионов. Ионные токи регулируются через открытие и закрытие этих ионных каналов. Знание механизмов работы ионных каналов позволяет понять, как генерируются электрические сигналы.
Свойства ионных каналов. Клеточная мембрана нервной клетки
Клеточные мембраны состоят из жидкой фазы липидов и встроенных в липиды белковыхмолекул. Молекулы липидов организованы в двухслойную мембрану (бислой) толщиной около 6 нм. Полярные гидрофильные головки липидов обращены к поверхностям мембраны, а гидрофобные хвосты вытянуты к середине бислоя. Липиды плохо пропускают воду и практически непроницаемы для ионов. Белковые молекулы частично погружены в слой липидов, либо с внеклеточной, либо с цитоплазматической стороны. Некоторые белки целиком пронизывают мембрану. Именно пронизывающие мембрану (трансмембранные) белки образуют ионные каналы. Основные ионы, участвующие в генерации электрических сигналов, такие как калий, натрий, кальций или хлор, движутся через ионные каналы пассивно благодаря градиенту концентраций и электрическому потенциалу мембраны.
Другие трансмембранные белки служат в качестве насосов и переносчиков, обеспечивающих транспорт веществ через клеточную мембрану против электрохимических градиентов. Транспортные механизмы поддерживают ионный состав цитоплазмы, удаляя или возвращая те ионы, которые прошли клеточную мембрану по их электрохимическим градиентам. Они также выполняют важную функцию переноса через клеточные мембраны субстратов метаболических реакций, таких как глюкоза и аминокислоты
Для ионных каналов функционально важными являются переходы между открытым и закрытым состояниями. Эти переходы совершаются практически моментально. С другой стороны, при системном изучении поведения любого ионного канала мы обнаружим, что время открытого состояния варьирует случайным образом. Иногда канал открыт только одну миллисекунду или даже меньше, хотя в следующий раз он может быть открыт на гораздо более продолжительное время. Тем не менее, каждый канал имеет характерное среднее время открытого состояния (т), и все вариации происходят вокруг этого среднего показателя.
Некоторые ионные каналы открываются достаточно часто даже в покое. Иными словами, вероятность нахождения таких каналов в открытом состоянии в неактивированной клетке относительно высока. Большинство таких ионных каналов проницаемо для калия или хлора. Они важны для генерации мембранного потенциала покоя. Остальные ионные каналы при этом закрыты, то есть вероятность нахождения их в открытом состоянии очень низка. Активация этих каналов адекватным стимулом резко увеличивает вероятность открытия. Этот же стимул может деактивировать ионные каналы, бывшие активными в покое. Важно помнить, что активация или деактивация канала означает возрастание или снижение вероятности открытия канала, но не увеличение или уменьшение времени открытого состояния (т) канала.
Помимо активации и деактивации, ионный ток через каналы регулируется двумя другими факторами. Первый фактор заключается в том, что ионный канал переходит в новое конформационное состояние, в котором обычный активирующий стимул не способен вызвать открытие канала. Для ионных каналов, активируемых деполяризацией, такое состояние называется инактивацией. Для каналов, отвечающих на химические стимулы, это состояние известно как десенситнзация. Второй механизм блок открытого канала. Такое случается, когда, например, крупная молекула (такая как токсин) связывается с ионным каналом и физически закупоривает пору. Другим примером может служить блокирование некоторых катионных каналов ионами магния. В этом случае ионы магния сами не проникают через ионный канал, но связываются с каналом в области его устья и тем самым мешают проникновению других катионов.
Некоторые каналы специфически отвечают на физические изменения в клеточной мембране н
Читайте также:


