Предшественник синтеза дофамина при болезни паркинсона
Препараты подгрупп исключены. Включить
Описание
Данная фармакотерапевтическая группа объединяет лекарственные средства, обладающие способностью устранять или облегчать симптомы болезни Паркинсона (наследственно-дегенеративное хроническое прогрессирующее заболевание) и синдрома паркинсонизма. Последний может быть обусловлен различными поражениями ЦНС (инфекции, интоксикации, травмы, атеросклероз мозговых сосудов и т.д.), а также применением некоторых препаратов, в т.ч. нейролептиков, антагонистов кальция и др.
Патогенез болезни Паркинсона и ее синдромальных форм остается неясным. Однако установлено, что эти состояния сопровождаются дегенерацией нигростриарных дофаминергических нейронов и/или уменьшением содержания дофамина в стриопаллидарной системе. Дефицит дофамина приводит к повышенной активности холинергических интернейронов и, как следствие, развитию дисбаланса нейромедиаторных систем. Нарушение равновесия между дофаминергической и холинергической нейротрансмиссией проявляется гипокинезией (скованность движений), ригидностью (выраженный гипертонус скелетных мышц) и тремором покоя (постоянное непроизвольное дрожание пальцев, кистей, головы и т.д.). Кроме этого у пациентов развиваются постуральные расстройства, усиливается саливация, потоотделение и секреция сальных желез, появляется раздражительность и плаксивость.
Целью фармакотерапии болезни Паркинсона и ее синдромальных форм является восстановление баланса между дофаминергической и холинергической нейротрансмиссией, а именно: усиление дофаминергических функций или подавление холинергической гиперактивности.
К лекарственным средствам, способным усиливать дофаминергическую передачу в ЦНС , относятся леводопа, агонисты дофаминовых рецепторов, ингибиторы МАО типа В и катехол-О-метилтрансферазы (КОМТ) и др.
Леводопа устраняет дефицит эндогенного дофамина в нейронах стриопаллидарной системы. Она представляет собой физиологический предшественник дофамина, который не обладает способностью проникать через ГЭБ . Леводопа проникает через ГЭБ по аминокислотному механизму, подвергается декарбоксилированию при участии ДОФА-декарбоксилазы и эффективно повышает уровень дофамина в стриатуме. Однако процесс декарбоксилирования леводопы происходит и в периферических тканях (где нет необходимости в повышении уровня дофамина), обусловливая развитие нежелательных эффектов, таких как тахикардия, аритмия, гипотензия, рвота и др. Экстрацеребральная продукция дофамина предотвращается ингибиторами ДОФА-декарбоксилазы (карбидопа, бенсеразид), которые не проникают через ГЭБ и не влияют на процесс декарбоксилирования леводопы в ЦНС . Примером комбинаций леводопа + ингибитор ДОФА-декарбоксилазы являются препараты Мадопар, Синемет и др. Значительное повышение уровня дофамина в ЦНС может приводить к нежелательным эффектам, таким как появление непроизвольных движений (дискинезия) и психических расстройств. Избежать выраженных колебаний уровня леводопы и ряда ее побочных эффектов позволяет использование препаратов с контролируемым высвобождением действующего вещества (Мадопар ГСС, Синемет СР). Такие препараты обеспечивают стабилизацию плазменных уровней леводопы, сохранение их на более высоком уровне на несколько часов дольше, а также возможность уменьшения кратности приема.
Повысить содержание дофамина в стриопаллидарной системе можно не только за счет увеличения его синтеза, но и за счет торможения катаболизма. Так, МАО типа В разрушает дофамин в полосатом теле. Этот изофермент селективно блокируется селегилином, что сопропровождается угнетением катаболизма дофамина и стабилизацией его уровня в ЦНС . Кроме того, антипаркинсонический эффект селегилина обусловлен нейропротективными механизмами, в т.ч. угнетением образования свободных радикалов. Деградация леводопы и дофамина путем метилирования блокируется ингибиторами другого фермента — КОМТ (энтакапон, толкапон).
Агонисты дофаминовых рецепторов также могут устранять признаки дефицита дофаминергической нейротрансмиссии. Некоторые из них (бромокриптин, лизурид, каберголин, перголид) являются производными алкалоидов спорыньи, другие — неэрготаминовыми субстанциями (ропинирол, прамипексол). Эти ЛС стимулируют D1, D2 и D3 подтипы дофаминовых рецепторов и, по сравнению с леводопой, характеризуются меньшей клинической эффективностью.
Способствовать восстановлению нейромедиаторного баланса в ЦНС за счет угнетения холинергической гиперактивности могут холинолитики — антагонисты м-холинорецепторов (бипериден, бензатропин). Периферические холинолитические эффекты наряду с нарушением когнитивных функций в значительной мере ограничивают использование этой группы препаратов. Однако они являются препаратами выбора при лекарственном паркинсонизме.
Производные амантадина (гидрохлорид, сульфат, глюкуронид) взаимодействуют с рецепторами ионных каналов N-метил-D-аспартат (NMDA) глутаматных рецепторов и уменьшают высвобождение ацетилхолина из холинергических нейронов. Компонентом антипаркинсонического эффекта производных амантадина является и непрямое дофаминомиметическое действие. Они обладают способностью увеличивать высвобождение дофамина из пресинаптических окончаний, тормозить его обратный захват и повышать чувствительность рецепторов.
В настоящее время стало известно, что лекарственные средства на основе активных форм кислорода (водорода пероксид) способны при назальном применении рефлекторным путем повышать физиологическую эффективность нейромедиаторов, регулировать нейротрансмиттерные взаимодействия, индуцировать антиокислительные и нейропротекторные механизмы мозга.
Терапевтический эффект антипаркинсонических средств развивается постепенно. Одни из них в большей степени влияют на гипокинезию и постуральные расстройства (леводопа, агонисты дофаминовых рецепторов), другие — ослабляют тремор и вегетативные нарушения (холинолитики). Возможно проведение как моно-, так и комбинированной (препараты из разных групп) антипаркинсонической терапии. Следует учитывать, что лечение болезни Паркинсона и ее синдромальных форм — симптоматическое, поэтому эффекты антипаркинсонических препаратов проявляются в период применения и непродолжительное время после их отмены. Дозирование этих средств должно быть максимально индивидуализировано. Режим назначения предусматривает кратковременные перерывы (1–2 в неделю) в приеме для предупреждения возникновения толерантности. Не рекомендуются длительные перерывы в терапии антипаркинсоническими препаратами (возможны тяжелые или необратимые нарушения двигательной активности), но в случае необходимости отмена лечения проводится постепенно во избежание обострения симптомов.
Дофамин. Нервные клетки, которые передают импульсы с помощью дофамина, сосредоточены преимущественно в трёх областях: в гипоталамусе, в чёрной субстанции и в вентральной покрышке. Нейромедиатором он работает только тут.
Итак, гипоталамус. Те нервные клетки, которые пользуются дофамином, чтобы общаться между собой, в этой области довольно замкнуты друг на друга: далеко свои аксоны не тянут, предпочитают свой тесный внутренний круг. Но при этом рулят довольно важными системными функциями: могут отдать команду на выработку ряда гормонов или тормознуть её, могут также, к примеру, понизить мотивацию на предмет чего-нибудь пожрать, могут усилить агрессивность или повысить либидо. Раз — и вектор человеческого поведения заметно поменялся.
Ну с гипоталамусом учёным ещё долго разбираться, там уж очень тесно и сложно намешано нервного и гормонального, а вот в чёрном веществе и в вентральной покрышке дофаминовые нервные клетки изучены подробнее. Не в последнюю очередь из-за паркинсонизма, шизофрении и наркотиков.
Если дофамина в чёрном веществе дофига, и чёрная субстанция активна, то такие люди — как правило, живчики. То есть, с удовольствием двигаются, танцуют, занимаются спортом и вообще получают кайф от движения. Те, кто победнее дофамином в своей чёрной субстанции — внешне кажутся более ленивыми, зато умеют получать удовольствие от чего-то иного: еды, например, новизны как таковой, созерцания.
Отростки нервных клеток из этой чёрной субстанции не только между собой соединены: в отличие от тех, что в гипоталамуса, у них более длинные лапки. И много таких отростков идут вверх, к большим полушариям головного мозга. И в частности — к скоплениям нервных клеток, которые названы базальными ганглиями. 80% этих ганглиев отвечают за движения.
На оставшиеся 20% идут отростки от другого образования —вентральной покрышки - на них-то как раз во многом завязана система, которая отвечает за формирование потребностей и мотиваций, которая тесно связана с эмоциями.
Соответственно, и нарушение работы в этой связке тоже не проходит для человека бесследно. Если в силу ряда (в том числе генетических) причин покрышка работает слабо — человек недополучает положительные эмоции от новизны. И в ряде случаев это оказывается стержнем будущей депрессии. Если дофамина в покрышке слишком много — получите скачку идей и неспособность долго сосредоточиться на одной мысли, как при выраженной мании. В отдельных же случаях система срабатывает вхолостую: вроде бы и нет входящего стимула, а отклик в покрышке почему-то возник.
Среди тех базальных ганглиев, к которым идут отростки от покрышки, есть такое образование — прилежащее ядро, или nucleus accumbens - центр, генерирующий положительные эмоции.
Именно на связь покрышки с прилежащим ядром и действуют наркотики амфетамин и кокаин, разгоняя, усиливая действие дофамина в ней. Именно это действие и даёт тот фейерверк положительных эмоций, тот прилив бодрости и сил, а также ощущение предельной собранности и кристальной ясности мышления вкупе с его быстротой.
![]()
Уж если в заголовок вынес болезнь Паркинсона, то как-то надо поподробнее про неё. И не понятно за каким ты в конце наркоту приплел ко всему. Начал за здравие, а кончил за упокой
Наркота, типа феназепама, вызывает синдром паркинсонизма
Внутри шизофрении. Часть 1.
Заболевание, которое можно счесть за шизофрению, было известно с древних времен, возможно, даже доисторических. Отчетливые упоминания есть в Библии (помните, как царь Навухудоносор кушал траву с луга?), ими сквозит Античность и так далее. Однако утверждать на 100% ничего невозможно: существуют психозы и помимо шизофрении, а также есть, например, паразиты, поражающие нервную систему и способные вызвать галлюцинации. К тому же, не надо забывать о сифилисе, который с человеком живет уж точно не меньше, чем шизофрения.

В историю шизофрении я не собираюсь сильно вдаваться, поскольку об этом много сказано. Все написанное выше я упоминаю только с одной целью: чтобы показать, насколько сложный и ускользающий смысл вкладывается в этот термин.
Здесь нужно сделать небольшую оговорку: нам с вами, с раннего детства давящимися плодами науки, которые созревали в течение столетий, люди прошлого могут казаться очень недалекими. Ну как тут было не отличить, скажем, расстройства настроения и психозы? Ну вот больного глючит, как скотину, а вот он просто грустный сидит. Очевидно же, что это разные заболевания! На самом деле, нет. Главная боль всей медицины состоит в том, что одна болезнь в большинстве случаев не мешает развиваться другой. И расстройства настроения (аффективные расстройства) не только не мешают психозам, а зачастую сочетаются.
(Вот и сам Крепелин):

Надо сказать, что в те годы содержимое черепа было настоящим черным ящиком для науки. Оно и сейчас в значительной мере остается черным ящиком, но тогда мы даже представить не могли, КАКАЯ херня там творится. Все эти нервные связи, нейромедиаторы, нейронные сети, колонки, контуры… Едва ли хоть кто-то догадывался, что все может быть устроено так странно. Сама идея о том, что электрическая активность мозга большей частью опосредуется химическими веществами – дикость какая-то. Поэтому все, что оставалось психиатрам тех лет – наблюдать и накапливать знания, надеясь на психиатров будущего.
Для того, чтобы хоть немного приоткрыть завесу тайны над заболеванием, нужны были очень крупные открытия в нейробиологии и нейрофизиологии, которые в те времена были невозможны просто технологически. Первый толчкок, который помог предположить истинные причины шизофрении, был со стороны фармакологии. Это открытие аминазина. Цитата с одного ресурса:
В 1950 году французский нейрохирург Генри Лабори предположил, что чрезмерные переживания его пациентов перед операцией вызывают выброс избыточного количества гистамина. Гистамин — небольшая молекула, которая регулирует сотни процессов в организме: от выделения желудочного сока до температуры. Лабори считал, что именно чрезмерный выброс гистамина из-за тревоги пациентов может вызывать осложнения анестезии и даже внезапную смерть.
Лабори методом проб и ошибок пытался подобрать подходящий антигистаминный препарат. Совершенно случайно он обнаружил, что не самое популярное лекарство — хлорпромазин — действительно успокаивает пациентов. Более того, хлорпромазин усиливал действие анестезии.
Предположение довольно типичное для тех времен, хотя и неверное. Тем не менее, ошибочное предположение привело к великому открытию – открытию первого на свете нейролептика. А сочетание нейролептиков с анестетиками используется до сих пор (нейролептанальгезия). Нейролептики (они же антипсихотики) – препараты, (относительно) избирательно действующие на симптомы психоза – бред и галлюцинации. Это открытие, в конечном счете, и помогло составить современные представления о причинах и патогенезе (т.е развитии болезни) шизофрении. Последовавшие исследования позволили открыть различные рецепторы в головном мозге, в том числе рецептора домафина. Именно тогда и оказалось, что основным эффектом нейролептиков является блокада эффектов дофамина, а дальше все заверте…
Вот мы и подошли к тому, чтобы описать сегодняшние представления о патогенезе шизофрении. Только представьте, какую дикую работу пришлось проделать, чтобы подойти к примерному представлению о том, как развивается эта психическая болезнь. Я буду идти в своем рассказе по такому принципу: от самых элементарных представлений на уровне молекул и клеток до нарушений в работе мозга в целом, а затем до нарушений психики.

Возможно, у вас уже возник вопрос: а почему тогда не использовать методы типа позитронно-эмисионной томографии или ф-МРТ и не выявить, какие отделы мозга работают неправильно? Да, заманчивая идея, и это, конечно же, пытались сделать, и даже есть результаты. Однако результаты эти породили больше вопросов, чем ответов. Действительно, удалось найти нарушения в работе мозга при шизофрении на ПЭТ и ф-МРТ, и касаются они преимущественно работы височных и лобных долей мозга, а также лимбической системы и их взаимодействия. Однако они встречаются не только при шизофрении, и не у всех шизофреников идентичны, чтобы можно было вбить в программу шаблон, который бы автоматически определял подобные изменения. Идея не нова, и в свое время изучали шизофрению с помощью рентгена, эхоэнцефалографии/скопии и других методик, однако результат всегда был похожим: да, что-то есть, но данных, однозначно указывающих на шизофрению, нет.
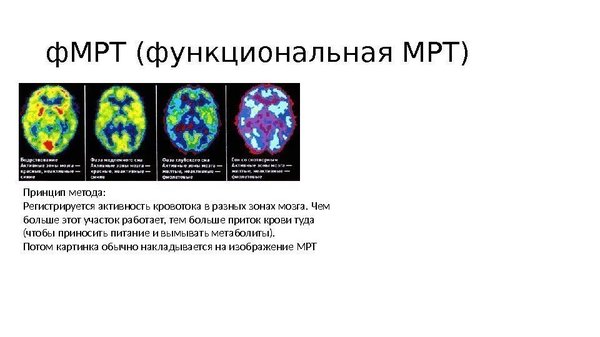
Как видно, даже здесь шизофрения дает прикурить. Очень мозаичное и скользкое заболевание, не дающее нам никакой нити, за которую можно было бы уцепиться и распустить весь клубок. Таким же оно предстает перед психиатрами – королева масок.
Как нетрудно догадаться, эти анатомические изменения порождают нейрохимические изменения, и тут, боюсь, придется вкратце напомнить основы нейрохимии мозга.
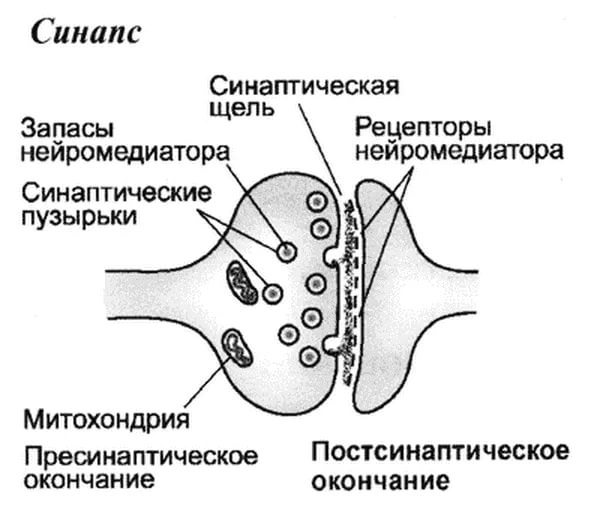
В нашем мозге постоянно осуществляется напряженная работа, которая проявляется в передаче электрических импульсов между нейронами. Соединение между двумя нейронами осуществляется с помощью специальной структуры – синапса. Примерно так он выглядит:
Дофамин – гормон удовольствия, который естественным образом вырабатывается в мозгу и дарит вам отличное настроение и ощущение уверенности в себе. Выбросы дофамина являются ответной реакцией на занятие чем-то приятным, к примеру вкусную еду или занятие сексом.[1] Недостаток же дофамина в организме может привести к ощущению усталости, депрессии и утрате интереса к жизни. Вот несколько способов, которые помогут вам повысить уровень дофамина в организме, если у вас неважное настроение.
Метод 1 из 3: С помощью диеты
2
Потребляйте больше антиоксидантов. Дофамин легко окисляется, а антиоксиданты могут уменьшить повреждение свободными радикалами, клеток мозга, отвечающих за производство дофамина. Многие фрукты и овощи богаты антиоксидантами, в частности к ним относятся:[3]
Бета-каротин и каротиноиды: зеленые овощи, оранжевые овощи и фрукты, спаржа, брокколи, свекла.
Витамин C: перец, апельсин, клубника, цветная капуста, брюссельская капуста.
Витамин Е: орехи и семечки подсолнуха, зеленые овощи, брокколи, морковь.[4]
Реклама
Метод 2 из 3: Изменив стиль жизни
1
Ведите активный образ жизни. Физические упражнения повышают уровень кальция в крови, что, в свою очередь, стимулирует более интенсивную выработку мозгом дофамина. Чтобы увеличить рост уровня дофамина, попробуйте ежедневно гулять по 30-60 минут, плавать или бегать трусцой.
Кроме того, это увеличит уровень эндорфинов, прямо как у Элль Вудс. Искренний смех или растяжка повысит содержание эндорфинов в крови, по эффекту сходных с действием дофамина. Однако, слишком высокий уровень эндорфинов может быть опасен, поскольку эндорфины снижают чувствительность к боли.[5]
2
Высыпайтесь. Одно из лучших средств для того, чтобы чувствовать себя полным энергии и быть готовым встретить день во всеоружии — выспаться. Дофамин связывают с ощущением бодрости, поэтому, чтобы быть бодрым — спите каждую ночь порядка 7-8 часов.
Или… не спите вовсе. Если вы хотите радикально увеличить уровень дофамина, но без положительных эмоций, знайте — уровень дофамина вырастает до небес при лишении (потере) сна. Вы будете чувствовать себя изнуренным, слабым и раздражительным, но ваш уровень дофамина будет выше крыши.[6][7]
1
Попринимайте пищевые добавки. Некоторые врачи рекомендуют принимать Витамин В6 и L-фенилаланин для повышения уровня дофамина. Данные добавки можно свободно приобрести в ближайшей аптеке. Аналогично, фенилэтиламин (РЕА), компонент, содержащийся в шоколаде, также поднимает уровень дофамина. Кроме того, он якобы может содействовать снижению веса. Его можно заказать через интернет. Но, перед этим обязательно посоветуйтесь с врачом.[8][9]
На других языках:
English: Increase Dopamine, Français: augmenter son taux de dopamine, Italiano: Incrementare la Dopamina, Español: aumentar la dopamina, Deutsch: Das Dopamin Niveau erhöhen, Português: Aumentar a Dopamina, Nederlands: Je dopaminegehalte verhogen, 中文: 增加多巴胺的分泌, Bahasa Indonesia: Meningkatkan Hormon Dopamin, Čeština: Jak zvýšit hladinu dopaminu, 日本語: ドーパミンを増やす
О
Противопаркинсонические средства
Противопаркинсонические средства. Общее
Эти средства используются при лечении больных с идиопатической болезнью Паркинсона (дрожательный паралич), а также у больных с синдромом паркинсонизма различного происхождения. Данный синдром может возникнуть при самых разнообразных поражениях нервной системы: инфекционных, сосудистых, токсических, травматических, а также онкологических и дегенеративных.
Болезнь Паркинсона представляет собой хроническое заболевание, при котором поражаются ядра экстрапирамидной системы. Обнаружено, что при этом заболевании в базальных ядрах (полосатое тело, состоящее из хвостатого ядра и скорлупы), а также в бледном шаре и, в так называемой, черной субстанции снижается содержание дофамина, который оказывает на структуру, включающую в себя хвостатое ядро и скорлупу приемущественно тормозящее влияние. Данное структурное образование участвует в регуляции функции спинного мозга. Дефицит дофамина в оральных отделах головного мозга как раз и является первичным биохимическим дефектом при паркинсонизме.
Черная субстанция при паркинсонизме постепенно обесцвечивается, так как в ней гибнут нейроны, содержащие пигмент нейромеланин. Данный пигмент образуется из катехоламинов ДОФА и дофамина. Кроме того, в патогенезе отдельных проявлений паркинсонизма могут участвовать серотонинергические, норадренергические, ГАМКергические и пептидергические системы.
Дофамин, как и другие катехоламины, образуется в организме из аминокислоты фенилаланина: фенилаланин переходит в тирозин, тот в ДОФА, который, в свою очередь, превращается в дофамин, из которого образуется норадреналин и, затем, адреналин. Каждый из этапов превращения требует наличие специфического фермента. Например, ДОФА превращается в дофамин благодаря ДОФА-декарбоксилазе.
Важным фактом является то, что дофаминергические нейроны локализуются не только в черной субстанции, но и в других структурах лимбико-ретикулярного комплекса:
в лимбической и префронтальной коре;
в ядрах миндалевидного комплекса;
в системах, связывающих гипоталамус с гипофизом. Отсюда понятна огромная роль дофамина, принимающего участие а контролировании психических, двигательных и эндокринных функций организма.
Высвобождение дофамина происходит под влиянием нервного импульса, который вызывает выброс квантов медиатора из пресинаптического пространства в синаптическую щель. Медиатор взаимодействует с дофаминергическим рецептором постсинаптической мембраны и вызывает ее деполяризацию. Выполнив эту задачу медиатор удаляется из синаптической щели.
Его устранение осуществляется двумя способами:
1. Около 80% выделившегося медиатора может быть возвращено в пресинаптическое пространство;
2. Оставшаяся часть дофамина инактивируется в основном с помощью фермента моноаминооксидазы (МАО).
Значение этих деталей неоспоримо, поскольку сейчас известны средства, позволяющие избирательно воздействовать (стимулировать или оказывать тормозящее влияние) на основные звенья медиаторной системы, перечисленные выше. Согласно этому можно выделить несколько принципиальных возможностей повышения эффективности фармакологической коррекции в виде заместительной терапии при паркинсонизме:
- повышение синтеза дофамина в головном мозге;
- прямая стимуляция рецепторов, чувствительных к дофамину;
- стимуляция процесса высвобождения дофамина из пресинаптического пространства;
- торможение процесса обратного поглощения дофамина из синаптической щели пресинаптическими структурами;
- торможение процесса метаболизма (распада) дофамина.
Все эти различные способы воздействия на синапс способствует оптимальному достижению одной цели – повышению его функциональной активности.
Наиболее частыми клиническими проявлениями болезни Паркинсона являются скованность движений (акинезия – a – отрицание, kinesis – движение), ригидность мышц (резко повышенный тонус мышц), а также тремор (постоянное непроизвольное мелкое дрожание).
В регуляции функции ядер экстрапирамидной системы принимиют участие также холинергические нейроны. При недостатке дофамина преобладают также холинергические структуры, причем происходит увеличение их активности, преимущественно в нигро-стриарном комплексе. Однако современные данные свидетельствуют о том, что в некоторых зонах (лобной коре, гиппокампе) наблюдается гибель холинергических рецепторов.
Возникающий дисбаланс между дофамин- и холинергическими нейромедиаторными системами регулируют с помощью лекарственных средств. Помимо дофаминергических преепаратов используют также так называемые центральные холиноблокаторы.
Противопаркинсонические средства. Классификация
1. Холинергические средства (циклодол, тремблекс).
2. Дофаминергические средства:
- средства, стимулирующие освобождение дофамина из везикул (мидантан)
- средства, тормозящие, снижающие обратный захват дофамина (аминотриптилин, мелипрамин).
- ингибиторы МАО (депренил, нуредал)
- средства, возбуждающие дофаминовые рецепторы (бромкриптин, лизурид, перголит, пиребедил, апоморфин и др.)
- средства, стимулирующие синтез дофамина (дофаминсодержащие препараты пролонгированного действия) (леводопа, наком, мадопар).
Противопаркинсонические средства. Леводопа
Наиболее эффективным средством при лечении больных паркинсонизмом является ЛЕВОДОПА (Levodopa; L-ДОФА, леводопа; в табл. по 0, 25; 0, 5). Леводопа представляет собой левовращающий изомер диоксифенилаланина, являющегося предшественником дофамина. Сам дофамин использоваться не может, так как не проникает через ГЭБ. Леводопа быстро всасывается из ЖКТ. В организме препарат превращается в дофамин. Накапливается в базальных ганглиях, дофамин устраняет проявления паркинсонизма. Особенно выражен эффект L -дофа в отношении акинезии. Действие препарата начинается через неделю и достигает максимума через месяц. Дозу постепенно увеличивают. Назначают после еды. Лечение длительное имеет характер заместительной терапии.
Побочные эффекты связаны с тем, что L-дофа проникает не только в головной мозг, но и в другие паренхиматозные органы. Нежелательные эффекты нивелируются снижением дозы. Однако лучше побочные эффекты устраняются комбинацией леводопы с ингибиторами перифирической дофа-декарбоксилазы, не проникающими через ГЭБ. Здесь следует сказать о следующих двух комбинированных препаратах:
– наком или синимет (леводопа плюс карбидопа);
– мадопар (леводопа плюс бенсеразид).
При использовании данных препаратов резко увеличивается колическтво L-дофы в ЦНС. Данные ингибиторы (карбидопа и бенсеразид) дофа-декарбоксилазы тормозяят образование дофамина лишь на периферии.
В качестве стимулятора рецепторов к дофамину используется бромкриптин (парлодол). Стимуляция освобождение дофамина из пресинаптического пространства достигается введением мидантана – противовирусного средства против гриппа А-2. Используют в случае непереносимости больными L-дофы, или когда L-дофа не показана (тяжелые сердечно-сосудистые заболевания, патологии почек, печени, психозы).
Мидантан снижает проявления акинезии, регидность, но не влияет на тремор.
Улучшение наступает через 1-2 дня, а максимальный эффект развивается через неделю.
Побочные эффекты: бессоница, галлюцинации, ортостатическая гипотензия, диспепсии.
Антидепрессанты (мелипрамин, амитриптилин) используют при врожденных акинетикоригидных формах. Кроме того, амитриптилин оказывает и выраженный М-холиноблокирующий эффект (равный таковому циклодола).
Торможение катаболизма дофамина достигается с помощью ингибиторов МАО.
Ниаламид (нуредал) ведет к накоплению в головном мозге дофамина и норадреналина.
Другой ингибитор МАО – депренил (юмекс) обладает более специфическим действием, он ингибирует только ту МАО, которая расщепляет дофамин (но не норадреналин). Поэтому использование депренила усиливает только дофаминергические влияния. При приеме этого препарата побочные эффекты, свойственные нуредалу, практически отсутствуют, но вместе с тем депренил менее эффективен по тем же показаниям.
Противопаркинсонические средства. Циклодол
Вторая группа противопаркинсонических средств – М-холиноблокаторы. Основным препаратом данной группы является Циклодол.
Циклодол (Cyclodolum; в табл. по 0, 002) – оказывает как центральный, так и периферический М-холиноблокирующие эффекты. Центральное действие реализуется снижением или устранением двигательных нарушений, связанных с поражением экстрапирамидной системы.
Циклодол наиболее эффективен для снижения ригидности и, в меньшей степени, способствует снижению акинезии, на треморные расстройства циклодол не влияет.
При назначении больным циклодола следует помнить о том, что к данному препарату развивается толерантность.
Побочные эффекты: сухость слизистых, тахикардия, нарушение аккомодации, снижение тонуса кишечной мускулатуры.
К этой же группе средств относят препараты норакин, тропацин, дидепил и др.
Причины и механизмы
Надо отметить, что семейные формы БП отличаются высокой генетической гетерогенностью. На сегодняшний момент идентифицировано как минимум 11 хромосомных локусов и 7 самостоятельных генов. Из наследственных форм БП наиболее частым является аутосомно-рецессивный паркинсонизм (мутации на 6 хромосоме в гене белка паркина) с ранним началом (более 50—70% случаев с дебютом до 25 лет). В позднем возрасте чаще встречаются варианты с аутосомно-доминантным типом наследования в результате мутации в гене LRRK2.Вместе с тем на долю наследственно-семейных форм приходится не более 5—10% случаев БП. Генетический фактор имеет наибольшее значение при дебюте заболевания в молодом возрасте.
БП относится к числу заболеваний пожилого возраста. С увеличением возраста происходит потеря части пула дофаминергических нейронов в компактной части черной субстанции. Каждое десятилетие число нигральных нейронов снижается на 10%. К 60 годам их количество при естественном старении сокращается в 1,5—2 раза. С возрастом снижается активность фермента тирозин-гидроксилазы, регулирующего синтез дофамина. В процессе старения в дофаминергических нейронах накапливается так называемый пигмент старения — меланин, метаболиты которого обладают нейротоксическими свойствами. Увеличивается уязвимость нейронов черной субстанции к воздействию свободных радикалов, которые образуются в процессе окисления дофамина. Активность антиоксидантной системы с возрастом падает, и накапливающиеся свободные радикалы оказывают повреждающее воздействие на нейрональные структуры.
Кроме того, с возрастом повышается чувствительность дофаминсинтезирующих нейронов к пропаркинсоническим агентам. Пропаркинсонические свойства обнаружены у многих экзогенных токсинов: моно- и дисульфид углерода, марганец, цианиды, гербициды, пестициды, продукты кобальтовой и ртутной промышленности, пиридиновые производные органических растворителей. Вероятнее всего, имеет значение длительная интоксикация токсическими препаратами, часто в сочетании с нарушением детоксицирующих свойств печени.
Изучается роль эмоционального стресса в развитии заболевания. Клинический опыт показывает, что многие пациенты связывают развитие заболевания с психологическим стрессом. Доказано, что чрезмерные психологические и физические нагрузки могут истощать резервы компенсации дофаминергических структур и приближать момент дебюта заболевания.
В основе БП лежит нейродегенеративный процесс, приводящий к прогрессирующей гибели нейронов черной субстанции. С течением заболевания дегенеративный процесс становится более распространенным, выходит за рамки черной субстанции и захватывает ядра ствола, лимбические структуры, кору головного мозга. Повреждение нигральных нейронов происходит по механизму апоптоза и связано с нарушением внутриклеточного метаболизма — оксидантным стрессом, эксайтотоксическим действием возбуждающих аминокислот — глутамата и аспартата, запуском механизмов кальциевого каскада, дисфункцией митохондрий.
Дофамин является медиатором нигростриарного, мезолимбического и мезокортикального путей. Дефицит дофамина в нигростриарном пути приводит к развитию основных моторных проявлений БП, дисфункции мезолимбического и мезокортикального путей к когнитивным и аффективным нарушениям при этом заболевании. Первые симптомы БП появляются, когда содержание стриарного дофамина падает на 60—80% от возрастной нормы. Дефицит дофамина в стриатуме ведет к относительному переизбытку ацетилхолина. Дисбаланс нейромедиаторов приводит к нарушению соотношения между возбуждающими и тормозными влияниями внутри базальных ганглиев. Развивается чрезмерная тормозная активность базальных ганглиев по отношению к коре, что является причиной брадикинезии и ригидности. Возникновение тремора связывают с усилением спонтанной осцилляторной активности нейронов полосатого тела и зрительного бугра.
Заболевание развивается преимущественно в возрасте 55—70 лет. Ядро клинической картины составляет триада симптомов — брадикинезия, тремор покоя, мышечная ригидность. Болезнь может начаться с каждого из этих симптомов, а в дальнейшем к нему присоединяются другие. Четвертый важнейший признак заболевания — постуральная неустойчивость?— обычно присоединяется на более поздней стадии заболевания.
Брадикинезия представляет собой снижение спонтанной двигательной активности. Первые жалобы больных могут быть связаны с нарушением мелкой моторики — неловкость при застегивании пуговиц, завязывании шнурков, при нарезании продуктов, замедление письма. Эти изменения возникают, как правило, в одной руке или ноге и постепенно прогрессируют. Скованность переходит на проксимальные отделы, распространяется на другую конечность той же стороны, а затем и на другую сторону. У больных с БП, прежде всего, затруднено начало движения. Больному бывает трудно встать со стула, сделать первый шаг, изменить положение тела в постели. Походка становится замедленной, шаркающей. Впоследствии присоединяются пропульсии и латеропульсии. Распространение гипокинезии на мышцы лица приводит к гипомимии, лицо становится маскообразным. К проявлениям гипокинезии относятся частые поперхивания во время еды, монотонность речи, микрография.
Вегетативная недостаточность. Для больных с БП характерны такие вегетативные нарушения, как слюнотечение, запоры, расстройства мочеиспускания, импотенция, ортостатическая гипотензия, сальность кожных покровов.
Заболевание носит неуклонно прогрессирующий характер. Стадию гемипаркинсонизма неизбежно сменяет стадия двусторонних нарушений. На поздних стадиях болезни наступает тяжелая обездвиженность, требующая постоянного постороннего ухода. В большинстве случаев смерть больных БП наступает от соматических осложнений — бронхопневмонии, уросепсиса и других инфекционных осложнений.
Развитие БП нередко осложняется присоединением когнитивных нарушений. Когнитивные нарушения различной тяжести встречаются у 80—90% больных и имеют тенденцию к прогрессированию. В некоторых случаях деменция развивается уже в первые годы заболевания, в других — через 10—20 лет. Наиболее часто присоединение когнитивных нарушений наблюдается через 5—7 лет от начала болезни. Самым значимым фактором риска развития деменции при БП является пожилой и старческий возраст. Успехи современной фармакотерапии БП привели к увеличению продолжительности жизни пациентов, но в то же время обострилась проблема деменции при этом заболевании. Определенный вклад в развитие деменции вносят лекарственные препараты, в частности холинолитики, способствующие нарастанию ацетилхолинергического дефицита в коре головного мозга. Когнитивные, психотические нарушения при адекватно подобранной терапии двигательных расстройств становятся наиболее дезадаптирующим фактором и значительно осложняют проблему ухода за такими больными.
Психотические нарушения, как правило, провоцируются приемом противопаркинсонических средств и бывают представлены в виде зрительных, реже слуховых галлюцинаций, иллюзиями, бредом. У большинства больных галлюцинации носят обратимый характер и проходят при снижении дозы или отмене того или иного дофамиметического средства. Предиктором галлюцинаций нередко являются яркие сновидения.
Аффективные нарушения в виде депрессии, тревоги, апатии, обсессивно-компульсивного синдрома часто встречаются при БП. Депрессия может появиться на любом этапе заболевания, а в ряде случаев предшествует моторным проявлениям болезни. У большинства больных выраженность депрессивной симптоматики бывает легкой или умеренной. Частыми признаками депрессии при БП являются угнетенный фон настроения, ангедония (неспособность испытывать удовольствие), быстрая утомляемость, снижение аппетита, тревожность, раздражительность, нарушения сна. В то же время такие частые проявления депрессии, как чувство вины, тоски, а также суицидальные мысли и попытки, встречаются нечасто. Распространенность депрессии выше у лиц женского пола, с ранним дебютом заболевания. Ряд авторов отмечает корреляцию между депрессией и выраженностью акинетико-ригидного синдрома. Обычно более выраженные аффективные нарушения встречаются в первые три года заболевания, затем происходит адаптация к заболеванию, а с появлением осложнений дофасодержащей терапии вновь нарастает частота депрессий.
Диагностика БП базируется на клинических критериях. Чаще всего используются критерии Hughes A. J. (1992 г.). Необходимым условием является наличие брадикинезии в сочетании не менее чем с одним из следующих основных симптомов паркинсонизма — тремором покоя, ригидностью и постуральной неустойчивостью. Важным дополнительным критерием служит прогрессирующий характер заболевания в сочетании с положительной реакцией на терапию дофасодержащими препаратами.
К дополнительным методам диагностики можно отнести ПЭТ с использованием радиофармпрепарата 6-(18F)флюродопы. Изменения в виде снижения накопления флюродопы, выявляемые этим методом, опережают по времени клинические проявления болезни. Кроме того, ПЭТ позволяет отдифференцировать БП от других форм паркинсонизма (при мультисистемной атрофии, прогрессирующем надъядерном параличе, сосудистом паркинсонизме). Вместе с тем стоимость ПЭТ с данным радиоизотопом очень высока и используется во всем мире нечасто. В России такие исследования до настоящего времени не проводились. Методы томографии могут быть использованы лишь для исключения некоторых форм вторичного паркинсонизма (сосудистого, гидроцефального, на фоне объемного образования), но не для диагностики БП. Информативность методов функциональной диагностики на сегодняшний день не подтверждена.
Лечение должно быть непрерывным и начинаться с момента появления бытовой и профессиональной дезадаптации. На самых начальных стадиях болезни (например, при легком треморе одной руки) можно не назначать специфической терапии, ограничиваясь рекомендациями по соблюдению высокой двигательной активности. Имеются данные о положительном влиянии физических упражнений на выраженность брадикинезии, постуральных нарушений. Особое значение должно уделяться упражнениям на разгибательную группу мышц для предотвращения развития сгибательной установки туловища.
Оптимальными препаратами для старт-терапии БП считаются препараты с потенциально нейропротективным действием.
Агонисты дофаминовых рецепторов (АДР) наиболее часто рекомендуют в качестве средств начальной терапии БП. Противопаркинсонический эффект этой группы препаратов связан со стимуляцией дофаминовых рецепторов. Эффективность применения АДР на ранних стадиях БП сопоставима с препаратами леводопы. Их раннее назначение приводит к снижению риска возникновения моторных флуктуаций и лекарственных дискинезий. АДР эффективны в отношении основных симптомов болезни — брадикинезии, ригидности, тремора. Обладают умеренным антидепрессивным эффектом, некоторые способствуют улучшению когнитивных функций.
Амантадины являются антагонистами глутамата и снижают патологическое действие глутамата на нигральные нейроны, в связи с чем предполагается наличие у них нейропротективного эффекта. Кроме того, амантадины увеличивают синтез дофамина в пресинаптических терминалях, его высвобождение в синаптическую щель и уменьшают обратный захват дофамина в синаптической щели. Назначение амантадинов приводит к уменьшению мышечной ригидности, акинезии; в меньшей степени влияют на тремор. Особенностью действия амантадинов является их антидискинетический эффект. В связи с этим препараты этой группы назначают как на ранней стадии БП, так и в сочетании с препаратами леводопы для уменьшения дискинезий. Инфузионная форма амантадинов может использоваться для лечения тяжелых форм заболевания (акинетических кризов), у больных с дисфагиями, а также в качестве начальной терапии амантадинами, позволяющей добиться быстрейшего улучшения симптоматики.
Ингибиторы моноаминооксидазы (МАО) типа В блокируют фермент, способствующий метаболизму дофамина по пути окислительного дезаминирования, в результате чего способствуют увеличению содержания нейромедиатора. Кроме того, повышают чувствительность дофаминовых рецепторов, что ведет к увеличению высвобождения дофамина. В эксперименте был показан антиоксидантный эффект этой группы препаратов. Ингибиторы МАО типа В являются мягкими противопаркинсоническими препаратами и рекомендуются к применению на ранней стадии заболевания, а также в комбинированной терапии с препаратами леводопы для коррекции моторных флуктуаций.
Холинолитики — старейшая группа противопаркинсонических препаратов. В настоящее время они обычно назначаются относительно молодым пациентам (до 55 лет), без когнитивных нарушений, имеющих тремор покоя, резистентный к терапии леводопой и АДР. Ограничением к применению этих препаратов является большое количество побочных эффектов — галлюцинации, дезориентация, повышение внутриглазного давления, нарушение аккомодации, нарушение сердечного ритма, задержка мочеиспускания. Их нельзя назначать пациентам старше 55—60 лет, поскольку они усиливают когнитивную дисфункцию и способствуют развитию деменции.
При неэффективности моно- или комбинированной терапии препаратами вышеуказанных групп переходят к назначению препаратов леводопы.
Новым направлением дофатерапии, позволяющим повысить биодоступность леводопы и реализовать стратегию постоянной дофаминергической терапии, является применение интрадуоденальной формы леводопы. С помощью чрескожной эндоскопической гастротомии с установкой дуоденального зонда или гастротомии устанавливается постоянный доступ к кишечнику, и препарат дозированно вводится через индивидуально программируемую помпу. Эти операции уже получили широкое распространение в странах Европы и в ближайшем будущем планируется их проведение в РФ.
Отдельно разрабатываемым направлением в лечении БП является использование стволовых клеток и генной терапии с применением трофических пептидных факторов.
В заключение хочется отметить, что эффективность долгосрочного лечения БП определяется тесным взаимодействием лечащего врача, пациента и его родственников. Постоянная коррекция терапии позволяет избежать возможных побочных явлений и сохранить высокий уровень двигательной активности. Не надо забывать о коррекции сопутствующих когнитивных и эмоционально-аффективных расстройств. Развившаяся депрессия может явиться причиной стойкого ухудшения симптомов заболевания и снизить комплаентность больного. Важным дополнительным методом терапии БП является лечебная физкультура. Сохранение высокого уровня физической активности положительно влияет на выраженность симптомов болезни, предотвращает развитие вторичных костно-мышечных изменений. Сбалансированной должна быть диета больных с БП. В рацион питания должна быть включена волокнистая пища и достаточное количество жидкости для профилактики нарушений перистальтики кишечника. Если у пациента снижается масса тела или он вынужден снижать количество белковой пищи (для улучшения адсорбции препаратов леводопы), необходимо увеличить содержание углеводов и ненасыщенных жиров.
Е.А.КАТУНИНА, доктор медицинских наук, доцент кафедры неврологии и нейрохирургии лечебного факультета РГМУ
Результаты проведенного в 2006 г. эпидемиологического исследования в 15 странах Западной и Восточной Европы, Азии, Африки позволили сделать прогноз по распространенности БП к 2030 г. В 14 странах из 15 (кроме Нигерии) прогнозируется повышение распространенности БП. В РФ численность больных с БП увеличится с 0,21 до 0,34 млн.
Эффективность долгосрочного лечения БП определяется тесным взаимодействием лечащего врача, пациента и его родственников. Постоянная коррекция терапии позволяет избежать возможных побочных явлений и сохранить высокий уровень двигательной активности.
Читайте также:


