Диссертация на тему герпес

В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции при этом, спектр клинических проявлений, развитие которых они обусловливают, чрезвычайно широк [7]. Особого внимания заслуживает рецидивирующая форма герпетической инфекции (ГИ), относящаяся к числу наиболее распространенных психосоматических кожных заболеваний. Хроническое течение, зуд, частая локализация и характер высыпаний на лице или интимно значимых участках кожного покрова сопровождаются изменениями эмоциональной сферы. В свою очередь, состояния стресса, восприятие самим пациентом проявлений болезни оказывает влияние на интенсивность и частоту рецидивов простого герпеса (ПГ) [24].
Многочисленные исследования в области проблемы ГИ, особенно вызванные вирусами простого герпеса (ВПГ) 1 и 2 типов, не теряют своей актуальности в настоящее время [21, 16].
Серьёзной проблемой является высокая инфицированность здорового населения, преимущественно молодого, трудоспособного возраста. В мире ежегодно заражаются от 16 до 800, а в России – от 40 до 80 человек на 100 тыс. населения. В настоящее время заболеваемость ПГ крайне высока, по статистике ВОЗ, она занимает второе место среди вирусных поражений, уступая лишь гриппу. ВПГ-1 инфицировано около 90 % взрослого населения планеты, распространенность ВПГ-2 колеблется от 7 до 40 %. В США ежегодно регистрируется до 98 млн случаев лабиального герпеса и 20 млн случаев рецидивирующего герпеса гениталий, 500 тыс. случаев офтальмогерпеса и более 5 тыс. случаев герпетического энцефалита, около 1 тыс. случаев герпеса новорожденных. По мнению ведущих специалистов, в нашей стране ежегодная заболеваемость герпесом губ составляет 10 млн, герпесом кожи – 1 млн, офтальмогерпесом – 250 тыс. случаев. Рецидивирующими формами герпеса страдают от 10 до 20 % населения, а ежегодный прирост увеличивается на 15–17 % [3, 13, 23].
Литературные данные свидетельствуют, что большинство населения Земли инфицировано ВПГ-1, ВПГ-2 или тем и другим вирусом одновременно. Первичная инфекция, ассоциированная с ВПГ-1 или ВПГ-2, может протекать в клинически выраженной форме в очаге инфицирования (например, в орофациальной или генитальной области) либо как бессимптомная или нераспознанная инфекция. Генитальная форма простого герпеса может быть связана с ВПГ-1, так же как и лабиальная форма – с ВПГ-2. После первичного инфицирования у 50–75 % больных отмечается рецидивирующее течение простого герпеса. В течение первых 12 месяцев после инфицирования ВПГ-2 рецидив возникает у 80 % пациентов, ВПГ-1 – у 55 % [15, 26].
Современная медицина не располагает методами лечения, позволяющими элиминировать ВПГ из организма человека. Целью лечения герпеса является: 1) подавление репродукции ВПГ в период обострения (купирование рецидива); 2) снижение частоты и длительности рецидивов заболевания, тяжести их течения; 3) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Всё разнообразие методов терапии и профилактики обострения герпесвирусных инфекций можно сгруппировать в направления этиотропного, патогенетического и симптоматического лечения с применением химиотерапии, иммунотерапии и комплексного лечения [1, 7, 11].
Большое внимание уделяется антигерпетическим соединениям растительного происхождения, природным антиоксидантам, адаптогенам из лекарственного растительного сырья и витаминно-минеральным комплексам, ввиду изменения иммунного статуса пациентов [14, 19].
Патогенетическая терапия направлена на нормализацию функции иммунной системы организма, в том числе на активацию системы интерфероновой защиты, как правило, связанная с применением интерферонов (ИФН), индукторов ИФН и иммуномодуляторов. Специфическая иммунотерапия состоит в применении герпетической вакцины, хотя ряд исследователей считает, что надежды, возлагаемые на специфическую вакцинопрофилактику, не оправдали себя [11, 19]. Иммунотропные препараты, обладающие активностью против вируса герпеса, разнообразны и представлены в таблице.
Иммунотропные препараты, обладающие активностью против вируса герпеса
Использование противовирусной химиотерапии велико при лечении рецидивирующих форм простого герпеса с поражением кожи и слизистых оболочек. В лечении простого герпеса с применением противогерпетических химиопрепаратов можно выделить два принципиально отличающихся друг от друга подхода: 1) эпизодическое лечение – прием ациклических нуклеозидов (АН) в момент рецидива в терапевтических дозах при соблюдении кратности и длительности лечения; 2) супрессивная терапия – длительный, иногда многолетний, постоянный прием препаратов АН вне рецидива в более низких дозах [9, 25].
Согласно проведенным исследованиям, биодоступность (per os) противогерпетических препаратов из группы ациклических нуклеозидов возрастает следующим образом: ацикловир – 20 %, валацикловир – 54 % и фамцикловир – 77 % [24]. Тем не менее применение ацикловира по-прежнему остаётся востребованным среди врачей и пациентов в настоящее время, и одновременно ведутся исследования по увеличению растворимости ацикловира [5] и синтезу его производных [8].
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия [20].
Возможно сочетанное использование противовирусной терапии и глюкокортикостероидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую боль и возвращает пациента к обычной жизнедеятельности в случае постгерпетической невралгии [2].
Наружные средства дополняют системную противовирусную терапию. Многочисленные наблюдения подтверждают, что в случае назначения таблетированных форм ациклических нуклеозидов на стадии предвестников в сочетании с наружной противовирусной терапией значительно чаще удается полностью прервать дальнейшее развитие рецидива или наблюдать его абортивное течение [20].
Местная терапия противовирусных лекарственных средств при герпесе кожи и слизистых оболочек требуется для уменьшения отёка, экссудации, боли и зуда, ускорения заживления язвочек и эрозий и сокращения длительности выделения вируса на участках поражения [22]. Применение данных лекарственных форм начинают при появлении первых признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают вплоть до эпителизации эрозий. Рано начатое местное лечение может предотвратить развитие везикул.
В комплексную терапию пациентов с простым герпесом необходимо включать местные противовирусные средства, способствующие стабилизации и разрешению процесса [12].
При анализе ассортимента противовирусных средств на российском рынке установлено, что большинство противовирусных препаратов выпускается в виде твёрдых лекарственных форм – 66 %, в виде мягких лекарственных форм – 22 %, а в форме жидких – 12 % [22], лидером же является ацикловир [6].
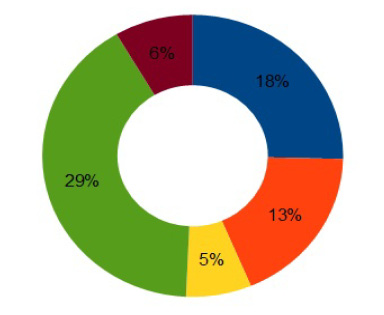

Ассортимент лекарственных форм, содержащих ацикловир
Следует отметить, что современная фармакотерапия герпеса эффективно уменьшает его клинические проявления, положительно влияет на психическое состояние пациентов и приобретает комплексный подход. Несмотря на различные достижения в лечении герпеса, ацикловир по-прежнему играет значительную роль в данном направлении и привлекает внимание исследователей по созданию комбинированных препаратов. В связи с чем актуальными являются исследования по разработке лекарственной формы комбинированного состава, обладающей противогерпесным эффектом – медицинские карандаши.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Хаджиева З.Д., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Команда учёных Медицинского центра Утрехтского университета под руководством Эммануэля Вирца и Роберта Ян Леббинка в электронном научном журнале PLOS Pathogens сообщила об успешном эксперименте по очищению заражённых клеток от герпес-вирусов. Это революционное событие.
В эксперименте использовались культуры клеток линии Vero, поражённые тремя типами вируса: HSV-1, цитомегаловирусом человека (HCMV) и вирусом Эпштейна – Барр (EBV). Очевидно, что в дальнейшим полученный результат может привести к появлению метода полного излечение людей от вирусов герпеса, а также способов борьбы с другими инфекциями, имеющими латентную стадию.
До сих пор носители герпеса считались обречёнными. Многочисленные препараты (ацикловир, валацикловир и другие) не избавляют от болезни, они могут лишь подавить размножение вируса и предотвратить появление симптомов болезни. В нормальном состоянии организма антитела иммунной системы человека смогут самостоятельно держать вирус под контролем. Но если этот контроль ослабнет, болезнь проявится вновь и может привести к ряду тяжёлых заболеваний.
Герпес-вирусы способны проникать в нервные клетки и таиться там подолгу. В такие периоды вирусная ДНК не запускает процесс производства новых вирусов, а лишь создаёт особую цепочку РНК, так называемый транскрипт латентой стадии. Его роль в жизни вируса поняли в 2008 г. Транскрипт латентной стадии разделяется на цепочки микроРНК, которые блокируют работу генов, связанных с размножением вируса. Это и обеспечивает герпес-вирусам маскировку. При воздействии на организм человека стресса (например, переохлаждения) ДНК вируса начинает работать активнее. Она начинает производить больше информационной РНК, запускающей синтез необходимого для размножения белка. МикроРНК не успевают блокировать все молекулы информационной РНК, белок синтезируется, размножение вируса возобновляется — герпес выходит наружу. Такой жизненный цикл вирусов герпеса привёл к тому, что ими заражено не менее 90% людей. А 10% — это преимущественно маленькие дети, которые просто не успели повстречать вирус герпеса.
Большая часть перечисленных болезней кажутся неопасными и, как правило, быстро проходят (то есть прекращаются их проявления). Но вирус герпеса не безобиден. Если иммунная система ослабнет, он способен вызвать серьёзные проблемы: висцеральный герпес (герпес внутренних органов), энцефалиты, лимфомы. Генитальный герпес связан с высоким риском рака шейки матки и рака простаты. Герпетическое поражение глаз может вызвать помутнение роговицы. Крайне опасен вирус герпеса для эмбрионов. Если у матери заболевание вышло в активную стадию, он приводит к гибели плода или тяжёлым патологиям и смерти новорождённого. Потенциальные жертвы серьёзных проявлений герпеса — все те, чья иммунная систем не работает в полную силу: получающие химиотерапию больные раком, пациенты с пересаженными органами, больные СПИДом.
Теперь в Нидерландах призвали на борьбу с герпесом технологию редактирования генома CRISPR/Cas9. Эта система предназначена для того, чтобы вырезать определённые участки из молекулы ДНК. Для того чтобы указать ей, где именно нужно резать, необходимы специальные направляющие молекулы РНК. В клетки вводят ДНК, кодирующую направляющую РНК и ген белка Cas9. ДНК строит направляющую РНК, та направляет белок Cas9 к нужной точки ДНК герпес-вируса, белок разрезает вирусную ДНК.
Наиболее эффективно такая система действует на вирус Эпштейна — Барр. При разрезе в двух точках вирусного генома количество вирусов EBV в клетках падало на 95%. Цитомегаловирус тоже оказался уязвимым к действию системы, но среди этих вирусов стали появляться мутантные формы с изменениями в участке, на который нацелена направляющая РНК, что обеспечивало им устойчивость. Учёные пришли к выводу, что при дальнейшем применении такого метода борьбы с вирусом необходима разработка и строгое соблюдение методик, исключающих возникновение мутантных устойчивых форм, подобно тому, как это делается при назначении антибиотиков. Вирус HSV-1 в латентной фазе оказался менее подвержен действию системы CRISPR/Cas9, но она смогла останавливать активную фазу вируса.
Исследователи полагают, что дальнейшая разработка новых направляющих РНК позволит создать технологию удаления из клеток вирусов герпеса всех типов, в том числе и в латентной фазе.
Номер работы: 678621
Без учета скидки. Вы получаете файл формата pdf
Вы получаете первые страницы диссертации в формате txt
Просмотр 1 страницы = 3 руб
Оглавление диссертации:
Актуальность темы: Простой герпес (ПГ) в настоящее время является объектом активных научных исследований. Это связано с высокой заболеваемостью на фоне почти 100% инфицированности населения [45, 48, 151, 57, 96, 181]; трудностью контроля за передачей вируса, особенно при бессимптомных и атипичных формах ПГ [44, 64, 82, 62, 202, 143]; склонностью к хроническому рецидивирующему течению процесса - примерно у 25-50% существенным влиянием часто инфицированных лиц рецидивирующих форм [45, 103]; ПГ
1.1. Этиология, патогенез и иммуногенез простого герпеса. Простой герпес (ПГ) одно из наиболее распространенных вирусных заболеваний человека, возбудителем которого является вирус простого герпеса (ВПГ). ВПГ относится к семейству ДНК-вирусов и состоит из следующих компонентов - нуклеоида, располагающегося в его центре, капсида, окружающего ядро вириона, и наружной оболочки, в которую заключены эти структуры. В оболочку вируса встроены гликопротеины. Различают два антигенных типа ВПГ - ВПГ-1
В связи с выраженной нейротропностью ВПГ одним из клинических проявлений ГБ являются поражения нервной системы (НС) - от мононевритов до энцефалитов и полинейропатий [31]. В России ежегодно не менее причем 3000 человек переносят достигает герпетические частота нейроинфекции, летальность 20%, а инвалидизации - 50% [97]. ВПГ может поражать любые нервные образования, что клинически проявляется различными неврологическими симптомами в зависимости от свойств нервных структур, вовлеченных в
. В клиническом течении ГИ различают первичный и рецидивирующий герпес. Дерматологический синдром ГБ чрезвычайно многолик (Таблица
1) [по М. А. Самгину, А. А. Халдину, 2002]. Таблица 1. Классификация клинических разновидностей ПГ кожи и слизистых. Первичный ПГ 1 .Герпетический гингивостоматит 2.Первичный лабиальный герпес 3.Первичный генитальный герпес 4.Первичный анальный герпес 5.Герпес борцов 6.Первичный герпес кистей 7.Первичный герпес новорожденных 8.Первичная герпетическая экзема
1.4 Психосоматические аспекты простого герпеса. В настоящее время ПГ относят к психосоматическим заболеваниям, так как больные наряду с клинической симптоматикой переживают довольно серьезные психологические проблемы [13, 7]. В рамках концепции психодерматологии по данным Bodemer W., Roos J.L. (2001) РПГ входит в группу дерматологических болезней, зависящих от психологических стрессов (психофизиологические расстройства) [131]. По мнению Иванова О. Л., Львова А. Н., Остришко В. В. и др., (199
1.5. Психонейроиммунологические концепции патогенеза простого герпеса. Пожалуй, самой перспективной и быстроразвивающейся областью психосоматики является психонейроиммунология. С позиций современных демонстрируют знаний нервная многочисленные (НС) и иммунная аналогии: наличие (ИС) системы центральных органов, оказывающих влияние на эффекторы, локализованные во всех областях организма; возможность памяти; присутствие на клетках обеих систем одних и тех же антигенных маркеров; проявление меди
1.6. Современные подходы к терапии герпетической болезни. Существует два приоритетных направления терапии ПГ: иммунное и этиотропное. Препараты иммунокорригирующего действия можно условно разделить на две группы: 1 - иммуномодуляторы (ИФН и его индукторы) и 2 - специфическая иммунотерапия (герпетическая поливакцина)[82]. Из препаратов ИФН для лечения различных форм РПГ используются рекомбинантные генно-инженерные ИФН: реаферон (агЬ-ИФН), виферон (а 2 Ь-ИФН в комбинации с витаминами Е и С ),
. Основой настоящей работы явилось комплексное динамическое клинико-иммунологическое и психодиагностическое обследование 93 пациентов с ПГ, находившихся на амбулаторном и стационарном лечении в клинике кожных и венерических болезней ММА им И.М. Сеченова, в том числе направленных из КВД г. Москвы. Анализ клинической симптоматики и анамнестических данных включал в себя учет возраста и пола пациентов, частоты рецидивирования, длительности, локализации и типа течения вирусного процесса. Особенно
. Для иммунологического исследования использовалась сыворотка крови больных. Забор крови производился двукратно по стандартным методикам всей группе пациентов. Первый раз - в период ремиссии (не менее чем через 2 недели после купирования очередного рецидива) для оценки иммуностатуса с целью подбора терапии. Второй раз - после окончания курса лечения. Иммунологическое исследование осуществлялось на базе лаборатории онтогенеза и коррекции системы интерферона НИИ им. И. Ф. Гамалеи - зав. проф.
--PAGE_BREAK-- Основные группы препаратов и методы лечения ОГС и ХРГС Противовирусные препараты
Как и всякое противоинфекционное лечение, антивирусная терапия имеет целью приостановить или ликвидировать активность вируса с минимальными негативными последствиями для функций организма хозяина. Современные антивирусные препараты, предназначенные для системного применения, могут вмешиваться в репродуктивный цикл вируса на разных его стадиях (на стадии адгезии к клеточной мембране, на стадии проникновения в клетку, в ходе транскрипции и трансляции вирусных белков, в процессе накопления вирусных частиц), но не влияют на состояние покоящегося, латентного вируса.
Разрабатываются препараты, способные помешать прикреплению вирусов к эпителиоцитам: такие свойства проявляют бактерицидные средства, а также гепарин и препараты, содержащие полисульфитные группы. Перенос вируса по нервным тканям к месту латенции и обратно, к месту рецидивирующих повреждений СОПР, может быть блокирован препаратами на основе капсаицина (вещества, присутствующего в перечной мяте), обратимо блокирующего внутриневральный транспорт.
Принцип действия клинически эффективных антивирусных препаратов заключается в прекращении синтеза ДНК-вируса. Молекулярными
мишенями противовирусных препаратов являются специфические, связанные с вирусом (вирусные или вирусиндуцированные) ферменты, участвующие в синтезе вирусной ДНК.
Так, в клетках, инфицированных ВПГ, появляются вирусиндуцированные ферменты тимидинкиназа, ДНК-полимераза, дезоксирибонуклеаза, урацил-ДНК-гликозилаза, дезоксиуридинтрифосфатаза, рибонуклеотидредуктаза.
Эти ферменты по биохимическим и иммунологическим свойствам, а также по особенностям отношения к субстратам отличаются от соответствующих клеточных ферментов. Современные антивирусные препараты работают по схемам, представленным ниже.
Для реализации первой схемы нужны соединения, которые избирательно ингибируют только вирусиндуцированный фермент, участвующий в репродукции ВПГ, но не соответствующий ферменту клетки-хозяина (см. Цидофовир, Фоскарнет).
Препараты второй группы изначально не являются активными, но, проникая в ВПГ-инфицированную клетку, обрабатываются (активируются и/или метаболизируются) вирусными ферментами и приобретают способность вмешиваться в синтез вирусной ДНК. Поскольку противовирусные препараты, в идеале, являются субстратом только для вирусных и вирусиндуцированных, но не для аналогичных клеточных ферментов, то препараты являются селективными, т. е. проявляют избирательное вирусстатическое действие и не оказывают никакого влияния на функции клетки.
На практике селективность препарата во многом определяется различием уровней сродства лекарственного соединения к вирусным и к клеточным ферментам. Для современных противогерпетических препаратов, относящихся ко второй группе (см. Ацикловир, Валацикловир, Пенцикловир, Фамцикловир), ферментными мишенями являются тимидинкиназа ВПГ-1, ВПГ-2, ВПГ-3 и ДНК-полимераза всех герпесвирусов. Поэтому мишенями этих препаратов оказываются только те штаммы вирусов, которые используют в своем репродуктивном цикле названные ферменты (например, штаммы ВПГ, дефектные по тимидинкиназе, оказываются устойчивыми к препаратам второй группы). Как следует из механизма действия, препараты не оказывают вируцидного действия. Понятно, что описанные препараты не могут повлиять на вирусы, находящиеся в латентном состоянии, и не могут предотвратить начало их активации, т. е. предотвратить рецидив инфекции.
Ацикловир
—синтетический ациклический аналог 2-дезоксигуанозида (пролекарство). Для превращения в активную форму он должен быть захвачен клеткой, инфицированной вирусом простого герпеса или вирусом ветряной оспы. В клетке ацикловир воспринимается вирусоспецифической тимидинкиназой как нечто, очень похожее на нормальный клеточный нуклеозид — сырье, необходимое для синтеза вирусной ДНК, поэтому тимидинкиназа фосфорилирует его и превращает в ацикловир-монофосфат. Затем, уже с помощью клеточных ферментов, препарат превращается в ацикловир-трифосфат. Ацикловир-трифосфат ингибирует вирусную ДНК-полимеразу и, конкурируя с нормальным компонентом вирусной ДНК 2-дезоксигуанозин-трифосфатом, встраивается вместо него в растущую цепь ДНК. Так как при этом блокируется 3΄-гидроксильная группа, необходимая для присоединения следующего нуклеотида, то ацикловир-трифосфат становится терминатором цепи ДНК ВПГ.
Ацикловир выпускается в 3-х основных лекарственных формах: крем для местного применения, таблетки и суспензия для парентерального введения. Применение кремов и мазей эффективно примерно в 50 % случаев. Наиболее эффективно применение ацикловира внутрь (около 95 % успеха в общей популяции и 80 % — для иммунодепресивных больных), поэтому препарат чаще всего назначается в таблетках. Базовым режимом считается назначение 5 мг/кг массы тела каждые 8 ч; при иммуносупрессии и/или генерализации инфекционного процесса доза увеличивается в 2–4 раза. Курс обычно продолжают в течение 5–7 дней.
Наиболее успешным является назначение ацикловира в самые ранние сроки развития первичной инфекции или рецидива: таким образом можно добиться абортивного течения эпизода (схема 3).
Побочные явления (обратимое нарушение функции почек, нарушения деятельности ЦНС) могут возникнуть у 1–5 % пациентов, получающих высокие дозы препарата внутривенно.
Эффективность лечения герпетической инфекции ацикловиром в некоторых случаях может быть снижена по нескольким причинам: а) из-за патологии ЖКТ и нарушения всасывания ацикловира (в таких случаях рекомендуют внутривенное введение препарата); б) из-за дефектности данного штамма вируса герпеса по тимидинкиназе (рекомендуют препараты, ориентированные на другие вирусные ферменты — например, фоскарнет).
Схема 3.Выделение ВПГ у детей с ОГС при лечении ацикловиром или плацебо
Валацикловир— это L-валиновый эфир ацикловира. Он быстро превращается в ацикловир после приема внутрь и далее работает по вышеописанной схеме. Биодоступность и стабильность валацикловира значительно выше, чем ацикловира, что позволяет принимать валацикловир реже. Это очень важно, особенно при проведении супрессивной терапии хронической инфекции, в ходе которой значительно сокращается частота периодов выделения герпеса и клинически манифестных рецидивов. Имеются сведения о том, что при профилактическом применении препарата, начатом до заражения вирусом, возможно предотвращение колонизации нервных ганглиев герпесвирусом и, следовательно, предотвращение установления латентной инфекции.
Валацикловир впускается только в капсулах для приема внутрь. Побочными эффектами могут быть головная боль и тошнота.
Пенцикловир— ацикличный аналог гуанина, химически близкий ацикловиру, однако, сродство препарата к вирусной ДНК-полимеразе на два порядка выше, чем у ацикловира, что делает препарат в ряде случаев более эффективным (например, в некоторых случаях резистентности ВПГ к ацикловиру). Даже при относительно позднем начале лечения пенцикловир, в отличие от ацикловира, успешно справляется с генерализованной ВПГ-инфекцией. Спектр противовирусной активности пенцикловира тот же, что и у ацикловира, токсичность выражена меньше.
Пенцикловир выпускается в виде крема для местного лечения при хронической герпетической инфекции и в виде препарата для внутривенного введения при лечении герпетической инфекции иммунодефицитных больных.
Фамцикловир— пролекарственная форма пенцикловира. Препарат легко всасывается и превращается в пенцикловир в кишечнике и в печени. Фамцикловир выпускается в таблетках, предназначен только для орального применения. Спектр активности и механизм действия аналогичен таковым пенцикловира и, соответственно, ацикловира. Благодаря высокой биодоступности фамцикловир эффективен при невысоких дозах и двукратном применении в течение суток, что позволяет применять его для супрессивной терапии хронической инфекции и значительно снижать частоту клинических рецидивов. Сообщают о возможности предотвращения установления латентной герпетической инфекции при профилактическом назначении фамцикловира.
Цидофовирявляется ацикличным фосфатным производным нуклеозидов. Препарат не нуждается в вирусных ферментах, так как фосфорилируется клеточными ферментами. Активный метаболит цидофовира селективно ингибирует вирусную ДНК-полимеразу, прекращая синтез ДНК вируса. Цидофовир активен в отношении большинства герпесвирусов (ВПГ-1, ВПГ-2, ВПГ-3, а также вирусов Эпштейн–Барра, цитомегаловируса), аденовирусов и папилломавирусов.
Длительный период полувыведения активного метаболита цидофовира позволяет применять препарат 1 раз в неделю и только внутривенно (так как цидофовир имеет низкую биодоступность). Его большой недостаток — это высокая нефротоксичность. К другим побочным эффектам, возникающим при применении цидофовира, можно отнести цитопению, падение внутриглазного давления и метаболический ацидоз. Поэтому для лечения герпетической инфекции цидофовир применяется только в случаях устойчивости герпеса к ацикловиру и его аналогам, и чаще используется для борьбы с цитомегаловирусом.
Фоскарнет — неорганический пирофосфат, ингибирует вирусную ДНК-полимеразу всех герпесвирусов (а также вирусов гриппа А и В, вируса гепатита В и ВИЧ) без предварительной активации. Препарат высоко токсичен, что ограничивает его применение в лечении герпетической инфекции только случаями резистентности герпеса к ацикловиру и его аналогам.
Другие препараты, указанные в таблице 6, имеют меньшую клиническую эффективность, поэтому их применение возможно при недоступности современных антивирусных средств.
--PAGE_BREAK-- Иммунотерапия герпетической инфекции В связи с тем, что течение острой и хронической герпетической инфекции тесно связано с иммунным статусом, одним из важных направлений патогенетической терапии является иммунокоррекция: а) стимуляция иммунитета; б) коррекция дисбаланса разных звеньев иммунологической реактивности;
в) компенсация нарушений иммунного статуса. Для успешного проведения иммунокоррекции необходимо знать исходную глубину и спектр повреждения иммунной системы, а затем контролировать изменение иммунного статуса в процессе лечения.
При лечении герпетической инфекции у детей применяют ограниченное число иммунотропных средств:
1) из группы средств, замещающих дефицитные факторы иммунитета, — интерфероны, иммуноглобулины, лизоцим;
2) из группы средств, стимулирующих выработку и активность интерферонов, — интерфероногены;
3) из группы иммуномодуляторов, стимулирующих выработку других иммунных клеток и факторов, — иммуностимуляторы, адаптогены;
4) из группы иммуномодуляторов, изменяющих соотношение активности различных звеньев иммунитета, — иммунокорректоры.
Одним из популярных средств заместительной терапииявляются интерфероны.Их высокая эффективность связана как с прямым противовирусном действием, так и с ярко выраженной способностью стимулировать иммунный ответ (см. ранее). В детской практике рекомендовано применение интерферона-β (табл. 7); применение натуральных и синтетических препаратов интерферонов-α ограничено значительной частотой и тяжестью побочных эффектов. Препараты интерферонов не должны применяться более 2-х недель во избежание угнетения синтеза собственных интерферонов. Отменяют препараты постепенно, со снижением частоты приема.
Иммуноглобулины — препараты, содержащие широкий спектр антител, нейтрализующих вирусы и посредничающих в фагоцитозе зараженных вирусами клеток. Препараты оказывают заместительный эффект на фоне дефицита гуморальной защиты, а также антитоксическое и иммуномодулирующее действие. Эти препараты применяются при тяжелых формах инфекции у новорожденных и при других иммунодефицитах у детей.
Интерфероногеныиндуцируют повышение выработки интерферонов и, наряду с этим, повышают активность других факторов противовирусного иммунитета. Интерфероногены, содержащие липополисахариды бактериальной стенки (пирогенал и продигиозан), практически не применяются в детской практике из-за серьезных побочных эффектов.
--PAGE_BREAK--Один из известных способов иммунотерапии хронической герпетической инфекции — вакцинация (в детском возрасте не применяется). Применение лазера в лечении герпетической инфекции
с проявлениями в полости рта у детей
Лазеротерапия является одним из методов физиотерапии, а именно — светолечения, поэтому в историческом смысле является развитием идеи гелиотерапии.
Лазер — техническое устройство, испускающее свет. Генерация излучения в лазере происходит следующие этапы:
2) квантовые системы активного вещества приходят в возбуждение;
3) квантовые системы возвращаются на исходный энергетический уровень с излучением фотона света;
4) фотон попадает в резонансную систему зеркал, которые обеспечивают многократный пробег через активное вещество, т. е. многократное возбуждение квантовой системы;
5) генерированный свет выходит из источника через его единственную незеркальную грань.
Поскольку в процессе генерации света повторяется однотипный переход между одними и теми же энергетическими уровнями, все фотоны, излучаемые данным активным веществом в данном режиме, имеют одинаковые характеристики. Узкий диапазон длин волн (монохромность) обеспечивает тот или иной цвет излучения лазера что, в свою очередь, предопределяет характер взаимодействия света с конкретной тканью, т. е. степень его отражения или поглощения. Одинаковая направленность, поляризованность и фазовая согласованность фотонов лазерного света (когерентность) обуславливает минимальное расхождение пучка света и поэтому дает возможность сконцентрировать луч, уменьшить его диаметр (вплоть до размеров фотона!) и, таким образом, многократно повысить его энергетическую плотность (мощность) луча.
Фотобиологические эффекты лазерного излучения имеют дозозависимый характер, т. е. определяются тем, сколько энергии будет передано тканям. Поэтому процедура каждого лазерного воздействия описывается несколькими параметрами:
· длиной волны излучения;
· его интенсивностью (мощностью);
В стоматологии применяют несколько энергетических уровней лазерного излучения:
1) невозмущающее воздействие, при котором ткани, рассеивая, отражая и поглощая свет, сохраняют свои свойства; используют для диагностики свойств ткани (лазерная рефрактометрия для определения уровня кариесрезистентности эмали);
2) фотофизическоеи фотохимическое воздействие, возбуждающее атомы и молекулы и вызывающее в них химические и физические реакции; используют для диагностики (например, диагностика скрытого кариеса), акупунктуры, терапии (лечение поражений кожи и СОПР при ОГС и ХРГС);
3) фотодеструктивное(тепловое, гидродинамическое, фотохимическое) действие; используют в хирургии для препарирования твердых тканей зуба, в эндодонтии и т. д.
Первой фазой является поглощение энергии лазера атомами-фотоак-цепторами тканей, обуславливающее развитие внутреннего фотоэффекта на атомно-молекулярном уровне.
Возбужденные электроны переходят на более высокий энергетический уровень, и это в свою очередь приводит:
– к увеличению электропроводности тканей, обладающими свойствами полупроводников и диэлектриков;
– увеличению реакционных способностей атомов;
– разрыву слабых меж- и внутримолекулярных связей (изомеризации молекул, их диссоциации, ионизации, изменению рН среды);
– к повышению температуры тканей на 0,1–10,0°С, что приводит к изменению проницаемости термолабильных каналов мембран.
Наиболее важными специфическими акцепторами красного света являются производные порфирина (гемоглобин) и ферменты, в том числе каталаза, — важнейший и универсальный участник процессов энергообразования. Неспецифическим акцептором света является вода: при поглощении красного света изменяется структурная организация водного слоя мембран (изменяется их проницаемость) и тканевой жидкости — среды, формирующей структурную организацию молекул и таким образом влияющей на активность биохимических процессов.
Под действием НИЛИ активируются биохимические реакции:
– растет скорость окислительно-восстановительных реакций;
– в митохондриях становится более эффективной (со снижением потребления кислорода) выработка универсального источника энергии — АТФ;
– в клеточных ядрах увеличивается содержание РНК и ДНК, растет число рибосом (при этом отмечен антимутагенный эффект НИЛИ!), следовательно, активизируется синтез белка;
– увеличивается энергетическая и транспортная активность мембран.
Натканевом уровне воздействие НИЛИ проявляетсякак:
– противовоспалительное (укорочение фаз воспаления, в первую очередь, экссудации);
– анальгезирующее (эффекты прямого воздействия НИЛИ на нервные окончания и уменьшения отека тканей);
– трофическое (следствие повышения насыщенности крови кислородом, увеличения количества новых микрососудистых коллатералей, повышение скорости кровотока, активации транспортных веществ через сосудистую стенку);
– репаративное (результат повышения темпов пролиферации клеток, регенерации тканей);
– иммунотропное (результат повышения активности синтеза белков).
Науровне организма отмечают общие саногенные эффекты — повышение общей резистентности организма, что проявляется, в частности, в снижении частоты рецидивов герпетической инфекции после фотолечения ОГС (облучения в зонах нервных ганглиев) и ХРГС.
Системные эффекты НИЛИ объясняют как следствие:
– переизлучения и резонанса первичного фотоэффекта клетками и жидкими средами;
– реализации комплекса адаптационных и компенсаторных реакций на первичные локальные фотоэффекты.
Показаниями к применениюНИЛИ при ОГС и ХРГС является переход заболевания в стадию угасания.
Относительные противопоказанияк применению НИЛИ у детей: патология гемостаза, соматическая патология в стадии декомпенсции, активный туберкулез легких.
Метод применения НИЛИописан в подготовленной изготовителем инструкции по применению лазера для лечения воспалительной патологии мягких тканей. В настоящее время с этой целью применяют гелий-неоновый (He-Ne), углекислотный (СО2), эрбиевый (Er-YAG) и полупроводниковые лазеры (AlGaInP). Общие правила для их применения таковы:
– в течение одного сеанса фототерапии планировать облучение не более 5 полей (полями являются единичные элементы или места наибольшего скопления элементов поражения);
– удерживать световод на расстоянии приблизительно 1 cм от воспаленного участка, избегая прямого контакта световода и тканей;
– облучение проводить круговыми движениями над каждым полем с элементом поражения не дольше 1 минуты; суммарное время фототерапии не должно превышать 5 минут;
– продолжать лечение в течение нескольких дней (при среднетяжелой форме до 7, при тяжелой — до 10 дней), вплоть до полного восстановления тканей;
– суммарнаяэффективность лазерной терапии герпетического поражения СОПР колеблется от 50 до 85 %, в отдельных случаях достигая 95 %.
продолжение
--PAGE_BREAK--
Читайте также:


