Вторичные иммунодефициты при герпесе на

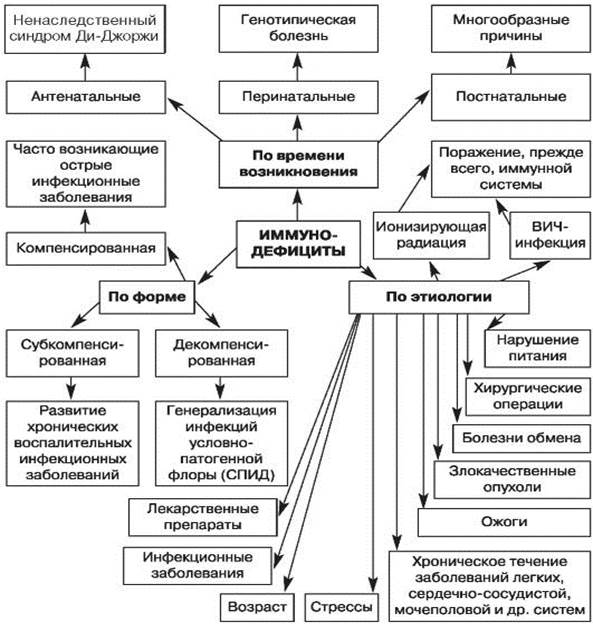
Рис. 1. Классификация вторичных иммунодефицитов по времени возникновения, этиологии, форме (по Белозерову Е.С. и др., 1992) [3]
Подводя итог в теоретической составляющей статьи – актуальности, необходимо обобщить следующее.
В педиатрии (17 лет 11 месяцев и 29 дней) в доминирующем большинстве речь идет об антенатальных и перинатальных иммунодефицитных болезнях, вторичных по отношению к анатомо-морфологическому субстрату иммунной системы – функциональных.
Таким образом, заключение врача-иммунолога должно быть сформулировано следующим образом. Антенатальная (или функциональная) иммунодефицитная болезнь, смешанного типа (или, при возможности, по отдельным звеньям, что мало вероятно), комбинированная индукция (инфекционная, гипоксическая и т.д.) с клиническими проявлениями основных синдромов – инфекционного, аллергического, аутоиммунного, неопластического и/или лимфопролиферативного.
Данные теоретические изыскания легли в основу целого цикла научно-исследовательских работ. Одно из таких исследований представлено в данной статье и посвящено исследованию иммуноиндуцирующей роли герпеса 4 типа - вируса Эпштейна-Барр у детей.
Цель: изучение особенностей клинических проявлений у детей с герпес-индуцированными формами иммунодефицитов (на примере 4 типа герпеса).
Все дети (100%) относились к часто и длительно болеющим, при этом 72 ребенка были неорганизованными (22,5%). У 78 (24,4%) детей были зарегистрированы признаки рецидивирующей герпетической инфекции с локализацией на губах, крыльях носа, слизистой оболочке полости рта. Ежегодно 92 ребенка (28,4%) переносили бактериальные инфекции в виде тонзиллитов, пневмоний, пиелонефритов, фурункулезов, гнойных конъюнктивитов, отитов, рино-синуситов. Признаки лимфоаденопатии (микролимфоаденопатии) регистрировались у 270 детей (84,4%). У 2 детей были диагностированы неопластические процессы (один ребенок умер в 2009 году). Одна девочка с лейкемоидной реакцией наблюдается у гематоонколога в течение 2 лет. Субфебрильные реакции более 12 месяцев были зарегистрированы у 39 детей (12,2%). Грубые неврологические нарушения (преимущественно двигательные) были зафиксированы у 43 детей (13,4%) (рис. 2).
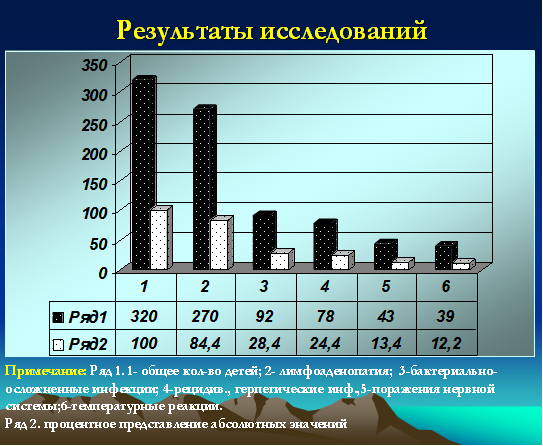
Рис. 2. Частота распределения клинических проявлений у детей с герпесиндуцированными иммунодефицитами
Иммунологические данные (в т.ч. данные лейкограммы), кроме количества лейкоцитов и лимфоцитов (абсолютное и относительное количество), носили неоднозначный характер. Классический супрессорный тип (в т.ч. и со снижением клеток цитолитической направленности) выявлялся у 108 детей (33,7%). Активация в системе клеток естественной цитотоксичности (CD16+) зафиксирована у 52 детей (16,2%). Увеличение В-клеточного пула было зарегистрировано у 38 детей (11,8%). Интересными, на наш взгляд, были полученные данные по CD95 маркеру, у 92 (28,7%) детей данный показатель был резко повышен и достигал значений 20-25%, у 30 (9,3%) детей указанный показатель не превышал 3% (рис. 3).
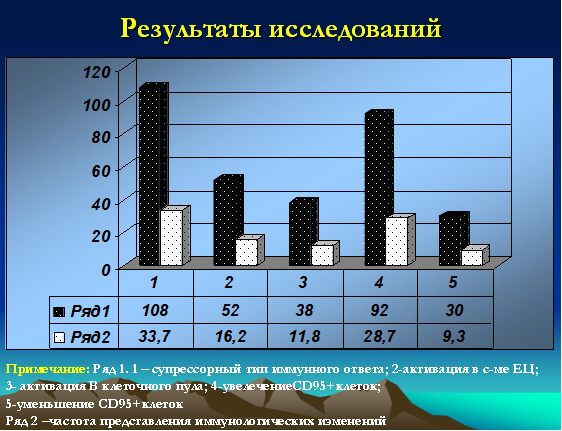
Рис. 3. Иммунологические особенности (типы распределения) у детей с герпесиндуцированными иммунодефицитами
ИФА, проведенный у детей, выявил 100% контаминацию вирусом ЭБ. Определялась следующая совокупность специфических антител:
- IgM к VCA (к капсидному антигену) – выявляются в крови в первые дни и недели болезни, максимально сохраняются до 3-4 недель;
- IgG к VCA (к капсидному антигену) – появляются в крови спустя 1-2 месяца от начала болезни, затем постепенно снижаются и сохраняются на пороговом (низком уровне) пожизненно. Повышение их титра характерно для обострения хронической ЭБВИ;
- IgM к EA (к раннему антигену) – появляются в крови в первую неделю заболевания, сохраняются в течение 2-3 месяцев и исчезают. Могут сохраняться в высоких титрах длительное время (более 3-4 месяцев), тревожно в плане формирования хронической формы ЭБВИ. Появление их при хронической инфекции служит индикатором реактивации;
- IgG к ЕA (к раннему антигену) – появляются к 3-4-й неделе заболевания, становятся максимальными на 4-6-й неделе болезни, исчезают через 3-6 месяцев. Появление высоких титров повторно указывает на активацию хронической инфекции;
- IgG к NA-1 или EBNA (к нуклеарному или ядерному антигену) – являются поздними, поскольку появляются в крови через 1-3 месяца после начала заболевания. При этом острофазные антитела выявлялись (IgM к VCA и IgM к EA) у 42 детей (13,1%), у 268 (83,7%) детей титры антител (IgG VCA + IgG к NA-1 или EBNA) значительно превышали нормативные и достигали значений более 160, у 10 (3,1%) детей диагностически значимых титров выявлено не было [9; 13] (рис. 4).
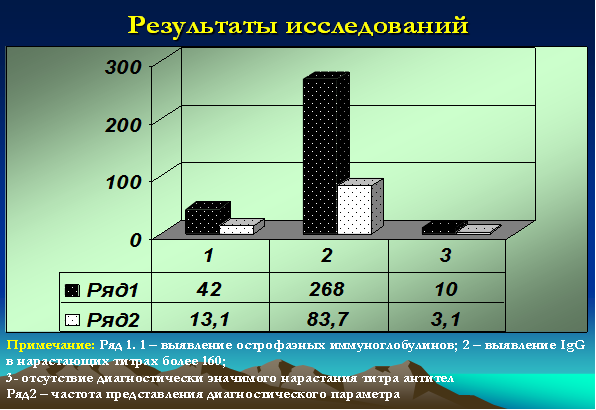
Рис. 4. Серологические исследования у детей с герпесиндуцированными иммунодефицитными болезнями
Клинические, иммунологические и этиологические сопоставления выявили следующие закономерности.
Отдельно хочется остановиться на методах ПЦР-диагностики. В литературе активно обсуждается вопрос об использовании ПЦР для исследований на инфекции семейства герпес в различных биологических субстратах. Здесь необходимо понимать, что данный метод, особенно при использовании его для исследования плазмы, имеет свои особенности – он всегда количественный! Определение качественное не имеет смысла, так как инфекция пожизненно персистирует в организме человека. Как у больных ЭБВИ, так и у носителей может быть положительная ПЦР. Поэтому для их дифференцировки проводится ПЦР-анализ с заданной чувствительностью: для носителей до 10 копий в пробе, а для активной инфекции – 100 копий в пробе. Специфичность данного метода хоть и достигает 100%, при этом не исключает ложноположительные результаты, т.к. ПЦР-анализ информативен только при размножении (репликации) вируса, то существует и определенный процент ложноотрицательных результатов с отсутствием репликации в момент исследования [5; 9].
В результате проведенного нами исследования, ПЦР крови всегда имела отрицательный результат, даже у детей с неопластическими процессами. Распределение ПЦР-положительных результатов у детей со слизистых оболочек (ротоглотка, нос) и мочи имело следующее цифровое распределение.
Положительные реакции с 3 биологических объектов имели 36 детей (11,25%), у 62 положительные ПЦР реакции были с зева и носа – 19,38%, у 43 детей диагностировали положительный результат только с зева (13.44%), и 71 ребенок имели положительные значения ПЦР со слизистой оболочки носа (22,19%). Положительные значения только в моче имели 51 ребенок (15,94%). Остальные дети (в количестве 57) имели отрицательный результат ПЦР-исследований с биологических сред.
Дети с неопластическими процессами, длительным субфебрилитетом, лейкемоидной реакцией, лимфоаденопатией имели признаки активации хронической инфекции, резкое увеличение CD95+ клеток, положительные маркеры наличия и обострения ВЭБ в ИФА и ПЦР-исследованиях.
Таким образом, все дети имели индуцированные формы функциональной иммунодефицитной болезни, доминирующей причиной которой являлся вирус ЭБ. Проведенные предварительные клинико-иммунологические исследования наглядно демонстрируют необходимость комплексного обследования детей с функциональными нарушениями в системе иммуногенеза с обязательной оценкой уровня инфекционной (вирусной) контаминации. Выявление основных причин трактуется необходимостью применения комплексных методов лечения, в т.ч. и с применением противовирусных препаратов.
[youtube.player]В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная. Многие вопросы патогенеза и терапии тяжелого и крайне-тяжелого течения герпесвирусной инфекции по-прежнему не решены.
Вид ВПГ относится к семейству Herpesviridae, подсемейству L-Herpesviridae, виду ВПГ. Различают два основных типа вируса — ВПГ 1 и ВПГ 2. Инфицирование возможно как одним, так и двумя типами возбудителя. ВПГ способен внедряться в различные клетки организма человека: в клетки кожи, слизистых оболочек урогенитального и желудочно-кишечного трактов (ЖКТ), дыхательных путей, центральной и периферической нервной системы, печени, эндотелия сосудов, а также в клетки крови — лимфоциты и др. [1]. Место постоянного обитания (пожизненного персистирования) ВПГ — паравертебральные сенсорные ганглии. ВПГ передается прямым контактным путем, возможна передача возбудителя контактно-бытовым и вертикальным путем (от матери к плоду), а также трансфузионным и парентеральным путями через инструменты при оперативных вмешательствах, стоматологических процедурах и т. д.
Как известно, большинство людей инфицированы ВПГ. Первичный иммунный ответ на инфекцию протекает латентно или с герпетическими высыпаниями с местной и общей воспалительной реакцией. У лиц с нормальным иммунным ответом размножение (репликация) ВПГ находится под иммунологическим контролем, и рецидивы бывают крайне редко или не возникают в течение всей жизни. В противовирусной защите организма участвуют факторы неспецифической защиты, уничтожающие или блокирующие вирусы: макрофаги и другие клетки-продуценты интерферонов (ИФН) α, β и γ, ряд интерлейкинов (ИЛ) (фактор некроза опухоли (ФНО), ИЛ-6 и др.), естественные киллеры и факторы, формирующие специфический иммунный ответ против конкретного вируса: цитотоксические Т-лимфоциты (ЦТЛ) (CD 8+ Т-лимфоциты) и В-лимфоциты, ответственные за продукцию специфических антител, блокирующих репликацию вируса и расположенные вне клетки вирусы. Для адекватного функционирования этих клеток и поддержания иммунного ответа необходима соответствующая продукция ИФН и ИЛ.
Под влиянием различных экзогенных и эндогенных факторов, повреждающих иммунную систему, возможно ослабление контроля над репликацией вируса и соответственно развитие рецидива. Рецидив ВПГ-инфекции могут спровоцировать другие инфекционные заболевания, переохлаждение, чрезмерная инсоляция, психические или физические стрессы, интоксикации различного генеза, в том числе употребление алкоголя, циклические изменения гормонального статуса (менструации), особенно при дисбалансе уровня гормонов у женщин, резкая смена климатических поясов и др.
При длительной хронической инфекции вирусы оказывают многостороннее неблагоприятное действие на иммунную систему человека. ВПГ прямо повреждают клетки иммунной системы (лимфоциты, макрофаги и естественные киллеры). Синтезируя белки-супрессоры и химерные белки, вирусы угнетают многие реакции иммунитета: ВПГ могут блокировать действие ИФН, нарушать распознавания инфицированных клеток и другие защитные реакции. Кроме того, высокая мутационная активность вирусного генома также способствует ускользанию вируса от иммунологического контроля.
В зависимости от числа и выраженности рецидивов, выделяют легкое, среднетяжелое и тяжелое течение болезни (табл. 1).
При тяжелом течении ВПГ-инфекции возможно одновременное появление нескольких очагов поражения (например, в области половых органов, губ, крыльев носа), а также последовательное возникновение высыпаний разной локализации (один рецидив на фоне другого), продолжительность обострения при этом может достигать 16–20 дней. В месте высыпания больные ощущают жар, жжение, боль, напряжение и/или зуд кожи. На инфильтрированной коже появляется группа пузырьков, заполненных прозрачным содержимым. Пузырьки могут сливаться в сплошной многокамерный элемент. Прозрачное их содержимое затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах ВПГ часто поражает одни и те же участки кожи. Как правило, при тяжелом течении инфекции значительно ухудшается физическое и психическое состояние больных. У части пациентов в период рецидива увеличиваются или появляются слабость, лихорадка, озноб, миалгии, цефалгии, артралгии, раздражительность, нарушение сна, эмоциональная лабильность, также могут развиваться тяжелые депрессивные состояния, требующие медикаментозной коррекции. По данным органов здравоохранения США, ВПГ-инфекция аногенитальной локализации является примерно в 10% случаев причиной депрессий и суицидов. Тяжелое течение генитальной формы ВПГ-инфекции с частыми рецидивами приводит к нарушению нормальной половой функции пациента, болезнь нередко создает конфликтные ситуации в семье, на работе. Лечение больных с тяжелым течением ВПГ-инфекции представляет собой сложную задачу и должно включать как медикаментозную терапию, так и психологическую адаптацию пациента.
У больных с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные средства, общеукрепляющие препараты). Как правило, такие больные меняют много лечебных учреждений в поисках адекватной помощи.
С течением заболевания появляется много побочных реакций на медикаменты или их непереносимость, в ряде случаев развивается устойчивость ВПГ к ацикловиру, ИФН a, другим средствам. Иммуностимуляторы, используемые эмпирически, могут приносить облегчение в период их приема, но во многих случаях они оказываются неэффективными и даже ухудшают клиническое течение болезни. Усугубляются проявления вторичного иммунодефицита, присоединяются другие инфекции, субдепрессивные состояния переходят в стойкие нарушения психики, теряется вера больных в выздоровление, в возможность современной медицины им помочь.
Для разработки современных подходов к лечению и контролю над ВПГ-инфекцией и более углубленного понимания патогенеза заболевания нами было изучено состояние различных звеньев противовирусной защиты и системы цитокинов у больных с тяжелым и крайне тяжелым течением ВПГ-инфекции аногенитальной и лабиальной локализации, а также степень инфицированности (системности заболевания) и частота сочетания с другими герпесвирусными инфекциями.
Обследовано 102 больных, страдающих тяжелой ВПГ-инфекцией более 2 лет (28 мужчин и 74 женщины, средний возраст — 34 ± 1,5 года) и имеющих частоту рецидивов более шести в год.
При этом у 60 больных наблюдалось от 6 до 11 рецидивов ВПГ-инфекции в год, а у 42 больных — от 12 до 20 рецидивов. У большинства пациентов преобладала аногенительная или смешанная локализация герпеса. Средняя длительность тяжелого течения заболевания составила 9,3 ± 1,2 года. Группу контроля составили 32 практически здоровых добровольца (14 мужчин и 18 женщин, средний возраст — 32 ± 1,6 года). Анализ ряда изучаемых параметров включал результаты обследования пациентов с легким течением заболевания (36 человек — 10 мужчин, 26 женщин, средний возраст — 33,4 ± 2,1 года, с частотой рецидивов 2,9 ± 0,8 в год). При рецидивах жалобы больных были характерными. Часто встречались депрессия, раздражительность, снижение памяти и другие нарушения физического и психического состояния и познавательных функций.
У многих больных в анамнезе были указания на повторные курсы противовирусной и/или иммунотропной терапии, оказывавшей неоднозначное влияние: или кратковременное положительное влияние на течение ВПГ-инфекции, или ухудшение и развитие рецидива на фоне или после отмены иммунокоррекции. Такие анамнестические данные отражают тяжесть иммунной недостаточности и неадекватность проводимой эмпирической терапии без оценки иммунного статуса и индивидуального подбора иммунокорректоров, а также восстановительной терапии — иммунореабилитации [5].
При обследовании больных с тяжелым течением ВПГ-инфекции выявлялись многие маркеры вторичного иммунодефицита в виде хронических инфекционно-воспалительных заболеваний различной локализации, со смешанным характером микрофлоры и в большинстве случаев ее устойчивостью к повторным курсам антибиотикотерапии. Из 102 больных хронической ВПГ-инфекцией тяжелого течения выявлены:
- у 86,3% — хронические рецидивирующие заболевания респираторного тракта (хронический фарингит, хронический трахеит, хронический ларингит, хронический бронхит, хронические синуситы, повторные отиты);
- у 88,2% — хронические рецидивирующие заболевания урогенитального тракта смешанного генеза (цистит, уретрит, вульвовагинит, аднексит, сальпингоофорит, простатит);
- у 50–70% — астено-вегетативный и астено-депрессивный синдром, формирование синдрома хронической усталости;
- у 91,2% — дисбактериоз кишечной флоры, хронические воспалительные заболевания ЖКТ (хронический энтероколит, хронический гастродуоденит);
- у 25–30% — кожные псевдоаллергические реакции (кожный зуд, крапивница, дерматит).
Эти данные свидетельствуют о необходимости комплексного подхода к лечению ВПГ-инфекции тяжелого течения с учетом осложнений вторичного иммунодефицита.
Наличие ВПГ-инфекции подтверждали на основании данных анамнеза, клиники, а также выявления дезоксирибонуклеиновой кислоты (ДНК) ВПГ методом полимеразной цепной реакции (ПЦР) в отделяемом из высыпаний. Исследование иммунного статуса включало определение основных субпопуляций лимфоцитов CD3 + , CD4 + , CD8 + , CD72 + , CD16 + , активационных маркеров лимфоцитов главного комплекса гистосовместимости — HLa-DR+, CD11b в периферической крови с помощью моноклональных антител. Также определяли содержание иммуноглобулинов (Ig) a, M, G, циркулирующих иммунных комплексов (ЦИК) в сыворотке крови. Функциональную активность нейтрофилов — продукцию активных форм кислорода, обеспечивающих бактерицидность, определяли по тесту с нитросиним тетразолием (НСТ-тест). Стимулированный НСТ-тест исследовали при инкубации in vitro с культурой Staphylococcus аureus. Интерфероновый статус оценивали по уровню сывороточного ИФН и продукции лейкоцитами ИФН a при стимуляции вирусом болезни Нью-Кастла и ИФН ( при стимуляции фитогемагглютинином. Количественное содержание цитокинов (ИФН α, ИФН γ, ФНО α, ИЛ-1β, ИЛ-2, ИЛ-4 ИЛ-6,) в плазме/сыворотке крови определяли методом иммуноферментного анализа (ИФА) с использованием тест-систем (ProCon, С.-Петербург, и Вектор-Бест, Новосибирск).
Кроме того, проводили ПЦР-исследование биологических материалов на наличие ДНК ВПГ 1 и 2 типа и других вирусов герпес-группы: цитомегаловируса, вируса герпеса человека (ВГЧ) 6 типа, вируса Эпштейна–Барр. Используемые нами программы амплификации позволяли выявлять ДНК вирусов на уровне, соответствующем активной их репликации. Наличие активной репликации вирусов подтверждали полуколичественным ПЦР-исследованием и серологическими тестами.
В результате исследования у больных с тяжелым течением ВПГ-инфекции обнаружены лабораторные признаки вторичного иммунодефицита.
Так, у большинства пациентов (91%) отсутствовало адекватное повышение продукции IgG в ответ на рецидив ВПГ-инфекции (рис. 1). При частоте рецидивов ВПГ-инфекции 6–11 рецидивов в год низкий уровень IgG выявлялся у 25% больных, при частоте — 12–20 рецидивов в месяц — уже у 64,3% больных. Более чем у 70% больных был повышен уровень ЦИК в 1,5–2,0 раза от показателей нормы. Известно, что длительная циркуляция ЦИК может приводить к отложению их на эндотелии сосудов и служить одним из факторов формирования аутоиммунной патологии.
У большинства больных с ВПГ-инфекцией тяжелого течения (70%) были обнаружены нарушения в системе естественной и/или специфической цитотоксичности (рис. 2) — снижение содержания зрелых активированных естественных киллеров CD16 + (менее 11%), Т-киллеров и/или ЦТЛ CD8 + (менее 27%). Важно отметить, что выраженное снижение уровня CD8 + (в состав которых входят также и супрессорные клетки) в большинстве случаев сочеталось с повышением уровня CD4 + и иммунорегуляторного индекса, что является фактором риска в отношении формирования аутоиммунных процессов. Как известно, системы естественной и специфической цитотоксичности играют ведущую роль в противовирусной защите.
У больных с тяжелым течением ВПГ-инфекции при рецидиве число естественных киллеров было достоверно ниже нормы и в 2 раза ниже среднего показателя лиц с легким течением заболевания. Почти у половины больных ВПГ-инфекцией выявленные нарушения сочетались с дисиммуноглобулинемией и дефицитом продукции IgG. Уровень HLa-DR + лимфоцитов, отражающих продукцию ИЛ-2 и несущих рецептор DR + , необходимый для распознавания вирус-инфицированных клеток и других реакций иммунитета, был снижен у 39% больных ВПГ-инфекцией (его повышение отмечалось только у 17,4% больных).
Обнаруженные нарушения в системах цитотоксичности и их активационных маркерах при ВПГ-инфекции косвенно свидетельствуют о недостаточном уровне продукции Т-хелперами 1 типа ИЛ-2 — одного из важнейших звеньев цитокиновой сети, необходимого для полноценного противовирусного иммунного ответа.
При исследовании функционального состояния нейтрофилов у больных с тяжелым течением ВПГ-инфекции повышение спонтанного НСТ-теста было выявлено почти в половине случаев. Однако показатели стимулированного НСТ-теста и индекса стимуляции, напротив, были существенно снижены у большинства больных, что свидетельствует об истощении у них резервных способностей нейтрофилов.
При изучении интерферонового статуса пациентов в период обострения ВПГ-инфекции выявлены различия при легком и тяжелом течении болезни. Так, уровень сывороточного ИФН у пациентов с легким течением заболевания был повышен в 2 раза по сравнению с группой контроля (р
- Хахалин Л. Н. Вирусы простого герпеса у человека// Consilium Medicum. 1999. Т. 1. № 1. С. 5–18.
- Европейские стандарты диагностики и лечения заболеваний, передаваемых половым путем. М.: Медицинская литература, 2003. С. 102–110.
- Малашенкова И. К., Дидковский Н. А. Принципы иммунокорригирующей терапии вторичных иммунодефицитов, ассоциированных с хронической вирусно-бактериальной инфекцией// Русский медицинский журнал. 2002. Т. 10. № 21. С. 973–977.
- Малашенкова И. К., Дидковский Н. А., Танасова А. Н., Щепеткова И. Н., Левко А. А. Принципы терапии герпесвирусной инфекции// Доктор.Ру. 2004. № 4. С. 26–30.
- Малашенкова И. К., Дидковский Н. А., Левко А. А. К вопросу о роли индивидуального подбора иммунокорректоров// Фарматека. 2004. С. 118–122.
- Левко А. А. Значение индивидуального подбора иммунокорректоров в комплексной терапии хронического рецидивирующего простатита, вызванного урогенитальной инфекцией: автореф. дис. . канд. мед. наук. М., 2005.
- Шульженко А. Е., Викулов Г. Х., Тутушкина Т. В. Герпетические инфекции — настоящее и будущее// Трудный пациент. 2003. № 4. Т. 1. С. 6–15.
Н. А. Дидковский, доктор медицинских наук, профессор
И. К. Малашенкова, кандидат медицинских наук
Ж. Ш. Сарсания, кандидат биологических наук
А. Н. Танасова, И. Н. Зуйкова, И. А. Зуйков, Н. М. Хитрик
НИИ физико-химической медицины, ММА им. И. М. Сеченова, Москва
Лечение герпеса – задача непростая. Иногда самые сильные противовирусные препараты оказываются неэффективными. Происходит это обычно при снижении иммунитета.
Иммунитет и герпес
Активность герпетической инфекции напрямую зависит от состояния иммунитета. Вирус может всю жизнь прожить в человеческом теле практически никак себя не проявляя. Но случаются и обратные ситуации. У некоторых людей обострения возникают раз за разом, а периоды ремиссии очень короткие.
Ни одно лекарство не может полностью уничтожить вирус. Иммунная система тоже не в состоянии вывести его из организма. Однако если иммунитет у человека достаточно сильный, он тормозит размножение и активацию герпеса. И, наоборот, как только уровень защитных сил снижается, вирус крепнет. Чем слабее иммунитет, тем более вероятен рецидив болезни. Что происходит, если у человека врожденный или приобретенный иммунодефицит?
Вирус при иммунодефиците
Иммунодефицит – это нарушение работы иммунной системы в каком-то из ее звеньев. Он бывает врожденным, что встречается редко, и приобретенным.
Приобретенный иммунодефицит – это следствие онкологических болезней, ВИЧ-инфекции, лучевой терапии и полихимиотерапии, лечения цитостатиками и стероидными гормонами.
В нормальном функционировании иммунной системы важна сбалансированная работа B и T-лимфоцитов. Первые отвечают за борьбу с бактериями, а вторые – за подавление вирусных инфекций.
При дефиците T-клеток создаются все условия для обострения герпеса. При этом он не встречает на своем пути сопротивления и протекает в тяжелой форме – в виде опоясывающего лишая, который характеризуется многочисленными высыпаниями на теле, сильной болью и зудом. Лечение герпеса у лиц с иммунодефицитами сложный и не всегда эффективный процесс.
К тому же сам герпес обладает угнетающим действием на иммунную систему человека, и таким образом возникает порочный круг. Чтобы его разорвать, требуется не только противовирусное лечение, но и укрепление иммунитета. Как повысить иммунитет при герпесе?
Укрепление иммунитета

Укреплять иммунитет можно разными способами. Подход должен быть комплексным – от использования природных факторов до назначения иммуномодуляторов.
Иммунитет часто снижается при нехватке витаминов в организме. В условиях плохой экологии, нерационального питания и малоподвижного образа жизни гиповитаминозы становятся распространенной патологией не только среди детей, но и у взрослых. Лечение этого состояния называется витаминотерапией.
Витамины и микроэлементы – залог успешного функционирования иммунной системы организма, поэтому важно следить за их достаточным поступлением в организм. Они участвуют в обмене веществ, восстановлении поврежденных кожных покровов, продукции иммуноглобулинов.
Витамины при герпесе, особенно при тяжелых его формах, множественных высыпаниях на теле – неотъемлемая часть комплексного лечения. Какие из них лучше укрепляют иммунитет и используются в терапии вирусных болезней?
При герпетическом поражении наиболее эффективно назначение следующих витаминов:
Чаще всего в аптеках встречаются комплексные поливитаминные препараты – Комплевит, Мультитабс, Супрадин, Ундевит, Витрум, Биовиталь, Дуовит, Центрум. В них также входят необходимые организму микроэлементы и минералы. Но иногда врачи назначают при герпесе отдельные витамины – в виде инъекций или таблеток.

Эта группа витаминов известна большинству людей. Препараты на ее основе часто назначаются при патологии нервной системы, инфекционных заболеваниях, герпетическом поражении тела. Группа объединяет в себе следующие витамины:
- B1, или тиамин.
- B2, или рибофлавин.
- B6, или пиридоксин.
- B12, цианкобаламин.
Витамины группы B незаменимы для нормального существования человеческого организма. В дерматовенерологии при лечении герпеса используют следующие препараты, содержащие эти вещества:
- Нейровитан.
- Нейрорубин.
- Мильгамма.
- Витагамма.
- Витаксон.
- Нейрогамма.
Тиамин играет важную роль в нормальном функционировании центральной и периферической нервной системы. Он отвечает за работоспособность и интеллектуальные функции, нормальный тонус кишечника и желудка, сердечной мышцы.
При недостатке витамина B1 развиваются полиневриты – патология нервных волокон. Так как при герпесе нервная система также страдает, сочетание этой инфекции с нехваткой тиамина значительно ухудшает состояние пациента. Иногда следствием этого является выраженный болевой синдром во всем теле. В природе витамин B1 содержится во многих продуктах питания:
- злаковых;
- крупах;
- миндале, фундуке, грецких орехах;
- капусте;
- шиповнике;
- зеленом горошке;
- шпинате.
Врачи в своей практике используют широко распространенный препарат – тиамина хлорид, который выпускается в ампулах. Назначается он в комплексе с пиридоксином и цианкобаламином.

Этот витамин важен для здоровья кожи. При его нехватке развиваются трещины и эрозии, особенно в области губ и ротовой полости. Герпес также чаще всего поражает эти участки. Возникновение высыпаний на уже пораженной коже вызывает мучительную боль во всем теле и зуд. Повышается и риск вторичного инфицирования. Гиповитаминоз B2 способствует развитию дерматита.
Рибофлавин активно участвует в усвоении железа. А ведь именно железодефицит – явный или скрытый – является очень частой причиной иммунодефицита, приводит к повышенной заболеваемости и в первую очередь герпесом.
Нервная система также не может обойтись без рибофлавина, он обеспечивает нормальную работу ее клеток и волокон.
Витамин B2 присутствует в продуктах животного и растительного происхождения:

Витамин B6 оказывает самое значимое влияние на иммунитет человека. Он участвует в работе всех звеньев иммунной системы и обеспечивает выработку антител разных классов. Нехватка пиридоксина очень быстро приводит к ослаблению защитных сил человеческого тела и повышенной восприимчивости к герпетической инфекции.
Важен он и для нормального состояния кожи. При недостатке этого витамина она теряет свои защитные свойства и способность к хорошей регенерации.
Пиридоксин содержится в мясе птицы, телятине и свинине, хлебе, черешне, яйцах.
В медицине, как и тиамин, он выпускается в виде монопрепарата – пиридоксина гидрохлорида. Но по отдельности практически не назначается, только в комплексе с другими витаминами группы B.
Как и тиамин, значение цианкобаламина для человеческого тела сложно переоценить. Он активно участвует не только в метаболизме, но и в работе практически всех систем. Особенно важна его деятельность для нервной и иммунной системы.
Цианкобаламин восстанавливает миелиновую оболочку поврежденных нервных волокон во всем теле, тем самым предупреждая развитие полинейропатий. Он участвует в синтезе защитных антител.
Нехватка витамина B12 приводит к развитию тяжелого заболевания – мегалобластной анемии, которая в первую очередь сказывается на работе иммунитета. При этой болезни становится невозможным нормальное функционирование костного мозга, и теряется способность бороться с герпесом.
Цианкобаламин присутствует в сое, молоке, яйцах, печени, сердечной мышце, орехах, морской капусте.
В фармакологической промышленности цианкобаламин выпускается в ампулах. Эти уколы врачи назначают как в комплексе с остальными витаминами при герпетических нейропатиях, так и отдельно.
Иногда цианкобаламин применяется совместно с инъекциями железосодержащих препаратов – для лечения анемии и укрепления иммунитета.

Витамин C известен большинству как аскорбиновая кислота. Это лекарство назначают с самого детства – для укрепления иммунитета. Часто врачи рекомендуют принимать витамин C при простудных болезнях, которые сопровождаются герпетическими высыпаниями.
За счет своего антиоксидантного и иммуностимулирующего действия аскорбиновая кислота помогает организму бороться с любой инфекцией, и вирусной в том числе. Обычно назначается в комплексе с витаминами группы B.
Недостаток витамин E сказывается на здоровье кожи. Она становится легкой мишенью для герпетического поражения.
Восполнить дефицит этого вещества можно при помощи капсул Аевит. Масляный раствор препарата дерматологи рекомендуют наносить непосредственно на вскрывшиеся пузырьки. Таким образом, облегчается заживление язвочек на теле, уменьшается болевой синдром, стихает зуд.
В Аевит входит также витамин A, который улучшает регенерацию кожи и показан при герпетической инфекции.
Однако, несмотря на пользу витаминотерапии, не всегда ее эффективности достаточно для борьбы с вирусом. И тогда врачи обращаются к иммуномодуляторам.

Иммуномодуляторы пришли на смену иммуностимуляторам – лекарствам, повышающим защитные силы организма. Не всегда такая стимуляция идет на благо пациенту.
Современные препараты способны по-разному влиять на иммунитет – усиливать или угнетать – в зависимости от потребностей организма в конкретный момент. Они считаются очень важными и эффективными средствами в терапии вирусных болезней и особенно герпеса. Вместе с тем бесконтрольный прием этих лекарств способен существенно навредить пациенту, поэтому назначение иммуномодуляторов – прерогатива врача.
При герпесе чаще всего используются следующие препараты:
Из растительных лекарств наиболее известными являются готовые средства на основе эхинацеи, которые не только оказывают иммуномодулирующее действие, но и повышают тонус всего организма.
Но даже фитопрепараты при герпесе нельзя принимать без рекомендации дерматовенеролога или терапевта.
[youtube.player]Читайте также:


