Лечение грибовидного микоза в германии
Одной из наиболее актуальных задач современной дерматологии является изучение механизмов развития, разработка ранних критериев диагностики и дальнейшее совершенствование методов лечения злокачественных Т-лимфом. Среди них наибольший удельный вес приходит
Одной из наиболее актуальных задач современной дерматологии является изучение механизмов развития, разработка ранних критериев диагностики и дальнейшее совершенствование методов лечения злокачественных Т-лимфом. Среди них наибольший удельный вес приходится на грибовидный микоз (ГМ). Согласно современным взглядам, биологическая сущность ГМ, вне зависимости от клинических проявлений и стадии процесса, определяется как пролиферация трансформированных Т-лимфоцитов [3, 6]. Причем ГМ относится к лимфомам низкой степени злокачественности.
Разнообразие клинических проявлений, отсутствие единых критериев систематизации патологического процесса, а также изменение представлений о кроветворении объясняют разнообразие различных классификаций злокачественных лимфом кожи. Так, L. Fuks оценивает степень тяжести ГМ следующим образом: I стадия — поражение только кожи; II стадия — поражение кожи и дерматопатический лимфаденит; III стадия — поражение кожи, регионарных лимфоузлов и/или селезенки; IV стадия — кожные и внекожные поражения с или без вовлечения в патологический процесс лимфоузлов и селезенки. Группа исследователей из ФРГ выделяет 5 стадий ГМ: I–III стадии — кожный ГМ (I — экзематоидные очаги поражения, II — папулы и бляшки, III — опухолевидные очаги поражения); IV стадия — кожный ГМ с лимфоаденопатией; V стадия — любые клинические проявления при наличии поражения внутренних органов. В основу классификации, применяемой в США, положена оценка степени выраженности следующих элементов лимфопролиферативного процесса: клиническая характеристика кожного процесса (T — tumor); наличие или отсутствие клинической и гистологической патологии лимфоузлов (N — nodus); наличие или отсутствие патологии внутренних органов (M — metastasis). Каждый элемент имеет несколько градаций, обозначаемых цифрами, которые отражают степень или распространенность патологического процесса. Учитывая несовершенство многочисленных классификаций ГМ, до настоящего времени в дерматологии широко применяется деление ГМ на 3 стадии: экзематоидно-эритродермическую, инфильтративно-бляшечную и туморозную [4, 5].
Таким образом, анализ литературного материала показал, что ГМ выделяется в самостоятельную нозологию и рассматривается как экстранодальная, поражающая преимущественно кожу, эпидермотропная лимфома, представленная инфильтрацией Т-хелперных клеток, имеющая своеобразную клинику, течение и патогистологическую картину.
Этиология и патогенетические механизмы ГМ до сих пор не ясны. До настоящего времени не известны побудительные мотивы неконтролируемой Т-клеточной пролиферации. Предполагается, что возникновение ГМ может быть связано с персестирующей вирусной инфекцией. Так, в ряде работ сообщается о выявлении в первичной клеточной культуре, полученной из лимфоузла больного в инфильтративно-бляшечной стадии ГМ, вирусных частиц, морфологически характерных для ретровирусов типа С [15]. Кроме того, в ДНК первичных клеточных культур, полученных от больных ГМ, выявлено наличие последовательности, родственной гену gag HTLV-1.
Определенную роль в возникновении злокачественных лимфом отводят генетическим факторам. Доказано, что развитие различных видов солидных опухолей и лейкемий связано с появлением и дальнейшим нарастанием хромосомных аномалий. В последние годы появились публикации о хромосомных перестройках при ГМ, которые способствуют активации онкогенов и инактивации генов опухолевой супрессии при развитии лимфопролиферативного процесса. В настоящее время в литературе широко обсуждается положение о том, что значимые патогенетические факторы ГМ могут быть носителями ксеногенной информации, приводящей к патологическим сбоям в функционировании различных систем и клеток макроорганизма [13]. В первую очередь такие изменения наблюдались со стороны иммунокомпетентных клеток, эпидермоцитов, макрофагальных элементов кожи, рецепторного аппарата кожи и продукции цитокинов. Имеющиеся в отечественной и зарубежной литературе сведения о состоянии иммунного гомеостаза убедительно свидетельствуют о стойких патологических сдвигах как в клеточном, так и в гуморальном звеньях иммунитета. Анализ иммунного статуса показал, что у большинства больных ГМ при нормальном количестве в сосудистом русле В-лимфоцитов среднее содержание Т-клеток значительно снижено по сравнению с показателями здоровых доноров. Отмечено снижение как Т-супрессорных, так и Т-хелперных лимфоцитов, причем количество последних снижается более существенно. Относительную лимфопению многие авторы рассматривают как наиболее часто встречающийся гематологический признак ГМ. Другие, кроме того, отмечают наличие абсолютной лимфопении в опухолевой стадии заболевания. Функциональная активность лимфоцитов у больных ГМ, по данным ряда авторов, снижена. Другие сообщают об отсутствии достоверных различий в характере пролиферации лимфоцитов периферической крови больных и здоровых лиц. Установлено, что течение патологического процесса при ГМ сопровождается снижением активности естественных киллеров.
Разноречивы результаты исследований состояния гуморального звена иммунитета. В ряде работ не выявлено существенных нарушений в продукции В-лимфоцитами иммуноглобулинов. Вместе с тем есть указания на наличие при ГМ явного IgМ- и скрытого IgA- и IgG-дефицита антителообразования. Другие исследователи выявили увеличение в крови больных ГМ количества IgA, IgМ, а также значительный рост концентрации IgG. При этом увеличение уровня иммуноглобулинов объясняют хелперным фенотипом опухолевого субстрата при ГМ. Таким образом, изменения показателей иммунного статуса у больных ГМ характеризуются значительной вариабельностью и отсутствием признаков, имеющих безусловное диагностическое значение.
В последние годы достигнут значительный прогресс в терапии ГМ, однако лечение больных с этим тяжелым, неуклонно прогрессирующим заболеванием представляет значительные сложности. Ситуация усложняется еще и тем, что не существует лабораторных критериев, позволяющих четко определить дозы, сроки или эффективные комбинации препаратов. Руководствуясь принципом интенсивной терапии опухолевых процессов, для лечения ГМ используют различные полихимиотерапевтические схемы: ЦОП — блео (циклофосфан, винкристин, преднизолон, блеомицин), ЦХОП (циклофосфан, винкристин, доксорубицин, преднизолон), МОПП (мехлорэтамин, винкристин, прокарбазин, преднизолон). Противоопухолевые средства, вошедшие в практику лечения ГМ, относятся к различным группам: антиметаболиты (метотрексат, метотрексат лахема, метотрексат-эбеве, меркаптопурин, пури-нетол), замедляющие нуклеиновый обмен и рост активно пролиферирующих тканей; алкилирующие агенты (циклофосфан, циклофосфамид-тева, циклофосфан-ЛЭНС, тиофосфамид), действующие непосредственно на ДНК клетки; вещества растительного происхождения (винкристин, винкристин ликвид-рихтер, винбластин, винбластин-рихтер), блокирующие деление клеток на стадии метафазы; синтетические противоопухолевые антибиотики (спиробромин, проспидин); противоопухолевые антибиотики (адриамицин, блеомицин, брунеомицин).
Препараты назначались в общепринятых для лечения онкологических заболеваний дозировках и режимах введения. Однако различные осложнения (чаще всего угнетение костно-мозгового кроветворения), а также недостаточная эффективность явились основанием для исключения из практики ряда цитостатических препаратов.
Высокой терапевтической эффективностью в сочетании с небольшими дозами кортикостероидов при лечении ГМ обладает проспидин. Существенным достоинством проспидинотерапии, отличающим ее от лечения другими химиопрепаратами, является отсутствие серьезных побочных эффектов. Это связано с тем, что основной мишенью действия проспидина являются не ДНК клеток, а их мембраны. Однако длительное применение препарата приводит к привыканию, в связи с чем эффективность терапии заметно снижается.
Для лечения больных ГМ широко используется ПУВА-терапия, основанная на применении фотосенсибилизаторов в комбинации с УФ-облучением в области А [7, 11]. Учитывая тот факт, что зона воздействия УФА-света находится в пределах эпидермиса и верхней трети дермы, целесообразно применение данного метода в доопухолевых стадиях заболевания. В опухолевой стадии ГМ обычно используют сочетание УФ-облучения с полихимиотерапией или рентгеновским облучением. Для лечения больных ГМ применяется также электронно-лучевая терапия, основанная на облучении быстрыми электронами. Данная методика позволяет воздействовать на опухолевый субстрат в глубоких отделах кожи, что значительно повышает эффективность лечебных мероприятий при ГМ. На ранних стадиях ГМ часто используются ретиноиды (изотретиноин, этретинат, тигазон), действие которых направлено на процессы созревания Т-хелперов [12].
В последние годы большое внимание уделяется разработке иммунокоррегирующих методов лечения ГМ. Иммуномодулирующее воздействие гемосорбции, плазмафереза, лейкофереза, фотофореза при ГМ позволяет сократить разовые и курсовые дозы цитостатиков, что в определенной степени способствует снижению частоты побочных эффектов химиотерапии. Мы изучали влияние тимодепрессина на состояние иммунного статуса у 12 больных ТМ. Препарат вводился ежедневно всем по 2 мл в течение 3 семидневных курсов лечения с недельным перерывом. Изучение иммунного статуса больных ГМ показало, что тимодепрессин сдерживает развитие пула атипичных Т-лимфоцитов, устраняя воспалительные и пролиферативные изменения в эпидермодермальном пространстве пораженных участков кожи. После окончания терапии состояние клинической ремиссии было достигнуто у 5 больных, значительное клиническое улучшение — у 6 пациентов, в течение года состояние клинической ремиссии сохранялось у 4 больных, еще у 4 больных возникли рецидивы ГМ спустя 3–6 мес после лечения. Повторное назначение тимодепрессина во всех случаях позволило купировать патологический процесс.
В терапевтические схемы лечения ГМ нередко включаются гормоны тимуса: Т-активин, тимопоэтин, тимозин, тималин, тимоген и др. Применяется также леакадин, обладающий противоопухолевым и иммуномодулирующим действием. Широко используются при лечении ГМ интерфероны [8, 14]. Они обладают выраженной противоопухолевой активностью, обусловленной не только прямым цитостатическим действием на опухолевые клетки, но и модуляцией механизмов гуморальной регуляции иммунного ответа. Установлено, что препараты данной группы (α-интерферон — виферон, реальдирон, вэллферон; β-интерферон — ребиф 22, бетаферон, лейкинферон; γ-интерферон — имукин) активируют макрофагальную и комплементарную системы организма, нормализуют продукцию провоспалительных цитокинов, воздействуют на экспрессию генов и антигенов главного комплекса гистосовместимости.
Сравнительный анализ терапевтических возможностей различных методов лечения ГМ позволил американской медицинской ассоциации рекомендовать следующую тактику ведения больных ГМ. На ранних стадиях лимфопролиферативного процесса показаны наружное применение кортикостероидов (локоид, полькортолон, фторокорт, целестодерм-в, флуцинар, элоком, адвантан, кутивейт, дермовейт), ПУВА-терапия, локально наносимые цитостатики, радиотерапия быстрыми электронами и мягколучевая рентгенотерапия. При прогрессировании ГМ используется системная терапия в виде комбинации ПУВА-терапии с ретиноидами или рекомбинантным α-интерфероном. При эритродермической форме ГМ рекомендован экстракорпоральный фотофорез в сочетании с α-интерфероном или ретиноидами. Таким образом, анализ литературного материала убедительно показал целесообразность дальнейшего изучения биологической сущности ГМ и разработки более эффективных схем его лечения.
- Гостева И. В. Фотофорез в комплексной терапии Т-клеточных злокачественных лимфом кожи: Автореф. дис. . канд. мед. наук. — 1995. — С. 22.
- Вавилов А. М., Лезвинская Е. М. Иммунокомпетентные структуры кожи и их роль в развитии первичных кожных лимфом//Архив патологии. 1996. — № 6. — С. 7–2.
- Ершов В. И., Бочкарникова О. В., Соколова И. Я. Кожные лимфомы//Актуальные вопросы внутренней медицины и педагогики: Сб. науч. тр. — 2000. — C. 232–240.
- Ламоткин И. А. Типы клинического течения грибовидного микоза// Междунар. мед. журн. — 2001. — № 5. — С. 427–428.
- Кутасевич Я. Ф. Особенности патогенеза, методы ранней диагностики и рациональной терапии грибовидного микоза: Автореф. дис. . докт. мед. наук, 1989. — С. 33.
- Трофимова И. Б. Т-клеточные злокачественные лимфомы кожи: иммунофенотипические особенности и терапия// Автореф. дис. . докт. мед. наук, 1994. — С. 34.
- Самсонов В. А., Вавилов А. М., Васина Н. И. Эффективность фотохимиотерапии в сочетании с лейкинфероном на различных стадиях Т-клеточных злокачественных лимфом кожи: Сб. науч. тр. — Астрахань, 1998. — С. 117–118.
- Самсонов В. А., Чистякова И. А., Аверина Л. В. Гаммаферон в терапии больных грибовидным микозом// Вестник дерматологии и венерологии, 1995. — № 5. — С. 4 — 6.
- Хасан Хамад А., Попова О. Н., Силуянова С. Н., Белушкина Н. Н. Исследование апоптоза лимфоцитов периферической крови больных с Т-клеточной лимфомой кожи и ангиитами кожи// Вопр. биол. мед. и фармац. химии. — 2000. —№ 4. — С. 22 — 25.
- Чиарион В., Бонони А., Форнаса К. Вторая фаза исследования применения интерферона-альфа с ПУВА-терапией у больных Т-клеточной лимфомой кожи// Журнал клинической онкологии. — 2002. — № 15. — С. 2876 — 2880.
- Carretero C. D., Fivenson D. P. A complement and durable response to denileukin diftitoх in a patient with micosis fungoides. J. Acadam Dermatol., 2003; 48, 275 — 276.
- Eichmuller S., Usener D. Tumor-specific antigens in cutaneous T-cell lymphoma. Int. J. Cancer. — 2003; 104. Р. 482 — 487.
- Kim Y., Martines G. Topical nitrogen mutard in management of micosis fungoides. Arch.Dermatol. — 2003; 139. Р. 165 — 173.
- Ferenczi K. Increased CCR4 expression in cutaneous T cell lymphoma. J. Invest Dermatol. 2002; 119; 1405 — 1410.
- Mucher J. Vaccination therapy for cutaneous T-cell lymphoma. Clin Exp. Dermatol. 2002; 27; 602 — 607.
- Rook A., Wysocka M. Citokines and other biologic agents as immunotherapeutics for cutaneous T-cell lymphoma. Adv. Dermatol. 2002; 18; 29 — 43.
Н. Г. Короткий, доктор медицинских наук, профессор
М. В. Уджуху
РГМУ, Москва
• Редкость грибовидного микоза обусловливает ограниченность данных о доказательных методах лечения, поскольку хорошо организованные проспективные контролируемые клинические исследования, в которых бы сравнивались различные виды терапии отсутствуют.
• Для первой стадии заболевания с локализацией патологического процесса в коже, рекомендуется симптоматическая терапия эмолентами, противозудными препаратами (доксепин крем 5%) и местными стероидами высокой степени активности (клобетазол крем 0,05% два раза в день) в амбулаторных условиях. Местные ретипоиды (бексаротен по 300 мг/м2 один раз в день внутрь ежедневно) или местная химиотерапия (азотистый иприт, бихлороэтилнитрозомочевина или кармустин) являются альтернативными методами лечения при локальной форме заболевания и эффективными дополнительными мероприятиями при генерализации процесса.
• Если, несмотря на лечение, заболевание персистирует пли при непереносимости других препаратов может применяться бексаротен 1% местный гель. Когда бексаротен используется в комбинации с усиленным псораленом ультрафиолетовым светом (ПУВА), общая дозировка УФА снижается, а если он используется в качестве поддерживающей терапии, увеличивается продолжительность ремиссии.
• Альтернативно, ПУВА-терапия может также использоваться одновременно с интерфероном (ИФ) (три раза в педелю) или ретиноидами до разрешения очагов, затем лечение продолжается в качестве поддерживатощей терапии.
• При бляшках, не реагирующих на комбинированную терапию (ПУВА + ретиноид), в одном из исследований было показало успешное разрешение очага после применения 5% местного крема имиквимода.
• УФА вместо псоралена может также усиливаться метоксаленом или оксораленом.
• Была доказана эффективность применения УФВ узкого спектра действия на ранней стадии грибовидного микоза с продлением ремиссии, однако оптимальный протокол поддерживающей терапии еще предстоит определить. • При фотодинамической терапии 5-аминолевулиноная кислота была эффективнее в отношении отграниченных инфильтратов, чем местные стероиды, однако для стандартизации этого метода лечения необходимо большое количество исследований. В основном, фотодинамическая терапия действует через механизмы непосредственной цитотоксичности, альтерации стенок сосудов и воздействия на иммунный ответ организма.
• Во второй стадии грибовидного микоза поражаются регионарные лимфатические узлы, при этом применяются те же методы терапии, что и при стадии I. Для стадии ИВ чаще всего рекомендуется тотальная кожная электронная лучевая терапия (ЭЛТ), за которой следует лечение азотистым ипритом в течение > 6 месяцев. При рецидиве заболевания после ЭЛТ может применяться ПУВА в комбинации с интерфероном или системным ретиноидом. Другие методы системной терапии включают использование фузионных рекомбинантных токсином, моноклональпых антител и мопохимиотерапию. Свидетельств в пользу более высокой выживаемости при лечении рецидивирующих опухолей с помощью комбинированной системной химиотерапии по сравнению с монотерапией не получено.
• В стадии III или при эритродермической форме без впекожных проявлений, либо только с ограниченным вовлечением лимфатических узлов и чеченце 4 недель применяется химиотерапия или фотофорез. Экстракорпоральная фотохимиотерапия подразумевает облучение лейкоцитов с ПУВА-терапией после лейкофереза перед внутривенной реинфузией клеток крови. Если ответная реакция задерживается, фотоферез можно комбинировать с интерфероном или системными ретиноидами.
• В стадии IV, характеризующейся внекожным поражением, назначается системная химиотерапия. Хотя после комбинированной химиотерапии наступает улучшение, оно длится менее одного года. Различные режимы включают следующие методы и препараты: циклофосфамид, випкристин и преднизон (ЦВП); ЦВП плюс адриамицин; ЦВП плюс метотрексат или циклофосфамид, винкристин, адриамицин и этопозид. При адъювантном лечении используются интерферон, системные ретиноиды и фотоферез. При монохимиотерапии применяются метотрексат, липосомальный доксорубицип, гемцитабин, этопозид, циклофосфамид и пуриновые аналоги. Таких пациентов необходимо направить к дерматологу, онкологу и специалисту по лучевой терапии.
• Пациенты должны находиться под наблюдением в связи с возможным развитием вторичных злокачественных опухолей.
Рекомендации пациентам с грибовидным микозом:
• Пациентам с грибовидным микозом следует избегать воздействия солнца, находиться в прохладной окружающей среде и постоянно смазывать кожу смягчающими препаратами.
• При ранней диагностике, если пятнистые или папулезные бляшки запимают менее 10% поверхности кожи (стадия IA), продолжительность жизни не меняется.
• В остальных случаях терапия при грибовидном микозе и синдроме Сезари малоэффективна, продолжительность жизни при стадии ИВ с поражением кожи составляет 4-6 лет, при стадии III - стадии генерализованной эритродермии - 3,2 года и менее 1,5 лет при стадии IVA и стадии IVB с вовлечением лимфоузлов и внутренних органов.
Через несколько дней появились другие гипопигментированные пятна и бляшки, распространившиеся на руки и бедра. При физикальном исследовании лимфаденопатия не выявлена. При исследовании материала, полученного с помощью трепанобиопсии и окрашенного гематоксилин-эозином, у дермо-эпидермального соединения были выявлены лимфоциты с мозговидными ядрами, характерные для грибовидного микоза - разновидности кожной Т-клеточной лимфомы. Основные показатели крови были в норме, тест на ВИЧ-инфекцию - отрицательный.
Пациентка сообщила об отсутствии улучшения после местного применения кортикостероидов высокой степени активности, которые наносились на пораженные участки, в связи с чем ей назначена терапия УФ-Б узкого спектра действия два раза в неделю.
Микоз грибовидный (mycosis fungoides; син.: гранулема фунгоидная, fibroma fungoides, sarcomatosis generalis и др.) — дерматоз, обусловленный злокачественной пролиферацией клеток лимфоидной ткани. Относится к группе гемодермий (см.).
Содержание
Этиология и патогенез
Этиология и патогенез не известны. Теория микробного происхождения заболевания оказалась несостоятельной. Достоверных данных, подтверждающих роль вирусов в возникновении Микоза грибовидного, также не получено. Предполагается, что постоянная антигенная (вирус, микроорганизмы или их белковые компоненты) стимуляция клеток лимфоидной ткани (см.) может привести к развитию злокачественных лимфопролиферативных процессов в коже. Не установлено, является ли М. г. первично-неопластическим процессом или результатом малигнизации воспалительно-гранулематозного процесса. Нек-рые исследователи рассматривают М. г. как Т-лимфопролиферативное злокачественное поражение кожи (см. Лимфома).
Амер. и англ. авторы относят М. г. к группе злокачественных лимфом. Согласно классификации, предложенной консультативным центром по лейкозам и гематосаркомам при ВОЗ (1977), М. г. входит в группу неходжкинских гематосарком, в подгруппу диффузной лимфосаркомы.
Обнаружение скоплений Т-лимфоцитов в очагах поражения кожи, иммунных комплексов в сосудах инфильтратов, увеличение содержания в сыворотке крови больных IgA, IgG, IgE и фактора, угнетающего миграцию макрофагов, и др. свидетельствуют об участии иммунных механизмов в патогенезе М. г.
В 70—80% случаев М. г. начинается в возрасте старше 40 лет и, как исключение, у лиц моложе 20 лет; мужчины болеют в 1,5—2 раза чаще, чем женщины. Микоз грибовидный регистрируется во многих странах Азии, Америки, Европы, в т. ч. и в СССР.
Патологическая анатомия
Гистологические изменения в коже варьируют в зависимости от клин, стадии заболевания.
Гистологические изменения кожи в экзематоидно-эритродермической стадии М. г. характеризуются акантозом, отеком и экзоцитозом в нижних отделах шиповидного слоя эпидермиса, расширением кровеносных и лимф, сосудов дермы и отложением в ней пролиферата, состоящего из лимфоцитов, фибробластов, плазматических клеток и небольшого числа эозинофилов, тучных клеток и нейтрофильных гранулоцитов.
В бляшечно-инфильтративной стадии Микоза грибовидный гистологические изменения более характерны: в эпидермисе выраженный акантоз с образованием гнезд лимфоцитов и гистиоцитов (микроабсцессы Потрие), к-рым придается большое диагностическое значение (однако отсутствие их не исключает М. г.); пролиферат в дерме более массивен и распространен в ее глубокие отделы, частично проникает в подкожную клетчатку и состоит из лимфоцитов, фибробластов, гистиоцитов, ретикулярных и плазматических клеток, эозинофильных и нейтрофильных гранулоцитов.
В опухолевой стадии М. г. клеточный пролиферат занимает всю толщу дермы, подкожную клетчатку и может распространиться на подлежащие ткани, прилегает к эпидермису, инвазируя, а нередко и сплошь его инфильтрируя. Среди пролиферирующих элементов много лимфоидно-ретикулярных и ретикулярных клеток в разных стадиях развития, часто с выраженной атипией, большое количество митозов. Сосуды расширены, их стенки утолщены и гиалинизированы, просветы нередко тромбированы или полностью облитерированы, часть из них разрушена п замещена клетками пролиферата. Эластические и коллагеновые волокна дистрофичны, в пределах клеточных скоплений фрагментированы. В пролифератах обнаруживают так наз. микозные клетки — атипичные лимфоидные клетки со свойствами Т-лимфоцитов с крупным мозговидным и почкообразным ядром. Висцеральная патология обнаруживается у больных М. г. в 15—20% случаев, при этом микроскопические изменения в органах менее выражены, чем в коже, и характеризуются гиперплазией клеток лимфоидной и ретикулярной ткани с признаками атипизма. В патол, процесс вовлекаются лимф, узлы, легкие, печень, селезенка, желудок, реже сердце, почки, надпочечники, поджелудочная железа, мозговые оболочки, крайне редко костная система.
Клиническая картина
В классической форме выделяют следующие стадии: I — экзематоидно-эритродермическую, II — бляшечно-инфильтративную, III — опухолевую.
I стадия характеризуется полиморфизмом начальных поражений кожи, напоминающих экзему, нейродермит, псориаз, красный плоский лишай, герпетиформный дерматит и локализующихся преимущественно на боковых поверхностях туловища, на животе, спине и конечностях. В 20—30% случаев в процесс постепенно вовлекается весь кожный покров (вторичная эритродермия). Общее состояние больных обычно удовлетворительное.


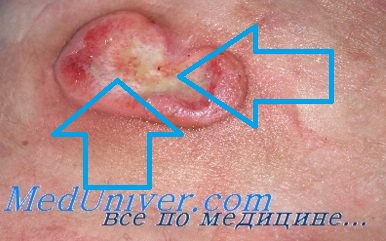
В III стадии на месте бывших бляшек появляются опухолевидные, нередко грибовидной формы образования, склонные к изъязвлению (цветн. рис. 2). Они насыщенно-красного с синюшнобагровым оттенком цвета, различной величины (в диаметре от 1 до 5 см и больше), плотны на ощупь, возвышаются на 1—4 см над уровнем окружающей кожи, тесно с ней спаяны; их поверхность гладкая или бугристая, слегка шелушащаяся. Для них характерен быстрый, в течение нескольких недель, рост и распад с образованием глубоких язв с валикообразно утолщенными краями, кровянисто-гнойным отделяемым и остатками гангренозно-распавшихся тканей. Во II и чаще в III стадии у больных нередко наблюдаются слабость, недомогание, потеря аппетита, субфебрильная температура, поражение внутренних органов (сердца, почек, легких), сепсис и другие тяжелые осложнения, от к-рых больные могут погибнуть.
Эритродермическая форма развивается у большинства больных без предшествующих высыпаний, в виде эритродермии по всему кожному покрову, сопровождающейся выраженной инфильтрацией, отеком кожи, обильным шелушением, на фоне плохого общего состояния и высокой температуры. Первоначально ярко-красная окраска кожи постепенно темнеет, приобретая синюшно-бурый оттенок; кожа резко истончается и собирается в складки, напоминая смятую папиросную бумагу. Периферические лимф, узлы увеличены, волосы на голове и в других местах редеют, ногти резко утолщаются, становятся ломкими, неровными, часто отпадают. Мучительный зуд, часто носящий пароксизмальный характер, вызывает многочисленные экскориации. Нередко отмечаются ощущения напряженности, стянутости кожи, чувство зябкости или жара в пораженных участках, в области складок кожи образуются глубокие трещины, вызывающие сильные боли.
Для всех форм Микоза грибовидного характерен изнурительный зуд кожи, к-рый в 20—25% случаев за много месяцев предшествует ее клин, изменениям. Поражение слизистых оболочек твердого и мягкого неба встречается редко. Почти у 2/3 больных М. г. отмечены гиперпигментация кожного покрова, дистрофия волос и ногтей, нарушение потоотделения, гиперкератоз ладоней и подошв. У 80—90% больных наблюдается поражение периферических лимфатических узлов, при этом они имеют мягкоэластическую, позднее — плотную консистенцию, обычно безболезненны, подвижны. В крови лейкоцитоз (моноцитоз), нейтрофилез с палочкоядерным сдвигом, эозинофилия; лимфоцитоз на ранних стадиях; лейкопения и ускоренная РОЭ в более позднем периоде М. г. Изменения показателей миелограммы обычно незначительны и неспецифичны.
Диагноз
Диагноз устанавливают на основании клин, картины и данных гистол, исследования. Цитограмма мазков-отпечатков пораженных участков кожи и пункция лимф, узлов имеют вспомогательное значение. Наибольшие трудности представляет диагностика I стадии классической формы М. г., когда специфические изменения кожи не выражены. Дифференциальный диагноз проводят с липомеланотическим ретикулезом (см.), бляшечным парапсориазом (см.), на ранних стадиях заболевания — с экземой (см.), нейродермитом (см.), псориазом (см.) и др.
Лечение
Кортикостероидные препараты (преднизолон, триамцинолон, урбазон, дексаметазон), цитостатические препараты (циклофосфамид, фосфазин, дипин, проспидин и др.) и рентгенотерапию применяют раздельно и в различных комбинациях.
Кортикостероидные препараты (суточная доза преднизолона 30— 40 мг, курсовая доза в пределах 1500—3000 мг) показаны гл. обр. в I и II стадиях классической формы М. г.; цитостатические препараты назначают во II и III стадиях этой формы, а также при эритродермической форме М. г.: циклофосфамид в дозе 100—200 мг внутривенно (или внутримышечно) ежедневно, на курс 2—4 г; фосфазин и дипин по 10—15 мг внутримышечно 2—3 раза в неделю, курсовая доза 150—200 мг. Проспидин в дозе 100—150 мг внутривенно (или внутримышечно) ежедневно, на курс до 3000—4000 мг, эффективнее в комбинации с небольшими дозами кортикостероидов во всех стадиях заболевания. Повторные курсы проспидина рекомендуется проводить через каждые 3— 6 мес. Другие цитостатики, напр, допан, рекомендуются при генерализованных опухолевых изменениях.
Местная рентгенотерапия (см.) показана при наличии опухолевидных образований, в среднем на курс доза составляет 1000—1200 р; в экзематоидно-эритродермической стадии классической формы М. г. иногда применяют пограничные лучи Букки в курсовой дозе 800—1000 р.
Возможно хирургическое иссечение отдельных изъязвившихся опухолей, беспокоящих больных, с последующей цитопатической или лучевой терапией.
Прогноз и Профилактика
Прогноз. В большинстве случаев Микоз грибовидный заканчивается летальным исходом. Средняя продолжительность жизни больных составляет 6—8 лет.
Профилактика обострений Микоза грибовидного заключается в диспансерном наблюдении и проведении периодических курсов поддерживающей терапии, индивидуальном подборе комбинаций лекарственных средств.
Библиография: Арутюнов В. Я. и Големба П. И. Гемодермии, М., 1964; Ашмарин Ю. Я. Поражения кожи и слизистых оболочек при ретикулезах, М., 1972; Каламкарян А. А. Некоторые актуальные вопросы клиники грибовидного микоза (Mycosis fungoides), Вестн, дерм, и вен., №12, с. 7, 1977; он же, Отечественный цитостатический препарат проспидин в терапии злокачественных ретикуло-гемобластозов, там же, № 6, с. 3, 19 78; Bohmer E. u. Heite H. J. Uber die Krankheitsdauer der Mykosis fungoides, Arch. Derm. Syph. (Berl.), Bd 196, S. 1, 1953; Gyr D. P., Geokas M. G. a. Worsley G. H. Mycosis fungoides, Hematologic findings and terminal cours, Arch. Derm., v. 94, p. 558, 1966; Fuks L., Bagshaw M. a. Farber E. Prognostic signs and the management of the mycosis fungoides, Cancer, v. 32, p. 1385, 1973; Gospos Ch. u. a. Mycosis fungoides, Med. Welt, S. 43, 1977; Hagedorn М., Kannen М. и. Реtres J. Mycosis fungoides—Klinik, Histopathologie und Therapie, Akt. Derm., Bd 2, S. 209, 1976; Rappaport H. The pathology of the extracutaneous lesions of mycosis fungoides, Bull. Cancer, v. 64, p. 275, 1977.
A. А. Каламкарян; В. В. Владимиров (цветн, рис.).
Читайте также:


