Биохимические маркеры эндогенной интоксикаций

Типичным представителем неодонтогенной гнойно-воспалительной патологии по-прежнему остается фурункул лица (ФЛ). Актуальность фурункула лица обусловлена неуклонным ростом количества больных данным заболеванием, развитием угрожающих для жизни осложнений и утратой трудоспособности пациента на длительный срок. По статистическим данным ряда авторов, фурункулы лица в России составляют около 30 % от всех воспалительных заболеваний челюстно-лицевой области. В 5-27 % случаев они осложняются флегмоной, тромбофлебитом, сепсисом, что нередко приводит к летальному исходу [4, 6, 8].
По мнению Матюнина О.Ю. (2009), развитие и особенность клинического течения фурункула лица в современных условиях связана с увеличением количества антибиотикорезистентных штаммов, снижением общей иммунологической реактивности организма, усилением вирулентности условно-патогенной микрофлоры, патоморфозом видового и количественного состава раневой микрофлоры. Другие авторы особое значение придают нарушению углеводного обмена, изменению гормонального фона и различным стрессорным факторам [4, 8, 9].
Фурункул лица отличается своим клиническим течением от фурункулов прочих локализаций, что зависит от особенности кровоснабжения челюстно-лицевой области. На лице расположено обширное венозное русло глубоких и поверхностных вен, которые имеют множественные анастомозы сетевидного строения, которые наиболее выражены вблизи средней линии лица. Для v. facialis характерна большая наклонность к формированию тромбов и последующему гнойному их распаду с образованием метастазов. У большинства больных отмечается развитие воспаления по гиперергическому типу. Стадия очищения и заживление гнойно-некротической раны при этом занимает длительное время. Пациенты с фурункулом лица находятся на лечении в среднем около 15 суток, а при сопутствующей патологии (сахарный диабет, иммунодепрессивные состояния) до одного месяца [1, 6].
Оптимизация диагностики и лечения неодонтогенных гнойно-воспалительных заболеваний лица является одной из актуальных задач челюстно-лицевой хирургии. Данной проблеме посвящено немало исследовательских работ. В настоящее время с успехом используют такие методы, как УФО, лазерная терапия, плазмаферез, экзогенная NO-терапия, иммунотерапия [4, 6, 8].
В последние годы уделяется пристальное внимание вопросам диагностики и лечения синдрома эндогенной интоксикации (ЭИ). Как правило, ее клинико-лабораторные проявления развиваются на фоне истощения внутренних компенсаторных механизмов организма, уменьшения активности антиоксидантной системы (АОС), повышенной концентрации продуктов перекисного окисления липидов (ПОЛ) и других токсических веществ в крови. Окислительный стресс способствует ингибированию репаративных процессов и может служить основанием к неблагоприятному исходу заболевания [3, 7].
Научно-исследовательских работ по изу-
чению антиоксидантной системы и эндогенной интоксикации у больных с неодонтогенной гнойно-воспалительной патологией челюстно-лицевой области в литературе не найдено. Следовательно, антиоксидантная терапия у пациентов с фурункулом лица не применялась и является новым перспективным направлением.
Цель исследования. Обосновать целесообразность включения антиоксидантных препаратов в традиционную схему лечения фурункула лица по результатам мониторинга клинических и лабораторных маркеров эндогенной интоксикации.
Материалы и методы исследования
В период с 2008 по 2011 г. в отделениях челюстно-лицевой хирургии ОКБ №1 г. Волгограда и ГКБ №1 им. С.З. Фишера г. Волжского нами было проведено обследование и лечение 59 пациентов с фурункулом лица в стадии абсцедирования. Возраст пациентов составлял от 18 до 35 лет (28,25 ± 1,59 лет). Среди пациентов было 36 мужчин (62,1 %) и 23 женщины (40 %).
Для определения региональных показателей нормы нами было обследовано 37 практически здоровых лиц в возрасте от 18 до 35 лет (26,29 ± 1,83 лет). Из них мужчин было 36 (62,1 %), женщин - 23 (40 %). Исключались лица с существенными отклонениями в общеклинических и биохимических анализах крови.
Распределение пациентов по клиническим группам проводили по методу простой рандомизации. Сформированные группы были репрезентативны и сопоставимы между собой по возрастному составу и полу. Набор группы условно здоровых лиц проводили на всем протяжении исследовательской работы.
Клиническое обследование больных включало анализ жалоб и данных анамнеза заболевания, объективных показателей общего состояния пациента: частоты дыхания, пульса, величины артериального давления, температуры тела, симптомов интоксикации. Также проводили оценку местного статуса: выраженности инфильтрации и перифокального воспалительного отека мягких тканей, изменения цвета кожных покровов, увеличения и болезненности регионарных лимфатических узлов, выраженности болевого синдрома и функциональных нарушений, площади раневой поверхности в динамике.
Величину инфильтрата и отека мягких тканей оценивали по трехбалльной шкале. Измерения проводились по модифицированной нами методике Н.Н. Свечниковой (2004) и В.В. Шеленковой (2008), с помощью сантиметровой линейки. Диаметр инфильтрата и отека мягких тканей, равный до 2 см, расценивался как 1 балл, от 2 до 3 см - 2 балла, более 3 см - 3 балла. Сокращение площади раневого дефекта оценивалось по методике Ярмольчука-Автандилова (1990). В ходе измерений использовалось прозрачное, самоклеящееся, нерастягивающееся плёнчатое покрытие Hydrofilm. Контур раны переносился на миллиметровую бумагу, с последующим подсчётом количества квадратных миллиметров внутри контура. Динамика площади раневой поверхности и перифокальных явлений протоколировалась цифровой фотокамерой в режиме макросъемки.
Анализ качества жизни проводили путем анкетирования и исчисляли по десятибалльной системе, разработанной на кафедре хирургической стоматологии и челюстно-лицевой хирургии ВолгГМУ (Хлыбов В.С., Химич И.В., Гутман Л.И., 2008). Отрицательный ответ на вопрос фиксировался как один балл. Качество жизни в 10 баллов расценивалось как удовлетворительное.
Лабораторные исследования осуществляли в клинической лаборатории ВОКБ №1. На основании данных общего анализа крови и результатов клинического обследования производили расчет ряда интегральных показателей (индексов) интоксикации: лейкоцитарного индекса интоксикации (ЛИИ) по формуле Я.Я. Кальф-Калифа (1941), гематологического индекса интоксикации (ГИИ) по Г.Н. Карабанову (1993), гематологического показателя интоксикации (ГПИ) по В.С. Васильеву (1983), пульсо-лейкоцитарно-температурного индекса интоксикации (ПЛТИИ) по формуле С.Д. Химича (1992). Поправочные коэффициенты определяли по соответствующим специально разработанным таблицам [7].
Традиционное лабораторное обследование было дополнено разработанным нами комплексом биохимических тестов, которые проводили на кафедре теоретической биохимии с курсом клинической биохимии ВолгГМУ [7].
Для оценки выраженности токсемии определяли уровень молекул средней массы (МСМ) в плазме крови спектрофотометрическим методом по Н.И. Габриэлян (1981), содержание диеновых конъюгатов и диенкетонов модифицированным методом Z. Placer et al., (1976). Для оценки степени мембранных повреждений определяли величину сорбционной способности эритроцитов (ССЭ) по А.А. Тогайбаеву (1988).
Материалом для биохимического исследования служили эритроциты и сыворотка крови. Забор крови осуществлялся натощак из локтевой вены одноразовым шприцем емкостью 10 мл, затем кровь медленно, постепенно перемешивая, добавляли в пробирку с 3,8 % раствором цитрата натрия в соотношении 1:10. Все анализы проводились при поступлении, на 3-4-е и на 8-10-е сутки после операции.
У 4 пациентов (14,3 %) контрольной группы в раннем послеоперационном периоде отмечена отрицательная динамика общего и местного статуса. Данным больным проведено дополнительное хирургическое лечение. В основной группе осложнения не наблюдались.
Сроки пребывания больных основной группы на стационарном лечении были меньше на 2-3 суток (см. табл. 1), следовательно, выздоровление происходило быстрее.
Анализ результатов клинико-лабораторного исследования показал, что у всех больных фурункулом лица в стадии абсцедирования в день госпитализации отмечалось достоверное повышение (p 9 /л)
1. Лейкоцитоз (увеличение количества лейкоцитов в венозной крови (более 10-10 /л). При оценке степени выраженности интоксикации лейкоцитоз следует учитывать наряду с другими признаками, свидетельствующими о длительности заболевания, распространенности патоло-ТОческого процесса и его динамики.
2. Лейкоцитарный индекс интоксикации (Кальф-Калиф Я. Я., 1941). Нормальные значения ЛИИ колеблются от 0,3 до 1,5.

3. Ядерный индекс интоксикации (Даштаянц Г. А., 1978). При ЯИИ, равном 0,05-0,08, состояние больного оценивается как удовлетворительное, 0,3-1,0 - средней степени тяжести, более 1,0 -тяжелое.
У больных в стадии токсемии ЛИИ и ЯИИ может снижаться, что свидетельствует о декомпенсации систем кроветворения и детоксикации. В этих случаях значительная часть токсичных продуктов белковой природы и эндотоксинов фиксируется на микросгустках и агрегатах и, выключаясь из общего кровотока, снижает токсичность крови.
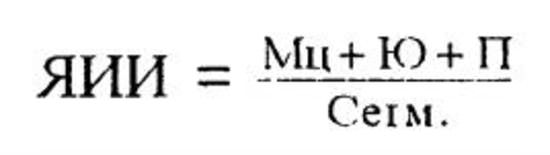
4. Индекс интоксикации (Гринев М. В., 1989). При ИИ, равном 35, прогноз заболевания неблагоприятный, при ИИ выше 45 в 100% случаев - летальный исход.
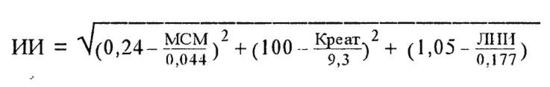
5. Концентрация общего белка в плазме крови.
- снижение уровня общего белка в плазме крови до 45 г/л указывает на тяжелую эндогенную интоксикацию и неблагоприятный исход болезни;
- уменьшение концентрации общего белка за счет альбуминовой фракции отражает использование альбумина как важнейшего фактора плазменной детоксикации, связывания и удаления токсинов;
- увеличение альфа-2-глобулинов в два раза огражает активность процесса с нарушением дезаминирования;
- увеличение гамма-глобулинов указывает на рост продукции грубодисперсных белков;
- снижение альбумино-глобулинового коэффициента (отношение количества альбуминов к количеству глобугашов) обусловливает при выраженной интоксикации переход альбуминов в ткани вследствие нарушенной проницаемости стенок сосудов, снижение интенсивности синтеза альбуминов в почечной ткани, ускорение их распада и превращения в другие белки, частично в глобулины, а также усиление синтеза альфа-2- и гамма-глобулинов. В норме атъбумино-глобулиновый коэффициент колеблется от 1,5 до 2,3.
6. Билирубин. Уровень билирубина более 30 ммоль/л вызывает выраженньш мембранотоксический эффект. Встраиваясь в мембраны и проникая в клетку, билирубин повреждает липиды митохондрий, вызывая их необратимое набухание, ингибирует утилизацию глюкозы, нарушает активность ферментов, ионную клеточную проницаемость. При эндогенной интоксикации билирубин плохо связывается с белками вследствие как гипоальбуминемии, так и вытеснения его из комплекса с альбумином лекарственными препаратами (гормонами, салуретиками).
7. Мочевина и креатинин. Увеличение уровня мочевины более 16 ммоль/л и креатинина более 0,2 ммоль/л указывает на наличие эндогенной интоксикации и сопровождается нарушением нейрогумо-рального контроля ЦНС.
8. Токсическая энзимопатия.
- увеличение уровней АЛТ, ACT, ЛДГ (изоферменты 1, 2, 5) указывает на нарушение проницаемости клеточных мембран;
- гипергликемия, увеличение концентрации лактата и пирувата отражает энергетическую несостоятельность клетки;
- увеличение концентрации молочной кислоты без повышения концентрации пировиноградной кислоты свидетельствует о повреждении ферментативных клеточных процессов;
- увеличение ДНКазы, РНКазы, кислой фосфатазы, катапрессина Д отражает степень деструкции клеток, лизиса внутриклеточных белков, а также энергодефицит клетки.
9. Молочная кислота. Увеличение концентрации молочной кислоты отражает уровень энергодефицита и гипоксии. Концентрация молочной кислоты более 4 ммоль/л расценивается как прогностически неблагоприятный признак.
10. Молекулы средней массы (МСМ) - являются олигопептидами с массой от 500 до 5000 Д, по своей природе относящимися к белковым токсинам с высоким содержанием дикарбоновых и низким - ароматических кислот.
МСМ обладают прямым мембранотоксическим действием и инициируют появление пептидов, близких по структуре к биорегуляторам. Среди них выделяют гепатоцеребральные, уремические, ишеми-ческие, ожоговые МСМ. На 80% МСМ состоят из белков и их метаболитов, в том числе продуктов гидролиза фибриногена и глобулинов, катаболизма глюкокортикоидов. В состав средних молекул входят биологически активные вещества (паратгормон, нейротоксин X, ингибиторы фагоцитоза, гемопоэза, хрупкости мембран эритроцитов, утилизации глюкозы и др.). Этим и определяется токсичность МСМ: нарушение эритропоэза, снижение розеткообразования, ингибирование дыхания митохондрий, нарушение синтеза ДНК в гепатопитах и лимфоцитах. Нейротоксические эффекты МСМ связаны с образованием ложных медиаторов: МСМ, взаимодействуя с инсулином, инактивируют гормон, ингибируя фосфорилирование, нарушают энергетический обмен в клетке.
Увеличение уровня МСМ - один из самых чувствительных признаков эндогенной интоксикации.
11. Коэффициент нейтрофилы/лимфоциты (отношение клеток неспецифической и специфической защиты). В норме коэффициент равен 2,0.
Увеличение коэффициента до 4,0 и более свидетельствует о нарастании тяжелой интоксикации.
опубликовано 19.04.2006 (Московское время 19:21) -->
II. БИОХИМИЧЕСКИЕ МЕТОДЫ ДИАГНОСТИКИ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ
1. ГРУППЫ МЕТАБОЛИТОВ СО СВОЙСТВАМИ ЭНДОГЕННЫХ ТОКСИНОВ
2. БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ МОЛЕКУЛ СРЕДНЕЙ МАССЫ
3. БИОХИМИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ ВЕЩЕСТВ СО СВОЙСТВАМИ ЭНДОГЕННЫХ ТОКСИНОВ. УРОВНИ ДИАГНОСТИКИ
В настоящее время существует много способов выявления эндогенной интоксикации с помощью гематологических, биохимических, биофизических, микробиологических, иммунологических методов и методов биологического тестирования.
К биохимическим показателям относят исследования:
1) компонентов и медиаторов воспаления,
2) метаболитов, характеризующих виды обмена и функции
жизненно важных органов,
3) компонентов перекисного окисления липидов (ПОЛ) и антиоксидантной защиты (АОС),
4) традиционных показателей эндогенной интоксикации – креатинина, мочевины, индикана, мочевой кислоты,
5) веществ низкой и средней молекулярной массы (ВСНММ).
Представляется целесообразным выделить три уровня биохимической диагностики синдрома эндогенной интоксикации.
Первый уровень
Метаболиты, характеризующие виды обмена и функции жизненно важных органов. Традиционные показатели эндогенной интоксикации – креатинин, мочевина, индикан, мочевая кислота.
Второй уровень
Вещества низкой и средней молекулярной массы.
Третий уровень
Компоненты и медиаторы воспаления, компоненты перекисного окисления липидов и антиоксидантной защиты.
В то же время, по мнению М.Я. Малаховой (1995), все методы лабораторной диагностики интоксикации можно разделить на: специфические, условно-специфические и неспецифические.
1. Специфические позволяют выявить действие токсических агентов, вызывающих синдром интоксикации: выделение конкретного токсического агента; метод биотестирования; реакция клапанного аппарата лимфатического сосуда брыжейки кишки; парамецийный тест; тетрахименовый тест; тест с семенным материалом быка; лимулис-тест; биомикроскопия конъюнктивы глаза; подвижность ядер буккального эпителия в электрическом поле.
2. Условно специфические позволяют выявить интоксикацию на клетках крови – эритроцитах и лейкоцитах: угнетение миграции лейкоцитов; фрагментация ядра лейкоцитов; реакция везикулообразования; реакция спонтанного лизиса лейкоцитов; НСТ-тест; катионно-лизосомальный тест; лейкоцитарный индекс интоксикации (ЛИИ); токсикогенная зернистость нейтрофилов; тест осмотической резистентности эритроцитов; тест на способность эритроцитов сорбировать метиленовый синий; тест токсической зернистости эритроцитов; оценка ВНСММ и олигопептидов эритроцитов по М.Я. Малаховой.
3. Неспецифические отражают либо воспалительную реакцию организма, либо изменения метаболизма: показатель лабораторный (Марчук и др.); индекс интоксикации: Гринева и др., Шугаева,
М.Я. Малаховой и др.; МСМ по Н.И. Габриэлян; ВСНММ по М.Я. Малаховой; олигопептиды по М. Глинскому; олигопептиды по Лоури; регистрация сверхмедленных колебаний потенциалов в
милливольтовом секундном и декасекундном диапазонах; уровень мочевины в биологических жидкостях; уровень плазменного фибронектина и церулоплазмина.
В настоящее время методы определения веществ (ВСНММ) являются общепризнанными критериями ЭИ. О содержании среднемолекулярных пептидов можно судить на основании прямой спектрометрии депротеинизированного супернатанта, полученного после осаждения белков раствором ТХУ при длинах волн 254 нм и 280 нм. Однако, по мнению В.В. Николайчика и др. (1991), для повышения точности метода белки вернее осаждать хлорной кислотой вместо ТХУ и проводить доосаждение высокомолекулярных примесей с помощью 80 % этанола.
Показатель Д254 рассматривается как интегральный критерий содержания УФ-поглощающих веществ низкой и средней молекулярной массы от 500 до 5000 Д, к которым, кроме пептидов относят около 200 соединений нормального и аномального метаболизма.
Согласно рекомендации М.Я. Малаховой (1995), суммарное содержание ВСНММ необходимо оценивать по площади под спектральной кривой оптического поглощения пробы в области 238-300 нм.
В последние годы предложен более чувствительный новый тест в диагностике интоксикации организма, и он не только более точный, но и простой, и заключается в определении концентрации тирозин-содержащих пептидов.
Так как эндогенная интоксикация может быть вызвана не только увеличением содержания каких-то конкретных веществ, но и нарушением равновесия между отдельными компонентами пула ВСНММ, было предложено рассчитывать коэффициенты, представляющие собой соотношение экстинкций на определенных длинах волн. Следовательно, характер физиологических и патологических процессов in vivo может быть определен не только по количественным изменениям специфических протеинов биологической среды, но и по их соотношению, что может дать дополнительную интегральную информацию о состоянии систем организма. Первым был предложен коэффициент Д280 / Д254, так называемый коэффициент распределения. Однако исследованиями А.Н. Ковалевского, О.Е. Нифантьева (1989) установлено, что показания этого коэффициента не всегда коррелировали с состоянием больного.
Далее были предложены другие коэффициенты: пептидно-нуклеотидного распределения и коэффициент ароматичности. Пептидно-нуклеотидный коэффициент рассчитывается по формуле соотношения экстинкций Д238 / Д260, который указывает на соотношение сдвигов в содержании пептидов и нуклеотидов в пуле ВСНММ. Коэффициент ароматичности рассчитывается по формуле Д238 / Д280 и свидетельствует о вкладе пептидов, не содержащих ароматичных хроматофоров, о соотношении хроматофоров ароматической и неароматической природы. Однако, эти данные не вызвали должного интереса.
В качестве показателя уровня эндогенной интоксикации предложено использовать:
- индекс токсичности, рассчитанный по соотношению содержания общей концентрации альбумина (ОКА) к концентрации ЭКА,
- коэффициент эндогенной интоксикации, рассчитанный по
формуле КЭИ= СМП/ЭКА* 1000
В последние годы все чаще используются исследования данных коэффициентов при ряде заболеваний.
В качестве основных показателей механизма детоксикации организма рекомендуют использовать сорбцию гидрофобных токсинов альбумином и липопротеинами плазмы. Это обусловлено тем, что альбумин, полифункциональный кислый белок, способен связывать эндо- и экзотоксины, приостанавливая их поступление в ткани. Низкое содержание этого белка создает условия для проникновения эндопатогенов в ткань и реализации их негативного воздействия.
Показано, что на ранних стадиях эндогенной интоксикации уровень СМП возрастает по сравнению с нормой в среднем на 20-30 %, на средней стадии - на 100-200 %, поздних - на 300-400 %.
Можно выделить лабораторные критерии нескольких уровней:
· маркеры острого отравления или эндогенной интоксикации, если они четко очерчены в данной клинической ситуации;
· лабораторные критерии, характеризующие вторичную токсическую аутоагрессию, ориентированные на оценку реакции организма данного больного на первичную и вторичную интоксикацию, а также позволяющие определять динамику токсичности компонентов внутренней среды и стадию ЭТ;
- показатели, характеризующие работу ФСД, органов и систем жизнеобеспечения организма.
Среди биохимических методов можно назвать исследование белкового спектра крови, содержание в крови мочевины и креатинина, функциональные пробы печени, активность протеаз, содержание в крови МСиНМ, интенсивность ПОЛ, активность моноаминооксидаз (МАО) и диаминооксидаз (ДАО) крови.
Считается, что основным токсическим субстратом, ответственным за возникновение стадии аутоагрессии эндотоксикоза, могут стать продукты клеточной дезорганизации, неполного распада и неферментного превращения белков крови и тканей. Они представлены в основном среднемолекулярными пептидами (СМП) с молекулярной массой 500—5000 Да. Наиболее точно фракцию СМП можно выделить методами гель-хроматографии на носителях, методами жидкостной и газовой хроматографии, масс-спектрометрии или ультрафильтрации.
Отдельно следует сказать о применении для выявления СМП спектрофотометрических методов, например, методики определения молекул средней массы (МСМ) по Н. И. Габриэлян или методики определения молекул низкой и средней массы (МНиСМ) по М. Я. Малаховой. Нормальная спектрограмма имеет следующий вид.
На основании характера спектрограмм плазмы крови, эритроцитов и мочи в процессе развития и прогрессирования эндотоксикоза М.Я.Малахова выделяет 5 биохимических фаз эндогенной интоксикации:
· в первой начальной фазе интоксикации наблюдается увеличение высоты эритроцитарного пика при неизмененной спектрограмме плазмы (компенсаторная фаза);
· во второй фазе увеличивается концентрация метаболитов как в плазме, так и в эритроцитах (фаза накопления продуктов из очага агрессии);
· для третьей фазы характерна стабилизация спектрограммы эритроцитов (полное насыщение) и дальнейшее увеличение высоты спектрограммы плазмы (фаза обратимой декомпенсации органов функциональной системы детоксикации);
· для четвертой фазы свойственно снижение высоты эритроцитарного пика до нормы и ниже (вероятно, вследствие изменения структуры мембраны эритроцитов) и продолжающийся рост количества оптически активных веществ в плазме (фаза несостоятельности систем гомеостаза и необратимой декомпенсации функциональной системы детоксикации).
· Довольно редко удается наблюдать пятую, терминальную стадию эндогенной интоксикации, когда отмечается значительное повреждение мембран, сопровождающееся снижением содержания метаболитов как на эритроцитах, так и в плазме крови (фаза полной дезинтеграции систем и органов).
Определение МСиНМ, например, при эндогенной интоксикации, вызванной термическими ожогами, высоко коррелирует как с тяжестью травмы (по индексу Франка), так и с другими показателями, отражающими тяжесть интоксикации – лейкоцитарным индексом интоксикации, индексом сдвига нейтрофилов, парамецийным тестом и др.
Широкое диагностическое значение приобрело определение активности ПОЛ. Процессы ПОЛ активируются при самых разнообразных патологических процессах, имея, таким образом, неспецифический характер. Исследование ПОЛ не может быть применено в целях дифференциальной диагностики, но для определения степени тяжести патологического процесса, в том числе и эндогенной интоксикации, оно используется весьма успешно. С этой целью применяются биохимические и биофизические методы, такие как хемилюминесцентный анализ, амперометрический анализ общей антиоксидантной активности биологических жидкостей, определение количества перекисных продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-активные продукты в виде тиобарбитурового числа (ТБЧ)).
Специфичным для некоторых видов эндогенной интоксикации, в частности ожоговой, является показатель аминооксидазной активации крови. В норме МАО (субстрат бензиламин) равняется 16,2 ± 3,8 мкмоль/(л•ч), а ДАО (субстрат ксилилендиамин) — 0,8 ± 0,05 мкмоль/(л•ч).
При тяжелой эндогенной интоксикации активность МАО может снижаться до 3,5 ± 1,8 мкмоль/(л•ч), в то время как ДАО увеличивается до 17,5 ± 1,6 мкмоль/(ч•л). Такие изменения очень характерны, что делает диагностически значимым коэффициент МАО/ДАО (в норме около 19, а при очень тяжелой ожоговой интоксикации может снижаться до 0,2).
Особенно информативна в этом отношении динамика ДАО-активности. При благоприятном течении ожоговой болезни активность ДАО постепенно нормализуется, в то время как при неблагоприятном исходе наблюдается повторный более выраженный рост активности ДАО до 4,5—6,5 мкмоль/(л•ч), предшествующий за 14—96 ч гибели больных.
Эндогенная интоксикация в стоматологии. При воспалительных заболеваниях челюстно-лицевой области, происходит накопление в крови и ротовой жидкости МСиНМ (прежде всего, продуктов распада коллагена, цитокинов, продуктов неферментативного распада жирных кислот), которые тормозят дифференцировку Т- и В-лимфоцитов, замедляют рост культуры фибробластов здоровой и воспаленной десны, значительно утяжеляют течение заболевания, приводя к угнетению местного иммунитета, способствуют хроническому течению воспалительных заболеваний. Также в слюну и ротовую жидкость могут поступать МСиНМ при соматических заболеваниях (почечная недостаточность, печеночная недостаточность и др.), что ведет к нарушениям гомеостаза в ротовой полости, способствует развитию и прогрессированию стоматологических заболеваний у данной категории больных.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Таким образом, развитие эндогенной интоксикации (токсикокинетика) и его клинические проявления (токсикодинамика) подчиняются общим законам токсического действия, рассмотренным выше.
Результаты научных исследований, проведенных в течение последних 10-15 лет, позволили сформировать понятие о биохимическом субстрате эндогенной интоксикации, в качестве которого чаще всего выступает ряд веществ среднемолекулярной массы. Клинически синдром впервые описал Л Бабб (1971) у больных с ХПН при выраженном нейротоксическом синдроме. В его состав входят продукты конечного обмена, промежуточного и измененного метаболизма, причем уровень их содержания в крови коррелирует с тяжестью состояния больных, степенью выраженности клинических и лабораторных проявлений интоксикации, а также летальностью.
В общем пуле веществ со среднемолекулярной массой в первую очередь следует выделять олигопептиды с молекулярной массой до 10 кД, среди которых различают регуляторные и нерегуляторные пептиды.
Регуляторные пептиды - гормоны, играющие важную роль в процессе жиз-недеятельности, обеспечении гомеосгаза и патогенезе различных заболеваний, например, нейротензины, нейрокинины, эндорфины, вазоактивный интестинальный пептид, соматостатин и другие, обеспечивающие анализ влияния внешней среды на организм.
Нерегуляторные пептиды - биологически активные вещества, поступившие извне токсины (бактериальные, ожоговые, кишечные и др) или образовавшиеся внутри организма в результате аутолиза, ишемии или гипоксии органов, интенсивного протеолиза продуктов разных метаболических процессов, причём наиболее обширную группу постоянно идентифицируемых пептидов составляют фрагменты коллагена, фибриногена и других белков плазмы крови, выделяемые с мочой при самых различных заболеваниях и синдромах ожогах, почечной и печёночной недостаточности, травмах со сдавлением тканей, инфекциях (особенно при сепсисе), панкреатите, онкологических и аутоиммунных заболеваниях и др.
Кроме того, существует также большая группа небелковых среднемолекулярных и низкомолекулярных веществ - метаболитов, катаболических и анаболических, биологическая активность которых весьма разнообразна от участия в работе гомеостаза до альтерирующего действия в токсических концентрациях. К ним относят, например, мочевину, креатинин, холестерин, билирубин и др.
Отдельные компоненты пула средних молекул:
- обладают нейротоксическим действием,
- вызывают вторичную иммунодепрессию,
- дают ингибирующий эффект на эритропоэз, биосинтез белка и нуклеотидов, тканевое дыхание, повышают проницаемость мембран, усиливают переокис- ление липидов,
- оказывают цитотоксическое действие,
- нарушают натрий-калиевый баланс, микроциркуляцию крови, лимфы и др.
Очевидно, что основной патологический процесс эндотоксикоза развертывается на клеточном и молекулярном уровне и связан с изменением свойств клеточных мембран, что приводит к нарушению внутриклеточного гомеостаза.
В клинической токсикологии понятие эндотоксикоза длительное время ассоциировали, в основном, с токсическим поражением печени и почек как важных составных частей системы естественной детоксикации организма. При этом клинические и лабораторные признаки эндотоксикоза обнаруживали в соматогенной стадии отравлений гепато- и нефротоксическими веществами через 3-4 дня после начала заболевания при формировании печёночно-почечной недостаточности. Однако эндотоксикоз развивается и в токсикогенной стадии острого отравления веществами нейро- и психотропного действия вскоре после химической травмы без заметных нарушений функции печени и почек.

[1], [2], [3], [4], [5], [6]
Лечение эндогенной интоксикации
- Учитывая указанные выше традиционно сложившиеся направления в лечении острых токсикозов, Е. А. Лужниковым (1977) была предложена клиническая классификация современных методов детоксикации, широко используемая в настоящее время в медицинской науке и практике. Согласно этой классификации в первую отдельную группу (А) выделяют методы стимуляции естественных процессов детоксикации выведения, биотрансформации, транспорта и связывания токсикантов.
- Во второй отдельной группе (В) представлены все методы искусственной физико-химической детоксикации, названные так в связи с искусственно созданным экстракорпоральным (часто аппаратным) дополнительным каналом выведения токсикантов, призванным разгрузить естественную систему детоксикации и даже временно заменить её.
- В третьей отдельной группе (С) собраны все фармакологические препараты для специфической (антидотной) терапии отравлений, которые по указанной выше причине занимают скромное место в арсенале детоксикационных средств и применяются в основном на догоспитальном этапе.
Помимо методов активной детоксикации, которые имеют характер этиологического лечения и поэтому наиболее эффективны в самой ранней фазе токсикогенной стадии отравлений (токсикокинетическая коррекция), при осложненной форме заболевания, по мере нарастания его тяжести, возрастает роль симптоматической терапии, обычно имеющей реанимационное содержание, что позволяет сохранить определённый минимум функций жизненно важных органов для обеспечения возможности проведения детоксикационных мероприятий (токсикодинамическая коррекция). Чаще всего основными видами осложнений становятся известные патологические синдромы токсический шок, ОДН, токсико-гипоксическая энцефалопатия, кардиомиопатия и эндотоксикоз.
При эндогенной интоксикации главное внимание уделяют лечению основного заболевания, вызвавшего развитие этого синдрома (отравление, ожоги, гепато- и нефропатии, панкреатит и др.), однако методы эфферентной детоксикационной терапии всегда занимают значительное место в комплексе лечебных мероприятий, особенно гемосорбция, диализ и ГФ, плазмаферез.
В клинической токсикологии раннее применение эфферентной терапии способствует заметному уменьшению выраженности эндогенной интоксикации и предупреждению полиорганных поражений.
При острых отравлениях синдром эндогенной интоксикации отчетливо проявляется только в соматогенной фазе заболевания вследствие химических ожогов пищеварительного тракта, развития почечно-печёночной недостаточности и токсико-гипоксической энцефалопатии.
В токсикогенной фазе явления эндогенной интоксикации спонтанно купируются во время проведения эфферентной детоксикационной терапии, направленной на выведение из организма основных экзотоксикантов, вызвавших острое отравление.
Читайте также:


