Как проверить воду на кишечную палочку
Санитарно-бактериологическое исследование воды - Ф. К. Черкес
Исследованию подлежит вода:
1) централизованного водоснабжения;
2) из колодцев различного типа;
3) открытых водоемов (рек, озер, морей);
4) плавательных бассейнов;
Примечание. Пробы хлорированной воды берут во флаконы с дехлоратором (гипосульфитом).
Отбор проб воды. Из открытых водоемов воду берут с помощью специальных бутылей или батометров, снабженных грузилами. Пробу воды рекомендуют брать на глубине 10-15 см от поверхности (так как поверхность подвергается воздействию атмосферных факторов) и на расстоянии 1,5 м от берега (вода у самого берега может быть загрязнена микрофлорой почвы).
Для отбора проб водопроводной воды используют стерильные флаконы вместимостью 500 мл, закрытые ватно-марлевыми пробками и покрытые бумажными колпачками.
Кран предварительно обжигают тампоном, смоченным спиртом, после чего воду спускают в течение 10-15 мин и набирают во флаконы. Заполненные флаконы закрывают стерильными пробками.
Примечание. Исследуют 333 мл воды (табл. 54).

Таблица 54. Эмпирическая таблица ГОСТ 16963-73
В распределительной сети водопровода отбор проб воды осуществляют в зависимости от количества населения, проживающего в зоне обслуживания.
Стандартные методы исследования регламентированы для воды центрального водоснабжения (ГОСТ 18963-73) и предусматривают:
1. Определение общего числа микроорганизмов (в 1 мл исследуемой воды должно быть не более 100).
2. Определение коли-индекса и коли-титра (коли-индекс 3, коли-титр 333 и выше; для Москвы и Ленинграда коли-индекс не более 2, а коли-титр более 500).
3. Исследование по эпидемиологическим показаниям на патогенную микрофлору (патогенных микроорганизмов не должно быть обнаружено).
Согласно ГОСТу 18963-73 общее число бактерий - это то количество микроорганизмов, которое содержится в 1 мл исследуемой воды, способных в течение суток при температуре 37° С образовывать колонии, видимые невооруженным глазом (или при увеличении с помощью лупы).
При исследовании водопроводной воды засевают 2 чашки. В одну из них вносят 1 мл неразведенной воды, в другую 1 мл воды, разведенной в 10 раз (т. е. 0,1 мл исходной пробы).
При исследовании более загрязненной воды засевают 1 мл воды, разведенной в 100 раз. Это соответствует 0,01 и 1 мл .воды, разведенной в 1000 раз (0,001 мл) и т. д. Для получения таких объемов готовят последовательно десятикратные разведения, по 1 мл каждого разведения вносят в чашку и заливают тонким слоем (12-15 мл) растопленного и остуженного до 45° С питательного агара. Для равномерного распределения исследуемой воды залитые агаром чашки перемешивают путем вращения их. После застывания агара посевы ставят в термостат и инкубируют при температуре 37° С 24 ч.
Чашки с посевами вынимают из термостата и подсчитывают число выросших колоний. Учитывают только те чашки, где число колоний находится в пределах 30-300. Если колоний немного, их подсчитывают невооруженным глазом или при помощи лупы.
Если колоний много, то подсчет можно вести с помощью специального прибора для счета микробных колоний (рис. 54).
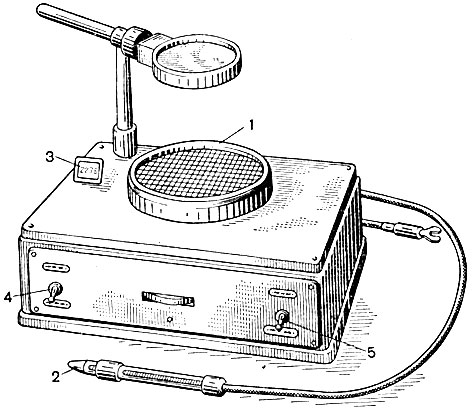
Рис. 54. Прибор для счета колоний микроорганизмов. 1 - столик для чашки Петри; 2 - игла с пружинным устройством; 3 - показатель счетчика; 4 - тумблер для включения импульсного счетчика; 5 - тумблер для включения лампы освещения счетчика
Подсчитанное количество колоний умножают на разведение и узнают число микробов в 1 мл исследуемой воды.
Наличие БГКП (бактерий группы кишечной палочки) является показателем фекального загрязнения, интенсивность которого характеризуют:
Коли-индекс - количество кишечных палочек, обнаруженных в 1 л воды.
Коли-титр - наименьшее количество воды, в котором обнаруживают присутствие кишечной палочки * .
* ( Коли-титр и коли-индекс - это один показатель, различно выраженный.)
Для выявления в воде БГКП можно пользоваться двумя методами: титрационным (бродильным) и методом мембранных фильтров.
Для исследования воды используют среду накопления глюкозопептонную (ГПС) среду Эйкмана с индикатором и бродильными трубками. Среда готовится концентрированной (в 10 раз) и нормальной концентрации - для посева 1 мл воды.
Исследуемую воду засевают по 100 мл в 3 колбы, по 10 мл в 3 пробирки (с концентрированной средой) и по 1 мл в 3 пробирки (со средой нормальной концентрации) - всего 333 мл. Посевы инкубируют в термостате при 37° С 24 ч.
Вынимают посевы из термостата и просматривают их.
При наличии помутнения в колбах или пробирках из них производят посев петлей на сектора среды Эндо в чашках Петри. Посевы инкубируют в термостате при 37° С.
Вынимают чашки из термостата. Из подозрительных колоний делают мазки. При наличии грамотрицательных палочек ставят пробу на оксидазную активность. Положительная проба на оксидазу дает право дать отрицательный ответ.
Проба на оксидазу. 1-й способ: со среды Эндо снимают петлей 2-3 колонии каждого типа и наносят на поверхность фильтровальной бумаги, смоченной диметилпарафенилендиамином. Положительная реакция характеризуется посинением штрихов, сделанных из колоний.
2-й способ: реактив можно нанести на изолированную колонию на среде Эндо (красная колония - синеет) (рис. 55).
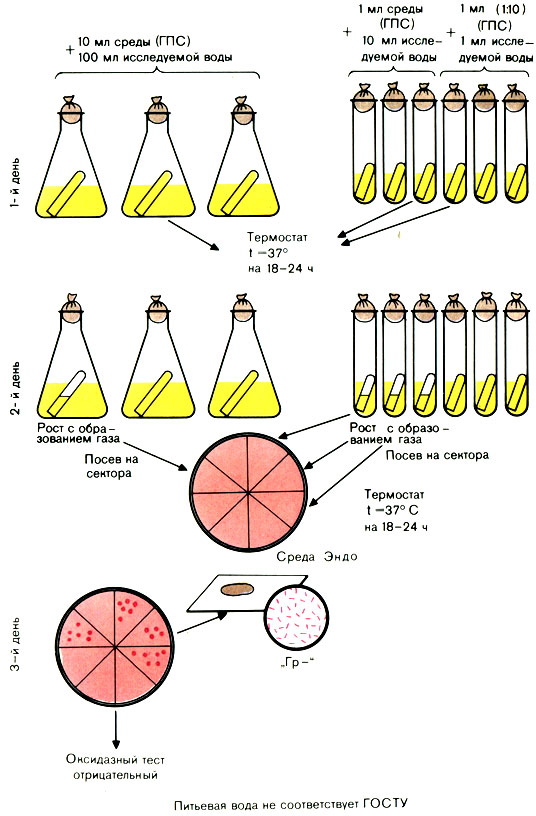
Рис. 55. Определение коли-индекса воды титрационным методом
Отрицательная проба на оксидазу свидетельствует о наличии в воде БГКП. В этом случае вычисляют коли-индекс и коли-титр с помощью стандартных (эмпирических) таблиц ГОСТа 16963-73 (см. табл. 54).
Эти таблицы предусматривают любую возможную комбинацию объемов посева, из которых выделена кишечная палочка.
Для фильтрации воды можно использовать воронку Гольдмана вместимостью 700-800 мл.
В воронку смонтированного и простерилизованного фильтровального прибора Зейтца наливают отмеренный объем исследуемой воды. С помощью насоса создают вакуум в приемном сосуде (обычно воду фильтруют через фильтры № 2 и 3). По окончании фильтрации стерильным или обожженным в огне пинцетом снимают фильтр и накладывают его на среду Эндо в чашке Петри так, чтобы поверхность с осевшими на ней микробами была обращена вверх (на одну чашку можно помещать 3-4 мембранных фильтра).
Посевы инкубируют в термостате при температуре 37° С 18-24 ч.
Чашки с посевами (фильтрами) вынимают из термостата. Отсутствие подозрительных колоний дает право дать отрицательный ответ.
Учету подлежат все красные и розовые колонии с металлическим блеском или без него. Из выросших колоний делают мазки, окрашивают по Граму (рис. 56).
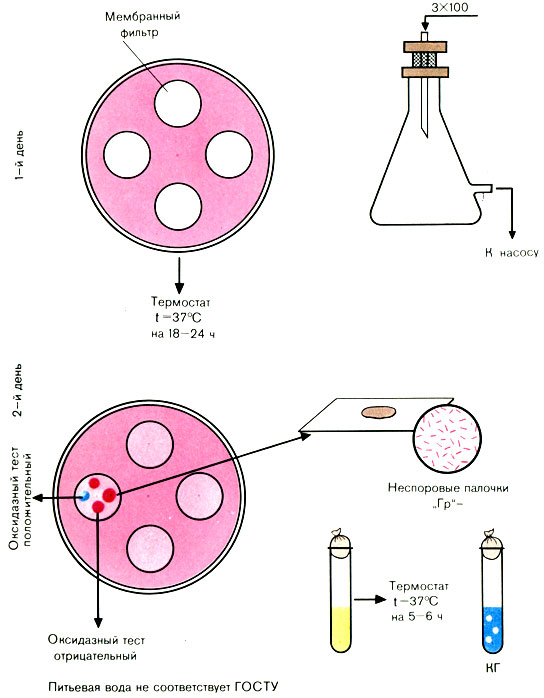
Рис. 56. Определение коли-индекса воды методом мембранных фильтров
При наличии грамотрицательных палочек ставят пробу на оксидазу. Положительная оксидазная проба дает право дать отрицательный ответ. При отрицательной оксидазной пробе производят посев на полужидкую среду с глюкозой и индикатором или на среду ГПС с бродильными трубками - для выявления ферментации углевода до кислоты и газа. При наличии кислоты и газа вычисляют коли-индекс. Например, на всех фильтрах, находящихся на среде Эндо, выросло 3 колонии, пропущено через фильтр было 300 мл воды.
Примечание. Титрационный метод более точный и может быть использован при наличии в воде примесей. Метод мембранных фильтров экономичнее и дает возможность дать ответ на 2-й день.
Для определения наличия в воде свежих фекальных кишечных палочек производят посев воды (3-х объемов) на лактозопептонную среду с борной кислотой. Инкубируют при 43° С 24 ч. Наличие кислоты и газа свидетельствует о свежем фекальном загрязнении.
По эпидемиологическим показаниям в воде определяют сальмонеллы, шигеллы, энтеровирусы.
Примечание. Общепринятым дополнительным показателем фекального загрязнения питьевой воды являются энтерококки. При проведении бактериологического исследования определяют все группы энтерококков, хотя санитарное значение имеют преимущественно фекальные стрептококки, обнаружение которых является показателем свежего фекального загрязнения.
1. Какова основная задача санитарной микробиологии?
2. Что такое санитарно-показательные микроорганизмы?
3. Что такое коли-индекс и коли-титр?
4. Какие Вы знаете методы определения БГКП?
Определите общее число микробов в исследуемой пробе воды. Среда ГПС (Эйкмана).
ГПС (Эйкмана) концентрированная. В 1 л воды растворяют 100 г пептона, 50 г хлорида натрия. Нагревают смесь до кипения, фильтруют, прибавляют 100 г глюкозы, устанавливают рН 7,4-7,6 и разливают по 10 мл в колбы вместимостью 250 мл, по 1 мл в 3 пробирки (концентрированной среды) и по 1 мл в 3 пробирки со средой нормальной концентрации (во всех емкостях среду до нужной концентрации доводят стерильной водой).
Примечание. При исследовании особенно загрязненных вод делают большие разведения (например, 10 -6 , 10 -7 и т. д.).
Цель занятия. Ознакомить студентовс микрофлорой воды, источниками ее загрязнения патогенной микрофлорой. Студенты должны овладеть различными методами бактериологического исследования воды: определения количества МАФАнМ, коли-титра и коли-индекса воды.
Материальное оснащение. Пробы речной воды и стерильные пробирки для взятия водопроводной воды; чашки Петри, расплавленный МПА в пробирках столбиком, стерильные пипетки на 1 мл, стерильный физраствор по 9 мл, спирт для факела, пинцет, вата.
Для демонстрации – прибор Зейтца, водоструйный вакуумный насос, кипяченые мембранные фильтры №3 в стакане с дистиллированной водой, среда Эндо в чашках Петри; глюкозо-пептонная среда (ГПС) с индикатором и поплавками, разлитая по колбам и пробиркам.
Для демонстрации – 3 колбы и 6 пробирок с ГПС с готовыми посевами воды для определения коли-титра воды методом бродильных проб. Только в первой колбе с посевом 100 мл исследуемой воды должно быть помутнение, изменение цвета индикатора (красный цвет индикатора меняется на желтый) и наличие пузырьков газа в поплавках. Агар Эндо в чашках Петри с 4 мембранными фильтрами после фильтрации воды и наличием красных колоний на поверхности белого фильтра.
Вода является естественной средой обитания многих микроорганизмов. Особую опасность для здоровья человека и животных представляют патогенные бактерии, которые могут быть в воде.
Источниками загрязнения воды патогенными микроорганизмами являются выделения больных животных и людей, трупы животных, сточные воды, особенно предприятий, перерабатывающих сырье животного происхождения и др. Длительность выживания патогенных микробов в воде зависит от их вида, условий окружающей среды и может составлять от нескольких часов до нескольких лет. Так, возбудитель сибирской язвы может сохраняться в воде до 3 лет, возбудитель туберкулеза до 1 года, а бруцеллы - до 100 дней. Имеется группа болезней, для которых характерен водный путь распространения (паратифы, лептоспирозы).
Таким образом, вода может стать источником распространения инфекционных болезней и возникновения эпидемий и эпизоотий.
Для санитарно-микробиологической оценки воды проводят следующие исследования:
1.Определение количества МАФАнМ в 1 мл воды;
2. Определение коли-титра (КТ) и коли-индекса (КИ);
3. Обнаружение в воде патогенных микроорганизмов по эпидпоказаниям.
При санитарно-микробиологических исследованиях пробы воды забирают в объеме не менее 0,5 л. Из открытых водоемов пробу воды отбирают батометром. Батометр – стерильная емкость с пробкой, в металлическом каркасе и свинцовым грузилом. На нужной глубине пробку открывают, подтягивая ее за веревочку. Воду из рек, озер отбирают с глубины 10-15 см от поверхности, а при небольшой глубине на расстоянии 10-15 см от дна.
Для отбора проб водопроводной воды из крана используют стерильные колбы на 0,5 л с ватной пробкой. Кран предварительно стерилизуют обжиганием, горящим спиртовым тампоном, затем в течение 10 мин спускают воду. Пробы воды исследуют тотчас же или не позднее 2 ч с момента взятия. Если это невозможно, то хранят не более 6 ч при 1-5 0 С.
Определение количества МАФАнМ в водопроводной воде. В чашку Петри с соблюдением правил асептики вносят 1 мл водопроводной воды без разведения, заливают 15 мл расплавленного и охлажденного до 45 0 С МПА. Посевы инкубируют в термостате при 30 0 С 72 ч. Количество бактерий в 1мл воды определяют по количеству выросших колоний.
Для определения количества МАФАнМ в воде открытых водоемов исследуемую воду в зависимости от предполагаемого загрязнения предварительно разводят стерильной водой от 1:10 -1 до 1:10 -4 , из двух последних разведений по 1 мл вносят в стерильные чашки (не менее 2 чашек на каждое разведение) и заливают 15 мл расплавленного и охлажденного до 46 0 С МПА. Посевы помещают в термостат при 30 0 С на 72 ч, подсчитывают количество колоний, умножают на степень разведения и определяют количество бактерий в 1 мл воды открытых водоемов.
Определение коли-титра (КТ) и коли-индекса (КИ) воды.
Коли-титром называют наименьший объем воды, в котором обнаружена одна кишечная палочка.
Коли-индекс показывает число кишечных палочек в 1000 мл воды.
Кишечная палочка является постоянным обитателем кишечника человека и животных, следовательно, ее присутствие в питьевой воде является индикатором фекального загрязнения. Чем выше концентрация бактерий группы кишечной палочки, тем вероятнее присутствие таких бактерий, как сальмонеллы, возбудители дизентерии и холеры. Показатели КТ и КИ указывают на санитарное состояние воды, ее пригодность в качестве питьевой. КТ и КИ определяют двумя методами:
1.Метод бродильных проб.
2.Метод мембранных фильтров.
Метод бродильных проб
Этот метод основан на ферментативной активности бактерий группы кишечной палочки (БГКП), которая выражается в способности расщеплять при помощи ферментов лактозу или глюкозу до кислоты и газа. Исследуемая вода засевается в различных объемах в среду накопления - глюкозо-пептонную среду (ГПС) с индикатором и поплавками. При наличии кишечной палочки появляется помутнение, меняется цвет индикатора, и появляются пузырьки газа в поплавках. Из забродивших посевов делают пересев на дифференциально-диагностические среды.
Методика: засевают водопроводную воду в объеме 333 мл, разделенной на 9 порций (три объема по 100 мл, три – по 10 мл и три - по 1 мл). При этом вода в объемах по 100 мл засевается в три колбы с 10 мл концентрированной ГПС, 10 мл - в три пробирки с 1 мл концентрированной среды, а 1 мл воды вносят – в пробирки с 10 мл среды с нормальной концентрацией. Посевы инкубируют в термостате 24 часа при 37 0 С. При отсутствии БГКП в исследуемой воде, изменение цвета индикатора и образование газа не происходит
Рост кишечной палочки сопровождается помутнением среды, изменением цвета индикатора (красный цвет переходит в желтый) и появлением газа в поплавках. Из колбы и пробирок с признаками роста проводят пересев на агар Эндо штрихом по секторам. Посевы инкубируют при 37 0 С 24 часа. При отсутствии роста на агаре Эндо или при наличии колоний, не характерных для БГКП, дается отрицательный ответ.
Из колоний, характерных для бактерий БГКП (ярко-красных с металлическим оттенком, розовых), готовят мазки, их окрашивают по Граму, микроскопируют. Дополнительно изучают культуру по оксидазному тесту. Для этого на фильтровальную бумагу пропитанную раствором альфа-нафтола-диэтил-n-фенилендиамина наносят штрихом 2-3 колонии снятые с агара Эндо.
Для кишечной палочки характерно: наличие грамотрицательных палочек в мазке и отсутствие изменений в окраске фильтровальной бумаги на оксидазный тест. Следовательно, наличие грамотрицательных палочек и отрицательный оксидазный тест подтверждает наличие кишечной палочки в исследуемой воде.
Для подтверждения свежего фекального загрязнения исследуемой воды посевы выращивают при 43 0 С для дифференциации от кишечных палочек хладнокровных, не растущих при такой высокой температуре. Требования к санитарному состоянию воды приведены в таблице 3.
Микробиологические нормативы санитарного состояния воды
| Объект контроля | МАФАнМ, КОЕ, не более | Коли- титр, не менее | Коли- индекс, не более | Периодичность контроля |
| Вода водопров-я | 100 в 1 мл | 1 раз в месяц | ||
| Вода открытых водоемов | 1000 в мл | - |
Из таблицы видно, что для питьевой воды установлены следующие нормативы бактериологических показателей:
- общее микробное число – не более 100 в 1 мл;
- коли-титр - не менее 333;
- коли-индекс не должен превышать 3 кишечных палочек в 1000 мл.
Вода открытых водоемов считается доброкачественной, если общее микробное число – не более 1000 в 1 мл, коли-титр – не менее 111, коли-индекс – не более 9.
Метод мембранных фильтров
Для исследования воды применяется мембранный фильтр №3 из нитроцеллюлозы, с диаметром пор 0,7 мкм, который задерживает на своей поверхности БГКП. Перед использованием мембранные фильтры кипятят 10-15 мин в дистиллированной воде. Фильтр, с соблюдением правил асептики, матовой поверхностью вверх накладывают на сетку фильтрационного прибора Зейтца. В воронку прибора наливают исследуемую воду и в приемной колбе Бунзена создают вакуум при помощи водоструйного насоса. Исследуемую воду фильтруют через мембранный фильтр, а бактерии, находившиеся в ней, остаются на поверхности. После фильтрации мембранный фильтр матовой стороной вверх переносят на поверхность агара Эндо в чашках Петри. Чашки ставят в термостат при 37 0 С на 18-24 ч.
Через поры мембранного фильтра происходит диффузия питательных компонентов среды Эндо, вследствие этого оставшиеся на поверхности БГКП размножаются на поверхности фильтра и образуют типичные колонии - красные с металлическим оттенком. По числу выросших колоний определяют количество кишечных палочек в 1000 мл воды и тем самым устанавливают коли-индекс.
Водопроводную воду исследуют в объеме 333 мл, которую дробно и последовательно пропускают через четыре фильтра в объемах - 200, 100, 30 и 3 мл воды.
Наличие в воде патогенных бактерий устанавливают путем посева на дифференциально-диагностические и селективные питательные среды с последующей их идентификацией методами, принятыми в микробиологии.
Не нашли то, что искали? Воспользуйтесь поиском:
Определение микробного числа воды.
Порядок выполнения работы.
Микробное число воды – это количество колоний микроорганизмов, вырастающих при посеве 1 мл воды на РПА за 24 часа при температуре 37° С. Этим показателем определяются не все микроорганизмы, а только те, которые способны расти на РПА при указанной температуре, т.е. это сапрофитные, мезофильные, аэробные и часть факультативно-анаэробных микробов. Микробное число воды характеризует общую загрязненность её микроорганизмами и для водопроводной воды не должно превышать 50.
При определении микробного числа водопроводной воды, воды из родников, артезианских скважин пробу сеют без разведения, а воду из открытых водоемов разбавляют стерильной водой. Степень разведения выбирают, исходя из предполагаемой загрязненности воды. Из каждой пробы употребляют для посева не менее двух различных разведений, с тем, чтобы на чашках вырастало от 30 до 300 колоний. Воду вносят стерильной пипеткой в стерильную чашку Петри, соблюдая правила стерильности, затем в чашку вливают 15 мл расплавленного и охлажденного до 45°С РПА или МПА, вращательным движением перемешивают воду с питательной средой. После застывания среды чашки вверх дном помещают в термостат. На крышке записывают все данные об анализе. Посевы водопроводной воды выращивают 24 часа при температуре 37°С, а посевы воды из естественных водоемов ещё 48 часов при температуре 20°С. Подсчитывают колонии как в глубине, так и на поверхности среды. Чашки не учитываются, если при посеве 1 мл воды из разведения 1:100 и более выросло меньше 20 колоний, а также не учитываются чашки при наличии в них роста ползущих колоний, маскирующих более ½ чашки.
Просчитывают среднее арифметическое по параллельным пробам. При малом числе колоний просчитывают колонии на всей поверхности чашки, при обильном росте колоний допустимо просчитать колонии в 10 квадратах по 1 см 2 , определить среднюю по 10 просчетам и пересчитать на площадь чашки Петри по формуле:
М – микробное число воды, кл/мл;
n – среднее число колоний на 1 см 2 площади чашки Петри;
r – радиус чашки Петри = 4,5 см;
Результат просчета округляют следующим образом:
| Количество колоний в чашке | Результат |
| От 1 до 100 | Фактическое число подсчитанных колоний |
| От 101 до 1000 | Округлить до десятка |
| От 1001 до 10000 | Округлить до сотни |
| От 10001 до 100000 | Округлить до тысячи |
| От 100001 до 1000000 | Округлить до десятков тысяч |
E. coli является нормальным обитателем – комменсалом микрофлоры кишечника человека и животных. У рыб, диких птиц и насекомых E. Coli является случайным паразитом и попадает к ним при контакте с фекалиями человека и домашних животных. Так, у домашних уток, гусей она обнаруживается постоянно, а у диких - только в редких случаях. У животных Арктики кишечная палочка обнаруживается только в 10% случаев, такие же результаты получены при исследовании почвы и водоемов. В девственных почвах Арктики, на высокогорьях никаких разновидностей E. coli не встречается. При непостоянном загрязнении почвы в ней обнаруживаются E. coli citrovorum и E. coli aerogenes – результат длительного пребывания E. coli в сапрофитных условиях.
Считается, что сначала E. coli стала непатогенным паразитом кишечника человека, с приручением животных она перешла к ним. При интенсивном обмене кишечной флорой между животными организмами, отдельные разновидности кишечной палочки со свойствами патогенности в больших сообществах получили преимущество (вызывали диарею). Это было полезно для распространения бактерии, поэтому это свойство закрепилось, и при дальнейшей эволюции бактерии появились и более патогенные штаммы.
Кишечная палочка – сборная совокупность бактерий, имеющих общие признаки, которые могут сильно изменяться в зависимости от того биоценоза, в котором микроб развивается. Особенно резко свойства кишечной палочки меняются, когда в организм хозяина внедряются патогенные микробы. В этом случае E. coli может утратить способность сбраживать лактозу (образуются лактозонегативные варианты – штаммы E. coli). Такие бактерии в массовых количествах выделяются от больных брюшным тифом, паратифом, дизентерией в конце болезни и в начале периода выздоровления.
E. coli была открыта в 1885 году Эшерихом. Она представляет собой небольшую грамотрицательную палочку, длина палочки 2,5-3,0 мкм, поперечник 0,5-0,8 мкм, может давать кокковидные формы и нити, спор не образует, некоторые штаммы образуют капсулу, большинство подвижны, имеют 2-6 жгутиков, но встречаются и неподвижные формы.
Кишечная палочка хорошо растет на МПА, РПА, РБ, МБ. На плотных средах она дает круглые мелкозернистые колонии 2-3 мм в диаметре, молочно-голубоватые, колонии могут быть гладкими и шероховатыми. При росте на бульоне сначала появляется диффузное помутнение, через несколько дней образуется осадок, а на поверхности – нежная пленка.
E. coli сбраживает глюкозу, лактозу, мальтозу, маннит с образованием кислоты и газа по типу гетероферментативного молочнокислого брожения, сахарозу не сбраживает. Желатин не разжижает, разлагает триптофан с образованием индола (но встречаются формы, не образующие индол), створаживает молоко через 1-4 суток, сероводород не образует.
Международный стандарт дифференцирует бактерии группы кишечной палочки E. coli и бактерии фекально-кишечной палочки.
Бактерии группы кишечной палочки (БГКП) сбраживают лактозу при температуре 35-37° С, а бактерии группы фекальной кишечной палочки (БГФКП) сбраживают её при 44°С.
Идентификация кишечных палочек осуществляется на основании группы признаков ТИМАЦ (ТЛИМАЦ): Т – температурный тест (тест Эйкмана). Для E. coli этот тест положительный, т.к. она сбраживает углеводы при температуре 43-44° С до кислоты и газа. Большинство бактерий других групп этим признаком не обладают. Однако, имеются сведения о том, что повышенная температура не является оптимальной для E. coli, и рост E. coli, выделенной из фекалий при температуре 37° С интенсивнее, чем при 43° С.
И – образование индола. E. coli образует индол при расщеплении триптофана, тиразина, фенилаланина. Определение индола:
1) по методу Мореля – в пробирку с культурой исследуемой бактерии подвешивают индикаторную бумажку, смоченную 12% раствором щавелевой кислоты. На следующий день в присутствии индола бумажка розовеет. Этот метод достаточно простой и удобный.
2) Метод Легаль-Вейля более чувствителен. К суточной или двухсуточной бульонной культуре добавляют 5 капель 5% раствора нитропруссида натрия, 5 капель 40% раствора NaOH и 7 капель концентрированной СН3СООН. В присутствии индола появляется сине-зеленое или темно-синее окрашивание.
М – реакция с метиловым красным служит для определения интенсивности кислотообразования. К жидкой культуре бактерий добавляют индикатор метиловый красный. При интенсивном кислотообразовании, что характерно для E. coli, окраска культуры меняется на малиновый цвет.
А – реакция образования ацетилметилкарбинола (ацетоин СН3СНОНСООСН3) – реакция Фогес-Проскауэра. К жидкой культуре бактерий добавляют 40% раствор КОН, в присутствии ацетилметилкарбинола появляется розовое окрашивание. E. coli не образует ацетилметилкарбинол.
Ц – цитратный тест. Характеризует способность бактерий усваивать лимонную кислоту или ее соли в жидкой питательной среде Козера или плотной питательной среде Симмонса. Фекальные кишечные палочки не растут на этих средах. Эти бактерии цитратотрицательные. Если бактерия способна усваивать цитраты – цитратположительная, это говорит о том, что кишечная палочка довольно длительное время выживала в природной среде и уже не является показателем свежего фекального загрязнения.
Л – сбраживание лактозы. Санитарно-показательные формы сем. Enterobacteriaceae сбраживают лактозу с образованием кислоты и газа (лактозоположительные формы). Патогенные бактерии из этого семейства – сальмонеллы и шигеллы лактозу не сбраживают.
Дополнительный тест – способность бактерий расщеплять мочевину. E. coli мочевину не расщепляет.
Большинство кишечных палочек подвижны. Подвижность бактерий определяют в столбике питательной полужидкой среды Гисса или среде Пешкова. Посев выполняют уколом. Неподвижные бактерии растут в виде тяжа, подвижные вызывают общее помутнение среды.
Классификация бактерий группы кишечной палочки по Минкевичу, основанная на эволюционном развитии сем. Enterobacteriaceae
| Вид бактерии | Рост на цитратах | Реакция с метилрот | Реакция Фогес-Проскауэра | Образование индола | Бродильная при 44º С | Подвижность | Образование H2S | Расщепление мочевины |
| E. coli commune | - | + | - | + / - | + | + / - | - | - |
| E. coli citrovorum | + | - редко + | - | - редко + | - редко + | + / - | + / - | - |
| E. coli aerogеnes | + | - | + | - | - | + | - | + / - |
Желатин бактерии не разжижают, за исключением E. coli aerogenes, у которой этот признак вариабелен.
Попадая во внешнюю среду, E. coli commune приспосабливается и через полгода превращается в E. coli citrovorum, начинает расти на средах с цитратами, сбраживать сахарозу и прекращает сбраживать сахара при температуре 43º С, далее она превращается в E. coli aerogenes, которая к вышеперечисленным признакам приобретает способность вырабатывать ацетилметилкарбинол.
На питательной среде Левина E. coli образует фиолетовые колонии, на бактоагаре – красные, Киченко – желтые, на среде Ресселя с индикатором Андреде – красные.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
В нашем организме живут миллионы бактерий — их общий вес составляет около двух килограммов. Кишечная палочка занимает среди них далеко не последнее место. Эта бактерия может долгое время помогать человеку в формировании микрофлоры и пищеварении, а может в один момент превратиться в серьезную медицинскую проблему. В нашей статье мы расскажем о способах выявления кишечной палочки.
Кишечная палочка, или Escherichia coli (Эшерихия коли) — это палочковидная бактерия, которая обитает в кишечнике человека и некоторых животных. Существует более сотни разновидностей этой палочки. Большинство из них совершенно безвредны, но некоторые могут вызвать серьезные заболевания.
У здорового человека Escherichia coli живет в толстом кишечнике. Ее количество обычно составляет 104–1010 КОЕ в 1 мл содержимого. В кишечнике эта бактерия участвует в переваривании пищи, синтезирует нужные нам витамины, а также производит органические кислоты. Эти кислоты создают благоприятную среду для развития лакто- и бифидобактерий.
Чаще всего кишечная палочка попадает в другие органы при нарушении гигиены или при снижении иммунитета. Попадая в женскую половую систему, она вызывает кольпит, аднексит, другие воспалительные заболевания. Особенно опасно заражение при беременности и после родов. Это может вызвать внутриутробную инфекцию у ребенка и стать причиной послеродового эндометрита у матери. Мужчин эта опасность тоже не обходит стороной. Кишечная палочка, попавшая в уретру, может вызвать уретрит, простатит, воспаление придатков и яичек.
Кроме этого, нормальная кишечная палочка может мутировать и становиться действительно опасной. Некоторые виды этой бактерии, например O157:H7, O104:H4, O121 и O104:H21, выделяют сильные токсины. Они могут вызвать гемолитико-уремический синдром, перитонит, пневмонию, пищевые отравления.
Чаще всего мутировавшая кишечная палочка попадает в организм вместе с продуктами питания, такими как немытые овощи, плохо обработанное мясо, молоко. Но в некоторых случаях такие штаммы могут образоваться внутри организма в результате мутаций и обмена генами.
Патогенная кишечная палочка нередко вызывает диарею. Обычно эшерихиозом страдают дети младшего возраста и люди, путешествующие в страны с низким уровнем гигиены (так называемая диарея путешественников). Вовремя проведенный анализ позволит выявить кишечную палочку и начать лечение.
Некоторые опасные штаммы кишечной палочки могут вызвать гемолитико-уремический синдром (ГУС). Это тяжелое состояние, при котором в мелких сосудах образуется большое количество тромбов, собственные эритроциты разрушаются и возникает полиорганная недостаточность — тяжелая стресс-реакция организма. При любом подозрении на ГУС обязательно проводят анализ на энтеропатогенные (опасные) эшерихии.
Обычный бактериологический анализ, который проводят при воспалительных заболеваниях органов половой системы, послеродовых эндометритах и других, — также может показать наличие кишечной палочки.
Еще одним показанием к проведению исследования является дисбактериоз. Изменение состава микрофлоры кишечника может привести к проблемам с пищеварением, к урчанию и болям в животе. Нарушение образования витаминов и повышенное всасывание токсинов приводит к слабости, утомляемости и другим неспецифическим симптомам.
Кишечную палочку можно обнаружить в кале, в моче, в мазках с поверхности половых органов или из ран, при посеве промывных вод. Также во время исследований она может быть обнаружена в ране, в легких.
Основным методом анализа для обнаружения кишечной палочки является бактериологический посев. Для этого небольшое количество материала помещают в питательную среду, на которой бактерии очень хорошо размножаются. Результат подсчитывают через несколько дней по количеству образовавшихся колоний. Единица измерения — КОЕ/мл, то есть количество бактерий, из которых при исследовании выросли колонии, в миллилитре материала.
Также существует метод ПЦР-диагностики. Он позволяет сказать, присутствует ли в материале патогенная кишечная палочка. Но ни количество бактерий, ни их чувствительность к лекарственным препаратам этот метод не покажет.
Другие методы, которые не подразумевают выделение чистой культуры кишечной палочки, могут сказать о заражении только косвенно. Например, в общем анализе мочи могут обнаружить бактерии в виде палочек. Но для того чтобы определить их вид придется сдавать дополнительно бактериологический посев. Похожая ситуация и с копрограммой. Анализ может дать представление о состоянии желудка и кишечника, но не позволяет выявить конкретные бактерии.
Общий анализ крови позволяет выявить характерные для воспалительных заболеваний сдвиги. Но они могут быть вызваны не только эшерихиозом, но и дизентерией, пневмонией или любым другим воспалительным заболеванием.
Любое бактериологическое исследование нужно проводить до начала лечения антибиотиками. В противном случае можно получить ложноотрицательный результат.
Анализ кала на кишечную палочку собирается в стерильную пробирку с транспортной средой. Для этого нужно заранее подготовить судно или другую емкость, тщательно вымыть ее и ополоснуть кипятком. В эту емкость собирается кал после естественной дефекации. Из специальной пробирки с транспортной средой нужно достать аппликатор, погрузить его в несколько участков собранного биоматериала и снова убрать в пробирку, плотно закрыв крышку. Если в собранном материале присутствуют кишечные палочки, бактериологический анализ это покажет.
Анализ мочи на бактериологическое исследование тоже собирают в специальную стерильную емкость. Собрать материал можно в любое время суток. Перед этим обязательно нужно принять душ, чтобы в емкость не попали бактерии с поверхности кожи. Чем скорее получится доставить материал в лабораторию, тем лучше.
Мазки и соскобы урогенитального тракта при подозрении на уретрит, вагинит и любые другие мочеполовые заболевания, вызванные кишечной палочкой, забирают сразу в лаборатории или на приеме врача. Специальной щеточкой делается соскоб из уретры, со стенок влагалища или с шейки матки. Это не очень приятная процедура, но без нее не обойтись.
Быстрый анализ, который позволяет выявить в материале ДНК кишечной палочки, проводится за 1–2 рабочих дня. Результат бактериологического анализа на кишечную палочку придется ждать дольше — от 5 до 7 дней. За это время выращивается культура клеток, определяется их вид, проводится анализ на чувствительность к антибиотикам и бактериофагам.
В норме кишечной палочки не должно быть нигде, кроме толстого кишечника. То есть если вы сдаете мочу или мазок, то лучший результат — это отрицательное заключение. Если речь идет о содержимом кишечника, то здесь не должно обнаруживаться энтеропатогенных кишечных палочек, таких как O157:H7. В некоторых лабораториях проводят быстрый ПЦР-тест на целую группу таких бактерий.
При определении чувствительности к антибиотикам или бактериофагам выдается бланк, на котором напротив каждого наименования написана степень влияния препарата на рост бактерии. По такому бланку врач за несколько минут подберет наиболее эффективный для конкретного случая антибиотик.
Анализ на эшерихиоз можно сдать как в обычной поликлинике, так и в частной лаборатории. Желательно заранее уточнить, какой метод исследования при этом используется.
Бактериологические исследования лучше проводить в клиниках и лабораториях, оснащенных автоматическими и полуавтоматическими анализаторами. Это исключает человеческий фактор, позволяет проводить исследование с широким перечнем антибиотиков и бактериофагов. Такие оснащенные лаборатории имеют как современные государственные больницы, занимающиеся лечением инфекционных болезней, так и частные медицинские центры.
Также стоит обратить внимание на время проведения исследования. Для бактериологического исследования это не менее пяти дней. Раньше бактерия просто не успеет вырасти в достаточном для анализа количестве. Время больше 7–10 дней говорит о том, что исследование будет проводиться в сторонней лаборатории. Это существенный недостаток, поскольку речь идет о транспортировке биоматериала, что нежелательно: чем раньше был доставлен материал, тем более достоверным будет результат.
Кишечная палочка — неотъемлемая часть микрофлоры кишечника. Пока она находится под контролем организма, ее клетки помогают синтезировать витамины, переваривать пищу, создавать благоприятную среду для жизни других полезных микробов. Но любое нарушение этого равновесия грозит патологиями вплоть до серьезных воспалительных заболеваний. К счастью, медицина помогает нам вовремя выявить отклонения от нормы и приять соответствующие меры.
Читайте также:


