Среда кесслера для кишечной палочки в термостате на 30 градусов
Среда Хейфеца.Выпускается в сухом виде. В состав, кроме основных питательных компонентов (вода, пептон, маннит, натрия хлорид), входят розоловая кислота, раствор метиленового синего. Готовая среда красно_фиолетового цвета, при росте кишечной палочки рН сдвигается в кислую сторону, и среда приобретает зеленоватую окраску.
ХБ.В 1000 мл воды растворяют 10 г пептона, 5 г маннита, 5 г хлорида натрия. Приготовленную смесь кипятят 15–20 мин, устанавливают рН 7,4–7,6, процеживают через бумажный фильтр, кипятят фильтрат 10 мин, охлаждают до температуры +60_С, после чего прибавляют 30 мл дрожжевого диализата, 15 мл желчи, 10 мл раствора хинозола и 10 мл 1,6%_ного спиртового раствора бромкрезола пурпурного. Среду разливают в стерильные пробирки по 7–8 мл.
Среда Кесслера.К 1000 мл дистиллированной воды добавляют 10 г пептона и 50 мл бычьей желчи. Смесь кипятят на водяной бане при помешивании в течение 20–30 мин, фильтруют через вату, добавляют 2,5 г лактозы, доводят объем дистиллированной воды до 1000 мл, устанавливают рН 7,4–7,6, добавляют 2 мл 1%_ного водного раствора генцианвиолета, разливают в пробирки с поплавками по 8–10 мл и стерилизуют при температуре +121_С в течение 10 мин. Готовая среда имеет темно-фиолетовый цвет.
Индикация сальмонелл.Навесок колбасы массой 25 г от объединенной пробы, тщательно измельченный ножницами, вносят во флакон, содержащий 100 мл среды обогащения (Мюллера, Кауфмана, хлористо-магниевой) или 225 мл селенитового бульона. Флакон встряхивают и помещают в термостат при температуре +37_С, через 24 ч петлей или пастеровской пипеткой проводят высев из среды обогащения в чашки Петри со средой Эндо, Плоскирева, Левина или ВСА. Посевы помещают в термостат при температуре +37_С на 16–24 ч. На среде Эндо, Плоскирева и Левина бактерии из рода сальмонелл образуют бесцветные колонии. На ВСА сальмонеллы образуют черные или коричневые колонии с металлическим блеском, при этом участок среды под агаром чернеет. Не менее 5 изолированных колоний, характерных для сальмонелл, пересевают на трехсахарный агар Крумвиде–Олькеницкого в модификации Ковальчука штрихом по скошенной поверхности и уколом в столбик и инкубируют при температуре +37_С в течение 12–16 ч.
При росте сальмонелл на трехсахарном агаре цвет скошенной поверхности среды розовый, столбик — желто-бурый. Газообразование устанавливают по наличию трещин и разрыву столбика агара, при образовании сероводорода питательная среда чернеет.
Другие грамотрицательные бактерии семейства энтеробактерий дают следующие изменения цвета трехсахарного агара:
-БГКП окрашивает среду в синий или сине-зеленый цвет с образованием газа или без него;
-палочка протея окрашивает среды в ярко-красный цвет (вследствие расщепления мочевины), в случае выделения Н2S может появиться черный осадок с возможным разрывом агара.
Для дальнейшей идентификации бактерий готовят мазки, которые окрашивают по Граму, микроскопируют, а также изучают антигенные свойства путем постановки РА на предметном стекле с поливалентной (или комплексной) сальмонеллезной агглютинирующей сывороткой. Далее проводят идентификацию с помощью монорецепторных О- и Н-агглютинирующих сальмонеллезных сывороток.
Обнаружение подвижных (кроме S. gallinarum и S. pullorum) грамотрицательных палочек, дающих характерный рост на элективных средах, не ферментирующих лактозу и сахарозу, сбраживающих глюкозу и маннит до кислоты и газа (S. typhisuis маннит не ферментирует), образующих Н2S и не образующих индол, дающих положительную реакцию агглютинации с комплексными, монорецепторными О- и Н-агглютинирующими сальмонеллезными сыворотками, указывает на выделение бактерий из рода сальмонелл.
Индикация протеяв Н_форме проводится внесением исследуемого продукта в конденсат свежескошенного МПА (метод Щукевича). Посевы помещают в термостат на 18–24 ч при температуре +37_С. При наличии в исследуемом продукте протея подвижная палочка поднимается вверх по скошенной поверхности агара, образуя вуалеобразный голубоватый налет. Культура издает характерный гнилостный запах.
Обнаружение полиморфных грамотрицательных палочек, подвижных, сбраживающих глюкозу и мочевину, не ферментирующих лактозу и маннит, указывает на наличие в продукте бактерий из рода протея.
Индикация стафилококкав исследуемом продукте основана на изучении морфологии, культуральных свойств и способности некоторых стафилококков ферментировать лецитиназу и коагулировать цитратную плазму крови кролика под воздействием фермента коагулазы.
Вначале исследуемый продукт разводят 1 : 10, вносят в МПБ, содержащий 6,5% натрия хлорида. Через сутки после инкубирования в термостате проводят пересев на молочно-солевой агар для изучения наличия пигмента и на желточно-солевой агар для выявления лецитиназной активности.
Не менее чем из 5 типичных колоний готовят препараты, которые окрашивают по Граму и микроскопируют. При наличии стафилококков обнаруживают грамположительные кокки, располагающиеся в виде беспорядочных кучек и гроздьев винограда. Для подтверждения патогенности выделенных стафилококков ставят реакцию плазмокоагуляции по следующей методике: в пробирку с 0,5 мл цитратной плазмы крови кролика, разведенной физраствором (1 : 5), вносят петлю чистой суточной культуры стафилококка и помещают в термостат при температуре +37_С. Реакцию плазмокоагуляции предварительно учитывают через 3–4 ч (осторожно наклоняя, не встряхивая пробирку). В сомнительных случаях пробирки оставляют в термостате для окончательного учета через 24 ч. Реакцию считают положительной, если плазма коагулирует в сгусток (реакцию подвижная палочка поднимается вверх по скошенной поверхности агара, образуя вуалеобразный голубоватый налет. Культура издает характерный гнилостный запах.
Обнаружение полиморфных грамотрицательных палочек, подвижных, сбраживающих глюкозу и мочевину, не ферментирующих лактозу и маннит, указывает на наличие в продукте бактерий из рода протея.
Индикация стафилококкав исследуемом продукте основана на изучении морфологии, культуральных свойств и способности некоторых стафилококков ферментировать лецитиназу и коагулировать цитратную плазму крови кролика под воздействием фермента коагулазы.
Вначале исследуемый продукт разводят 1 : 10, вносят в МПБ, содержащий 6,5% натрия хлорида. Через сутки после инкубирования в термостате проводят пересев на молочно-солевой агар для изучения наличия пигмента и на желточно-солевой агар для выявления лецитиназной активности.
Не менее чем из 5 типичных колоний готовят препараты, которые окрашивают по Граму и микроскопируют. При наличии стафилококков обнаруживают грамположительные кокки, располагающиеся в виде беспорядочных кучек и гроздьев винограда.
Для подтверждения патогенности выделенных стафилококков ставят реакцию плазмокоагуляции по следующей методике: в пробирку с 0,5 мл цитратной плазмы крови кролика, разведенной физраствором (1 : 5), вносят петлю чистой суточной культуры стафилококка и помещают в термостат при температуре +37_С. Реакцию плазмокоагуляции предварительно учитывают через 3–4 ч (осторожно наклоняя, не встряхивая пробирку). В сомнительных случаях пробирки оставляют в термостате для окончательного учета через 24 ч. Реакцию считают положительной, если плазма коагулирует в сгусток (реакцию оценивают по степени плотности сгустка от одного до четырех плюсов).
Индикация сульфитредуцирующих клостридий (СРК)в колбасе основана на учете специфического роста клостридий в железосульфитсодержащих средах. При взаимодействии натрия сульфита с хлоридом железа образуется сульфат железа, который вызывает почернение питательной среды.
Для выявления СРК 1 мл исследуемой взвеси стерильной пипеткой вносят в пробирку с 9 мл жидкой сульфит-циклосериновой среды или среды Вильсон–Блера. Затем проводят последовательные пересевы на аналогичные объемы среды и получают возрастающие 10_кратные разведения суспензии. Посевы выдерживают 18–20 ч при температуре +37_С, при наличии СРК среда чернеет.
Для подтверждения принадлежности выделенных культур к клостридиям проводят пересев на поверхность агаризованной плотной среды Вильсон–Блера и инкубируют в анаэробных условиях при температуре +37_С в течение 24–48 ч. Отбирают типичные колонии и изучают микроорганизмы по морфологическим и некоторым культурально-ферментативным свойствам, в частности, по отрицательной реакции на каталазу.
Если в посевах (в 4 колониях из 5) обнаружены СРК, спорообразующие палочки, грамположительные, каталаза-отрицательные, способные расти в анаэробных условиях, то делают заключение о наличии в продукте СРК по максимальному разведению суспензии, в посеве которого наблюдается почернение среды. Например, если характерные изменения наблюдаются в пробирках с разведением 10–1, то считают, что в 1 г исследуемого продукта содержится 10 клеток, при аналогичных изменениях в пробирках с разведением 10–2 — 100 клеток.
При получении неудовлетворительных результатов микробиологического анализа готовой продукции по требованию контролирующих организаций проводят исследование вспомогательных материалов при постоянном входном контроле.
Не нашли то, что искали? Воспользуйтесь поиском:
Питательная среда для обнаружения бактерий группы кишечной палочки, сухая.
Описание
Среда Кесслера-ГРМ Оболенск
Среда Кесслера-ГРМ Оболенск предназначена для обнаружения бактерий группы кишечной палочки при санитарном обследовании объектов внешней среды.
- характеристика набора
Среда Кесслера-ГРМ Оболенск представляет собой мелкодисперсный, гигроскопичный, светочувствительный порошок серовато-желтого цвета.
Выпускается в полиэтиленовых банках по 250 г.
2.1. ПРИНЦИП ДЕЙСТВИЯ
Совокупность компонентов, входящих в состав набора, обеспечивает питательные потребности для роста бактерий группы кишечной палочки и ингибиции отдельных видов микроорганизмов.
2.2. СОСТАВ набора
Среда Кесслера-ГРМ Оболенск представляет собой смесь сухих компонентов из расчета, г/л:
| Пептон сухой ферментативный ………………………………………………. | 3,0 |
| Панкреатический гидролизат рыбной муки (ПГРМ)………………………… | 7,0 |
| a-Д-лактоза, 1-водная, ………………………………………………………………… | 10,0 |
| Желчь очищенная сухая ………………………………………………………………… | 3,0 |
| Кристаллический фиолетовый ……………………………………………………….. | 0,04 |
| Натрий углекислый………………………………………………………………………… | 0,01-0,25 |
- АНАЛИТИЧЕСКИЕ И ДИАГНОСТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Среда Кесслера-ГРМ Оболенск должна обеспечивать во всех засеянных пробирках визуально обнаруживаемый рост тест-штаммов Escherichia coli 675, Klebsiella pneumoniae 418, Citrobacter freundii 101/57 в виде диффузного помутнения среды и газообразования, тест-штамма Enterobacter aerogenes 10006 — в виде диффузного помутнения среды и слабого газообразования, тест-штамма Pseudomonas aeruginosa 27/99 в виде слабого помутнения среды без газообразования через 22-24 ч инкубации при температуре (37±1) °С, а также тест-штамма E. coli 675 в виде диффузного помутнения среды и газообразования через 22-24 ч инкубации при температуре (43±1) °С при посеве по 0,5 мл микробной взвеси каждого тест-штамма из разведения 10 -6 :
Среда Кесслера-ГРМ Оболенск должна полностью подавлять во всех засеянных пробирках рост тест-штамма Proteus vulgaris HX 19 222 при посеве по 0,5 мл микробной взвеси из разведения 10 -4 и тест-штамма Staphylococcus aureus Wood-46 при посеве по 0,5 мл микробной взвеси из разведения 10 -1 через 44-48 ч инкубации при температуре (37±1) °С.
- ОБОРУДОВАНИЕ И МАТЕРИАЛЫ
- Термостат обеспечивающий температуру 37±1 °С
- Весы лабораторные 2 класса точности
- Автоклав
- Пробирки стеклянные
- Пипетки стеклянные позволяющие отбирать объемы жидкости 1 и 2 мл
- Цилиндр стеклянный мерный вместимостью 1000 мл
- Чашки Петри стерильные
- Вода дистиллированная
- Колбы
- Воронки стеклянные
- АНАЛИЗИРУЕМЫЕ ОБРАЗЦЫ
Объекты исследований в санитарной микробиологии, научные исследования.
- Проведение АНАЛИЗа
Исследования образцов проводятся по соответствующим Методическим указаниям и ГОСТам.
7.1. ПОДГОТОВКА К АНАЛИЗУ
23,0 г препарата размешивают в 1 л дистиллированной воды. Кипятят 2-3 мин, фильтруют через бумажный фильтр, разливают по 5 мл в стерильные пробирки с поплавками и стерилизуют автоклавированием при температуре 112 °С в течение 20 мин.
Готовая среда имеет фиолетовый цвет. Стерильную среду можно использовать в течение 4-х недель при условии ее хранения при температуре 2-8C, в темном месте.
- РЕГИСТРАЦИЯ И УЧЕТ РЕЗУЛЬТАТОВ
Диффузное помутнение питательной среды и газообразование в результате роста бактерий группы кишечной палочки, выделенных из исследуемых образцов, регистрируют визуально.
Для получения достоверных результатов посевы образцов производить не менее, чем в трех повторностях.
Среда Кесслера-ГРМ Оболенск необходимо хранить в герметично закрытой упаковке в сухом защищенном от света месте при температуре от 2 до 30 С.
Срок годности – 2 года.
Для получения надежных результатов необходимо строгое соблюдение настоящей инструкции по применению.
Цель определения бактерий этой группы — проверка соблюдения режима варки колбас или санитарно-гигиенических условий в процессе производства сырокопченых колбасных изделий. Анализ на БГКП проводят по общепринятой методике с использованием сред, содержащих углеводы (глюкоза, лактоза). К ним относятся среды Хейфеца, ХБ, Кода, Кесслер. БГКП ферментируют глюкозу и лактозу, поэтому в средах ХБ, Хейфеца и Кода образуются кислые продукты, меняющие цвет индикаторов, а в среде Кесслер в поплавке образуется газ вследствие расщепления глюкозы.
При микробиологическом контроле колбасных изделий в производственных лабораториях можно ограничиваться обнаружением бактерий из группы кишечной палочки без их биохимической дифференциации. Для выявления БГКП в пробирки с 5 см3 среды ХБ или Хейфеца двойной концентрации либо Кода вносят по 5 см3 испытуемой взвеси стерильной пипеткой с широким концом вместимостью 5—10см3. Допускается применение среды Кесслер по 10см3.
Посевы термостатируют при 37 °С в течение 18—20ч. Посевы смывов, отобранных тампонами с поверхности изделий без оболочки, выдерживают при температуре 43 °С (для обнаружения повторного бактериального загрязнения). При росте бактерий группы кишечной палочки среды ХБ и Кода окрашиваются в желтый цвет, среда Хейфеца — в салатно-зеленый, на среде Кесслер в поплавке образуется газ.
Для окончательного заключения о присутствии в продукте БГКП проводят высев со среды Кесслер (забродившие пробы) или Хейфеца (изменение цвета среды) в чашки Петри со средой Эндо (Плоскирева, Левина) и помещают в термостат при 37 °С на 18— 20 ч. На среде Эндо бактерии этой группы образуют темно-красные колонии с металлическим блеском или розово-красные без блеска, на среде Плоскирева — кирпично-красные с глянцевой поверхностью, на среде Левина — темно-фиолетовые или фиолетово-черные блестящие колонии. Из подозреваемых колоний готовят мазки, окрашенные по Граму: при микроскопии обнаруживают грамотрицательные палочки различной величины.
Специфическое изменение сред ХБ и Кода не требует дальнейшего подтверждения.
При заведомо высокой обсеменности анализируемого продукта его навеску массой не более 0,25 г помещают в пустую пробирку, закладывают комочек стерильной фильтровальной бумаги размером 5 х 5 см и стерильной стеклянной палочкой или фламбированной проволокой проталкивают его до дна (не уплотняя). В пробирку наливают среду ХБ, Кода или Хейфеца (нормальной концентрации) на 3/4 высоты и помещают ее в термостат с температурой 37 °С на 8—10ч. При росте БГКП среды ХБ и Кода изменяют цвет из фиолетово-пурпурного в желтый, среда Хейфеца — из красно-фиолетового до салатно-зеленого.
Определение БГКП в пробах, отобранных с поверхности изделий без оболочки тампонами, осуществляют аналогично.
Обнаружение грамотрицательных палочек, специфически изменяющих цвет жидких дифференциально-диагностических сред и образующих характерные колонии на элективных средах с лактозой, указывает на наличие БГКП.
2.3 Методика определения сальмонелл (Salmonella)
Навеску продукта массой 25 г от объединенной пробы, тщательно измельченной стерильными ножницами, вносят во флакон Сокслета, содержащий 100см3 среды обогащения (Мюллера, Кауфмана, хлористо-магниевой) или 225 см3 селенитового бульона. Содержимое перемешивают встряхиванием и помещают в термостат при 37 °С. Через 16—24 ч содержимое флакона тщательно перемешивают бактериологической петлей (диаметр 0,4—0,5 мм) или пастеровской пипеткой и проводят посев из среды обогащения в чашки Петри с предварительно подсушенной средой Эндо, БФА, Плоскирева, Левина или висмут-сульфит-агар (по выбору). При значительном помутнении следует использовать среду Плоскирева.
Посевы помещают в термостат при 37 °С на 16—24 ч. На среде Эндо бактерии из рода сальмонелл образуют бесцветные или с розовым оттенком колонии.
На среде БФА сальмонеллы растут в виде крупных, гладких, красноватого оттенка прозрачных колоний (колонии Staphylococcus typhi suis как и на среде Эндо, мелкие). Колонии БГКП желто-зеленого цвета. Бактерии группы протея дают рост через 72 ч.
На среде Плоскирева колонии сальмонелл бесцветные, но более плотные и несколько меньшего размера, чем на среде Эндо; при обильном росте среда желтеет.
На среде Левина сальмонеллы растут в виде прозрачных, бледных, нежно-розовых или розовато-фиолетовых колоний.
На висмут-сульфитном агаре сальмонеллы образуют черные или коричневые колонии с металлическим блеском, участок среды под колонией чернеет. Исключение составляют некоторые серологические типы из группы С, растущие на этой среде в виде нежных светло-зеленых или крупных серовато-зеленых колоний.
Изолированные колонии (не менее 5), характерные для бактерий из рода сальмонелл, пересевают на трехсахарный агар Крумвиде—Олькеницкого в модификации Ковальчука штрихом по скошенной поверхности и уколом в столбик и инкубируют при 37 ± 1 °С в течение 12—16 ч.
При росте сальмонелл цвет скошенной поверхности среды Крумвиде — Олькеницкого в модификации Ковальчука розовый, столбик желто-бурый. Газообразование устанавливают по наличию трещин и разрыву столбика агара, образующие сероводород виды вызывают потемнение столбика.
Другие грамотрицательные бактерии семейства энтеробактерий дают следующие изменения цвета трехсахарного агара:
· БГКП — равномерное окрашивание в синий или сине-зеленый цвет с образованием газа или без него;
· бактерии из группы протея — окрашивание в ярко-красный цвет, в случаях выделения Н2S может образоваться черный осадок;
· шигеллы и возбудители брюшного тифа окрашивают скошенную поверхность в розовый цвет, столбик — в синий или сине-зеленый.
Вместо среды Крумвиде—Олькеницкого в модификации Ковальчука допускается посев: на углеводные среды короткого пестрого ряда с глюкозой, лактозой, сахарозой, маннитом и мальтозой; полужидкий агар уколом (для определения подвижности); бульон Хоттингера для определения образования индола и сероводорода. При использовании полужидких сред с углеводами и индикатором ВР одновременно с ферментативной активностью можно определить подвижность бактерий.
Для дальнейшей идентификации бактерий готовят мазки, которые окрашивают по Граму, микроскопируют и изучают антигенные свойства путем постановки пробной агглютинации на предметном стекле с агглютинирующей адсорбированной поливалентной сальмонеллезной О - сывороткой. При получении положительной реакции на стекле с поливалентной сывороткой проводят идентификацию с помощью монорецепторных агглютинирующих О-сывороток. Установив серологическую группу исследуемых бактерий, с помощью Н-сывороток определяют тип (вид) бактерий.
Обнаружение подвижных (кроме Salmonella pullorum и Salmonella gallinarum) грамотрицательных палочек, дающих характерный рост на элективных средах, неферментирующих лактозу и сахарозу, сбраживающих глюкозу и маннит до кислоты и газа (Salmonella typhi suis не ферментирует маннит), образующих сероводород и не образующих индол, дающих положительную реакцию агглютинации с монорецепторными О- и Н-сальмонеллезными сыворотками, указывает на наличие бактерий из рода сальмонелл.
2.4 Методика определения рода Proteus
При необходимости проведения исследований на наличие в продукте протея в Н-форме 0,5 см3 анализируемой взвеси вносят в конденсационную воду свежескошенного мясопептонного агара, разлитого в широкие пробирки, не касаясь поверхности среды (метод Шукевича). Вертикально поставленные пробирки помещают в термостат при 37 °С. Через 18—24ч отмечают образование ползучего вуалеобразного налета с голубым оттенком. На скошенном мясопептонном агаре культура поднимается из конденсационной жидкости вверх по поверхности среды. При появлении характерного роста микробов рода протея микроскопируют окрашенные по Граму мазки и изучают подвижность микробов в раздавленной или висячей капле.
Для обнаружения нероящихся О-форм можно проводить посев на поверхность агара Плоскирева. О-формы протея растут на этой среде в виде прозрачных колоний, слегка подщелачивающих среду, окрашивая ее в желтый цвет. Затем колонии пересевают в среду Крумвиде—Олькеницкого в модификации Ковальчука, которая при наличии бактерий из группы протея окрашивается в ярко-красный цвет (вследствие расщепления мочевины). В результате выделения сероводорода может образовываться черный осадок с возможным разрывом агарового столбика.
Идентификацию протея проводят по морфологическим признакам (это грамотрицательные палочки), способности к гидролизу мочевины и образованию сероводорода. Дополнительно изучают ферментацию глюкозы (положительный результат), лактозы и маннита (отрицательный результат), подвижность в висячей или раздавленной капле либо проводят посев уколом в столбик полужидкой среды.
Обнаружение полиморфных грамотрицательных палочек, подвижных, образующих характерный ползучий рост на скошенном мясопептонном агаре (по Шукевичу), сбраживающих глюкозу и мочевину, неферментрующих лактозу и маннит, указывает на наличие в продукте бактерий из рода протея.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Санитарно-бактериологическое исследование молока и молочных продуктов Ф. К. Черкес, Н. А. Бельская
Молоко и молочные продукты являются благоприятной средой для размножения микроорганизмов.
При изготовлении некоторых молочных продуктов: творога, кефира, простокваши, ряженки и других используют специальную микрофлору, например молочнокислые стрептококки, молочно-кислые ацидофильные палочки и др. Микрофлора, используемая для приготовления этих продуктов, является для них специфичной и не учитывается.
Неспецифической микрофлорой, встречающейся в молоке и молочных продуктах, являются аэробные бактерии: БГКП, стафилококки и др.
С молоком могут передаваться возбудители туберкулеза, бруцеллеза, сальмонеллеза, сибирской язвы, вирус полиомиелита, анаэробные бациллы и т. д.
Обсеменение молока и молочных изделий неспецифической микрофлорой может произойти в момент удоя, транспортировки, хранения и т. д.
Исследование молока и молочных продуктов проводят согласно ГОСТу 9225-68.
Отбор проб. Пробы жидких и полужидких продуктов после тщательного их перемешивания отбирают в количестве 50-100 мл в стерильные колбы. Пробы сливочного масла, сыра, творога отбирают с помощью стерильного щупа из глубины продукта. Перед взятием пробы масла, творога верхний слой продукта тщательно зачищают, а поверхность сыра в месте отбора пробы прижигают раскаленным ножом. Из расфасованных продуктов берут по 2 образца в оригинальной упаковке. Взятые образцы сопровождают документом, в котором указывают:
1. Номер образца.
2. Наименование и сорт продукта.
3. Дату изготовления.
4. Дату и час отбора пробы.
5. Объем необходимых исследований.
6. Должность и подпись лица, отобравшего пробу.
Микробиологическое исследование продукта должно производиться не позднее чем через 4 ч с момента отбора пробы. При транспортировке температура не должна превышать 6° С.
ГОСТ для молока и молочных изделий предусматривает определение общего числа бактерий в 1 г (мл) и определение титра цитратотрицательных (цитратнегативных) разновидностей БГКП (коли-титр).
Подготовка образцов для исследования. Из молока и других молочных продуктов готовят десятикратные разведения (по общепринятой методике). Количество разведений для каждого вида продукта готовят с учетом наиболее вероятного микробного обсеменения (табл. 56).

Таблица 56. Разведение молока и молочных продуктов
Примечание. Для определения общего количества бактерий следует выбирать те разведения, при посевах которых на чашках вырастает не менее 50 и не более 300 колоний.
Посев. По 1 мл каждого разведения вносят в 2-3 стерильные чашки Петри и заливают 12-15 мл растопленного и остуженного до 45° С питательного агара. Предварительно чашки маркируют. Сразу после заливки содержимое чашки перемешивают (путем легкого вращательного покачивания) для равномерного распределения посеянного материала. Посевы ставят в термостат при 37° С на 48 ч.
По истечении срока инкубации чашки вынимают и подсчитывают число колоний при помощи счетчика. Число колоний, выросших на каждой чашке, умножают на соответствующее разведение. Полученные результаты по отдельным чашкам складывают, делят на количество чашек и получают среднее арифметическое, которое является показателем общего числа бактерий в 1 г (мл).
Соответствующие ГОСТы регламентируют качество продуктов, что устанавливают по допустимым показателям: общему числу микробов и коли-титру. Пример для двух видов продуктов представлен в табл. 57.

Таблица 57. Показатели общего числа бактерий и коли-титра в молоке
Примечание. Для других молочных продуктов также имеется ГОСТ обусловливающий допустимое количество микробов в 1 мл (г) продукта. Буквы А и Б обозначают категорию продукта.
В кисломолочных продуктах (кефир, простокваша, творог, сметана и др.), содержащих обильную специфическую микрофлору, общее количество бактерий не определяют, а контролируют состав микрофлоры. Для этого из кисломолочных продуктов готовят препараты и красят метиленовым синим. В поле зрения препарата должны находиться только специфические для данного продукта микроорганизмы. Например, для простокваши - молочно-кислые стрептококки и палочки; для кефира - молочно-кислые стрептококки и палочки, единичные дрожжи. Микроскопия позволяет выявить микроорганизмы порчи (плесени и большое количество дрожжей).
Обсемененность молока и молочных продуктов бактериями группы кишечной палочки определяют бродильным методом. Бродильный титр - это то наименьшее количество продуктов, выраженное в граммах или миллилитрах, в котором присутствует кишечная палочка. Согласно ГОСТу 9225-68 учитываются только цитратнегативные разновидности кишечной палочки (рис. 57).
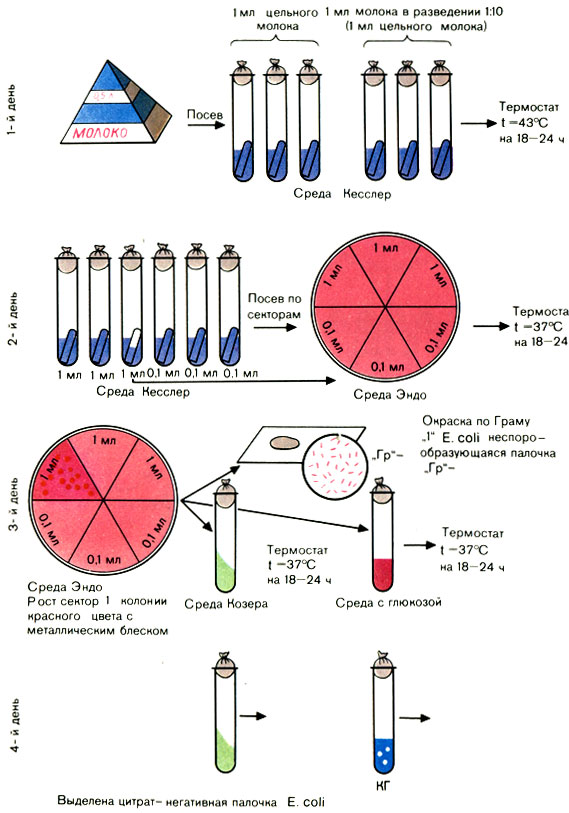
Рис. 57. Определение коли-титра молока
Посев молока и молочно-кислых продуктов производят в 6 пробирок с 5 мл среды Кесслер. В 3 пробирки засевают по 1 мл цельного продукта, в другие 3 пробирки по 1 мл из разведения 1:10 (0,1 мл). Посевы инкубируют в термостате при 43° С 18-24 ч.
Из каждой забродившей пробирки производят посев на сектор среды Эндо и инкубируют при 37° С 18-24 ч.
При отсутствии типичных для БГКП колоний продукт считают незагрязненным кишечной палочкой.
При наличии типичных для БГКП колоний делают мазки, окрашивают по Граму и микроскопируют. При обнаружении грамотрицательных палочек ставят пробу на оксидазу и производят посев на среду с глюкозой и среду Козера.
Производят учет результатов. Наличие кислоты и газа на среде с глюкозой и отсутствие роста на среде Козера свидетельствует о наличии цитратнегативных разновидностей кишечной палочки. Коли-титр вычисляют по табл. 58.
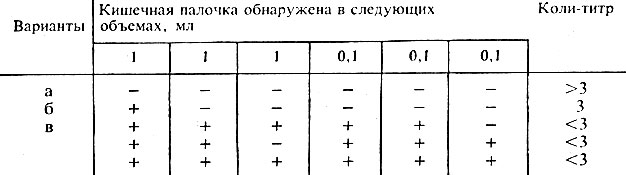
Таблица 58. Вычисление коли-титра в пастеризованном молоке, сливках, кефире, простокваше, ацидофильном молоке
Примечание. Вычисление коли-титра для масла, сыра, творожных изделий, мороженого и молочных консервов проводят по другим таблицам, указанным в ГОСТе.
Присутствие патогенных микроорганизмов в молоке и молочных продуктах недопустимо.
1. Как определяют в молоке и молочных продуктах общее число микробов?
2. Как определяют коли-титр?
3. Какие микроорганизмы могут встречаться в молоке и молочных продуктах?
Среда Кесслер. См. с. 484.
Среда Козера. К 1 л дистиллированной воды добавляют 1,0 г фосфата однозамещенного калия, 0,2 г сульфата магния, 2,5-3,0 г цитрата натрия. Раствор стерилизуют в автоклаве при 1 атм в течение 15 мин, добавляют 10 мл 0,5% спиртового раствора бромтимолового синего и разливают в стерильные пробирки.
Среда глюкозой. См. главу 7.
Желточно-солевая среда. См. главу 14.

(Номенклатурный номер: 01120201) Жидкая элективная среда, предназначенная для определения БГКП в продуктах по ГОСТ 32901-2014, а также для контроля санитарного состояния производства по МР 2.3.2.2327-08. Основу среды составляет лактопептон - гидролизат сывороточных белков молока
Кесслер
ТУ 9291-155-00008064-97
Номенклатурный номер: 01120201
Для проведения микробиологического контроля необходимо располагать комплексом питательных сред, обеспечивающим контроль всех значимых групп микроорганизмов. Выбор питательной среды определяется специалистами предприятия, проводящими микробиологический контроль и отвечающими за безопасность и качество выпускаемой продукции.
Основное требование, предъявляемое к питательным средам, – обеспечение ростовых характеристик и специфичности на уровне арбитражных сред, т.е. сред, использование которых регламентировано нормативными документами (национальными стандартами).
Рабочие питательные среды для посевов готовят из сухих питательных сред, путем их растворения в воде с последующей стерилизацией в соответствии с инструкцией по приготовлению.
Для приготовления рабочих питательных сред используют водопроводную или дистиллированную воду. Водопроводную воду питьевого качества рекомендуется предварительно выдержать на свету в течение суток, прокипятить в открытом сосуде 30 мин и охладить до комнатной температуры. Активная кислотность воды должна составлять 7,2-7,6 ед. рН. При использовании дистиллированной воды необходимо контролировать и доводить рН среды, т.к. рН дистиллированной воды имеет кислые значения.
Подготовленную воду используют для приготовления питательных сред и растворов для разведений.
Определение активной кислотности (рН) питательных сред
Определение активной кислотности (рН) питательных сред проводят с помощью анализатора потенциометрического для контроля рН по прилагаемым инструкциям. Ориентировочное определение активной кислотности (рН) питательных сред может проводиться с помощью индикаторных бумажек или готового универсального индикатора.
Контроль качества рабочих питательных сред
Качество вновь приготовленных питательных сред проверяют путем параллельного посева одних и тех же проб на новую и ранее используемую среду. Результат считается удовлетворительным при получении данных одного порядка.
Контроль стерильности рабочих питательных сред осуществляют путем термостатирования пробы среды при 37 °С в течение 48 ч. Если после термостатирования на средах отсутствуют признаки роста, то среда считается стерильной.
Хранение рабочих питательных сред
Если особые условия хранения конкретной рабочей питательной среды не оговорены в инструкции по ее применению, то среды хранят в холодильнике не более 3 мес. или при температуре 18-23 °С не более 1 мес. при условии сохранения внешнего вида среды.
16 г сухой среды Кесслер растворяют в (1±0,05) дм 3 специально подготовленной питьевой воды. Смесь размешивают и кипятят при помешивании 2-5 мин. Среду охлаждают до комнатной температуры. В полученной среде проверяют активную кислотность и при необходимости доводят 20-30 %-ным раствором гидроокиси натрия или 20 %-ным раствором молочной кислоты до (7,4±0,2) ед. рН.
Среду разливают в пробирки с поплавками по (5±0,5) см 3 или колбочки с поплавками по 40-50 см 3 и стерилизуют при (121±2) °С в течение (11±1) мин.
В процессе стерилизации поплавки должны полностью заполниться средой. Наличие воздуха в поплавках до посевов не допускается.
Готовая для применения среда имеет темно-фиолетовый или синий цвет. Оттенки цвета зависят от партии индикатора и не влияют на качество среды. Допускается наличие небольшого осадка.
Определение БГКП проводят в соответствии с ГОСТ 32901-2014.
Признак роста БГКП на среде Кесслер – появление газа в поплавке.
Читайте также:


